¿ Introducción
En el año 2001, en nuestro país se informó sobre 1118 casos de cáncer de recto y 230 casos en la unión recto-sigmoidea.1 Es bien reconocido que la quimiorradioterapia preoperatoria aumenta la tasa de curación, reduce el riesgo de recurrencia local y a distancia, logrando preservar el mecanismo esfinteriano.2 La definición de la unión entre el colon y el recto es anatómicamente controvertida; sin embargo, el Instituto Nacional del Cáncer en los Estados Unidos la define a los 12 cm del margen anal, utilizando un rectosigmoidoscopio rígido.3
El objetivo de esta revisión es analizar los resultados oncológicos de las resecciones locales y radicales en cirugía para cáncer rectal, evaluando los métodos de imagen para la etapificación preoperatoria, así como los parámetros quirúrgicos dentro de los que se incluyen: excisión mesorrectal total (EMT), preservación de nervios autónomos (PNA), margen radial, margen distal, número de ganglios linfáticos, preservación del esfínter, abordaje laparoscópico y calidad de vida.
¿ Métodos
Se incluyeron artículos publicados de 1983 a 2010 por medio de una búsqueda en PubMed, utilizando la combinación de términos MeSH de "cáncer rectal" con: ultrasonido, tomografía, resonancia magnética, cirugía, cirugía de invasión mínima, laparoscopia, excisión local, microcirugía transanal endoscópica, disfunción sexual, disfunción vesical, disfunción urinaria, margen radial, margen distal, ganglios linfáticos y calidad de vida.
¿ Epidemiología
La incidencia de cáncer de recto en los EU es de 44 casos por 100 000 habitantes, con un número total de 34 000 nuevos casos anuales.4 En los recientes años, el número de artículos publicados de la epidemiología del cáncer colorrectal en nuestro país son escasos. En un estudio de cáncer gastrointestinal realizado en cuatro centros hospitalarios en la Ciudad de México durante un periodo de 25 años, se observó que la frecuencia de cáncer de estómago disminuyó en dos de ellos, mientras hubo un incremento de cáncer de colon en los últimos años.5
Con respecto a la defunción por tumores malignos en México, en 2001, 4% de 56 213 correspondieron al cáncer de colon, lo que significó un total de 2248 pacientes finados por esta causa durante ese año.6 La mejor fuente de información en México está representada por el registro histopatológico de las neoplasias malignas, el sistema de vigilancia epidemiológica y el sistema epidemiológico basado en los certificados de defunción.
¿ Presentación clínica
Los pacientes con cáncer rectal pueden tener una amplia gama de presentaciones clínicas. Los primeros síntomas son sangrado y cambios en el hábito intestinal, manifestados como diarrea con moco o constipación.2 En estos pacientes se debe realizar una rectosigmoidoscopía rígida para determinar la distancia del tumor al borde anal, así como una colonoscopia para evaluar la presencia de tumores sincrónicos en el colon (2% a 9%).7-10
¿ Estadiaje
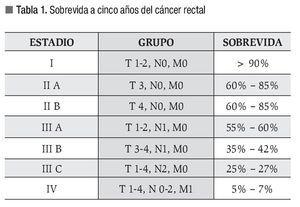
El estadio histopatológico es el factor pronóstico más importante de sobrevida. Actualmente la clasificación TNM es la más utilizada para evaluar la extensión del tumor.11-13 La etapificación preoperatoria permite la selección de diferentes opciones de tratamiento, así como el uso de quimiorradioterapia neoadyuvante14-16 (Tabla 1).
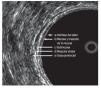
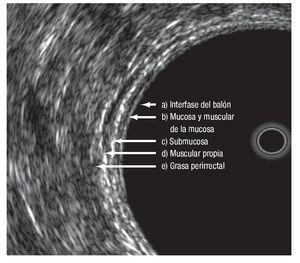
Las modalidades de imagen para la etapificación preoperatoria del cáncer rectal son el ultrasonido transrectal (UTR), la tomografía computarizada (TC) y la resonancia magnética nuclear (RM). El UTR es la técnica más utilizada para evaluar la profundidad de invasión de la pared rectal, con una sensibilidad y especificidad de 94% y 86% respectivamente; y de 94% y 69%, para la invasión del tejido perirrectal17,18 (Figura 1). La exactitud global del UTR para evaluar la T oscila de 80% a 95%.19-25 La RM con bobina endorrectal ofrece las ventajas de permitir mayor campo de visión, no es operador dependiente y evalúa tumores que causan estenosis. La etapificación T con este estudio tiene una exactitud que va de 50% a 95%.26-32
¿ Figura 1. Capas del recto evaluadas por medio de ultrasonido endorrectal.
Para la evaluación de las metástasis ganglionares, un contorno irregular con señal homogénea es el criterio más sensible para identificarlas.29 La sensibilidad y especificidad con este estudio son de 64% y 58%, respectivamente. A la mayoría de los pacientes se les realiza una TC abdominopélvica para identificar enfermedad metastásica intra-abdominal, así como para evaluar las relaciones locales del tumor con estructuras pélvicas.33,34 La sensibilidad de la TC para la etapificación local es de 79% y de 54% a 70% para evaluar la extensión a los ganglios linfáticos.24
¿ Consideraciones quirúrgicas
Existen cuatro objetivos mayores en el tratamiento del cáncer rectal:
Control local de la enfermedad,
Sobrevida a largo plazo,
Preservación del esfínter anal, función vesical y sexual, y
Mantener o mejorar la calidad de vida.
Estos objetivos se logran mediante un enfoque global realizado por un equipo multi-disciplinario.35
¿ Tratamiento quirúrgico del cáncer de recto resecable
El tipo y extensión de la cirugía depende de: la etapa preoperatoria, la distancia al complejo esfinteriano, la terapia neoadyuvante, las características histopatológicas y la capacidad del paciente para tolerar una cirugía radical.36-38
El éxito quirúrgico depende de la posibilidad de obtener un margen distal de 2 cm, aunque actualmente se acepta que para tumores distales, 8 mm son adecuados; así como de lograr un margen radial mayor a 1 mm.
¿ Cáncer rectal temprano (T1/T2 Y N0)
Resecciones locales: La resección local es aceptada para el tratamiento de los adenocarcinomas T1 de recto con características clínicas e histológicas favorables.39 Estos criterios incluyen tumores bien o moderadamente diferenciados, ausencia de invasión perineural y linfovascular, lesión de 8 cm a 10 cm del borde anal, menores a 4 cm y afección de menos de un tercio de la circunferencia del recto.40,41 Las alternativas quirúrgicas son la excisión local transanal, la proctectomía supraesfintérica posterior (procedimiento de Kraske), abordajes transesfintéricos posteriores (procedimiento de Bevan, York-Mason), microcirugía transanal endoscópica (MTE) y la fulguración transanal.42,43 El uso de resección local en lesiones más avanzadas (T2 y T3) ha reportado tasas altas de recurrencia (de 17% a 62%), incluso con el uso de quimiorradioterapia adyuvante, por lo que no se recomiendan para este tipo de tumores.44,45
Excisión local transanal: La excisión local transanal ofrece mínima morbilidad y problemas funcionales a largo plazo comparada con la resección radical. Esta implica la extirpación de espesor completo hasta la grasa perirrectal, un margen lateral mínimo de un centímetro y cierre primario del defecto.
Algunas revisiones retrospectivas han mostrado cierta preocupación en los resultados oncológicos, reportando tasas de recurrencia local de 17% a 21% y 26% a 47% para las lesiones T1 y T2, respectivamente.45,46
Steele y colaboradores47 mostraron que la resección local de lesiones T1 y T2 se asoció con una tasa de recurrencia local de 5% y 14% respectivamente. En el seguimiento a largo plazo con una mediana de 7.1 años (rango de 2.1 a 11.4 años), los tumores T1 y T2 tuvieron tasas de sobrevida global de 84% y 66%, respectivamente; y de sobrevida libre de enfermedad de 75% y 64%. La extirpación local para adenocarcinomas de recto T1 presenta un adecuado control local con una sobrevida global aceptable, a diferencia de los tumores T2 que, incluso con quimiorradioterapia adyuvante, muestran una mayor tasa de recurrencia.45,47,48
Microcirugía transanal endoscópica (MTE): La MTE es una opción viable para tumores inaccesibles a una extirpación transanal estándar.49,50 En ésta se utiliza un endoscopio de 40 mm de diámetro y 25 cm de largo, realizando resecciones de espesor completo, bajo visión directa. La distancia del margen anal que se puede alcanzar con esta técnica abarca 15 cm en la pared posterior, 12 cm en las paredes laterales y 10 cm en la anterior.49-53
Esta técnica incluye los mismos criterios de selección que la resección local.49 Los resultados oncológicos son similares a una resección anterior, en particular para una etapa temprana del cáncer rectal.51,52
¿ Cáncer de recto localmente avanzado (T3/T4 y/o N1)
Resecciones radicales: Para el manejo del cáncer de recto localmente avanzado (T3/T4 y/o N1) se toman en cuenta los siguientes puntos:
La excisión mesorrectal total,
Preservación de los nervios autónomos,
Margen de resección radial o circunferencial,
Margen de resección distal,
Número de ganglios linfáticos,
Opciones para la preservación del esfínter y restauración de la continuidad intestinal,
Abordajes laparoscópicos, y
Calidad de vida postoperatoria.
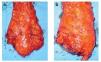
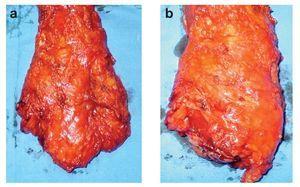
Excisión mesorrectal total: La EMT permite una disección precisa y la extirpación del mesenterio rectal completo como unidad intacta.54,55 La tasa de recurrencia local es menor a 7%, incluso sin terapia adyuvante.56 Se recomienda utilizar EMT en tumores del recto medio y distal. La longitud del mesorrecto distal al tumor primario debe ser de tres a 5 cm. En varios estudios, los implantes tumorales no se observaron a más de 4 cm del borde distal del tumor dentro del mesorrecto y no se observan implantes más allá de un centímetro en lesiones T1 o T257-61 (Figura 2).
¿ Figura 2. Pieza quirúrgica de una resección anterior baja del recto donde se observa excisión completa del mesorrecto: a) cara anterior, b) cara posterior.
Preservación de los nervios autónomos: Los nervios simpáticos de la pelvis se originan en las raíces nerviosas ventrales de T12 a L3.62 El plexo hipogástrico superior forma el nervio hipogástrico, íntimamente asociado con la fascia visceral del meso-recto. La lesión de estos nervios simpáticos aumenta el tono de la vejiga disminuyendo la capacidad vesical, produciendo dificultad para la micción, alteración de la eyaculación, y en mujeres, pérdida de la lubricación vaginal y dispareunia. Los nervios parasimpáticos de la pelvis (nervios erectores), emergen de raíces nerviosas ventrales de S2 a S4, estos se unen al nervio hipogástrico (simpático) en la pared pélvica para formar el plexo hipogástrico inferior.62 Cuando se realiza una cirugía preservadora de los nervios autonómicos, la disfunción genitourinaria y sexual postoperatorias se puede reducir de 25% y 75%, hasta un 10% y 28%, respectivamente.63 De forma más específica, la vejiga neurogénica se presenta de 9% a 40% con una resección convencional, y disminuye de 0% a 11% con una EMT con preservación de nervios.63-65
Margen distal: La longitud adecuada del margen distal en cáncer de recto es un tema controvertido. Los tumores ubicados por debajo de la reflexión peritoneal pueden propagarse a través de rutas linfovasculares intramurales o extramurales. La utilización de una RAP en tumores del recto inferior se ha basado en la necesidad de un margen distal de 5 cm. Algunos estudios retrospectivos han demostrado que un margen de un centímetro no se asocia a un mayor riesgo de recurrencia local.66
La propagación distal intramural generalmente se limita a 2 cm del tumor.67,68 Williams y colaboradores.68 demostraron que 12 de 50 RAP con márgenes distales de más de 5 cm tenían una extensión intramural distal más allá del borde tumoral, de los cuales 10 eran pacientes que tenían enfermedad en estadio III. En este estudio no se observó diferencia en la sobrevida o recurrencia local en pacientes cuyo margen de resección distal fue mayor o menor de 5 cm.
El Proyecto Nacional de Cirugía Adyuvante de Mama y de Intestino (NSABP) R-01, es un estudio prospectivo aleatorizado que evaluó 232 y 181 pacientes que fueron sometidos a RAP y RAB, respectivamente.69 En un análisis de los subgrupos se evaluó la longitud del margen de resección distal, encontrando que no hubo falla en el tratamiento y en la sobrevida cuando los márgenes fueron menores de 2 cm, de 2 cm a 2.9 cm, o mayores de 3 cm. En este estudio se concluye que un margen de uno a 2 cm es aceptable.
Al evaluar la seguridad oncológica con márgenes distales más cortos, actualmente los cirujanos han sido capaces de adoptar abordajes más agresivos para la preservación de los esfínteres. Este tipo de anastomosis colo-anales ahora son posibles con la ayuda de engrapadoras mecánicas circulares. También se han descrito resecciones inter-esfintéricas con anastomosis manuales.70-72
Margen radial: El margen radial en cáncer de recto se define como la distancia entre el borde más lateral del tumor, al límite externo de la resección. Este es positivo si se encuentra a un milímetro de distancia o menos. La capacidad de obtener un margen radial negativo se asocia con una disminución en la recidiva local.73 El margen radial positivo puede darse por extensión del tumor primario, extensión de los ganglios linfáticos afectados, o depósitos del tumor en el mesorrecto.73 Un margen radial positivo es factor independiente de mayor recidiva local y menor sobrevida global.74 Hall y colaboradores informaron una tasa de recurrencia local de 24% en pacientes que tenían un margen radial negativo, en comparación con 50% en tumores con un margen positivo, así como una pobre sobrevida global y libre de enfermedad.75
Ganglios linfáticos: La disección ganglionar proximal debe extenderse sólo distal al origen de la arteria cólica izquierda. No existe evidencia que indique una relación entre recurrencia local y sobrevida con una disección de ganglios iliacos más profundos.43,76 Nagawa y colaboradores realizaron un ensayo clínico controlado acerca de la disección ganglionar lateral (DGL). Los pacientes fueron sometidos a radioterapia preoperatoria y cirugía con o sin DGL. La DGL no proporcionó ningún beneficio adicional en cuanto la recurrencia local o sobrevida.77 La DGL se ha asociado con aumento de morbilidad postoperatoria, así como disfunción urinaria y sexual en 18% y 50% de los pacientes, respectivamente.78 Los ganglios linfáticos se deben resecar en el origen del vaso principal y deben ser enviados para su evaluación histopatológica. Los ganglios sospechosos de malignidad fuera del campo también deben ser biopsiados. Un grupo de expertos del Instituto Nacional de Cáncer en los Estados Unidos, recomienda que para alcanzar un alto grado de exactitud diagnóstica (> 90%), se requieren un mínimo 12 ganglios negativos, para confirmar que la enfermedad no tiene involucro ganglionar.3
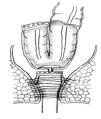
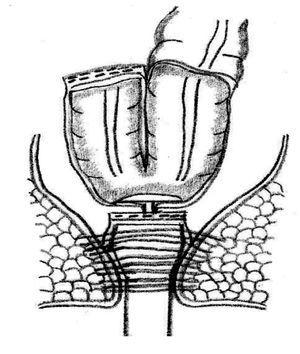
Preservación del esfínter y opciones de restauración: La preservación del esfínter es posible cuando el tumor se localiza a más de un centímetro por arriba del anillo anorrectal.63,79 La continuidad intestinal después de una RAB se restaura por medio de una anastomosis colorrectal o colo-anal. Se ha demostrado que la anastomosis colo-anal con reservorio colónico en J aumenta la capacidad de retención y mejorar la calidad de vida de los pacientes (Figura 3).80 Algunos estudios prospectivos han mostrado la superioridad de la anastomosis colo-anal con un reservorio en J de 6 cm a 8 cm, en relación con la anastomosis colo-anal lineal, en particular, durante el primer año de la cirugía.81 Se ha observado una reducción en la tasa de fuga de anastomosis, en el número de evacuaciones por día, así como una mejoría en la calidad de la vida de los pacientes con reservorio en comparación con las anastomosis colo-anales lineal después de una RAB.82,83
¿ Figura 3. Esquema de una anatomosis colo-anal con reservorio colónico en J.
En 1997 se desarrolló la coloplastía transversa.84 En esta técnica se realiza un corte longitudinal de la porción inferior de colon que se va a anastomosar con un cierre transversal del mismo. Un estudio aleatorizado reciente demostró resultados funcionales comparables a un reservorio, con una adecuada sensibilidad neo-rectal.83 Sin embargo, otro estudio documentó tasas de fuga mayores, sin diferencias en la función intestinal.85 El reservorio colónico en J proporciona una función intestinal óptima postoperatoria, con menor morbilidad que la coloplastía transversal y debe ser el método de reconstrucción después de RAB.80,85 Cuando la construcción del reservorio no es técnicamente factible, la anastomosis colo-anal con coloplastía transversa es una opción razonable.
¿ Cirugía laparoscópica del cáncer rectal
El uso de la colectomía laparoscópica para cáncer de colon está bien establecido con base en cuatro grandes ensayos clínicos prospectivos: Grupo de estudio de resultados clínicos de la terapia quirúrgica (COSTSG), Cirugía laparoscópica contra abierta para cáncer colorrectal (COLOR), Cirugía laparoscópica convencional contra cirugía laparoscópica asistida en cáncer colo-rectal (MRC CLASICC trial), y el grupo de Barcelona.86-89 Estos ensayos han mostrado de manera consistente y uniforme que este abordaje se asocia con una reducción significativa en la necesidad de uso de narcóticos, analgésicos orales, estancia hospitalaria y un retorno de la función intestinal.
El estudio Barcelona y el ensayo COSTSG, tienen un seguimiento suficiente para informar datos de recurrencia y sobrevida, en ninguno de ellos se observa alguna desventaja con el abordaje laparoscópico. Los resultados del grupo de Barcelona sugieren una ventaja en la sobrevida de pacientes tratados con abordaje laparoscópico, basado únicamente en las diferencias de los pacientes con enfermedad en estadio III; sin embargo, esto no se confirma en el estudio COSTSG.86,89
La utilidad de las técnicas laparoscópicas para el tratamiento del cáncer de recto continúa siendo incierta. Los primeros informes de la RAB laparoscópica y RAP en pacientes que tienen cáncer rectal muestran que estos abordajes son técnicamente posibles y no están asociados con una peor sobrevida o recurrencia.90,91
La experiencia en la investigación de la cirugía laparoscópica en cáncer rectal no está bien definida. El subgrupo de pacientes en el estudio CLASICC que tenían cáncer de recto (n = 253) constituyen los únicos datos disponibles en ensayos clínicos controlados. El reporte inicial a corto plazo documenta un número igual de pacientes en etapas IIIB y IIIC en los diagnósticos patológicos finales. La mortalidad intrahospitalaria fue de 5%, y los pacientes que necesitaron conversión a cirugía abierta tuvieron más complicaciones. Aquellos pacientes que fueron sometidos a una resección anterior baja laparoscópica tuvieron un mayor número de márgenes de resección involucrados (el doble que los de cirugía abierta) y un incremento en la recurrencia en los sitios del puerto (nueve veces más que la abierta).88 Además, la disfunción de la vejiga a largo plazo se ha reportado de 3.1% en los pacientes con resección rectal laparoscópica y la disfunción sexual es hasta de 44% en varones.92
Un ensayo prospectivo no aleatorizado, comparó la resección abierta contra la laparoscópica en 191 pacientes con cáncer rectal. La tasa de conversión fue de 18.4%. En el grupo laparoscópico el tiempo para la movilización de los pacientes fue más corto (1.7 vs. 3.3 días, p < 0.001), los pacientes pudieron canalizar gases antes (2.6 vs. 3.9 días, p < 0.001), las evacuaciones se presentaron antes (3.8 vs. 4.7 días; p < 0.01), con un inicio más rápido a la vía oral (3.4 vs. 4.8 días, p < 0.001). La media de estancia hospitalaria, así como las tasas de morbilidad y mortalidad no tuvieron una diferencia estadísticamente significativa. El grupo laparoscópico tuvo una tasa más elevada de fugas de anastomosis (13.5% vs. 5.1%) y de reintervenciones (6.1% vs. 3.2%), sin diferencia estadísticamente significativa. El grupo laparoscópico presentó una menor tasa de recurrencia local (3.2% vs. 12.6%, p < 0.05). A pesar que la tasa de sobrevida global y libre de enfermedad a los cinco años no fue significativa entre ambos grupos (80% y 65.4% con cirugía laparoscópica, y de 68.9% y 58.9% con cirugía abierta, respectivamente), la comparación por etapas mostró una sobrevida global más prolongada para las etapas III y IV en el grupo laparoscópico (82.5% vs. 40.5%, p = 0.006, y de 15.8% vs. 0%, p = 0.013, respectivamente), así como una reducción en la tasa de mortalidad relacionada al cáncer para la etapa III en el grupo laparoscópico (11.4% vs. 51.9%, p = 0.001).93
En una revisión de la base Cochrane, de 1990 al 2005 de cuarenta y ocho estudios con 4224 pacientes, sólo tres de ellos fueron ensayos prospectivos asignados al azar. Debido a que sólo uno describió resultados de sobrevida a tres y cinco años, no fue posible realizar un metanálisis. Ellos encontraron que el abordaje laparoscópico tuvo menor pérdida sanguínea, inicio más rápido a la vía oral, se asoció con menor dolor, uso de narcóticos y respuesta inmune, con mayor tiempo quirúrgico y costos.94 El uso de las resecciones laparoscópicas del cáncer rectal requiere mayor investigación y deberán limitarse a ensayos clínicos controlados en centros con experiencia en cirugía laparoscópica y colorrectal.
¿ Calidad de vida después de la resección radical
Recientemente han sido publicados varios reportes que analizan la calidad de vida de los pacientes después de cirugía radical por cáncer rectal. El realizar una resección rectal de acuerdo a los principios de EMT con PNA reduce la incidencia de disfunción genitourinaria y sexual postoperatoria. De hecho, una serie informó que, incluso en presencia de incontinencia fecal postoperatoria, disfunción genitourinaria y sexual, los pacientes estaban satisfechos con su calidad de vida después de una resección rectal.95
Un estudio prospectivo de 329 pacientes, que utilizó los cuestionarios de la Organización Europea para el Estudio y Tratamiento del Cáncer EORTC QLQ-30 y CR-38 informó que los pacientes sometidos a una RAB tienen mejor calidad de vida en comparación con los pacientes sometidos a RAP. Además, los pacientes que no tenían estoma, o con estoma temporal tuvieron una mejor calidad de vida en comparación con los pacientes con estoma permanente.96 Otra que utilizó los mismos cuestionarios EORTC QLQ-C30 y QLQCR-38, reportó resultados opuestos. Los pacientes con estoma permanente reportaron una mejor función social, menor ansiedad y una autoestima más alta, comparados con los pacientes sometidos a un procedimiento restaurativo.97 Estos hallazgos están apoyados por otros en la literatura.98 Otros estudios ha reportado que la calidad de vida postoperatoria mejora con el tiempo, y debe ser evaluada de manera dinámica.99 En un estudio reciente se observó que los pacientes que recibieron quimiorradioterapia, los que tienen un estoma permanente y aquellos con tumores del tercio inferior del recto se asociaron con peores parámetros de calidad de vida.100 Está claro que la calidad de vida postoperatoria depende de la interacción de factores del paciente (comorbilidad y función anorrectal preoperatoria), factores del tumor (extensión de la invasión local, distancia desde el margen anal), y factores quirúrgicos (nivel de la anastomosis). Sin embargo, los datos contradictorios en las publicaciones relativas a la evaluación de la calidad de vida en los pacientes con cáncer rectal remarcan la importancia del desarrollo de instrumentos más sensibles y validados para poder medirla.
En conclusión, la cirugía para el cáncer rectal tiene como objetivos además de realizar una resección oncológicamente apropiada, intentar mantener el mecanismo del esfínter, así como una adecuada función genitourinaria y sexual. En pacientes bien seleccionados, los procedimientos mínimamente invasivos permiten menor dolor postoperatorio, una estancia hospitalaria más corta y un regreso más rápido a las actividades cotidianas.
El objetivo final es que el cirujano pueda individualizar el tratamiento basado en la etapificación preoperatoria adecuada, optimizando la combinación de una terapia multidisciplinaria, aunado a una resección oncológica de calidad, con el fin de aumentar las tasas de sobrevida global, el control loco-regional de la enfermedad y la calidad de vida del paciente.
Correspondencia: Dr. Omar Vergara Fernández.
Vasco de Quiroga No. 15, Col. Sección XVI, Delegación Tlalpan. México, D. F. CP 14000.
Fax (52) 55 5655 1076. Correo electrónico: omarvergara74@hotmail.com
Recibido el 12 de julio de 2010;
aceptado el 21 de julio de 2010.