¿ Introducción
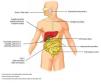
Desde el descubrimiento de las propiedades antiinflamatorias e inmunosupresoras de los glucocorticoides a finales de la década de 1940 por Kendall, Reichstein y Hench, estos fármacos han sido piedra angular en el tratamiento de una gran variedad de enfermedades autoinmunes e inflamatorias, siendo esta categoría de medicamentos una de las más prescritas.1,2 Debido a los efectos de acción en prácticamente todos los órganos y sistemas del cuerpo, la prescripción de glucocorticoides es frecuente a pesar de conocerse desde hace ya varios años los efectos adversos que traen consigo, entre los que se encuentran el síndrome metabólico, disminución de la densidad ósea, síntomas psiquiátricos y miopatía, entre otros. Estos efectos se presentan en mayor o menor medida hasta en 80% de los pacientes tratados con lo cual se limita su manejo (Tabla 1).
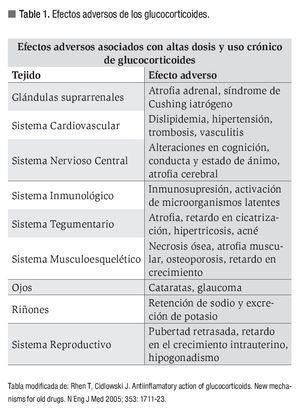
Los glucocorticoides ejercen sus múltiples funciones biológicas por medio de la activación de los elementos de respuesta a glucocorticoides (GRE, por sus siglas en inglés Glucocorticoid-Responsive Elements) al unirse a receptores intra-citoplasmáticos que se encuentran en la mayoría de las células, presentándose una serie de efectos en el sistema inmune que incluyen inhibición del reclutamiento y proliferación de linfocitos, monocitos y macrófagos, así como también reducción en la migración de neutrófilos a los sitios de inflamación y disminución en la producción de mediadores inflamatorios solubles como citocinas, leucotrienos y prostaglandinas.3 Los corticoesteroides y sus derivados sintéticos biológicamente activos son clasificados de acuerdo con su grado de actividad en el metabolismo o bien en la regulación electrolítica, denominándose glucocorticoides o mineralocorticoides, respectivamente (Tabla 2).
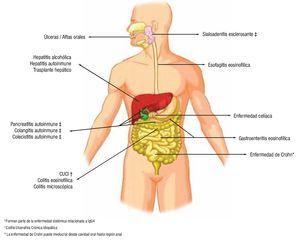
En gastroenterología, como en otras especialidades médicas, el uso de glucocorticoides es una herramienta ampliamente utilizada en el tratamiento de diversas patologías que afectan el tracto gastrointestinal, hígado, vías biliares y páncreas (Figura 1), siendo en algunos casos el tratamiento de primera línea. La dosis empleada varía considerablemente de acuerdo a la naturaleza y gravedad de la enfermedad, por lo que es necesario conocer cuándo y en qué pacientes está indicado su uso, así como también el tipo de glucocorticoide, dosis, vía de administración y duración del tratamiento, teniendo en cuenta en todo momento que el uso a largo plazo y sin un adecuado control conlleva el desarrollo de complicaciones que pueden superar a los efectos benéficos.
¿ Figura 1. Uso de corticoesteroides en gastroenterología.
A continuación presentamos una revisión sobre las indicaciones del uso de glucocorticoides en diversas patologías digestivas. A lo largo del trabajo los términos esteroides, glucocorticoides y corticoides se emplearán como sinónimos.
¿ Método
Se realizó una búsqueda en bases de datos electrónicas (PubMed y Medline) utilizando como palabras de búsqueda glucocorticoids, steroids, corticoids AND gastroenterology, de enero de 1990 marzo de 2010. Se complementó con una revisión de las referencias específicas publicadas recientemente de cada una de las patologías de gastroenterología y hepatología en las que se conoce se utilizan los esteroides.
¿ Esofagitis eosinofílica (EEo)
La EEo es una entidad clínico-patológica que se caracteriza por síntomas esofágicos persistentes a pesar de tratamiento con inhibidores de bomba de protones, lo anterior debido a que los síntomas son secundarios a actividad inflamatoria crónica por infiltración esofágica de eosinófilos4,5. La EEo afecta tanto a niños como adultos; en estos últimos, la enfermedad se caracteriza por la presencia de disfagia crónica a sólidos, no progresiva (aproximadamente 70% a 90%), impactación esofágica de alimentos y pirosis (38% de los casos), mientras que en los niños las manifestaciones clínicas son principalmente intolerancia alimentaria y síntomas de reflujo gastro-esofágico.4,6,7 Los hallazgos endoscópicos clásicos en EEo consisten en: 1) anillos concéntricos ("traquealización" o "felinización" esofágica); 2) surcos longitudinales; 3) exudados o placas blanquecinas; 4) apariencia avascular de la mucosa; 5) friabilidad de la mucosa ("papel crepé") y; 6) disminución de la luz esofágica.4 El diagnóstico se basa en criterios clínicos, endoscópicos e histopatológicos, siendo estos últimos indispensables, para lo cual deben tomarse al menos cinco biopsias que incluyan muestras de las porciones superior, media e inferior del esófago así como una muestra de mucosa gástrica y duodenal para descartar gastroenteritis eosinofílica y enfermedad de Crohn.8 El hallazgo característico es la presencia de más de 15 eosinófilos intra-epiteliales, pudiendo encontrarse además microabscesos eosinofílicos, agregados de eosinófilos en la superficie del epitelio e hiperplasia marcada de células basales, entre otros.7
El tratamiento incluye modificaciones dietéticas, terapia farmacológica dirigida a controlar la alergia y suprimir la producción de ácido, así como la dilatación endoscópica en casos seleccionados.
Existen ensayos clínicos y series de casos en los que se ha demostrado la efectividad de los corticoesteroides sistémicos y tópicos, encontrándose en un estudio que no hay diferencia significativa en la eficacia entre fluticasona tópica y prednisona oral, con resolución de síntomas en 97% y 100% respectivamente, mientras que en relación a los efectos adversos estos fueron de 40% en los pacientes tratados con prednisona oral y 15% en el grupo de fluticasona9. En el único estudio aleatorizado, controlado y comparativo de fluticasona vs placebo se encontró que un curso de tres meses de fluticasona induce remisión (menos de un eosinófilo por campo de alto poder) en 50% de los pacientes, comparado con 9% en el grupo placebo10.
Existen estudios en los que se han probado otros esteroides tópicos con resultados satisfactorios. Straumann y colaboradores realizaron un estudio aleatorizado, doble ciego, placebo controlado con budesonida acuosa vía oral (solución para nebulizar) observándose mejoría sintomática e histológica en comparación con placebo, sin embargo este estudio sólo se publicó en forma de resumen y evaluó únicamente la eficacia de budesonida para la inducción de la remisión en EEo activa, sin considerarse evolución a largo plazo.11
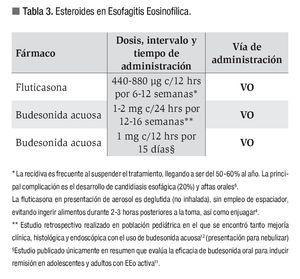
Por todo lo anterior, los esteroides tópicos son utilizados como tratamiento de primera línea en pacientes con EEo (Tabla 3).
Gastroenteritis eosinofílica (GEEo) y Colitis eosinofílica (CEo). La GEEo y la CEo son entidades diferentes a la EEo. Para fines de clasificación, la GEEo y CEo se dividen en primaria, también llamada gastroenteropatía alérgica/colitis alérgica de la infancia, y secundaria si se encuentra relacionada con otras alteraciones como síndrome hipereosinofílico, enfermedad de Crohn, enfermedad celíaca, vasculitis, entre otras.6,13
La manifestaciones clínicas dependen de la capa del tracto gastrointestinal afectada, teniéndose 3 tipos: mucosa, muscular y subserosa, siendo los porcentajes de presentación en caso de GEEo de 57.7%, 30% y 12.5% respectivamente. La infiltración por eosinófilos en el tracto digestivo puede involucrar cualquier parte del mismo, sin embargo, usualmente se afecta el estómago e intestino delgado.14
Debido a la baja frecuencia de estas entidades no existen adecuados estudios clínicos que evalúen las diferentes modalidades terapéuticas empleadas para la GEEo y CEo por lo que los tratamientos empleados se basan en reportes y series de casos exclusivamente.15 Hasta el momento el tratamiento de elección en casos de GEEo no obstructiva son los corticoesteroides asociados con dietas elementales o libres del agente alergeno (en caso de tenerlo), observándose mayor beneficio de los corticoesteroides en casos de involucro subseroso.16 Otras modalidades terapéuticas son el empleo de cromolin, montelukast, ketotifeno y derivados del ácido 5-aminosalicílico. En la CEo dada su menor frecuencia se extrapolan los resultados observados en casos de GEEo, sugiriéndose el uso de corticoesteroides como prednisona o budesonida.6,17 El tratamiento recomendado en la GEEo es prednisona a dosis de 20 mg a 40 mg/día por vía oral durante ocho semanas. El tratamiento recomendado en la CEo es prednisona a dosis de 20 mg a 40 mg/día por vía oral durante una a dos semanas o budesonida 9 mg/día por vía oral durante una o dos semanas.
Enfermedad Celíaca Refractaria (ECR). La enfermedad celíaca es una enteropatía autoinmune desencadenada por la ingesta de gluten en individuos genéticamente predispuestos. El tratamiento fundamental para esta enfermedad es una dieta libre de gluten, sin embargo, entre 7% a 30% de las personas afectadas no presentan una respuesta adecuada al tratamiento dietético.17 En estos casos es necesario descartar causas potencialmente tratables como consumo inadvertido de gluten, sobrepoblación bacteriana, colitis microscópica (hasta en 20% de los casos), entre otras. Es en este grupo de pacientes en los que se presenta la ECR, definida por la persistencia del síndrome de mala-absorción asociado a atrofia de vellosidades del intestino delgado e incremento en el número de linfocitos intraepiteliales (LIE), a pesar de una dieta estricta libre de gluten por al menos seis a 12 meses. La ECR se clasifica como primaria en los casos en que el paciente nunca presentó respuesta a la dieta libre de gluten, y secundaria si posterior a una respuesta a la dieta presenta recaída a pesar de apego dietético estricto. Existe otra clasificación que divide a la ECR en tipo I o tipo II de acuerdo a si los LIE son poli o monoclonales.18,19
En los pacientes con ECR, principalmente aquellos con síntomas graves, persistentes o recurrentes, el tratamiento de elección es el empleo de corticoesteroides solos o en combinación con inmunomoduladores. La budesonida es el fármaco de elección debido a su elevada actividad glucocorticoide tópica y baja biodisponibilidad sistémica, mostrando su mayor efectividad en casos de ECR tipo I.18,19 En un estudio retrospectivo de 29 pacientes con ECR se encontró respuesta clínica adecuada con el empleo de budesonida ya sea sola o en combinación con esteroides sistémicos o azatioprina en 75% de los pacientes, inclusive en 4/5 con ECR tipo II, sin reportarse efectos adversos con el uso de este fármaco, sin embargo dada la naturaleza del estudio no se especifica el papel de cada uno de los fármacos inmunosupresores en caso de tratamiento combinado, ni tampoco el porcentaje de recaída; además es importante considerar que en ninguno de los pacientes respondedores se demostró respuesta histológica18.
El tratamiento recomendado es budesonida 9 mg/día por vía oral o prednisona 20 mg a 40 mg/día por vía oral, generalmente por tiempo prolongado (más de seis meses), por lo que se debe ajustar la dosis de medicamentos de acuerdo a la respuesta clínica o desarrollo de efectos adversos.
Enfermedad Inflamatoria Intestinal (EII). La enfermedad de Crohn (EC) y la colitis ulcerativa crónica idiopática (CUCI) representan las dos principales formas de EII, sin embrago, en aproximadamente 10% a 15% de los casos no es posible diferenciar entre EC y CUCI, denominándose a esta entidad colitis no clasificada. El término de colitis indeterminada se reserva a aquellos casos que se hayan estudiado por patología el producto de colectomía.20,21 Es ya conocida la respuesta terapéutica a los corticoesteroides en EII, típicamente definida como la mejoría clínica posterior al inicio del tratamiento con altas dosis de corticoesteroide oral (40 mg a 60 mg de prednisona o su equivalente) en los primeros 30 días, o intravenoso durante los primeros siete a 10 días.22 En la actualidad la respuesta al tratamiento no se limita a la mejoría clínica, siendo necesario además mejoría en la calidad de vida, disminución en el número de hospitalizaciones, cirugía y de forma importante, la respuesta histológica (principalmente en CUCI).23 En un estudio de cohorte con seguimiento a 12 meses en el que se analizó la historia natural de la EII posterior al empleo de corticoesteroides, se evidenció que 74 pacientes (43%) con EC y 63 (34%) con CUCI, requirieron tratamiento con corticoesteroides; no obstante que 84% de los pacientes con EC o CUCI respondieron inicialmente al tratamiento, sólo 32% de los pacientes con EC y 49% con CUCI se mantuvieron en remisión sin necesidad de cirugía o tratamiento prolongado con corticoesteroides durante el tiempo de seguimiento.22 Resultados similares se observaron en el estudio de Chiam y colaboradores, que evidenciaron que a pesar de que los corticoesteroides son efectivos en el manejo de pacientes con EC o CUCI, la dependencia o resistencia a los mismos es frecuente, siendo los casos de EC fistulizante o estenosante y los de CUCI extensa los que presentan mayor riesgo de falla al tratamiento.24
Enfermedad de Crohn. La EC se caracteriza por una inflamación focal, asimétrica, transmural, y ocasionalmente granulomatosa que puede involucrar cualquier parte del tracto digestivo. Al momento del diagnóstico aproximadamente 50% de los pacientes presentan afección de íleon y colon, 28% ileal (como ileítis terminal), y 25% sólo involucro colónico. Los tipos de presentación de acuerdo a los patrones principales de afectación son el luminal (inflamatorio/estenosante) y fistulizante, siendo los datos clínicos característicos la presencia de diarrea crónica (85%), dolor abdominal, pérdida de peso y fiebre. La EC debido a su naturaleza multisistémica se asocia con una serie de manifestaciones extraintestinales a nivel de articulaciones, ojos, piel, entre otros.20,25
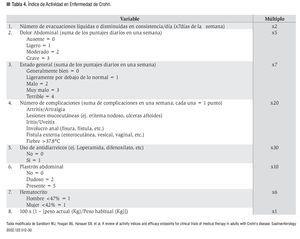
Para el inicio del tratamiento es necesario evaluar la localización, gravedad y complicaciones asociadas, empleándose el sistema de graduación de actividad de la enfermedad de la Organización Europea de Crohn y Colitis (Tabla 4).26,27 Las opciones terapéuticas en EC consisten en aquellas destinadas al tratamiento del cuadro agudo, las dirigidas a la inducción a la remisión clínica, y las orientadas a mantener la respuesta sostenida/remisión; empleándose para esto diversos fármacos (derivados del ácido 5-aminosalicílico, antibióticos, esteroides, inmunomoduladores, terapia biológica), así como también cirugía. La evidencia es clara y se conoce que, exceptuando a los pacientes con EC leve e involucro colónico, los derivados del ácido 5-aminosalicílico y antibióticos son inefectivos y su tratamiento de rutina no está justificado.28
El uso de corticoesteroides en el contexto de EC tiene indicaciones precisas (Tabla 5) y no se consideran fármacos de mantenimiento (incluyendo budesonida), siendo poco probable que los pacientes con EC permanezcan estables pasado el primer año de haber sido tratados de forma aguda con corticoesteroides si no se inicia una terapia de mantenimiento efectiva (inmunomoduladores, agentes biológicos).25
En pacientes con actividad leve no se recomienda el uso de corticoesteroides como fármacos de primera línea debido a sus efectos adversos,23 sin embargo en meta-análisis y revisiones sistemáticas se ha demostrado que el empleo de budesonida vía oral debido a su acción local y poca biodisponibilidad sistémica (por consiguiente menores efectos adversos) es una adecuada opción terapéutica comparada con placebo y mesalamina en la inducción y remisión en casos de EC con actividad leve-moderada y limitada a íleon y colon derecho.29,30
En casos de EC moderada-grave y grave-fulminante dada la necesidad de un tratamiento rápido para evitar complicaciones, los corticoesteroides orales e intravenosos son el tratamiento de elección para la inducción a la remisión, quedando los inmunomoduladores como la azatioprina y 6-mercaptopurina como fármacos ahorradores de esteroides para el mantenimiento de la remisión inducida por estos fármacos, debido a su inicio de acción tardío (tres meses).
El uso de metotrexate parenteral (25 mg/semanales), debe considerarse como un tratamiento de inducción a la remisión en caso de pacientes dependientes o refractarios a los esteroides. Los agentes biológicos como infliximab, adalimumab y certolizumab quedan reservados a los casos de EC moderada-grave que no haya presentado respuesta satisfactoria a un curso completo con esteroides o inmunospresores.23,25,26 Debido a que la EC es una enfermedad de naturaleza crónica y recidivante, uno de los objetivos terapéuticos una vez alcanzada la inducción a la remisión definida por una puntuación en el índice de actividad CDAI < 150 (CDAI por sus siglas en inglés Crohn Disease Activity Index) es prevenir la recurrencia de los síntomas, para lo cual es necesario el tratamiento de mantenimiento.31 Dentro de los fármacos empleados, la azatioprina y 6-mercaptopurina han mostrado su efectividad como tratamiento de mantenimiento en diversos estudios, siendo las dosis convencionales de 2 mg a 2.5 mg/kg/día para azatioprina, y de 1 a 1.5 mg/ kg/día para 6-mercaptopurina; otro fármaco empleado como terapia de mantenimiento es el metotrexate a dosis de 15 mg/semanales, el cual es efectivo en caso de que la inducción a la remisión se haya realizado con el mismo fármaco.32
El manejo por pasos (stepwise o step-up therapy) descrito previamente ha sido el abordaje convencional en los pacientes con EC, sin embargo, con el advenimiento de los fármacos biológicos y debido a sus resultados favorables en la inducción (40% a 80% en 14 a 12 semanas) y remisión observadas con infliximab, adalimumad y certolizumab, actualmente hay evidencia creciente que apoya el uso de estos fármacos como tratamiento de primera línea en combinación con inmunomoduladores o esteroides en caso de EC moderada-severa debido a sus propiedades inmunosupresoras potentes (top-down therapy), observándose los mejores resultados en caso de iniciarse estos fármacos en etapas tempranas de la enfermedad, así como también en pacientes vírgenes a tratamiento con inmunosupresores o inmunomoduladores.23,33
Colitis Ulcerativa Crónica Idiopática. La CUCI es una enfermedad inflamatoria crónica no granulomatosa que afecta invariablemente la mucosa rectal (95%), extendiéndose de forma proximal, circunferencial y continuamente a las distintas porciones del colon, llegando a afectar el íleon terminal (backwash ileitis) en caso de pancolitis. Típicamente la CUCI se caracteriza por un curso clínico de recaída y remisión.21 La extensión de la enfermedad varía ampliamente, al momento del diagnóstico aproximadamente 40% de los casos presentan sólo proctitis y 40% afección de colon izquierdo, mientras que un 20% tienen pancolitis.20 Las principales manifestaciones clínicas son evacuaciones diarreicas sanguinolentas, dolor abdominal de predominio en cuadrante inferior izquierdo, así como también pujo, tenesmo y urgencia rectal. Al igual que la EC, la CUCI puede presentar múltiples manifestaciones extraintestinales que pueden estar relacionadas a la actividad de la enfermedad como es el caso de la epiescleritis, escleritis, uveítis, artropatías periféricas, eritema nodoso y pioderma gangrenoso, o bien tener un curso clínico independiente de la CUCI como en el caso de la colangitis esclerosante primaria, artropatías axiales, sacroilitis y espondilitis anquilosante.34 El diagnóstico se realiza tomando en consideración las manifestaciones clínicas, segmento de intestino involucrado, características histopatológicas y el apoyo de marcadores inmunológicos en determinadas ocasiones.
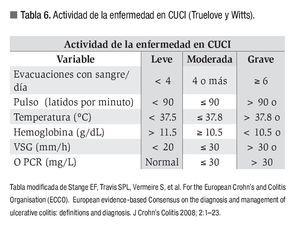
Una vez realizado lo anterior, y descartadas otras causas de colitis inflamatorias e infecciosas, el siguiente paso es evaluar el grado de actividad de la enfermedad mediante parámetros clínicos y de laboratorio, para lo cual se emplean los criterios de Truelove y Witts (Tabla 6), así como también determinar por medio de estudio colonoscópico el segmento de colon afectado.35 Los objetivos terapéuticos en la CUCI son el tratamiento del cuadro agudo, la inducción y mantenimiento de la remisión clínica e histológica, mejoría en la calidad de vida, disminución del uso a largo plazo de esteroides y reducción en el riesgo de cáncer.34 Los fármacos de primera línea son los derivados del ácido 5-aminosalicílico, reservándose el uso de esteroides a casos seleccionados (Tabla 7). Otros fármacos empleados son los inmunomoduladores (azatioprina, 6-mercaptopurina, metotrexate), agentes biológicos (infliximab), inhibidores selectivos de moléculas de adhesión (natalizumab), entre otros.3,35
Para el inicio del tratamiento en la CUCI es necesario conocer la gravedad del cuadro así como el segmento de colon afectado; en términos generales, y de acuerdo con las últimas recomendaciones del Colegio Americano de Gastroenterología, los esquemas de tratamiento recomendado son los siguientes:34 En casos de colitis distal con grado de actividad leve a moderada el tratamiento de elección son los derivados del ácido 5-aminosalicílico (aminosalicilatos), siendo la mesalazina tópica superior a esteroides tópicos (budesonida, hidrocortisona o beclometasona en enemas) y a los aminosalicilatos vía oral, teniendo un mayor beneficio con tratamiento combinado a base de aminosalicilatos tópicos y en enemas.
El uso de esteroides sistémicos en casos de colitis distal queda reservado a los casos excepcionales en los que no se consiga inducción a la remisión con los tratamientos previamente descritos, utilizándose en estos casos prednisona a dosis de 40 mg a 60 mg/día. Otra opción terapéutica diferente a la prednisona es el uso de infliximab; sin embargo, no existen estudios específicos para estos dos fármacos en casos de colitis distal.34
En relación al uso de esteroides tópicos (enemas) en casos de CUCI con actividad distal, son dos los ensayos clínicos en los que se informó la superioridad de la budesonida (budesonida 2 mg/100 mL de solución fisiológica al día) sobre placebo;36,37 y por otra parte en un meta-análisis se señaló que los enemas de dipropionato de beclometasona son igual de efectivos que los enemas de aminosalicilatos para el control sintomático en casos de CUCI distal38.
Para el mantenimiento de la remisión en CUCI distal, los fármacos más comúnmente empleados son los aminosalicilatos, ya sea en forma de supositorios para el caso de proctitis, o bien, en enemas/vía oral en caso de colitis distal, no teniendo ningún papel los esteroides tópicos en este contexto. En los casos de falla a los tratamientos anteriores, la azatioprina, 6-mercaptopurina e infliximab han probado ser efectivos como fármacos de mantenimiento.34
En los casos de colitis extensa (proximal a la flexura esplénica) con actividad leve a moderada el tratamiento de primera línea son los aminosalicilatos, mismos que se recomiendan como fármacos de mantenimiento, quedando reservado el uso de esteroides sistémicos (prednisona 40 mg a 60 mg/día) en caso de que no se logre controlar la actividad de la enfermedad a pesar del uso de amino-salicilatos orales y tópicos, o bien que los síntomas sean importantes y problemáticos para el paciente que justifiquen su uso de forma inicial. La azatioprina y 6-mercaptopurina se emplean en caso de que el paciente continúe con datos de colitis moderada a pesar del tratamiento con corticoides sistémicos y que no esté lo suficientemente grave para su empleo intravenoso, así como también como fármacos de mantenimiento en pacientes dependientes a esteroides. El uso de infliximab ha demostrado su efectividad en los caso de enfermedad refractaria o dependencia al uso de corticoides como terapia de inducción y mantenimiento.34
Existe un subgrupo de pacientes con CUCI grave que es refractaria al tratamiento vía oral y tópico a dosis máximas con aminosalicilatos y corticoides, en los que se puede iniciar tratamiento con infliximab siempre y cuando no haya contraindicaciones y no se requiera hospitalización de urgencia. En caso de que el paciente se presente con datos de toxicidad sistémica es necesaria su hospitalización para manejo integral y curso de corticoides intravenosos (hidrocortisona 300 mg/ día o metilprednisolona 60 mg/día), teniendo en mente que en caso de no existir mejoría dentro de los tres a cinco días el paciente deberá ser considerado para colectomía o ciclosporina intravenosa, ya que en pacientes hospitalizados con CUCI grave y tratamiento con corticoides intravenosos la falla al tratamiento llega a ser hasta de 20% a 40%.34 Debido a las características de la enfermedad y a su historia natural, el manejo de los pacientes con CUCI típicamente se realiza de forma escalonada (stepwise o step-up therapy) sin tener por el momento cabida en el esquema de manejo el tratamiento inicial con terapia biológica o top-down therapy.23
Colitis microscópica (CM). Es una entidad patológica de tipo inflamatorio distinta a la EC y la CUCI que comprende a dos patologías principales: colitis colagenosa (CC) y linfocítica (CL), caracterizadas clínicamente por la presencia de diarrea crónica, no sanguinolenta, principalmente de tipo secretor, asociada a mucosa de colon macroscópicamente normal. Algunos autores consideran a la CM como un subtipo de EII,20 sin embargo, dadas las manifestaciones clínicas, estructuras afectadas y hallazgos histológicos diferentes, es preferible considerar a la CM como una entidad aparte.39
La distinción entre CC y CL es histológica. Sus características principales son: engrosamiento de la capa de colágena subepitelial ≥10μm en la CC, y el aumento en el número de linfocitos intraepiteliales (≥ 20/100 células epiteliales) en la CL. La CM afecta principalmente a mujeres de edades entre 60 a 70 años, el curso clínico generalmente es crónico, recurrente y benigno, aunque hay reportes de complicaciones graves como perforación colónica39. Los pacientes con CM generalmente presentan enfermedades autoinmunes concomitantes, principalmente enfermedad tiroidea, esprúe celíaco (hasta 20% en casos de CC), diabetes mellitus y artritis reumatoide.40,41
La budesonida es el fármaco mejor probado para el tratamiento de la CM, ya que mejora los síntomas clínicos y la calidad de vida, sin embargo la recidiva en caso de descontinuación es frecuente.42-44 La dosis recomendada es 9 mg c/24 horas por seis a ocho semanas.
Recientemente, en una revisión sistemática de estudios aleatorizados se encontró que la budesonida es un fármaco efectivo y bien tolerado para la inducción y mantenimiento de la respuesta clínica e histológica en pacientes con CC, así como para la inducción clínica e histológica en casos de CL.45 Son varios los ensayos clínicos aleatorizados controlados en los que consistentemente se ha encontrado que la budesonida a dosis de 9 mg/ día por seis a ocho semanas es superior a placebo, en el control de la CC con respuestas superiores a 80%.46-48 En relación al tratamiento de mantenimiento con budesonida para CC, en dos estudios aleatorizados, doble ciego, placebo controlados se encontró que el tratamiento con budesonida 6 mg/ día por seis meses fue superior a placebo, con respuestas sostenidas de 74% y 76.5% en el grupo de budesonida, vs. 35 y 12% en el grupo placebo.49,50
A diferencia de la CC, existe sólo un estudio aleatorizado, doble ciego, placebo controlado en el que se evalúa el papel de la budesonida 9 mg/ día por seis semanas en la remisión clínica, encontrándose ésta en 86% de los pacientes tratados con budesonida y en 48% de los pacientes del grupo placebo (p = 0.01).51
Hepatitis alcohólica (HA). Consiste en un síndrome agudo, secundario a daño hepático predominantemente colestásico, desarrollado en aproximadamente 35% de los alcohólicos consuetudinarios y asociado a un mal pronóstico; con mortalidad de 30% a 50% de los casos a 28 días. Histológicamente se caracteriza por esteatosis, daño hepatocelular grave, infiltrado inflamatorio y fibrosis pericelular.52,53 Para establecer el diagnóstico de HA basta con tener el antecedente de consumo de alcohol de forma frecuente asociado a los hallazgos clínicos y estudios de laboratorio, siendo estos últimos indispensable para corroborar el diagnóstico y establecer la gravedad.52 El signo cardinal en la HA es la presencia de ictérica, la cual es de rápida instauración y progresiva. Otros datos clínicos frecuentes incluyen fiebre, ascitis y debilidad muscular proximal, así como también datos de encefalopatía hepática en casos graves.54
No existe ningún estudio de laboratorio que permita establecer de forma definitiva el diagnóstico de hepatitis alcohólica ya que son múltiples las alteraciones bioquímicas observadas en estos pacientes. Los niveles séricos de transaminasas juegan un papel importante en la evaluación diagnóstica en caso de HA, generalmente los niveles de aspartato aminotransferasa (AST) se encuentran elevados dos a seis veces por encima de su valor normal, siendo poco frecuente valores mayores a 500 UI/L, y en relación a la alanino aminotransferasa (ALT), sus valores rara vez son mayores a 200 UI/L. En aproximadamente 70% de los pacientes con enfermedad hepática alcohólica la relación AST/ALT es mayor a dos; valores mayores a tres sugieren altamente la presencia de HA, teniendo mayor rendimiento diagnóstico en pacientes no cirróticos.55
Son múltiples las escalas que predicen supervivencia en los casos de HA, sin embargo las más empleadas son la función discriminatoria de Maddrey, el modelo para la enfermedad hepática terminal (MELD), la puntuación de Glasgow, la puntuación de Lille, y recientemente el ABIC (por sus siglas en inglés Age, Bilirubin, INR, serum Creatinine).56 la abstinencia de alcohol corresponde al tratamiento angular en los casos de HA. La necesidad de considerar tratamiento farmacológico radica en si el paciente es de bajo o alto riesgo de acuerdo a las escalas pronósticas citadas previamente (Tabla 8). Los únicos tratamientos farmacológicos que han mostrado beneficio moderado en la supervivencia en casos de HA son el uso de esteroides y pentoxifilina (Tabla 9).52 En términos generales se sugiere el uso de corticoides en casos de HA con puntuación de Maddrey ≥ 32 con o sin encefalopatía hepática, siempre y cuando no exista contraindicación para su uso (infección activa, hemorragia gastrointestinal).55 En un estudio se evidenció que los pacientes con HA que presentaron disminución en las cifras de bilirrubina al día siete de haber iniciado el tratamiento con esteroides, presentaron una mejoría significativa en la supervivencia a seis meses, comparada con aquellos que no presentaron disminución (82.8% ± 3.3% vs. 23% ± 5.8%, p < 0.0001).57 En relación al uso de pentoxifilina, recientemente en un meta-análisis no se encontró evidencia consistente para establecer conclusiones sobre su uso, sin embargo, los autores encontraron un posible efecto benéfico en la mortalidad general y en la asociada a síndrome hepatorrenal en pacientes con HA, no obstante en los pacientes tratados se encontró el desarrollo de eventos adversos mayores y menores, por lo que no hay evidencia hasta el momento que justifique su empleo.58
Hepatitis autoinmune (HAI). La HAI es una enfermedad inflamatoria crónica de etiología desconocida, caracterizada por la presencia de ictericia, elevación de las transaminasas, presencia de autoanticuerpos y anormalidades en las globulinas séricas. La clasificación de la HAI se basa principalmente en los patrones de anticuerpos circulantes, teniéndose dos tipos. La HAI tipo 1 es la forma más frecuente, asociada a anticuerpos anti-nucleares (ANA), anticuerpos anti-músculo liso (SMA) y anticuerpos anti-actina (AAA). En la HAI tipo 2 los anticuerpos asociados son los antimicrosomales hígado/riñón (ALKM-1).59 Recientemente se ha propuesto una nueva clasificación de la HAI tomando en cuenta la presencia o ausencia de células plasmáticas con inmunotinción positiva para IgG4, observándose una respuesta importante al tratamiento con esteroides en la primera.60 El diagnóstico se fundamenta considerando las características clínicas, los parámetros bioquímicos, los auto-anticuerpos circulantes, las alteraciones en las globulinas séricas y la histología, siendo de utilidad el empleo de sistemas de puntuación (completo o simplificado) previamente estandarizados para apoyar el diagnóstico.61
Para la selección de pacientes candidatos a tratamiento médico, se deben considerar los siguientes aspectos: sintomatología incapacitante, evolución progresiva o fulminante, niveles de transaminasas y globulinas séricas, datos histológicos de fibrosis en puente, necrosis multiacinar, hepatitis de interfase (Tabla 10). Con lo anterior al paciente se le cataloga con indicación absoluta, relativa, o sin indicación. En caso de iniciarse el tratamiento se cuenta con dos tipos de esquemas de acuerdo con el protocolo de la Clínica Mayo (Tabla 11), ya sea monoterapia con esteroides o terapia dual con inmunomoduladores (azatioprina).62
El uso de corticoides en los casos de HAI se ha establecido como un tratamiento efectivo. La prednisona sola o en combinación con azatioprina induce remisión clínica, de laboratorio, e histológica hasta en 65% de los pacientes con HAI tipo 1 dentro de los primeros 18 meses, y hasta en 80% en el primer año.63 No obstante, la remisión de la enfermedad es difícil de mantener debido a que la suspensión del tratamiento se asocia con recaída en 50% a 86% de los pacientes dentro del primer año. Dentro de los factores implicados en la recaída una vez descontinuado el tratamiento se encuentran la falta de normalización en los parámetros bioquímicos (niveles séricos de AST, IgG y g-globulinas).64
En casos de HAI con presentación aguda-grave (rápidamente progresiva) o fulminante el tratamiento con corticoides se debe iniciar una vez descartadas las etiología más frecuentes como son las virales, inducida por fármacos, alteraciones tóxicas y metabólicas. La respuesta a esteroides generalmente se hace evidente de forma rápida, con tasas de respuesta de 36% a 100%, siendo la falta de respuesta en los marcadores bioquímicos de inflamación dentro de las 2 semanas de iniciado el tratamiento una indicación para trasplante hepático. Dentro de los marcadores de poca respuesta a esteroides en HAI aguda-grave se encuentran una puntuación de MELD ≥ 12 (sensibilidad 97%, especificidad 68%), así como también la presencia de proceso infeccioso activo.63
Anteriormente los pacientes con HAI asintomática y con actividad moderada se consideraban como no candidatos a tratamiento debido a que su supervivencia excedía 80% a los 10 y 15 años. No obstante se ha encontrado que este grupo de pacientes desarrollan cirrosis hasta en 49% de los casos a 15 años y que la mortalidad a 10 años puede ser mayor a 10%. Por lo anterior y de acuerdo a opinión de experto, se sugiere que este grupo de pacientes sean tratados con los esquemas convencionales para HAI.63
Pancreatitis autoinmune (PAI). No obstante que el primer informe de pancreatitis e hipergammaglobulinemia se realizó en 1961 por Sarles y colaboradores, fue hasta 1995 cuando Yoshida y colaboradores caracterizaron esta nueva entidad e introdujeron el nombre de PAI para su definición.66 Son varias las características clínicas, por imagen, serológicas e histopatológicas que definen a la PAI, sin embargo, la forma de presentación típica es la ictericia obstructiva. Clínica e histológicamente se conocen dos tipos principales: PAI tipo 1 o pancreatitis linfoplasmocítica esclerosante, la cual se encuentra asociada con enfermedad sistémica relacionada a IgG4 (ESRI) en 60% a 70% de los casos, afecta principalmente a hombres en edad adulta y se asocia a niveles séricos elevados de IgG4 en aproximadamente 75% de los casos; y la PAI tipo 2 o ductocéntrica, caracterizada por lesiones epiteliales granulocíticas, afecta a individuos jóvenes, generalmente no relacionada con elevación de IgG4 y sin involucro sistémico, con la excepción de EII (hasta en 20% de los casos).67
Para establecer el diagnóstico de PAI se emplean diversos criterios, entre los que se encuentran los estudios de imagen (colangiopancreatografia endoscópica o por resonancia magnética), histología y la respuesta al tratamiento con esteroides, piedra angular del tratamiento, observándose generalmente la respuesta dentro de las primeras dos semanas, misma que se corrobora por medio de niveles séricos de IgG4 e imagen.67 Se recomienda el empleo de prednisona a dosis de 40 mg/día por cuatro semanas y posteriormente su reducción de 5 mg/semana para un total de 11 semanas.
Enfermedad sistémica relacionada a IgG4 (ESRI). La ESRI constituye una nueva entidad clínico-patológica caracterizada por la infiltración de diversos órganos por células plasmáticas IgG4 positivas y linfocitos T, asociada a cambios fibróticos y en ocasiones flebitis, cuya patogenia y etiología son aún desconocidas. Entre las estructuras afectadas y que traducen manifestaciones clínicas se encuentran el páncreas, vesícula y vía biliar, glándulas salivales, retroperitoneo, riñón, pulmón, y próstata. La enfermedad habitualmente se presenta en hombres adultos, se asocia a linfadenopatía y tiene adecuada respuesta al tratamiento con esteroides.68
Algunas de las enfermedades asociadas a ESRI son las siguientes:
Pancreatitis autoinmune (PAI) tipo 1. Descrita anteriormente.
Colangitis asociada a IgG4 (CAI). Esta variante de enfermedad, se asemeja y asocia hasta en 92% de los casos con la PAI tipo 1. Histológicamente se caracteriza por infiltrado linfoplasmocítico rico en células IgG4 en muestras de tejido de la vía biliar. En los estudios de imagen es característica la presencia de estenosis a nivel de la vía biliar y, a diferencia de la colangitis esclerosante primaria, las estenosis presentan respuesta satisfactoria con el empleo de esteroides, de tal manera que este criterio y la presencia de células IgG4 positivas en las muestras de tejido biliar son considerados como criterios diagnósticos de CAI.69 Se recomienda el empleo de prednisona a dosis de 40 mg/ día por cuatro semanas, posteriormente reducción de 5 mg/semana por un total de 11 semanas. En los casos de CAI con involucro de la vía biliar externa (proximal) e intrahepática, debe considerarse la administración de azatioprina a dosis de 2 mg/Kg para mantener en remisión.
Hepatitis asociada a IgG4 (HAIg). En el contexto de ESRI y PAI tipo 1 el involucro a nivel de hígado y vía biliar son frecuentes, manifestándose principalmente como un patrón colestásico u obstructivo en las pruebas de funcionamiento hepático y documentándose por medio de estudio histopatológico la presencia de infiltrado por células plasmáticas con inmunotinción positiva para IgG4, presentando de forma característica respuesta al tratamiento con esteroides.69
Es importante diferenciar la HAIg que no es más que la manifestación hepática de la ESRI, de la hepatitis autoinmune IgG4 positiva la cual no se asocia a ESRI.
Trasplante hepático ortotópico (THO). Actualmente el THO es el tratamiento de elección en un grupo seleccionado de pacientes con enfermedad hepática terminal, falla hepática aguda y carcinoma hepatocelular. Gracias al perfeccionamiento en las técnicas quirúrgicas, así como también a los avances en el tratamiento inmunosupresor la sobrevida a cinco años llega a ser hasta de 70% a 80%, teniendo los pacientes en términos generales una adecuada calidad de vida.70 Como en todos los tipos de trasplante, el rechazo es una de las complicaciones esperadas, previamente la frecuencia de rechazo celular agudo era de 50% a 70%, siendo actualmente menor a 30%. La mayoría de los episodios de rechazo ocurren dentro de los tres primeros meses posteriores al THO por lo que los pacientes requieren inmunosupresión continua.71 En términos generales no existe un esquema de inmunosupresión "universal" para los pacientes con THO, por lo que el tratamiento debe ser individualizado. Son múltiples los fármacos empleados, entre los que se encuentran: inhibidores de calcineurina (ICN), inhibidores de rapamicina, mofetil micofenolato, esteroides, globulina anti-timocito y anti-linfocito.72
Los ICN (ciclosporina y tacrolimus) son la estructura medular del tratamiento inmunosupresor en el THO, por otra parte, los corticoesteroides son los inmunosupresores no-ICN más empleados debido a sus múltiples mecanismos efectores, principalmente a nivel transcripcional al bloquear la expresión de citocinas como las IL-1, IL-2, IL-3, e IL-6 (vía proteína activadora 1 y factor nuclear kb); así como también por su efecto en el bloqueo de la síntesis de eicosanoides, disminución en la expresión de moléculas de adhesión, incremento en la expresión de factor de crecimiento transformante b, estabilización de membrana lisosomal, y disminución en la liberación de histamina y bradicinina.71,73
El uso de corticoesteroides en el contexto de THO se centra en tres apartados: 1) durante la fase de inducción, 2) como terapia de mantenimiento asociada la mayoría de las ocasiones con ICN, y 3) en casos de rechazo celular agudo.
La dosis de esteroides e indicación en el THO varía de acuerdo con el protocolo de trasplante que se siga (Tabla 12).
¿ Conclusión
En gastroenterología, como en otras especialidades médicas, el uso de corticoesteroides es una herramienta ampliamente utilizada en el tratamiento de diversas patologías que afectan el tracto gastrointestinal, hígado, vías biliares y páncreas, siendo necesario conocer cuándo y en qué pacientes está indicado su uso, así como también el tipo de glucocorticoide, dosis, vía de administración y duración del tratamiento, teniendo en cuenta en todo momento que el uso a largo plazo y sin un adecuado control conlleva el desarrollo de complicaciones que pueden superar a los efectos benéficos.
Correspondencia: Dr. Luis Eduardo Zamora Nava.
Vasco de Quiroga # 15, Col. Juan Badiano, Delegación Tlalpan, CP 14000, México, D. F.
Correo electrónico: luiseduardozn@hotmail.com
Recibido el 26 de octubre de 2009;
aceptado el 22 de junio de 2010.