Las neoplasias neuroendocrinas (NNE) se presentan en todo lo largo del aparato gastrointestinal (GI), desde el esófago hasta el ano y también en el páncreas.
ObjetivosClasificar a las NNE de acuerdo con los criterios de la Organización Mundial de la Salud (OMS) 2010, y evaluar su distribución anatómica y características clínico-patológicas.
Material y métodosSe buscaron en los archivos de Patología todos los casos con diagnóstico de tumor carcinoide y carcinoma neuroendocrino del aparato GI y páncreas, estudiados en un lapso de 11 años (1999-2010). Los casos fueron reclasificados de acuerdo con los criterios de la OMS 2010. Se revisaron los expedientes clínicos de cada paciente.
ResultadosCiento veintisiete casos (68 hombres y 59 mujeres) conformaron el grupo de estudio. El rango de edad varió de 24 a 85, con una mediana de 52 años. Ciento trece (89,00%) ocurrieron en el tracto GI y 14 (11,00%) en el páncreas. El tamaño de los tumores varió de 0,4cm a 9cm (mediana: 2,5cm). El grado histológico de las neoplasias del aparato GI fue: 54,00% grado 1, 31,00% grado 2 y 15,00% grado 3. El grado histológico de los tumores pancreáticos fue: 43,00% grado 1, 36,00% grado 2 y 21,00% grado 3.
La sobreexpresión del Ki-67 se correlacionó con el grado tumoral (22,00% grado 3 vs 2,50% grado 1).
ConclusionesEl grado histológico en las neoplasias neuroendocrinas del aparato gastrointestinal y páncreas (NNE-GEP) es uno de los factores pronósticos más importantes. El término carcinoide debe ser abolido, ya que no refleja la conducta biológica de las neoplasias en cuestión.
Neuroendocrine tumors (NETs) present all along the length of the gastrointestinal (GI) tract, from the esophagus to the anus, and they also present in the pancreas.
AimsTo classify NETs according to the WHO 2010 criteria and to evaluate their anatomic distribution and clinicopathologic characteristics.
Material and methodsA search was carried out in the hospital pathology archives of all the cases diagnosed with carcinoid tumor and neuroendocrine carcinoma of the GI tract and pancreas studied over a period of 11 years (1999-2010). The cases were reclassified according to the WHO 2010 criteria. The clinical case records of each patient were reviewed.
ResultsThe study group was made up of 127 cases (68 men; 59 women). Age ranged from 24 to 85 years with a median of 52 years. A total of 113 (89.00%) tumors occurred in the GI tract and 14 (11.00%) in the pancreas. Tumor size varied from 0.4cm to 9cm (median: 2.5cm). GI tumor histologic grades were: 54.00% grade 1; 31.00% grade 2; and 15.00% grade 3. Pancreatic tumor histologic grades were: 43.00% grade 1; 36.00% grade 2; and 21.00% grade 3.
Ki-67 overexpression was correlated with tumor grade (22.00% grade 3 vs 2.50% grade 1).
ConclusionsHistologic grade of the gastroenteropancreatic neuroendocrine tumors (GEP-NETs) is one of the most important prognostic factors. The term carcinoid should be eliminated because it does not reflect the biological behavior of these tumors.
Las neoplasias neuroendocrinas (NNE) se presentan en la mayoría de los órganos del cuerpo y de acuerdo con su sitio de origen, muestran características clínicas y biológicas específicas del mismo, por otro lado, su aspecto morfológico (macro y microscópico) es similar1. La mayoría de las series reportadas en la literatura médica se refieren a las NNE que se originan en el pulmón, páncreas o aparato gastrointestinal (GI) y en ellas, se han propuesto sistemas de clasificación diversos2,3. Esta diferencia de criterios ha generado mucha confusión, principalmente porque neoplasias con una morfología idéntica pueden ser denominadas de manera distinta, dependiendo del sitio en el cual se presentan. En años recientes se han publicado varias guías para el manejo de las neoplasias neuroendocrinas del tracto gastrointestinal y páncreas (NNE-GEP)4,5, sin embargo, un consenso en el diagnóstico y tratamiento de las mismas es difícil de alcanzar debido a la experiencia limitada en este tema.
Cuando se analizan la mayoría de los sistemas de clasificación para las NNE-GEP publicados en la literatura médica, se puede observar una gran sobreposición en los criterios utilizados para establecer categorías tumorales específicas. Por lo anterior y con el objeto de contar con una terminología estandarizada, se han llevado a cabo varios consensos, la mayoría de los cuales ha coincidido en abandonar el término de “tumor carcinoide”6, utilizado en forma genérica para todas y cada una de las NNE-GEP, ya que el mismo no pone de manifiesto la conducta biológica de la neoplasia.
El tamaño del tumor, el número de mitosis, la extensión de la invasión y las metástasis en ganglios linfáticos o a distancia, son parámetros empleados en todos los sitios primarios7. Por lo tanto, existe un grupo de criterios básicos que deben reportarse en cada caso de NNE, lo cual permitirá transpolar con facilidad la información de un sistema de clasificación a otro.
Los objetivos de este estudio fueron:
- 1.
Clasificar a las NNE-GEP estudiadas en nuestro Hospital, durante un lapso de 11 años de acuerdo con los criterios actuales de la Organización Mundial de la Salud (OMS)8.
- 2.
Documentar las características clínico-patológicas y distribución anatómica de dichos casos.
Se buscaron en los archivos de Patología del Hospital de Oncología todos los casos (biopsias y/o especímenes de resección) con diagnóstico de: tumor carcinoide, carcinoide atípico, tumor neuroendocrino, carcinoma neuroendocrino, carcinoma de células grandes, carcinoma de células pequeñas y carcinomas poco diferenciados del tracto GI y páncreas, estudiados durante un periodo de 11 años (1999-2010). Los casos fueron evaluados y clasificados por 2 observadores en forma independiente, utilizando los criterios recientes de la OMS8 para ambos tipos de neoplasias (tabla 1).
Grado histológico de las neoplasias neuroendocrinas de acuerdo con la Organización Mundial de la Salud - 2010
| Número de mitosis | Ki67 (%) | Categoría tumoral | |
| Bajo grado | < 2/10 CSF | < 3,00 | Neoplasia neuroendocrina grado 1 |
| Grado intermedio | 2-20/10 CSF | 3,00-20,00 | Neoplasia neuroendocrina grado 2 |
| Alto grado | > 20/10 CSF | > 20,00 | Carcinoma neuroendocrino grado 3 de células pequeñas o grandes |
CSF: campos a seco fuerte.
En los casos cuya morfología no era la típica descrita para las NNE y en los cuales se sospechó su naturaleza neuroendocrina, se emplearon marcadores de inmunohistoquímica para la corroboración diagnóstica. El coctel de citoqueratinas (AE1/AE3) se utilizó para corroborar el origen epitelial de las neoplasias, cuando éstas fueron poco diferenciadas. La positividad de los marcadores como cromogranina, sinaptofisina y CD56, corroboraron la naturaleza neuroendocrina de la neoplasia.
Se eliminaron del estudio aquellos casos que resultaron ser adenocarcinomas poco diferenciados, así como los tumores compuestos (adenocarcinoma+NNE).
El antígeno de proliferación Ki67 se efectuó en todos los casos, tanto en biopsias como en especímenes de resección y en todos ellos se correlacionó con el número de mitosis. Ambos se evaluaron por unidad de área del tumor, expresado como el número de mitosis por 10 campos a seco fuerte o por cada 2mm2 del tumor, o como el porcentaje de células neoplásicas que expresaron el Ki67.
La información clínica se obtuvo de los expedientes de cada paciente.
Los términos “tumor” o “neoplasia neuroendocrina” fueron utilizados en forma indistinta en este estudio.
Análisis estadísticoSe obtuvieron las frecuencias simples y relativas en porcentajes para todas las características clínicas y las tumorales. Para contrastar las diferencias entre los tamaños tumorales según las diferentes topografías, así como la distribución de los grados histológicos, se resumió la distribución en gráficos de cajas y se utilizó análisis de varianza para grupos independientes.
ResultadosSe encontraron 113 casos de NNE del aparato GI y 14 pancreáticas. La distribución de casos por órgano se muestra en la tabla 2. Sesenta y ocho casos ocurrieron en hombres y 59 en mujeres, el rango de edad de los pacientes fue de 24 a 85 años (mediana: 52 años), sin diferencias significativas entre el género masculino y el femenino.
Número de neoplasias neuroendocrinas por órgano y grado histológico
| Órgano | Grado 1 | Grado 2 | Grado 3 | Total (%) |
| Esófago | 0 | 0 | 4 | 4 (4,00) |
| Estómago | 28 | 8 | 3 | 39 (35,00) |
| Duodeno | 6 | 6 | 4 | 16 (14,00) |
| Yeyuno | 3 | 4 | 1 | 8 (7,00) |
| Íleon | 4 | 4 | 0 | 8 (7,00) |
| Colon | 10 | 6 | 5 | 21 (19,00) |
| Recto | 8 | 3 | 0 | 11(10,00) |
| Apéndice cecal | 2 | 4 | 0 | 6 (5,00) |
Cincuenta y seis (44,00%) de los pacientes presentaron características clínicas vagas o poco específicas. Dos de los 4 pacientes con neoplasias esofágicas presentaron disfagia, reflujo y dolor torácico. Treinta y cinco (89,70%) de los pacientes con tumores gástricos tenían una larga historia de enfermedad péptica ulcerosa y/o gastritis crónica atrófica. Seis pacientes con neoplasias duodenales iniciaron su padecimiento con: hemorragia (n=2), ictericia (n=2) y obstrucción intestinal (n=2), respectivamente. Dos de los pacientes con tumores ileales tenían una historia de dolor abdominal intermitente, y otros 2 más con metástasis hepática, desarrollaron síndrome carcinoide. Seis de los pacientes con tumores colónicos debutaron con hemorragia y obstrucción intestinal. Tres de los tumores en recto se descubrieron en forma incidental. Los 6 casos de neoplasias apendiculares se manifestaron como apendicitis aguda.
Seis de los 14 pacientes con neoplasias pancreáticas iniciaron su padecimiento con dolor abdominal, pérdida de peso, anorexia y náuseas, 4 con dolor lumbar y 4 con síntomas obstructivos.
Enfermedades adicionalesUno de los pacientes con tumor esofágico tenía antecedentes de síndrome de inmunodeficiencia adquirida (SIDA), un paciente con NNE gástrica se presentó en el contexto de un síndrome de Zollinger-Ellison. Otro paciente con neoplasia duodenal, padecía además de neurofibromatosis tipo I. Tres pacientes con tumores colónicos, padecían además de enfermedad de Crohn, uno de los pacientes con NNE rectal tenía el antecedente de adenocarcinoma de ciego.
Dos de los pacientes con neoplasias pancreáticas padecían además de enfermedad de von Hippel Lindau y de Neoplasia Endocrina Múltiple tipo 1 (NEM 1), respectivamente.
Características histopatológicasNeoplasias del tracto gastrointestinal:Neoplasias esofágicasEn 3 casos la neoplasia infiltraba en forma difusa la pared del esófago y en uno de los casos se manifestó con un crecimiento polipoide. Todos los casos fueron carcinomas poco diferenciados de células pequeñas, con un tamaño mayor de 4cm.
Neoplasias gástricasEl tamaño de los tumores varió de 0,4cm a 6cm (mediana: 0,9cm). Treinta casos (77,00%) se describieron en el estudio endoscópico como lesiones polipoides principalmente localizadas en el fondo y cuerpo.
Neoplasias del intestino delgadoOnce casos fueron descritos como nódulos submucosos, el tamaño de las neoplasias varió de 0,9cm a 3cm (mediana: 1,4cm), 10 casos fueron nódulos únicos y en uno de los pacientes se encontraron 2 lesiones nodulares con una distancia entre sí de 1cm.
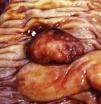
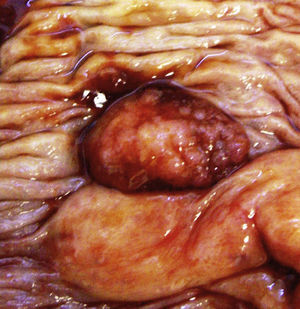
Neoplasias colónicasEl 19,00% de todos los casos en esta serie se localizaron en colon, el tamaño de las neoplasias fue de 1,5cm a 9cm, sólo un caso se manifestó como un pólipo (fig. 1), el resto de las neoplasias, en especial las mayores de 6cm, afectaban toda la pared del órgano y algunas mostraban ulceración en su porción central.
Neoplasias rectalesLas neoplasias rectales representaron el 10,00% de todos los casos en nuestra serie, la mayoría de ellas se describieron como lesiones polipoides solitarias con un diámetro mayor de 0,4cm.
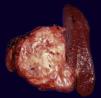
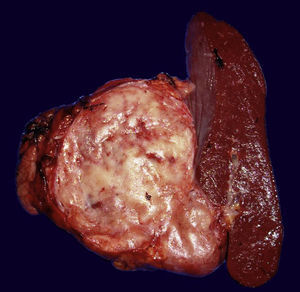
PáncreasCatorce casos de NNE pancreáticas fueron encontradas en nuestro estudio, su tamaño varió de 5cm a 8cm (mediana: 4cm), 10 se localizaron en la cabeza y 4 en la cola. La mayoría de los tumores eran bien circunscritos, de color café claro o café rojizo (fig. 2), pero el paciente con NEM 1 mostró múltiples nódulos que variaron en diámetro de 0,4cm a 0,6cm.
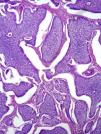
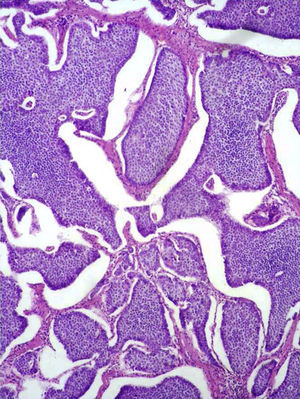
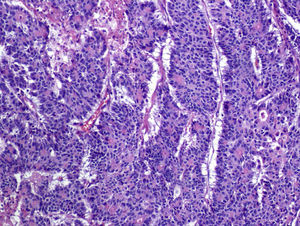
Características microscópicasEn la evaluación microscópica tanto las neoplasias del aparato GI como las pancreáticas, mostraron diferentes patrones de crecimiento o arquitectónicos. En algunos casos las células se disponían en grupos formando estructuras similares a nódulos o islas (“insulares”) (fig. 3), otras se disponían en cordones o trabéculas, o bien de manera circular en torno a un centro hialino o con formación de una luz central (“rosetas”) (fig. 4).
Las células de las neoplasias de grado 1 o grado 2 mostraron núcleos redondos, homogéneos entre sí, con cromatina fina y nucléolo poco aparente. Por otro lado, las neoplasias de alto o grado 3 mostraron núcleos con contornos irregulares e hipercromáticos.
Clasificación patológica de las neoplasias de acuerdo con los criterios de la OMS 2010Ciento trece NNE ocurrieron en el aparato GI, 56 (50,00%) tenían el diagnóstico inicial de tumor carcinoide, 31 (28,00%) de tumor carcinoide atípico, 12 (10,00%) de tumor neuroendocrino, 8 (7,00%) de carcinoma neuroendocrino y 6 (5,00%) de carcinoma poco diferenciado. Después de reclasificar estas neoplasias con los criterios de la OMS 2010, el 54,00% correspondieron al grupo de NNE de bajo grado o grado 1, 31,00% al grupo de NNE de grado intermedio o grado 2, y el 15,00% al grupo de NNE de alto grado o grado 3 (tabla 2).
Catorce casos de NNE se originaron en el páncreas, el diagnóstico inicial de las mismas fue de tumor carcinoide en 7 casos (50,00%), tumor neuroendocrino en 4 casos (29,00%) y de carcinoma neuroendocrino en 3 casos (21,00%). Cuando las mencionadas neoplasias se reclasificaron tomando en cuenta los criterios de la OMS 2010, el 43,00% fueron de bajo grado o grado 1, el 36,00% de grado intermedio o grado 2 y el 21,00% de alto grado o grado 3 (tabla 3).
Ocho casos diagnosticados inicialmente como carcinomas neuroendocrinos fueron eliminados del estudio, ya que su morfología y perfil de inmunohistoquímica no correspondieron a los descritos para este grupo de neoplasias.
Ki67 y mitosisEl número de mitosis por 10 campos a seco fuerte y el porcentaje promedio de expresión del Ki67, se correlacionaron entre sí y con el grado histológico de las neoplasias (tabla 4). Las neoplasias de alto grado mostraron un mayor índice de proliferación que las de bajo grado (grado 3 con 22,00% vs grado 1 con 2,50%).
DiscusiónLas NNE pueden ocurrir a todo lo largo del aparato GI, desde el esófago hasta el ano, pero son raras en éstas dos últimas topografías1–3. Estos tumores comprenden un amplio espectro de lesiones que van desde un proceso hiperplásico, una NNE de bajo grado hasta un carcinoma de células grandes o pequeñas7–9.
En 1963, Williams y Sandler10 clasificaron a las NNE-GEP en 3 grupos de acuerdo con el sitio en el cual se originan: derivadas del intestino proximal (estómago, páncreas, duodeno y porción superior del yeyuno), derivadas del intestino medio, (yeyuno medio, íleon, ciego y apéndice) y del intestino distal (colon y recto) y a todos ellos, se les denominó tumores carcinoides. Esta clasificación ya no se utiliza, debido a que cada una de estas neoplasias tiene considerables diferencias clínicas, histoquímicas e inmunohistoquímicas. Los tumores derivados del intestino proximal y distal son típicamente negativos a las tinciones argentafines, en contraste con los tumores derivados del intestino medio, que son positivos a las mismas1.
La clasificación de estas neoplasias ha sido motivo de debate y controversia durante muchos años y el término “carcinoide”, se considera en la actualidad inadecuado11, ello se debe principalmente a que las NNE-GEP comprenden una amplia gama de tumores con una conducta biológica diferente, que varía de acuerdo con el órgano en el que se originan, como también varían los síndromes clínicos a los que pueden asociarse12. En la actualidad, la nomenclatura de este grupo de neoplasias ha cambiado, en lugar de hablar de carcinoides derivados del intestino proximal, medio y distal, nos referimos a NNE del esófago, estómago, duodeno y porción superior del yeyuno, yeyuno distal e íleon, apéndice, colon y recto.
La última clasificación de la OMS para evaluar los grados de las NNE-GEP fue propuesta en el año 20108, y toma en cuenta el número de mitosis por 10 campos a seco fuerte y el índice de proliferación celular (IPC), evaluado mediante la expresión del Ki67. De esta forma, dichas neoplasias pueden clasificarse en 3 grandes grupos: bajo grado, grado intermedio y alto grado.
La presente revisión tuvo como objetivos principales evaluar todos los casos de tumores neuroendocrinos estudiados en el Hospital de Oncología durante los últimos 11 años, clasificarlos de acuerdo con los criterios patológicos propuestos por la OMS 2010 e investigar su distribución por órganos y características clínicas. Ciento trece casos (89,00%) se presentaron en el tracto GI, siendo el estómago (35,00%) el órgano en el que ocurrieron con mayor frecuencia, seguido por el intestino delgado (28,00%). En un estudio realizado en el año 200413, de entre todos los pacientes con cáncer, el 54,00% de los tumores neuroendocrinos se presentaron en el aparato GI; el intestino delgado fue el sitio más común de presentación (44,70%), seguido por el recto (19,60%), el apéndice (16,70%), colon (10,60%) y estómago (7,20%).
La frecuencia de presentación en los diferentes órganos de este tipo de neoplasias varía de acuerdo con el tipo de pacientes que se estudian en cada hospital, así al Hospital de Oncología sólo se refieren aquellos pacientes con diagnóstico de cáncer, es por ello que el número de casos de NNE del apéndice cecal fue muy bajo (5,00%), ya que estos casos son tratados en hospitales de primer y segundo nivel de atención. El cuadro clínico de los pacientes fue variable y estuvo en relación con el órgano en el que ocurrió la neoplasia.
La incidencia anual de las neoplasias pancreáticas no funcionantes es de 1,8 en mujeres y 2,6 en hombres14. El acceso más fácil a los métodos de diagnóstico por imagen ha favorecido la detección de un mayor número de NNE no funcionantes. La frecuencia de las NNE no funcionantes menores de 1cm halladas en estudios de autopsia varía del 0,80% al 10,00%15. En nuestra serie, encontramos en un lapso de 11 años, 14 ejemplos de NNE pancreáticas.
Las NNE gástricas se desarrollan en relación con diferentes contextos patológicos, de acuerdo a lo reportado en una serie por Rindi et al.16 79,00% de los casos se asociaron a gastritis crónica atrófica (GCA), 10,00% de los pacientes tenían el síndrome de Zollinger-Ellison y 11,00% de los mismos fueron esporádicos. En nuestra serie, 89,70% de las NNE gástricas se asociaron a GCA. Tal y como se ha descrito en la literatura médica, uno de nuestros pacientes con NNE duodenal padecía además de neurofibromatosis tipo I y 3 pacientes con tumores colónicos, tenían además enfermedad de Crohn17.
Con respecto a sus características macroscópicas, las NNE de grado bajo o intermedio tienden a ser nódulos submucosos, duros, miden menos de 2cm en diámetro y se desarrollan en la unión de la mucosa con la submucosa. La mucosa suprayacente por lo general permanece intacta o puede erosionarse18. Cuando el tumor invade la capa muscular del órgano, se produce fibrosis que ocasiona distorsión del mismo (por ejemplo, pared intestinal), lo cual da como resultado eventualmente a un proceso obstructivo. En nuestra serie, el tamaño de los tumores fue variable, siendo las neoplasias menores o iguales a 1,5cm por lo general polipoides, y las mayores a 8cm, grandes masas, ulceradas, infiltrantes, que correspondieron a carcinomas neuroendocrinos grado 3, la mayor parte de ellos ubicados en colon.
Las NNE por lo general se diagnostican con relativa facilidad debido a su aspecto microscópico característico, que puede ser sólido, nodular, insular, trabecular, tubular y con formación de rosetas, con nulo o escaso pleomorfismo nuclear y escasas mitosis1–3,19. En nuestra serie, la mayoría de las NNE bien diferenciadas o de diferenciación intermedia, por lo general ubicada en estómago e intestino delgado, mostró dichos patrones de crecimiento. Sin embargo, los casos de carcinomas neuroendocrinos (grado 3) estaban constituidos por una población de células pequeñas, ovales o alargadas, con núcleos hipercromáticos, abundantes mitosis y áreas extensas de necrosis o células con núcleos grandes y vesiculosos con cromatina fina.
La mayoría de los casos evaluados en esta serie (55,00%) tenían el diagnóstico de tumor carcinoide o tumor carcinoide atípico (18,00%), sin hacer referencia al grado histológico, después de utilizar los criterios establecidos por la clasificación de la OMS 2010, el 54,00% de las neoplasias GI fueron reclasificados como NNE de bajo grado o grado 1, el 31,00% como NNE de grado intermedio o grado 2, y el 15,00% como carcinomas neuroendocrinos grado 3 o de alto grado. Como se puede observar, el término “tumor carcinoide” es muy genérico y no refleja la conducta biológica de las neoplasias estudiadas20.
La presencia de diferenciación neuroendocrina focal en un tumor que carece de las características histológicas clásicas ya señaladas, no debe diagnosticarse como tumor o NNE. Ocho casos con el diagnóstico inicial de carcinoma neuroendocrino fueron eliminados de nuestro estudio, ya que se demostró que eran ejemplos de adenocarcinomas poco diferenciados, la negatividad a la cromogranina, sinaptofisina y CD56, corroboró nuestra sospecha morfológica. De manera contraria, 5 casos diagnosticados como carcinomas poco diferenciados fueron reclasificados como carcinomas neuroendocrinos, debido a sus características morfológicas y a su positividad a la cromogranina, sinaptofisina y CD56.
El IPC21 es muy útil para evaluar el pronóstico de las NNE, la mayoría de los sistemas de evaluación de grados se basan en el IPC, para separar a los tumores en grado bajo, intermedio y alto. Los sistemas propuestos en forma reciente para los tumores gastroenteropancreáticos por la OMS y por la Sociedad Europea de Tumores Neuroendocrinos8,14, utilizan tanto el índice de mitosis como el del Ki67 para categorizar a estos tumores. En nuestro estudio, la media de proliferación del Ki67 fue de 2,50%, 18,00% y 22,00%, para los NNE-GEP de bajo grado, grado intermedio y alto grado, respectivamente.
De lo analizado en esta serie de casos podemos llegar a la siguiente conclusión: el término “tumor carcinoide” debe abandonarse y las NNE-GEP deben clasificarse de acuerdo con los parámetros recientes establecidos por la OMS, con ello podremos establecer categorías de diagnóstico más estandarizadas que reflejen de manera más fidedigna la conducta biológica de las mismas.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
FinanciamientoNo se recibió patrocinio de ningún tipo para llevar a cabo este estudio.