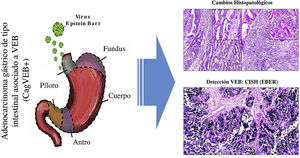
La infección por virus de Epstein-Barr (VEB) es un factor etiológico de un subgrupo de cáncer gástrico (cáncer gástrico asciado a virus de Epstein-Barr [CaGVEB]). El objetivo del estudio fue caracterizar la clínico-histopatología de la infección por VEB en muestras de adenocarcinoma gástrico de tipo intestinal.
Material y métodosSe estudiaron 28 de 180 muestras de gastrectomías parafinizadas, se realizó hibridación in situ cromogénica (CISH) para reconocimiento del VEB. Se obtuvieron datos sociodemográficos e histopatológicos de historias clínicas.
ResultadosResultaron positivas 21.4% de las muestras para VEB. La característica morfológica predominante fue patrón en encaje con denso infiltrado inflamatorio. De los pacientes CaGVEB+ 50% eran hombres, mediana de edad 59 años (rango 50-75), y de los CaGVEB– 77.2% eran hombres, mediana de edad 66 años (rango 34-89); 10.7% de los CaGVEB+ y 53.6% de los CaGVEB− se asociaron a infección por Helicobacter pylori (H. pylori). Entre los CaGVEB+, la localización del tumor más frecuente fue cardias (17.9%) y entre los CaGVEB− fue cardias y fondo (71.4%). En la clasificación según grado histológico, los CaGVEB+ se asociaron a grados 2 y 3 (7.1%), y los CaGVEB− a grado 2 (35.7%). Para la clasificación Borrmann, 17.9% de los CaGVEB+ presentaron clasificación III, mientras que 39.3% y 21.4% de CaGVEB− presentaron clasificación III y IV, respectivamente.
ConclusionesEste estudio presenta características clínico-histopatológicas asociadas a CaGVEB+ que pueden contribuir con la selección de casos candidatos a ser estudiados por métodos moleculares dirigidos a la identificación de la infección por VEB en adenocarcinoma gástrico de tipo intestinal.
Epstein-Barr virus (EBV) infection is an etiologic factor in EBV-associated gastric carcinoma (EBVaGC). The aim of our study was to describe the clinical and histopathologic characteristics of EBV infection in intestinal-type gastric adenocarcinoma samples.
Material and methodsOf 180 paraffin-embedded gastrectomy samples, 28 were studied. Chromogenic in situ hybridization was performed to detect EBV. Sociodemographic and histopathologic data were obtained from the patients’ clinical histories.
ResultsA total of 21.4% of the samples were positive for EBV. The predominant morphologic characteristic was the lace pattern, with dense inflammatory infiltration. Fifty percent of the EBVaGC + patients were men, and the median age of the positive patients was 59 years (range: 50-75); 77.2% of the EBVaGC– patients were men, and the median age of the negative patients was 66 years (range: 34-89). Helicobacter pylori infection was associated with 10.7% of the EBVaGC + patients and 53.6% of the EBVaGC– patients. In the EBVaGC + patients, the cardia was the most frequent tumor location (17.9%), 7.1% had histologic grades 2 and 3, and 17.9% presented with Borrmann classification type III. In the EBVaGC– patients, the cardia and fundus were the most frequent tumor locations (71.4%), 35.7% had histologic grade 2, and 39.3% and 21.4% presented with Borrmann classification type III and IV, respectively.
ConclusionsThe present study describes the clinical and histopathologic characteristics associated with EBVaGC positivity. Those data may aid in the selection of cases that are candidates for analysis through molecular methods aimed at identifying EBV infection in intestinal-type gastric adenocarcinoma.
El cáncer gástrico (CaG) es una de las neoplasias malignas más frecuentes. Según el Observatorio Global de Cáncer (GLOBOCAN), en el año 2018, el CaG ocupó el quinto lugar en incidencia con 1,033,701 casos, y el tercer lugar en mortalidad (782,685 muertes). En Colombia, se reporta un total de 7,419 casos nuevos de CaG y una mortalidad de 5,5051. En el suroccidente colombiano, donde la tasa de CaG es elevada2, el departamento del Cauca, ocupó el cuarto lugar en incidencia, con 26.8 casos en hombres y 16.9 en mujeres (tasa ajustada por edad por 100,000 años/persona) para el periodo comprendido entre 2007- 2011 y un total de1,426 muertes entre los años 2007-20133,4.
Entre los factores de riesgo relacionados con esta patología se describen factores genéticos5, factores biológicos como la infección por la bacteria Helicobacter pylori (H. pylori) y el VEB6, y factores asociados al estilo de vida7,8. Adicionalmente, la presencia de lesiones premalignas en la mucosa gástrica, tales como atrofia de la mucosa gástrica o metaplasia intestinal causadas ya sea por infección o por gastritis autoinmune o atrófica, también se han relacionado con la progresión a un proceso carcinogénico9.
Con base en sus características histopatológicas, el CaG puede ser clasificado como adenocarcinoma gástrico de tipo intestinal o de tipo difuso según la clasificación de Lauren10 o de tipo papilar, tubular, mucinoso y carcinomas pobremente cohesivos de acuerdo con la clasificación propuesta por la Organización Mundial de la Salud11. De manera alternativa, el Atlas del genoma del cáncer propuso una clasificación molecular dividida en cuatro subtipos: CaGVEB, inestabilidad de microsatélites, inestabilidad cromosómica y tumores genómicamente estables12.
El CaGVEB se presenta entre el 2-20% de la población mundial13,14, con reportes que oscilan entre 75,000 a 90,000 casos por año15. A nivel histológico, el CaGVEB se asocia preferencialmente con el adenocarcinoma gástrico de tipo intestinal16,17, el cual se caracteriza por una marcada infiltración intra o peritumoral de células inmunes, que a su vez se clasifica en tres subtipos: Linfoepitelioma like (LEL), adenocarcinoma convencional (CA) y carcinoma con reacción linfoide similar a la enfermedad de Crohn (CLR)18,19. Un estudio sobre 123 CaGVEB mostró que 43.1% eran LEL, 42.3% eran CLR y 14.6% eran CA18.
Adicionalmente, el CaGVEB en estadios tempranos se caracteriza por la presencia de un «patrón en encaje», esta característica histológica es predominante en el LEL, y también se ha observado en menor frecuencia en CA19. En términos de localización el CaGVEB predominantemente se ubica en el cardias y el fondo del estómago, donde la mucosa puede presentar atrofia y metaplasia intestinal como consecuencia de la infección por el virus20.
Actualmente la resección quirúrgica mejorada por linfadenectomía estandarizada es el gold standard en la terapia del CaG, sin embargo, los CaGVEB tienen un perfil tumorogénico distinto ya que se conoce que la positividad para VEB es un factor pronóstico favorable, por lo que podría ser usado potencialmente como biomarcador en CaG para el desarrollo de tratamiento dirigido21-23.
Este trabajo tuvo como objetivo determinar la frecuencia de la infección por el VEB en muestras de adenocarcinoma gástrico de tipo intestinal en el departamento del Cauca – Colombia, teniendo en cuenta que a la fecha no existen investigaciones relacionadas a este tema en el suroccidente colombiano24,25. Estos resultados podrían tener importantes implicaciones clínicas, ya que en la práctica médica no es común realizar la búsqueda de VEB en pacientes con CaG, lo que facilitaría la formulación de estrategias de prevención y tratamiento diferenciadas.
Material y métodosTipo de estudio: Estudio retrospectivo de corte transversal.
Selección de muestrasDado que, según los antecedentes, el CaGVEB se relaciona con mayor frecuencia a adenocarcinoma gástrico de tipo intestinal, se estudiaron 180 casos de pacientes con diagnóstico de este tipo de adenocarcinoma, provenientes del banco de muestras del Laboratorio de Patología de un Hospital entre los años 2013 y 2017. El proceso de selección de las muestras se realizó por parte de un especialista en anatomía patológica. Con base en los patrones de respuesta inflamatoria del huésped asociados a la presencia de la infección por VEB (LEL, CA, CLR), se seleccionaron 28 muestras provenientes de gastrectomías, las cuales cumplían con los criterios descritos a continuación.
Criterios de inclusiónMuestras de pacientes que, por estudios de patología, fueron diagnosticados con adenocarcinoma gástrico de tipo intestinal y que cumplían los criterios de los patrones histológicos mencionados anteriormente para sospechar infección por VEB, y de los cuales se disponía de bloques de parafina en adecuado estado de conservación para el uso en técnicas de biología molecular.
Criterios de exclusiónSe excluyeron los casos de pacientes en los cuales las historias clínicas reportaron terapias inmunosupresoras y antimicrobianas, uso de bloqueadores de receptor H2, inhibidores de la bomba de protones y drogas antiinflamatorias no esteroideas 30 días antes de la cirugía, o que tuvieran diagnóstico confirmado para VIH (sida) y los casos de pacientes que no estaban dentro de los patrones histopatológicos que han sido asociados con infección por VEB.
Análisis de historias clínicasSe diseñó un instrumento tipo encuesta donde se colectó información relacionada en las historias clínicas de los 28 pacientes seleccionados. Las variables analizadas fueron: edad, sexo, factores de riesgo asociados al CaG, clasificación de Borrmann, localización del tumor, grado histológico del tumor, hallazgos histopatológicos, clasificación TNM (clasificación de tumores malignos por T: tamaño del tumor original; N: ganglios linfáticos cercanos afectados; M: metástasis distante según el American Joint Committee on Cancer)26, estadiaje clínico y tamaño del tumor, así como el resultado de la hibridación in situ e inmunohistoquímica para la identificación de la Proteína Latente de Membrana (LMP-1) para el reconocimiento del VEB.
Identificación del VEB por (CISH)Las muestras parafinadas fueron cortadas en micrótomo, y dispuestas en láminas portaobjetos, para posteriormente ser instaladas en el equipo automatizado Ventana (Benchmark XT). Para el reconocimiento del ARNm codificado por el virus de Epstein-Barr (EBER) se aplicó la metodología de hibridación in situ usando una sonda EBER 1 DNP (Ventana, cat # 760-1209A, Tucson, AZ) y el sistema de detección ISH iView Blue Plus antiDNP (Ventana, Tucson, AZ), según las indicaciones del fabricante consignadas en el protocolo estándar de tinción y recomendadas para INFORM EBER Probe en instrumentos BenchMark XT. Las láminas resultantes fueron leídas por dos médicos especialistas en anatomía patológica en doble ciego.
Identificación del VEB por inmunohistoquímicaPara la identificación de la proteína latente de membrana (LMP-1) de 60 kDa, codificada por el gen BNLF1 del virus, por medio de la técnica de inmunohistoquímica se usó anticuerpo primario monoclonal de ratón (CS1-4) anti-LMP-1 (Sigma-Aldrich Co. LLC – E.E. U.U.) haciendo uso del kit de detección de Cell Marque (Sigma-Aldrich Co. LLC – E.E. U.U.), siguiendo las indicaciones del fabricante.
Análisis estadísticoLos datos fueron tabulados en el programa Microsoft Excel (versión 2013). Posteriormente se realizó un análisis estadístico descriptivo mediante el cruce de variables subclasificando las muestras como positivas o negativas para infección por VEB. Se realizó un análisis bivariado entre las variables de interés, utilizando la prueba de chi-cuadrado (χ2), y como criterio de significancia se definió un valor de probabilidad menor a 0.05 (p < 0.05). Los análisis se realizaron mediante el programa estadístico IBM SPSS versión 24.
Consideraciones éticasLa ejecución de esta investigación cumple con la normativa vigente en investigación bioética y obtuvo la autorización del comité de ética del Hospital Universitario San José de Popayán-Colombia, del cual se obtuvieron las muestras de material gástrico parafinado (Acta de aprobación N°6 del 19 de mayo de 2016), y del comité de ética de la Universidad del Cauca que aprobó la realización de la investigación con código de identificación 4487. Dado que los datos obtenidos de historias clínicas fueron tabulados y manejados bajo codificación numérica, preservado el anonimato de los datos del paciente, no se solicitó consentimiento informado para la publicación de este artículo.
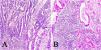
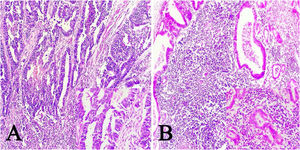
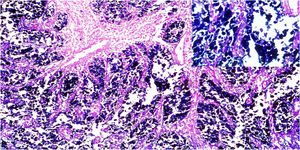
ResultadosDe las 28 muestras seleccionadas, el patrón histopatológico predominantemente fue el patrón en encaje, que muestra túbulos y cordones anastomosados de forma irregular asociados con infiltración linfocítica de moderada a densa (fig. 1A) seguido por el patrón de tipo LEL (fig. 1B). No se encontró ninguno de los otros patrones histopatológicos asociados a la infección por VEB.
Imágenes microscópicas de muestras de adenocarcinoma gástrico de tipo intestinal. A) Patrón en encaje, con discreto infiltrado inflamatorio mononuclear peritumoral (magnificación 10x), recuadro inferior derecho: aumento 40x. B) Adenocarcinoma gástrico de tipo linfoepitelioma like, con formación de acúmulos linfoides (magnificación 10x), recuadro inferior derecho: aumento 40x; células neoplásicas rodeadas por células de aspecto linfoide. Tinción hematoxilina-eosina.
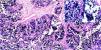
De las 28 biopsias analizadas 21.4% fueron positivas para infección por VEB (VEB+) por la técnica de CISH al detectar el ARNm del gen EBER. La señal de hibridación se observó en el núcleo de todas células neoplásicas, sin encontrar señal en las células del estroma ni en los linfocitos peritumorales (fig. 2).
Imágenes microscópicas de la hibridación in situ cromogénica para la detección del virus de Epstein-Barr en muestras de adenocarcinoma gástrico. Reactividad nuclear en hibridación in situ para el ARN codificado por el virus de Epstein-Barr (aumento 10x); recuadro superior aumento 40x, contraste con eosina.
De los pacientes VEB+, el 50% pertenecían a hombres y 50% a mujeres. La mediana de la edad fue de 59 años con rango entre 50 -75 años. De los pacientes negativos para infección por VEB (VEB−), el 77.3% pertenecían a hombres y 22.7% a mujeres. La mediana de la edad fue de 66 años con rango entre 34-89 años. Al analizar los datos sociodemográficos de edad y sexo entre los pacientes VEB positivos y negativos no se encontraron diferencias significativas (datos no mostrados).
En cuanto a los factores de riesgo relacionados con CaG consignados en las historias clínicas, se observó que las variables de mayor frecuencia entre los pacientes VEB+ fueron: consumo de alcohol (10.7%), antecedente de hipertensión (10.7%), antecedente de diabetes mellitus (14.3%), antecedentes de gastritis atrófica (10.7%), y antecedentes de H. pylori (10.7%). En los pacientes VEB-, las variables con mayor frecuencia fueron consumo de alcohol (50%), consumo de tabaco (46.4%), exposición al humo de leña (42.9%), antecedente de diabetes mellitus (46.4%), antecedentes de gastritis atrófica (50%), antecedente de úlcera péptica (50%) y antecedentes de H. pylori (53.6%). Al comparar estadísticamente los datos de factores de riesgo entre los pacientes VEB+ y VEB− no se encontraron diferencias significativas (tabla 1).
Identificación de factores de riego de cáncer gástrico asociados a la presencia del virus de Epstein-Barr en pacientes con adenocarcinoma gástrico de tipo intestinal
| Factor de riesgo | CaGVEB+ (n = 6) | CaGVEB- (n = 22) | Total (n = 28) |
|---|---|---|---|
| (%) | (%) | (%) | |
| Consumo de alcohol | |||
| Sí | 10.7 | 50 | 60.7 |
| No | 0 | 10.7 | 10.7 |
| Sin dato | 10.7 | 17.9 | 28.6 |
| Consumo de tabaco | |||
| Sí | 7.1 | 46.4 | 53.6 |
| No | 0 | 3.6 | 3.6 |
| Sin dato | 14.3 | 28.6 | 42.9 |
| Exposición a humo de leña | |||
| Sí | 3.6 | 42.9 | 46.4 |
| No | 3.6 | 7.1 | 10.7 |
| Sin dato | 14.3 | 28.6 | 42.9 |
| Antecedente de hipertensión arterial | |||
| Sí | 10.7 | 21.4 | 32.1 |
| No | 3.6 | 39.3 | 42.9 |
| Sin dato | 7.1 | 17.9 | 25 |
| Antecedente de diabetes mellitus | |||
| Sí | 14.3 | 46.4 | 60.7 |
| No | 0 | 14.3 | 14.3 |
| Sin dato | 7.1 | 17.9 | 25 |
| Antecedente de gastritis atrófica | |||
| Sí | 10.7 | 50.0 | 60.7 |
| No | 3.6 | 10.7 | 14.3 |
| Sin dato | 7.1 | 17.9 | 25 |
| Antecedente de úlcera péptica | |||
| Sí | 7.1 | 50.0 | 57.1 |
| No | 3.6 | 7.1 | 10.7 |
| Sin dato | 10.7 | 17.9 | 28.6 |
| Antecedente de Helicobacter pylori | |||
| Sí | 10.7 | 53.6 | 64.3 |
| No | 3.6 | 3.6 | 7.1 |
| Sin dato | 7.1 | 21.4 | 28.6 |
En cuanto a la ubicación del tumor dentro del estómago, se encontró que la localización más frecuente entre los pacientes VEB+, fue el cardias (17.9%), seguido del fondo y el cuerpo (14.3% para ambos casos), y entre los pacientes VEB− la localización del tumor más frecuente fue el cardias y el fondo (71.4% para ambos casos), seguido del píloro (57.1%) y el cuerpo (50%) (tabla 2).
Localización de tumor en cáncer gástrico asociados a la presencia del virus de Epstein-Barr en pacientes con adenocarcinoma
| Localización de tumor | CaGVEB+ (n = 6) | CaGVEB- (n = 22) | Total (n = 28) | p |
|---|---|---|---|---|
| (%) | (%) | (%) | ||
| Cardias | ||||
| Sí | 17.9 | 71.4 | 89.3 | 0.53 |
| No | 3.6 | 7.1 | 10.7 | |
| Fondo | ||||
| Sí | 14.3 | 71.4 | 85.7 | 0.19 |
| No | 7.1 | 7.1 | 14.3 | |
| Cuerpo | ||||
| Sí | 14.3 | 50 | 64.3 | 0.64 |
| No | 7.1 | 28.6 | 35.7 | |
| Antro | ||||
| Sí | 3.6 | 39.3 | 42.9 | 0.16 |
| No | 17.9 | 39.3 | 57.1 | |
| Píloro | ||||
| Sí | 7.1 | 57.1 | 64.3 | 0.098 |
| No | 14.3 | 21.4 | 35.7 | |
Valor p, prueba de chi-cuadrado (χ2).
En la clasificación según el grado histológico, los pacientes VEB+ presentaron grados histológicos 2 y 3 (7.1%), mientras que los VEB− mostraron grado histológico 2 (35.7%). En la clasificación de Borrmann, la mayoría de los pacientes VEB+ mostraron una clasificación tipo III (17.9%), mientras que 39.3% de los pacientes VEB− presentaron una clasificación tipo III y el 21.4% una clasificación tipo IV (tabla 3).
Clasificación histológica de biopsias de cáncer gástrico asociado a la presencia del virus de Epstein-Barr en pacientes con adenocarcinoma gástrico de tipo intestinal
| CaGVEB+ (n = 6) | CaGVEB- (n = 22) | Total (n = 28) | p | |
|---|---|---|---|---|
| (%) | (%) | (%) | ||
| Grado histológico | ||||
| Grado 1 | 3.6 | 10.7 | 14.3 | |
| Grado 2 | 7.1 | 35.7 | 42.9 | 0.75 |
| Grado 3 | 7.1 | 28.6 | 35.7 | |
| Sin dato | 3.6 | 3.6 | 7.1 | |
| Clasificación de Borrmann | ||||
| Tipo I | 0 | 7.1 | 7.1 | |
| Tipo II | 0 | 10.7 | 10.7 | |
| Tipo III | 17.9 | 39.3 | 57.1 | 0.47 |
| Tipo IV | 3.6 | 21.4 | 25 | |
Valor p, prueba de chi-cuadrado (χ2).
En la clasificación histológica del TNM, que evalúa el estadio clínico de la enfermedad, se encontró que 17.9% y 57.1% de los pacientes con biopsia VEB positiva y negativa respectivamente, eran estadio T4a. En el análisis de N, el 14.2% de los pacientes VEB+ se ubicaron en los estadios N1 y N2, y entre los pacientes VEB-, el 25% se encontraban en estadio N3a, seguido de los estadios N0 y N1 con el 17.9% cada uno. A nivel de Metástasis, el 17.9% de los pacientes VEB+ estaban en el estadio M0 y el 3.6% en estadio M1. De las muestras VEB-, 78.6% correspondieron al estadio M0 (tabla 4).
Clasificación TNM de tumores de cáncer gástrico asociados a la presencia del virus de Epstein-Barr en pacientes con adenocarcinoma gástrico de tipo intestinal
| Clasificación TNM | CaGVEB+ (n = 6) | CaGVEB (n = 22) | Total (n = 28) | p |
|---|---|---|---|---|
| (%) | (%) | (%) | ||
| T | ||||
| T1a | 0.0 | 3.6 | 3.6 | |
| T1b | 3.6 | 0.0 | 0 | |
| T2 | 0 | 7.1 | 7.1 | 0.25 |
| T4a | 17.9 | 57.1 | 75 | |
| T4b | 0 | 10.7 | 10.7 | |
| N | ||||
| N0 | 3.6 | 17.9 | 21.5 | |
| N1 | 7.1 | 17.9 | 25 | |
| N2 | 7.1 | 7.1 | 14.2 | 0.38 |
| N3a | 0 | 25 | 25 | |
| N3b | 3.6 | 10.7 | 14.3 | |
| M | ||||
| M0 | 17.9 | 78.6 | 96.5 | |
| 0.21 | ||||
| M1 | 3.6 | 0 | 3.6 | |
valor p, prueba de chi-cuadrado (χ2).
En este estudio se encontró que, de los 180 pacientes diagnosticados con adenocarcinoma gástrico de tipo intestinal, 15.5% mostraron las características histopatológicas predominantes reportadas para infección por VEB tales como patrón histológico en encaje, caracterizado por la conexión y fusión de las glándulas neoplásicas27. Esta descripción coincide con investigaciones previas, las cuales encontraron este tipo de patrón en el 38% de los casos de CaGVEB28.
El otro patrón histológico encontrado fue el LEL. Este se caracteriza por un alto infiltrado linfocitario, una mejor respuesta inmune frente a células cancerígenas, un estadio de cáncer más bajo, una menor incidencia de metástasis, y por lo tanto, un mejor pronóstico en comparación con aquellos cánceres gástricos no asociados con la infección por VEB que contienen menor infiltración linfocítica29,30. Wang et al. en 201631 describieron el caso de un paciente diagnosticado con carcinoma gástrico similar al linfoepitelioma y encontraron que el tumor estaba compuesto por nidos de células epiteliales rodeados por una gran cantidad de células plasmáticas y linfocitos, lo que confirma los hallazgos comunes a este patrón histológico. Tang et al. en 2012 también reportaron descripciones similares32.
De los 28 pacientes, 21.4% fueron positivos en el análisis de hibridación in situ. Este resultado concuerda con el rango de positividad que ha sido informado en la literatura, el cual varía entre un 2 a 20%14,33. Además, la hibridación fue observada únicamente en las células tumorales; se ha explicado que esta distribución exclusiva34 se debe a que la carcinogénesis por VEB es un evento tardío en el proceso de la carcinogénesis gástrica bien y/o moderadamente diferenciada, ya que existe evidencia que soporta que el VEB no está presente en la displasia gástrica ni en los carcinomas superficiales35.
Por otra parte, se observó total negatividad para la proteína latente de membrana en las muestras analizadas, lo que concuerda con lo reportado por otros autores34,36,37 y confirman que una LMP-1 negativa no descarta la presencia del VEB. La identificación del VEB por inmunohistoquímica es altamente específica, pero poco sensible, debido a que la LMP-1 se expresa únicamente en la fase II de latencia del virus. En el adenocarcinoma gástrico la fase de latencia del VEB es I mayoritariamente, seguido de la latencia II, por lo que el método ideal o gold standard es la hibridación in situ para el RNA EBER-1, que se transcribe en ambas latencias38.
Respecto a las características sociodemográficas del grupo de pacientes analizados, los resultados mostraron que el 50% de las muestras VEB+ pertenecían a casos masculinos, contrario a lo descrito en la literatura que reporta que este sexo es el más predominante para esta patología39,40. En cuanto a la edad de los casos, el rango fue amplio (50-75 años), lo que concuerda con lo reportado en el metaanálisis de Lee et al. en 2009, donde se manifiesta que la asociación entre VEB y CaG se presentó en pacientes con un rango promedio de 50 a 68 años de edad39.
En este estudio la localización del tumor en las muestras de carcinoma de tipo intestinal indica que la ubicación más frecuente es predominante en las regiones proximales y medias del estómago, especialmente en el cardias, similar a lo reportado por otros autores24,41,42, y lo recopilado por metaanálisis como los de Lee et al. en 2009, quienes analizaron los datos de 48 artículos, y encontraron una alta asociación del CaGVEB+ con la localización de cardias y cuerpo con OR (Odds Ratio) de 1,687 (IC 95%: 1.330–2.139) y 2,144 (IC 95%: 1.614–2.848) respectivamente, sugiriendo que estas partes del estómago pueden ser un ambiente más adecuado para la infección por VEB39. Por otro lado, Li et al. en 2010, en un metaanálisis realizado con datos de 22 artículos, encontraron que la positividad para VEB fue mayor en el cardias y menor en el píloro43.
En consistencia con estudios previos, los grados de diferenciación más frecuentes en los casos de CaGVEB+ fueron los de tipo 2 y 3, que corresponden al grado de diferenciación celular de moderado y pobremente diferenciado22,44,45. Este grado de diferenciación muestra que las células infectadas por VEB originalmente se desarrollan con una histopatología diferenciada y luego progresan a pobremente diferenciado en las etapas más avanzadas de la enfermedad, esto demuestra que este tipo de cáncer es de grado intermedio a alto. En los casos de biopsias VEB− se mostró una mayor distribución en el tipo 2 seguido del tipo 3 y luego tipo 1, similar a lo reportado por van Beek et al. en 200422. En estos casos, las células moderadamente diferenciadas muestran que son cánceres predominantemente de grado intermedio.
De acuerdo con las características macroscópicas, con base en la clasificación de Borrmann, los casos CaGVEB+ mostraron un predominio del tipo III, similar a lo reportado previamente46,47, lo que significa que el tumor es ulcerado e infiltrante48. En los casos CaGVEB-, fueron más frecuentes los tipos III y IV; estos se distinguen por características clínico-patológicas agresivas que incluyen invasión serosa (T3 y T4) y tasas más altas de metástasis en los ganglios linfáticos48.
Según la clasificación TNM, los casos CaGVEB+ mostraron altos porcentajes en T4a, N1, N2 y M0. Esto indica que a pesar de que los CaGVEB+ presentan invasión a estructuras vecinas (T4a), tienen limitada extensión hacia los ganglios y demuestra que los pacientes CaGVEB+ que presentan menor afectación de los ganglios linfáticos tienen menor enfermedad residual indicando a un mejor pronóstico22,46,49. Por otro lado, los pacientes CaGVEB− presentaron mayor frecuencia de T4a, N3a y M0, a diferencia de los casos CaGVEB+, este grupo de pacientes presentó mayor número de ganglios con metástasis (N3), lo que indica que al tener mayor compromiso de ganglios existe mayor probabilidad de procesos de metástasis a otros órganos, por lo tanto, la tasa de la mediana de supervivencia específica a cinco años disminuye50.
De acuerdo con la información recopilada en relación con los factores de riesgo asociados a CaG, los datos consignados en las historias clínicas muestran que un alto porcentaje de los pacientes con CaG, independiente del estatus de positividad para VEB, consumían alcohol y tabaco, se expusieron al humo de leña, tenían antecedentes de gastritis atrófica, de ulcera péptica e infección por H. pylori, factores de riesgo frecuentes en esta enfermedad51,52. Cerca del 60% de los pacientes con CaG presentaron antecedente de diabetes mellitus y alrededor del 30% hipertensión arterial, sin embargo, no existe evidencia que relacione estas patologías con el desarrollo de CaG; estas comorbilidades podrían estar asociadas con la edad promedio de los pacientes estudiados (65 años, rango 34-89 años)53. De los anteriores factores, el consumo de tabaco ha sido considerado como factor de riesgo frecuente en pacientes CaGVEB+, lo que coincide con los resultados de este estudio54.
El factor de riesgo más frecuente entre los pacientes con CaG fue la infección por H. pylori (64.3%). Se encontró antecedentes de infección en el 10.7% de los CaGVEB+, y en el 53.6% de los CaGVEB−. Esto también ha sido expuesto por autores como Wu et al. en 2000, quienes detectaron la presencia del ADN de H. pylori por medio de reacción en cadena de la polimerasa (PCR), y reportaron un porcentaje de positividad de 36.4% y 68.3% en muestras CaGVEB+ y CaGVEB-, respectivamente; concluyendo que no existe una relación estadísticamente significativa entre el CaGVEB y la infección por H. pylori6. De igual forma, Luo et al. en 2006, mediante PCR encontraron que el 46.15% de casos CaGVEB+ fueron positivos para la bacteria, mientras que para los casos CaGVEB− la positividad para H. pylori fue de 81.40%55.
La asociación entre VEB y H. pylori en pacientes con CaG es controversial. Algunos estudios sugieren que existe algún tipo de cooperación entre VEB y H. pylori, donde la presencia de uno de estos microorganismos puede promover el crecimiento del otro y viceversa, lo que también podría aumentar su virulencia. Si bien los mecanismos de esta sinergia no se conocen por completo, hay evidencia de que, durante el curso de la coinfección con H. pylori y VEB, se incrementa el número de células inmunes en el sitio de infección, lo que potencia la inflamación gástrica y el daño tisular56,57.
Los resultados encontrados en el presente trabajo muestran que los casos de carcinoma gástrico asociado al VEB detectados en el departamento de Cauca, tienen características epidemiológicas, clínicas e histopatológicas congruentes con otras investigaciones realizadas58,59. Se confirma que la técnica EBER-CISH permite la adecuada detección de la infección por VEB en pacientes con CaG.
En el Departamento del Cauca, no se realizan de rutina pruebas de laboratorio para la identificación del VEB en pacientes con diagnóstico de adenocarcinoma gástrico de tipo intestinal. Los resultados de este trabajo pretenden sensibilizar a los patólogos para que, con base en el reconocimiento de los patrones histopatológicos de la respuesta inmune del huésped frente al tumor, se puedan seleccionar los casos que serían candidatos para realizar diagnósticos de tipo molecular mediante hibridación in situ para detectar el VEB y de esta manera, sería posible subclasificar este tipo de cáncer, lo que puede contribuir no sólo al entendimiento de la enfermedad, sino que pueden servir para proponer ensayos clínicos en este subgrupo de pacientes, buscando terapias que contribuyan a mejorar su sobrevida12 (fig. 3).
- •
Existen patrones histológicos de adenocarcinoma gástrico relacionados a VEB.
- •
El grado de diferenciación moderado y pobremente diferenciado se asocia a CaGVEB.
- •
CaGVEB se asocia con limitada extensión hacia ganglios y ausencia de metástasis.
- •
La identificación de LMP-1 no es adecuada para determinar la presencia de VEB en CaG.
- •
No existe asociación significativa entre la infección por H. pylori y CaGVEB+.
Resumen gráfico. La infección por virus de Epstein-Barr (VEB) es un factor etiológico de un subgrupo de CaG (CaGVEB). Este tipo de cáncer se diferencia por un patrón histológico en encaje, caracterizado por la conexión y fusión de las glándulas neoplásicas. Estos parámetros histopatológicos facilitan la selección de casos candidatos para estudios de tipo molecular, como la hibridación in situ, lo que puede contribuir al entendimiento de la enfermedad, y ser de utilidad para la evaluación de determinantes clinicopatológicas en regiones de alta incidencia de CaG.
Andrés Vidal Realpe: adquisición, análisis e interpretación de datos, escritura del borrador del artículo.
Rosa Amalia Dueñas-Cuellar: concepción y diseño del estudio, interpretación de datos, escritura del borrador del artículo, revisión crítica del contenido intelectual.
Victoria Eugenia Niño Castaño: análisis e interpretación de datos, escritura del borrador del artículo.
Diana Lorena Mora-Obando: concepción y diseño del estudio, revisión crítica del contenido intelectual.
José de Jesús Arias Agudelo: adquisición de datos.
Harold Jofre Bolaños: revisión crítica del contenido intelectual, aprobación definitiva de la versión que se presenta.
FinanciaciónEl presente trabajo ha sido financiado por la Vicerrectoría de investigaciones de Universidad del Cauca, Convocatoria XI-2016, Proyecto ID4487. Se indica que no existió ningún tipo de participación por parte de esta en el diseño del estudio, la recolección, el análisis y la interpretación de los datos, la redacción del artículo o la decisión de enviar el artículo para su publicación.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.