La infección por Clostridioides difficile es la principal causa de diarrea nosocomial. El tratamiento de primera línea es vancomicina oral; sin embargo, esta presentación no está disponible comercialmente en Latinoamérica. Nuestro objetivo fue determinar la concentración fecal de la preparación de vancomicina intravenosa (VCM) administrada por vía oral, a dosis convencional, en un modelo experimental.
MétodosEnsayo preclínico, con 18 ratones macho (cepa Balb-C), en 3 grupos. Se administraron las siguientes dosis de VCM: en grupo A) 125mg; grupo B) 500mg; y grupo C) VCM-placebo. Después de recibir la dosis de VCM, los ratones se colocaron en jaulas metabólicas por grupo. Se recolectaron las heces y se analizó la concentración fecal de VCM mediante cromatografía líquida de alta presión 2, 4 y 6h después de la administración.
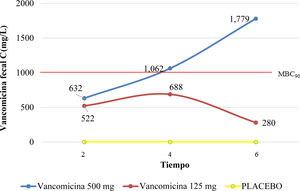
ResultadosLa dosis de 125mg de VCM alcanzó la concentración mínima inhibitoria (CMI) para C. difficile, sin alcanzar la concentración bactericida mínima (CBM90) a las 2, 4 y 6h (521, 688 y 280mg/L, respectivamente). Asimismo, la dosis de VCM 500mg alcanzó la CMI a las 2h, aumentó gradualmente y alcanzó CBM90 entre las 4 y 6h, en heces (1,062 y 1,779mg/L, respectivamente), ANOVA, p=0.0005.
ConclusiónLa concentración fecal de vancomicina depende de la dosis intragástrica administrada; solo la dosis de VCM 500mg alcanzó concentración terapéutica para C. difficile (CMI y CBM90) en ratones. Sugerimos comenzar con una dosis de 500mg QID para lograr la concentración terapéutica contra C. difficile, tan pronto como 4h después de la primera dosis.
Clostridioides difficile infection is the main cause of nosocomial diarrhea. First-line treatment is oral vancomycin, but that presentation is not commercially available in Latin America. Our aim was to determine the fecal concentration of the oral administration of the conventional dose of an intravenous vancomycin preparation (VCM), in an experimental model.
MethodsA preclinical trial was conducted on 18 male mice (Balb/C strain), in three batches. The following doses of VCM were administered: 125mg in batch A; 500mg in batch B; and VCM-placebo in batch C. After receiving the doses, the mice were placed in metabolic cages, by batch. Feces were collected and the fecal concentration of VCM was analyzed through high pressure liquid chromatography 2, 4 and 6h after drug administration.
ResultsThe 125mg dose of VCM reached the minimum inhibitory concentration (MIC) for C. difficile, without reaching the minimum bactericidal concentration (MBC90), at 2, 4, and 6h (521, 688, and 280mg/L, respectively). Likewise, the 500mg dose of VCM reached the MIC at 2h, increased gradually, and reached MBC90 between 4 and 6h, in feces (1,062 and 1,779mg/L, respectively), ANOVA, p=0.0005.
ConclusionThe fecal concentration of vancomycin was dependent on the intragastric dose administered. Only the 500mg dose of VCM reached therapeutic concentration for C. difficile (MIC and MBC90), in the mice. We suggest starting a dose of 500mg QID for achieving therapeutic concentration against C. difficile, as soon as 4h after the first dose.
La infección por Clostridioides difficile (ICD) es la causa principal de diarrea nosocomial en los países industrializados. Recientemente se ha observado un incremento en la incidencia en Europa y América del Norte. Existen pocos estudios sobre la prevalencia o incidencia de la ICD en Latinoamérica, por lo que el impacto real de la infección en nuestra población es desconocido1–3. En Argentina y México, la tasa de incidencia reportada en pacientes hospitalizados es de 3.1 casos/1,000 pacientes-día y 1.1 casos/1,000 pacientes-día, respectivamente, durante un periodo de seguimiento a 30 días4. En México, la tasa de mortalidad cruda a 30 días fue del 8.4%5. Las recomendaciones internacionales para el tratamiento de la ICD proponen el uso de antibióticos por vía oral (metronidazol, vancomicina y fidaxomicina), de acuerdo con la gravedad del cuadro clínico, al igual que otras modalidades de tratamiento, como el trasplante de microbiota fecal6,7. Por muchos años, el metronidazol fue la recomendación como tratamiento de primera línea, pero desde el 2017, los lineamientos internacionales han recomendado la vancomicina y fidaxomicina orales como tratamiento de primera línea debido a la recurrencia de la ICD tras el tratamiento con metronidazol8. La dosis recomendada de vancomicina oral es de 125mg a 500mg QID por 10-14 días1,6–8. Sin embargo, la dosis óptima para la ICD no ha sido bien establecida, mientras que la concentración mínima inhibitoria (CMI) es 0.5-8mg/L y su concentración bactericida mínima (CBM90) es arriba de 1,000mg/L9,10.
Actualmente, la presentación oral de vancomicina no está disponible comercialmente en México, lo que nos obliga a extrapolar la información de la presentación oral a la administración oral de la preparación intravenosa. La diarrea asociada a ICD es una infección de alta prevalencia, y en México solo está disponible la presentación intravenosa (de aquí en adelante referida como VCM). Además, existen pocos estudios que evalúen la concentración fecal de la vancomicina. Por lo tanto, nuestro principal objetivo fue determinar, en un modelo experimental, la concentración fecal de vancomicina a 3 intervalos diferentes, posteriormente a la administración oral de una sola dosis de 125mg y 500mg de VCM, utilizando agua como vehículo.
Material y métodosEnsayo preclínico.
Materiales y animalesLa formulación intravenosa de clorhidrato de vancomicina fue obtenida de los Laboratorios PISA bajo el nombre Vanaurus (Guadalajara, Jalisco, México; Reg. No. 487M96 SSA. IPP-A: GEAR-108175/RM 2002). Se utilizaron ratones macho de la cepa Balb/C (peso 27.8±0.5g; 18 semanas de edad). El presente estudio fue aprobado por el Comité de Investigación y Ética de nuestro hospital (R-2016-3601-199). Los ratones fueron conservados en un ambiente con temperatura de 18 a 26̊C, con humedad relativa del 40-70%, con un sistema de ventilación de 15 a 18 recambios de aire por hora, durante las 24h, con un ciclo de luz/oscuridad de 12h con luz artificial de lámparas fluorescentes, e intensidad de ruido por debajo de 85dB. Los ratones tuvieron libre acceso al agua y recibieron de 3 a 6g de alimento comercial para roedores diariamente. El alimento contenía 17-24% de proteína cruda, 4-11% de grasa cruda, 3-6% de fibra cruda, 5-7% de ceniza, y sin vitamina C. Los ratones fueron manejados de acuerdo con las Normas Internacionales para la Investigación Biomédica con Animales, desarrolladas por el Consejo de Organizaciones Internacionales de Ciencias Médicas (CIOMS, por sus siglas en inglés)11 y la Norma Oficial Mexicana de especificaciones técnicas para la producción, cuidado y uso de animales de laboratorio12.
Preparación de la vancomicina para su administración a los ratonesEl polvo de clorhidrato de vancomicina fue pesado en una balanza analítica (Ohaus, Analytical Plus), para obtener la dosis necesaria para cada ratón, y fue reconstituida en su diluyente (agua para inyección), para la presente investigación, a una razón de 1.0mL por dosis. La dosis administrada de clorhidrato de vancomicina fue de 125mg (equivalente a 1.78mg/kg del peso corporal del ratón) y 500mg (equivalente a 7.14mg/kg del peso corporal del ratón). A continuación, la VCM reconstituida fue administrada de la siguiente manera:
Grupo A: 125mg VCM en agua para inyección.
Grupo B: 500mg VCM en agua para inyección.
Grupo C: placebo VCM (vehículo).
Administración oral de vancomicinaSe utilizaron 3 grupos de 6 ratones en el ensayo. La dosis para el grupo A fue de 125mg de VCM en agua para inyección (API); para el grupo B, 500mg de VCM en API; y para el grupo C 1mL del vehículo. Las dosis fueron administradas intragástricamente vía cánula orogástrica.
Tras recibir la dosis, los ratones fueron colocados en jaulas metabólicas, separadas por grupo, y se tomaron muestras de heces a las 2, 4 y 6h postadministración de la VCM. Las muestras de heces fueron suspendidas en 4mL de API y mezcladas por medio de un agitador Vortex®Thomas (Thomas Scientific Analog Vortex Mixer, modelo 945700). La suspensión resultante se dejó reposar, y el sobrenadante fue colocado en un microtubo Eppendorf (1.5mL, MTC-150-C Maxiclear™ homopolymer boil-proof 311-08-051) y después fue centrifugado en una minispin (Eppendorf) a 12,500rpm durante 10min. La totalidad del sobrenadante fue filtrada (PALL filtro 0.45μm, Acrodisc Nylon 13μm), y 20μL de la filtración fue inyectada en el cromatógrafo de líquidos de alta presión (HPLC, por sus siglas en inglés) para cuantificar la vancomicina.
Ensayo de vancomicinaEl análisis de vancomicina se efectuó en un cromatógrafo de líquidos Waters 2795 equipado con un detector de fotodiodos Waters 996, con inyector automático, y el programa Millenium 3.1. Utilizamos una columna Waters Spherisorb de 4.6×250mm y una fase móvil de fosfato monobásico de potasio de 0.025M a pH 3.0, y acetonitrilo en proporción de 92:8, con flujo de 0.8mL/min; la detección se efectuó a 230nm.
La concentración de vancomicina en las muestras fue cuantificada por medio de interpolación del área del pico correspondiente al medicamento en una curva de calibración, obtenida con soluciones de vancomicina en concentraciones de 21.5, 43, y 86μg/mL, con una R2 de 0.9933.
Análisis farmacocinéticoLos parámetros medidos incluyeron el tiempo de ejecución (TE) y el área bajo la curva (ABC) de la concentración de vancomicina fecal, multiplicada por la cuantificación en muestra fecal-tiempo. La concentración VCM fue calculada con la siguiente ecuación:
X=(y/2.7047)-(0.9268)
Análisis estadísticoTodos los valores fueron expresados como media±desviación estándar (DE), mediana (intervalos) y proporciones. La concentración tiempo/vancomicina fue graficada utilizando el programa estadístico Graph-Pad. Se utilizó ANOVA para evaluar las diferencias en los valores de medias entre los 3 grupos, y comparaciones múltiples con la corrección de Bonferroni. La significación estadística fue determinada con valor de p<0.05.
ResultadosSe incluyeron un total de 18 ratones macho de la cepa Balb/C en el estudio, los cuales fueron divididos en 3 grupos. El peso corporal promedio fue de 27.8g (±0.5) y el peso promedio de las heces en los 3 grupos fue mayor de 0.200g.
Dos horas posteriores a la administración intragástrica de 125mg de VCM, observamos una concentración fecal de vancomicina de 522mg/L, considerada terapéutica contra C. difficile, pero la CBM90 no fue alcanzada. El pico máximo de 688mg/L fue alcanzado a las 4h y después cayó a 280mg/L a las 6h.
Respecto a la administración intragástrica de 500mg de VCM, 2h posteriores a la administración, se alcanzó una concentración en heces de 632mg/L. Continuó ascendiendo a las 4 y 6h, alcanzando la CBM90, con un pico máximo de 1,779mg/L a las 6h, como se muestra en la figura 1.
Concentración de vancomicina fecal a 2, 4, y 6h posteriores a la administración intragástrica de VCM. El rojo representa la dosis de 125mg, el azul representa la dosis de 500mg, y el amarillo representa el placebo. La CBM90 fue lograda solamente con la dosis de 500mg (señalada por la línea punteada).
Tras la administración intragástrica, el ABC para la VCM de 500mg fue aproximadamente 1.9 veces mayor que con la dosis de 125mg a las 4h, y aproximadamente 6 veces mayor a las 6h. Cuando las dosis de vancomicina fueron comparadas (125mg y 500mg), se encontró una diferencia significativa en la concentración de vancomicina a 4 y 6h posteriores a la administración (ANOVA, p=0.0005; prueba Bonferroni, IC 95%, –1.11 - 0.089, y –2.194 - –0.803, respectivamente) (fig. 2).
La concentración fecal de VCM promedio para el grupo con dosis de 125mg fue de 522mg/L (±26.3), 688mg/L (±145.7), y 280mg/L (±31.5), a 2, 4 y 6h, respectivamente. Para el grupo de 500mg, fue de 632mg/L (±70.5), 1,062mg/L (±261) y 1,779 (±181.2), a 2, 4 y 6h, respectivamente. Para el grupo A, no existió diferencia significativa entre 125mg y 500mg (p=0.7), mientras que sí existió una diferencia significativa a 4h y 6h entre las dosis de 125mg y 500mg, para los grupos B y C (p=0.005).
La ICD es actualmente una de las principales causas de infección nosocomial alrededor del mundo, y existe un aumento en la prevalencia de ICD adquirida en la comunidad a lo largo de la década pasada. Asimismo, hay un incremento mundial de las cepas hipervirulentas1,2,5. El tratamiento recomendado depende de la gravedad del cuadro clínico. En los años 70, el tratamiento se basaba en metronidazol oral y en vancomicina oral. El tratamiento de primera línea actual es vancomicina oral y fidaxomicina oral8. Los lineamientos de tratamiento para ICD de grupos de gastroenterología norteamericanos y europeos recomiendan vancomicina oral a dosis que van de 125mg a 500mg cada 6h6,7. Sin embargo, la vancomicina oral no está disponible comercialmente en México y otros países latinoamericanos, por lo que se ha utilizado la VCM intravenosa administrada por vía oral, con resultados en la práctica clínica variables4,5. En nuestro estudio, evaluamos indirectamente la concentración fecal de vancomicina utilizando muestras fecales de ratones que recibieron una sola dosis de VCM por medio de cánula orogástrica, y los resultados variaron de acuerdo a la dosis. Con base en dichos resultados, sugerimos evaluar el uso de VCM intravenosa administrada de forma oral en una dosis de 500mg cada 6h, para lograr una concentración terapéutica (CMI y CBM90) contra la C. difficile, tan pronto como 4h posteriores a la primera administración.
Se realizó un ensayo donde se estimó la CMI de vancomicina en 6 aislados de C. difficile en una infusión de caldo de cerebro-corazón, que fue incubada anaeróbicamente, y se obtuvo la CBM90 por medio de un subcultivo de caldos en agar sangre, tras 24 y 96h. La media geométrica de la CMI de vancomicina para el aislado de C. difficile fue 1-2mg/L. Sin embargo, la CBM90, que es la concentración necesaria de vancomicina para producir una disminución del tamaño original del inóculo bacteriano en un porcentaje igual o mayor del 99.9%, fue superior a 1,000mg/L, presumiblemente debido a la supervivencia de las esporas10.
Actualmente, la vancomicina oral no está disponible comercialmente en México, por lo que es necesario extrapolar la información disponible sobre la utilidad de la vancomicina oral en el tratamiento de ICD a la preparación intravenosa administrada por vía oral. Considerando las complicaciones éticas y legales que surgen cuando el personal médico decide utilizar medicamentos bajo condiciones que difieren de las de la ficha técnica correspondiente, decidimos llevar a cabo el ensayo en un modelo murino, utilizando ratones de cepa Balb/C, dado que la fisiología y respuesta inmunológica de su tracto gastrointestinal es similar al de los humanos, y también, es un modelo que se ha utilizado previamente para el estudio preclínico de otros antibióticos13. Encontramos que un estudio de biodisponibilidad correcto requeriría un enfoque diferente, como la utilización de un biomarcador intestinal y la recolección de toda la materia fecal a lo largo de un periodo de tiempo suficiente, para confirmar el 95-100% de la eliminación de la dosis, por lo que decidimos llevar a cabo el estudio por medio de un modelo experimental. Aunque la farmacocinética es el punto de interés, los resultados son limitados para la aplicación clínica en humanos. Sin embargo, los ratones no fueron expuestos a otros compuestos y las muestras fueron recolectadas de manera homogénea a lo largo de periodos regulares y cortos, lo cual simplificó el análisis.
Nuestro estudio es el primero en México que evalúa la biodisponibilidad de VCM, administrada oralmente, a dosis de 125mg y 500mg, de acuerdo con las recomendaciones internacionales para el tratamiento de ICD. Observamos mayores concentraciones fecales de vancomicina con la dosis mayor, y las dos dosis analizadas alcanzaron la CMI, comenzando a 2h posteriores a la administración. Sin embargo, solo la VCM de 500mg alcanzó la CBM90 (>1,000mg/L) contra C. difficile entre 2-4h y fue mantenida a 6h. Un grupo canadiense evaluó los niveles fecales de vancomicina, posteriormente a la administración de 125mg, 250mg, y 500mg de VCM genérica por un promedio de 6 días, en pacientes con sospecha de ICD14. Concluyeron que la concentración fecal de vancomicina se incrementó proporcionalmente con la dosis y encontraron que los pacientes que recibieron la dosis estándar de 125mg cada 6h podrían tener niveles bajos en materia fecal durante el primer día de tratamiento. Por lo tanto, una dosis inicial de 250mg o 500mg QID en las primeras 24-48h, seguida de la dosis estándar, debería ser evaluada en estudios clínicos, ya que podría ser menos dañina para la flora intestinal y reducir costos14.
Nuestros resultados, basados en una sola administración oral de VCM, a dos diferentes dosis, son similares a los reportados por otros autores que han evaluado varias presentaciones de vancomicina en humanos. Una preparación líquida de vancomicina de 125mg cada 6h obtuvo una concentración promedio de 399mg/L (rango 152-880)15. A lo largo del mismo año, dichos autores encontraron una concentración media de vancomicina de 3,100mg/L en materia fecal a una dosis de 500mg cada 6h, aunque los días en que las muestras fueron tomadas y analizadas no se especificaron en el estudio16. Otro estudio comparó dosis de 125mg y 250mg de vancomicina oral en pacientes con diarrea leve a moderada y encontraron que ambas producían concentraciones fecales equivalentes, sin un incremento en absorción o toxicidad10.
Con base en los resultados anteriores, podemos decir que la administración oral de 125mg y 500mg de VCM tuvo un perfil de biodisponibilidad en nuestro modelo murino que fue similar a los hallazgos en estudios con humanos con varias presentaciones orales que están comercialmente disponibles en los Estados Unidos y Europa6,7,17. Una dosis de 500mg de VCM resultó en un desempeño seguro y estable, alcanzando y manteniendo CMI y CBM90 para C. difficile, desde las primeras 4h posteriores a su administración. Por otro lado, la dosis de 125mg logró la CMI, pero no la CBM90, lo cual favorece posiblemente la recurrencia de infección debido a la eliminación limitada de esporas bacterianas y una consecuente falla terapéutica.
Respecto a las limitaciones de nuestro estudio, las heces no fueron recolectadas durante un periodo de tiempo suficientemente largo, para confirmar la excreción de la dosis al 95-100%, y por lo tanto para evaluar si las dosis permanecieron a concentraciones terapéuticas más allá de las 6h. Igualmente, no utilizamos un biomarcador intestinal. Además, sugerimos realizar un ensayo experimental con un modelo que incluya infección con C. difficile, para evaluar la vancomicina en presencia de inflamación y condiciones de motilidad típicas de la infección. También creemos necesario determinar el impacto del vehículo de administración sobre la biodisponibilidad y absorción del medicamento.
ConclusiónNuestro estudio evaluó la concentración fecal de vancomicina tras administración intragástrica de VCM a una sola dosis. Encontramos que la concentración de vancomicina fecal era dependiente de la dosis. Con base en estos resultados, sugerimos evaluar el uso de la VCM administrada oralmente a una dosis de 500mg cada 6h, para alcanzar las concentraciones terapéuticas (CMI y CMB90) contra C. difficile, dentro de las primeras 2-4h de administración.
Consideraciones éticasEl protocolo del presente estudio fue conforme a la Declaración de Helsinki y fue aprobado por el Comité de Investigación y Ética del hospital (R-2016-3601-199). Este estudio siguió los lineamientos ARRIVE para ensayos preclínicos. Ratones macho fueron incluidos y fueron manejados de acuerdo con las Normas Internacionales para la Investigación Biomédica con Animales desarrolladas por el Consejo de Organizaciones Internacionales de Ciencias Médicas (CIOMS); la Norma Oficial Mexicana de especificaciones técnicas para la producción, cuidado y uso de animales de laboratorio (NOM-062-ZOO-1999); y la Guía para el Cuidado y Uso de Animales de Laboratorio del NIH (NIH Publications No. 8023, revisado 1978).
El ensayo no incluyó experimentos en humanos.
Aprobación del Comité de ÉticaEl presente estudio fue aprobado por el Comité de Investigación y Ética de nuestro hospital (R-2016-3601-199).
FinanciaciónEl presente trabajo fue realizado con el apoyo del Fondo de Investigación en Salud FIS/IMSS/PROT/G17/1665.
Conflicto de interesesEl equipo declara que no existe ningún conflicto de intereses.
Véase contenido relacionado en DOI: 10.1016/j.rgmx.2022.04.004, Asbun-Bojalil J. Concentración fecal de la preparación de vancomicina intravenosa posterior a administración oral: datos preclínicos que sustentan necesidades clínicas no satisfechas. Rev Gastroenterol Mex.2023;88:83–84.