La tasa de detección de adenomas (TDA) es el más importante indicador de calidad para la prevención del cáncer colorrectal. Sin embargo, los pólipos serratos también son lesiones precursoras de cáncer colorrectal. El objetivo del estudio fue comparar la tasa de detección de pólipos serratos proximales (PSP) y la tasa de detección de pólipos serratos clínicamente significativos (PSCS), entre endoscopistas, y analizar la relación entre estos parámetros y la TDA.
MétodosEstudio observacional, transversal y prospectivo. Se incluyeron a todos los pacientes que acudieron para colonoscopia al Policlínico Peruano Japonés entre julio del 2015 y agosto del 2016. Se utilizó regresión logística multivariada para comparar la TDA, la tasa detección de PSP y la tasa de detección de PSCS entre los endoscopistas. Se calculó la asociación entre estos parámetros mediante el coeficiente de correlación de Pearson.
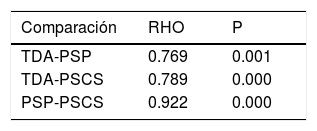
ResultadosFueron incluidos 15 endoscopistas y 1,378 colonoscopias. La tasa de detección de PSP estuvo en el rango de 1.8-17% entre los endoscopistas. La tasa de detección de PSP tuvo una correlación casi perfecta con la tasa de detección de PSCS (ρ = 0.922). La tasa de detección de PSP tuvo una fuerte correlación con la TDA (ρ = 0.769).
ConclusionesLa tasa de detección de PSP tiene gran variabilidad entre endoscopistas, y tiene una correlación casi perfecta con la tasa de detección de PSCS, así como una fuerte correlación con la TDA. Estos resultados sugieren una alta tasa de PSCS perdidos por los endoscopistas con una baja tasa de detección de PSP.
The adenoma detection rate (ADR) is the most important quality indicator for the prevention of colorectal cancer but serrated polyps are also precursor lesions of the disease. The aim of our study was to compare the detection rate of proximal serrated polyps (PSPs) and that of clinically significant serrated polyps (CSSPs) between endoscopists and analyze the relation of those parameters to the ADR.
MethodsAn observational, prospective, cross-sectional study was conducted on all patients that underwent colonoscopy at the Policlínico Peruano Japonés within the time frame of July 2015 and August 2016. The ADR and PSP and CSSP detection rates between endoscopists were compared through multivariate logistic regression and the association between those parameters was calculated through the Pearson correlation coefficient.
ResultsThe study included 15 endoscopists and 1,378 colonoscopies. The PSP detection rate ranged from 1.8-17% between endoscopists and had an almost perfect correlation with the CSSP detection rate (p = 0.922), as well as strongly correlating with the ADR (p = 0.769).
ConclusionsThere was great variability in the PSP detection rate between endoscopists. It also had an almost perfect correlation with the CSSP detection rate and strongly correlated with the ADR. Those results suggest a high CSSP miss rate at endoscopy and a low PSP detection rate.
El cáncer colorrectal (CCR) es una de las causas más frecuentes de mortalidad por cáncer en el mundo1. Se desarrolla a partir de lesiones precursoras, sobre el curso de años. De hecho, resecar dichas lesiones reduce la incidencia y mortalidad del CCR2,3. Sin embargo, la colonoscopia no es totalmente protectora para la aparición de CCR, especialmente el del lado derecho del colon4,5. La mayoría de los denominados cánceres de intervalo, se desarrollan a partir de lesiones precancerosas no detectadas durante la colonoscopia previa, y la mayoría de estos tumores ocurren en el colon proximal6-9. En una revisión sistémica y metaanálisis de la localización del CCR de intervalo (desde los seis a los 36 meses de la colonoscopia), la prevalencia de cáncer de colon de intervalo proximal fue 6.5% comparado con 2.9% para cáncer de colon de intervalo distal10. Dos artículos publicados mostraron una relación inversa entre el riesgo de cáncer de intervalo y la tasa de detección de adenomas (TDA) de un endoscopista11,12. Por ello, la TDA es considerada el principal indicador de calidad en el contexto de la prevención de CCR. Sin embargo, la TDA es considerada un marcador impreciso, dado que la detección de un solo adenoma es suficiente para considerar que una colonoscopia es de alta calidad (fenómeno uno-y-terminamos, ya descrito en la literatura especializada)13. Adicionalmente, sabemos que los adenomas no son la única lesión precursora de CCR14. Por todo ello, se necesitan evaluar otros indicadores de calidad para considerar que una colonoscopia es de alta calidad.
Por muchos años, los adenomas han sido considerados la única lesión premaligna del CCR. Pero, en los últimos años las investigaciones han mostrado que los pólipos serratos juegan también un rol importante en la oncogénesis del CCR, siendo responsables de aproximadamente 15-30% de todos los CCR15. Una proporción significativa de todos los cánceres de intervalo se desarrollan a partir de los pólipos serratos, presumiblemente a causa de la alta tasa de pólipos serratos no detectados localizados en el colon proximal16. Los pólipos serratos pueden no ser detectados debido a sus bordes indistinguibles, su naturaleza plana, y por estar cubiertos muchas veces con una capa de moco. Sin embargo, no todos los pólipos serratos parecen ser premalignos. Los pólipos hiperplásicos diminutos localizados en el recto-sigmoides son considerados benignos, mientras que los pólipos hiperplásicos grandes y/o localizados proximalmente, los pólipos/adenomas serratos sésiles y adenomas serratos tradicionales, son considerados con alto potencial neoplásico14. Este último grupo, al cual llamaremos pólipos serratos clínicamente significativos (PSCS), deben ser detectados y resecados en una colonoscopia de calidad. Actualmente, la detección de pólipos serratos no es un indicador de calidad establecido en colonoscopia.
Varios estudios han evaluado la variabilidad de la tasa de detección de ≥ 1 pólipo serrato proximal (PSP) entre endoscopistas17-21. La tasa de detección de PSP es considerado un parámetro fácil de medir, que se correlacionaría con la tasa de detección de PSCS. En un gran estudio retrospectivo, se evidenció que la tasa de detección de PSP fue dependiente del endoscopista, en un rango de 1 a 18%, entre 15 endoscopistas17. Un estudio prospectivo, describió una gran variabilidad en la tasa de detección de PSP (6-22%) entre cinco endoscopistas18. Otro estudio prospectivo, llevado a cabo en Ámsterdam con 16 endoscopistas y 2,088 colonoscopias realizadas, encontró tasas de detección de PSP en un rango de 2.9 a 18.6%19. Un estudio retrospectivo llevado a cabo en Francia, con la participación de 18 endoscopistas y 2,979 colonoscopias completas, halló tasas de detección de PSP en un rango de 1.28 a 19.25%20. Más recientemente, un trabajo llevado a cabo en Washington, en pacientes sometidos a colonoscopia de cribado, reportó también una variación significativa en las tasas de detección de PSP, con rango de 1.1 a 22%21.
El objetivo del estudio fue comparar la tasa de detección de PSP, así como la tasa de detección de PSCS entre endoscopistas, y analizar la asociación entre ambos parámetros y la TDA.
Material y métodosEs un estudio analítico, observacional, de corte transversal y prospectivo. Se incluyeron a todos los pacientes ambulatorios que acudieron para colonoscopia al servicio de Gastroenterología del Policlínico Peruano Japonés, entre julio del 2015 y agosto del 2016. El Policlínico Peruano Japonés es una institución privada que atiende pacientes ambulatorios. Un total de 17 gastroenterólogos realizaron los procedimientos, pero solo se incluyeron en el análisis los procedimientos de 15 de ellos. Los otros dos fueron excluidos debido a que realizaron menos de 30 colonoscopias durante el período de estudio. Todos los gastroenterólogos participantes son endoscopistas con una experiencia mayor de 10 años, quienes realizan más de 100 colonoscopias por año en sus diferentes centros de trabajo. Las colonoscopias fueron realizadas con equipos marca Olympus®, modelos CF-H 180, CF-Q 160 ZL, marca Fujinon®, modelo EC-590 WL, y marca Pentax® modelo EC-I10L. Todos los procedimientos fueron grabados y archivados. Todos los pacientes recibieron instrucciones verbales y por escrito, para la preparación intestinal, empleándose el sistema de dosis dividida para todos los procedimientos. Los laxantes empleados para la preparación intestinal fueron el PEG y el fosfato sódico. Así, si el examen fue en la mañana, se indicó tomar tres sobres de PEG en la noche previa y uno en la mañana, o un frasco de fosfato sódico en la noche previa y otro en la mañana. Si el examen fue en la tarde, se indicó tomar dos sobres de PEG en la noche previa y dos en la mañana del día del examen, o un frasco de fosfato sódico en la noche previa y el otro frasco en la mañana del examen.
Durante el procedimiento se recogieron datos de la colonoscopia: endoscopista que la practicó, hora de inicio, profundidad de inserción, calidad de la preparación intestinal y características de los pólipos. La preparación intestinal durante la colonoscopia fue evaluada por el endoscopista usando la escala de Boston22,23. Dicha escala está basada en un sistema de puntuación de 0 a 3 puntos para cada uno de los tres segmentos del colon: Derecho (incluyendo ciego y colon ascendente), transverso (incluyendo ángulo hepático y esplénico) e izquierdo (incluyendo colon descendente, sigmoides y recto). La puntuación alcanzada va de 0 a 9, con los valores más bajos correspondiendo a una preparación menos óptima. La calidad de preparación intestinal fue categorizada como excelente (escala de Boston de 8 y 9), buena (escala de Boston de 6 y 7) y regular-pobre (escala de Boston ≤ 5). Los pólipos detectados fueron fotografiados y sus características endoscópicas fueron detalladas en el informe de la colonoscopia, incluyendo el tamaño y la localización anatómica. Cada pólipo fue sometido a una biopsia o fue resecado y enviado para estudio histopatológico. La histopatología de los pólipos fue evaluada por tres patólogos expertos en patología gastrointestinal, de acuerdo con los criterios revisados de Viena24. Los pólipos fueron subdivididos en adenomatosos o serratos. Los pólipos serratos fueron clasificados como pólipos hiperplásicos, pólipos serratos sésiles y adenomas serratos tradicionales usando los criterios de la World Health Organization25. La porción proximal al colon descendente se definió como colon proximal (ángulo esplénico, colon transverso, colon ascendente y ciego). Todos los PS detectados en el colon proximal fueron incluidos para medir la tasa de detección de PSP. Se consideraron PSCS los pólipos serratos con alto potencial neoplásico. Para efectos del trabajo, se consideraron a todos los pólipos/adenomas serratos sésiles, todos los adenomas serratos tradicionales y a los pólipos hiperplásicos proximales al rectosigmoides, así como los pólipos hiperplásicos ubicados en rectosigmoides ≥ 5 mm en tamaño19.
Criterios de inclusión y exclusiónSolo se incluyeron para el análisis los endoscopistas que realizaron al menos 30 colonoscopias durante el período de estudio, con el objeto de que las tasas de detección de pólipos fueran lo más representativas posibles. Solo se incluyeron pacientes adultos (≥ 18 años). Fueron excluidos los pacientes con historia de resección de colon y aquellos en los que se repitió la colonoscopia durante el período de estudio (ejemplo, por control post polipectomía). Se excluyeron, asimismo, las colonoscopias realizadas en pacientes con síndrome de cáncer colorrectal hereditario o enfermedad inflamatoria intestinal.
Análisis estadísticoPara el cálculo del tamaño de la muestra se utilizó el software Epidat® v.4.2 en su módulo de muestreo, cálculo de tamaño de muestra para proporción. Con parámetros de 10% de proporción de pacientes con pólipo serrato proximal, precisión de 3%, población de 15,000 pacientes que acuden a consulta externa de gastroenterología,
Haciendo las operaciones indicadas, se obtuvo una muestra de n = 997.
Fórmula utilizada
n = N * Z2α p * q
d2 * (N-1) + Z2α p * q
- n = tamaño de muestra
- Z2α = 1.962, valor Z (distribución normal estándar) correspondiente al riesgo deseado
- p = Proporción esperada de la característica que se pretende estudiar
- q = 1 - p
- d = precisión deseada (3%)
-N = total de la población
Se utilizó un muestreo no probabilístico para obtener la muestra calculada (n = 997).
Los datos fueron reportados como frecuencias absolutas y relativas para variables discretas o nominales, y como el promedio, desviación estándar (DS) y rango para las variables continuas. Se registraron los datos de la colonoscopia de todos los endoscopistas que ingresaron al estudio, calculándose su tasa de detección de adenomas (TDA) individual (la proporción de colonoscopias en las cuales se detectó ≥ 1 adenoma confirmado histológicamente), la tasa de detección de PSP (la proporción de colonoscopias en las cuales se detectó ≥ 1 pólipo serrato localizado en el colon proximal), y la tasa de detección de PSCS (la proporción de colonoscopias en las cuales se detectó ≥ 1 PSCS, definido previamente).
Para comparar la tasa de detección de PSP y PSCS de cada endoscopista, se utilizó análisis de regresión logística multivariado corregido para edad del paciente, sexo y calidad de preparación intestinal. Basada en estos análisis, se calculó la odds ratio (OR) para la detección de ≥ 1 PSP o ≥ 1 PSCS durante la colonoscopia para cada endoscopista, comparado con el endoscopista con la más alta tasa de detección.
La asociación entre la TDA, la tasa de detección de PSP y la tasa de detección de PSCS fue calculada usando el coeficiente de correlación de Pearson. Un valor de p < 0.05 fue considerado estadísticamente significativo. Todos los análisis estadísticos fueron realizados usando el paquete estadístico SPSS® versión 21.
ResultadosDe las 1,509 colonoscopias realizadas durante el período de estudio, 1,413 fueron consideradas elegibles para el estudio. Fueron excluidas 96 colonoscopias debido a que no consignaron el grado de preparación intestinal con la escala de Boston o no fue posible encontrar los resultados del estudio patológico de las lesiones encontradas. De los 1,413 restantes solo se incluyeron para el análisis 1,378 procedimientos realizadas por 15 endoscopistas, quienes realizaron cada uno al menos 30 procedimientos. No se incluyeron 35 colonoscopias, las cuales fueron realizadas por dos endoscopistas que realizaron menos de 30 procedimientos durante el período de estudio. De los 1,378 procedimientos incluidos en el estudio, 282 correspondieron a colonoscopias de cribado. La edad media de los pacientes fue de 57.99 (± 14.26) años, y 546 fueron hombres (39.6%).
Se encontraron un total de 555 adenomas y 267 pólipos serratos. La calidad de preparación intestinal fue categorizada como excelente (escala de Boston de 8 y 9) en 654 pacientes (47.46%), buena (escala de Boston de 6 y 7) en 636 pacientes (46.15%) y regular-pobre (escala de Boston ≤ 5) en 88 pacientes (6.39%). La tasa de intubación cecal fue de 98.3%
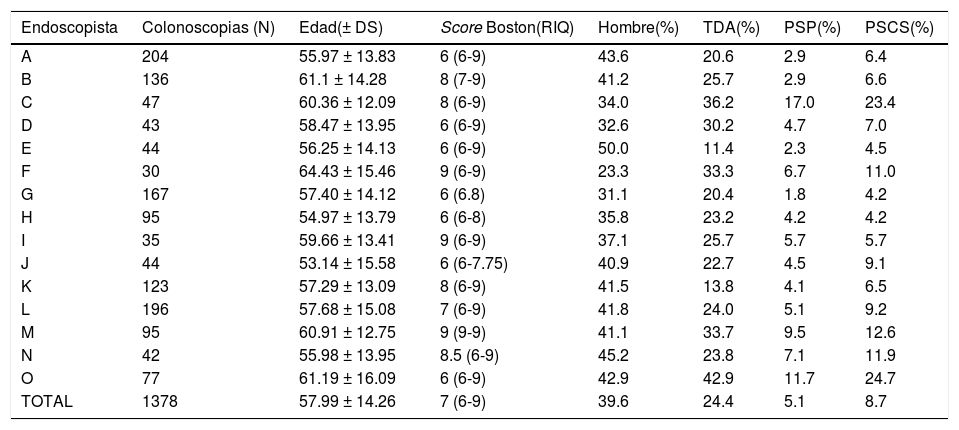
La tasa de detección promedio de los adenomas fue de 24.4% (rango de 11.4-42.9%), la tasa de detección promedio de los PSP fue de 5.1% (rango de 1.8-17%), y la tasa de detección promedio de los PSCS fue de 8.7% (rango de 4.2-24.7%). En la tabla 1 se aprecian las características de las colonoscopias y la performance por endoscopista.
Performance en colonoscopia por endoscopista
| Endoscopista | Colonoscopias (N) | Edad(± DS) | Score Boston(RIQ) | Hombre(%) | TDA(%) | PSP(%) | PSCS(%) |
|---|---|---|---|---|---|---|---|
| A | 204 | 55.97 ± 13.83 | 6 (6-9) | 43.6 | 20.6 | 2.9 | 6.4 |
| B | 136 | 61.1 ± 14.28 | 8 (7-9) | 41.2 | 25.7 | 2.9 | 6.6 |
| C | 47 | 60.36 ± 12.09 | 8 (6-9) | 34.0 | 36.2 | 17.0 | 23.4 |
| D | 43 | 58.47 ± 13.95 | 6 (6-9) | 32.6 | 30.2 | 4.7 | 7.0 |
| E | 44 | 56.25 ± 14.13 | 6 (6-9) | 50.0 | 11.4 | 2.3 | 4.5 |
| F | 30 | 64.43 ± 15.46 | 9 (6-9) | 23.3 | 33.3 | 6.7 | 11.0 |
| G | 167 | 57.40 ± 14.12 | 6 (6.8) | 31.1 | 20.4 | 1.8 | 4.2 |
| H | 95 | 54.97 ± 13.79 | 6 (6-8) | 35.8 | 23.2 | 4.2 | 4.2 |
| I | 35 | 59.66 ± 13.41 | 9 (6-9) | 37.1 | 25.7 | 5.7 | 5.7 |
| J | 44 | 53.14 ± 15.58 | 6 (6-7.75) | 40.9 | 22.7 | 4.5 | 9.1 |
| K | 123 | 57.29 ± 13.09 | 8 (6-9) | 41.5 | 13.8 | 4.1 | 6.5 |
| L | 196 | 57.68 ± 15.08 | 7 (6-9) | 41.8 | 24.0 | 5.1 | 9.2 |
| M | 95 | 60.91 ± 12.75 | 9 (9-9) | 41.1 | 33.7 | 9.5 | 12.6 |
| N | 42 | 55.98 ± 13.95 | 8.5 (6-9) | 45.2 | 23.8 | 7.1 | 11.9 |
| O | 77 | 61.19 ± 16.09 | 6 (6-9) | 42.9 | 42.9 | 11.7 | 24.7 |
| TOTAL | 1378 | 57.99 ± 14.26 | 7 (6-9) | 39.6 | 24.4 | 5.1 | 8.7 |
DS: desviación estándar; PSCS: pólipo serrato clínicamente significativo; PSP: pólipo serrato proximal; RIQ: rango intercuantilo; TDA: tasa de detección de adenomas.
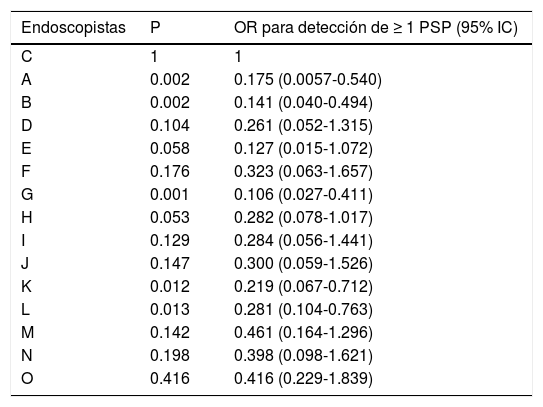
En la tabla 2 vemos las diferentes tasas de detección de pólipos según calidad de preparación /Boston ≥ 6 vs. ≤ 5. Se encuentran mayores tasas de detección de adenomas, PSP y PSCS, en el grupo de colonoscopias con preparación Boston ≥ 6, pero dichas diferencias solo son significativas para los PSCS (p = 0.007). En la tabla 3 se aprecian, para cada endoscopista, el OR corregido para la detección de ≥ 1 PSP comparado con el endoscopista con la más alta tasa de detección. El rango del OR para la detección de ≥ 1 PSP estuvo entre 0.106 (p = 0.001, intervalo de confianza [IC] del 95%: 0.027-0.411) y 0.649 (p = 0.416, IC 95%: 0.229-1.839). Cinco endoscopistas mostraron significativamente más baja tasa de detección de PSP, comparado con el endoscopista con la más alta tasa de detección.
Tasas de detección de pólipos según calidad de preparación intestinal
| Boston ≥ 61,290 colonoscopias | Boston ≤ 588 colonoscopias | p | |
|---|---|---|---|
| TDA (%) | 24.4 | 23.9 | 1.000* |
| Tasa de detección de PSP (%) | 5.3 | 2.3 | 0.314* |
| Tasa de detección de PSCS (%) | 9.1 | 3.4 | 0.007** |
PSP: pólipos serratos proximales; PSCS: pólipos serratos clínicamente significativos; TDA: tasa de detección de adenomas.
OR para la detección de ≥ 1 PSP comparado con el endoscopista con la más alta tasa de detección
| Endoscopistas | P | OR para detección de ≥ 1 PSP (95% IC) |
|---|---|---|
| C | 1 | 1 |
| A | 0.002 | 0.175 (0.0057-0.540) |
| B | 0.002 | 0.141 (0.040-0.494) |
| D | 0.104 | 0.261 (0.052-1.315) |
| E | 0.058 | 0.127 (0.015-1.072) |
| F | 0.176 | 0.323 (0.063-1.657) |
| G | 0.001 | 0.106 (0.027-0.411) |
| H | 0.053 | 0.282 (0.078-1.017) |
| I | 0.129 | 0.284 (0.056-1.441) |
| J | 0.147 | 0.300 (0.059-1.526) |
| K | 0.012 | 0.219 (0.067-0.712) |
| L | 0.013 | 0.281 (0.104-0.763) |
| M | 0.142 | 0.461 (0.164-1.296) |
| N | 0.198 | 0.398 (0.098-1.621) |
| O | 0.416 | 0.416 (0.229-1.839) |
IC: intervalo de confianza; OR: Odds ratio; PSP: pólipo serrato proximal.
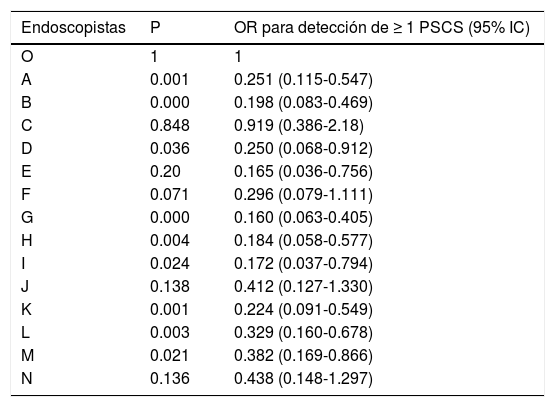
En la tabla 4 se aprecian, para cada endoscopista, el OR corregido para la detección de ≥ 1 PSCS comparado con el endoscopista con la más alta tasa de detección. El rango de OR para la detección de ≥ 1 PSCS estuvo entre 0.160 (p = 0.000 e IC del 95%: 0.063-0.405) y 0.919 (p = 0.848 e IC del 95%: 0.386-2.18). Nueve endoscopistas mostraron significativamente más baja tasa de detección de PSCS, comparado con el endoscopista con la más alta tasa de detección.
OR para la detección de ≥ 1 PSCS comparado con el endoscopista con la más alta tasa de detección
| Endoscopistas | P | OR para detección de ≥ 1 PSCS (95% IC) |
|---|---|---|
| O | 1 | 1 |
| A | 0.001 | 0.251 (0.115-0.547) |
| B | 0.000 | 0.198 (0.083-0.469) |
| C | 0.848 | 0.919 (0.386-2.18) |
| D | 0.036 | 0.250 (0.068-0.912) |
| E | 0.20 | 0.165 (0.036-0.756) |
| F | 0.071 | 0.296 (0.079-1.111) |
| G | 0.000 | 0.160 (0.063-0.405) |
| H | 0.004 | 0.184 (0.058-0.577) |
| I | 0.024 | 0.172 (0.037-0.794) |
| J | 0.138 | 0.412 (0.127-1.330) |
| K | 0.001 | 0.224 (0.091-0.549) |
| L | 0.003 | 0.329 (0.160-0.678) |
| M | 0.021 | 0.382 (0.169-0.866) |
| N | 0.136 | 0.438 (0.148-1.297) |
IC: intervalo de confianza; OR: Odds ratio; PSCS: pólipo serrato clínicamente significativo.
En la tabla 5 se observa la correlación entre la TDA, la tasa de detección de PSP y la tasa de detección de PSCS. Se encontró una fuerte correlación entre la tasa de detección de PSP y la TDA (ρ = 0.769; p = 0.001). También se encontró una fuerte correlación entre la tasa de detección de PSCS y la TDA (ρ =0.789; p = 0.000). Finalmente, la correlación entre la tasa de detección de PSP y la tasa de detección de PSCS fue casi perfecta (ρ = 0.922; p = 0.000).
Discusión y conclusionesEn los últimos años se ha reconocido el potencial maligno de los pólipos serratos. Dichas lesiones pueden no ser detectadas debido a sus características particulares como bordes indistinguibles, morfología plana o presencia de capa de moco en su superficie. Una buena preparación intestinal es clave para una adecuada detección26,27. En nuestro estudio la calidad de preparación fue excelente-buena (Boston ≥6) en 93.61% de pacientes, lo que facilita una adecuada detección. Al evaluar las tasas de detección de pólipos según calidad de preparación intestinal encontramos mayores tasas de detección de adenomas, PSP y PSCS en los pacientes con preparación intestinal Boston ≥ 6 vs. Boston ≤ 5, peros solo alcanzando diferencia significativa para los PSCS, con una p = 0.007.
La TDA fue de 24.4%, con una amplia variabilidad entre los endoscopistas (rango de 11.4-42.9%). Esta variabilidad ya ha sido reportada en estudios previos28,29. Esto está relacionado con diferencias en la técnica de exploración. Chen y Rex usaron criterios específicos para evaluar el desempeño de los endoscopistas: Observación de los lados proximales de pliegues y válvulas, adecuada limpieza, adecuada distensión y apropiado tiempo de evaluación; encontrando que quien tenía mejor técnica de retirada tenía menor tasa de pólipos perdidos. En este contexto, el presente estudio demuestra que la tasa de detección de los pólipos serratos proximales también es ampliamente variable entre los endoscopistas. En este estudio la tasa de detección de PSP estuvo en el rango de 1.8 a 17% (media de 5.1%), mientras que la tasa de detección de PSCS estuvo en el rango de 4.2 a 24.7% (media de 8.7%). Se encontró una casi perfecta correlación entre la tasa de detección de PSP y la tasa de detección de PSCS (p = 0.922; p = 0.000), lo cual indica la intercambiabilidad de estos parámetros. De igual forma, se encontró una correlación significativa entre la tasa de detección de PSP y la TDA (p = 0.769; p = 0.001), así como también entre la tasa de detección de PSCS y la TDA (p = 0.789; p = 0.000), aunque presentando una menor fuerza de asociación.
De estos hallazgos se deduce que la tasa de detección de los PSP es un potencial parámetro de calidad en colonoscopia, y comparable con la tasa de detección de todos los pólipos serratos clínicamente relevantes. Lo ideal, claro está, es que la evaluación de todos los pólipos serratos clínicamente relevantes se base en la tasa de detección de los PSCS en vez de la tasa de detección de los PSP. Sin embargo, la caracterización histopatológica de los subtipos de pólipos serratos es difícil, y el diagnóstico de patólogos expertos y no expertos puede diferir ampliamente en la práctica diaria. Usando la tasa de detección de PSP en vez de la tasa de detección de PSCS tendremos un riesgo bajo de resultados sesgados a causa de incorrecta tipificación de pólipos serratos por parte del patólogo, no afectando la medición de todos los pólipos serratos localizados en el colon proximal. En el presente estudio, la tasa de detección de PSP y de PSCS mostró una correlación casi perfecta.
Entre las fortalezas del estudio tenemos que el tamaño de muestra es adecuado para llegar a conclusiones significativas. Igualmente, hemos incluido en el trabajo un importante indicador de calidad en colonoscopia, como lo es la calidad de preparación intestinal, usando un score validado (escala de Boston). Por otro lado, todos los endoscopistas participantes son colonoscopistas experimentados. Otra fortaleza del trabajo es la exclusión de sujetos con síndrome de cáncer colorrectal hereditario o enfermedad inflamatoria intestinal, patologías con incrementado número de lesiones preneoplásicas.
El estudio presenta algunas limitaciones. En primer lugar, los pacientes incluidos en el estudio se realizaron colonoscopias por motivos diversos, incluyendo pacientes sintomáticos y asintomáticos. Esto podría favorecer la gran variabilidad en la tasa de detección de pólipos serratos entre los endoscopistas. Sin embargo, la gran mayoría de colonoscopias fueron realizadas en pacientes sintomáticos. De otro lado, no se registró el tiempo de retirada, que, como sabemos, está relacionado con la tasa de detección de pólipos. Hubo un 6.39% de casos con inadecuada preparación, lo cual pudo afectar la detección de pólipos en tales pacientes. Por otro lado, si bien se trabajó con tres patólogos expertos, no se hizo revisión de láminas para corroborar la concordancia de sus observaciones, sobre todo en el diagnóstico de las lesiones serratas.
Nuestros resultados concuerdan con otros estudios, cuatro de ellos realizados en población asintomática y uno con población sintomática y asintomática, que muestran diferencias similares en la detección de PSP entre los endoscopistas. En el estudio retrospectivo de Kahi et al.17, la tasa de detección de PSP estuvo en el rango de 1 a 18% entre 15 endoscopistas. En el estudio prospectivo de de Wijkerslooth et al.18, la tasa de detección de PSP estuvo en el rango de 6 a 22% entre cinco endoscopistas. El estudio de Bretagne et al.20 reportó también tasas de detección de PSP en rango de 1.28 a 19.25% entre 18 endoscopistas. Y más recientemente, el estudio de Mandaliya et al., en colonoscopias de cribado, reportó variaciones en la tasa de detección de PSP en el rango de 1.1 a 22%21. Todos estos estudios fueron realizados en población sometida a cribado. En el estudio transversal de Ijspeert et al.19, realizado en población sintomática y asintomática (como el nuestro), la tasa de detección de PSP estuvo entre 2.9 y 18.6% entre 16 endoscopistas. Nosotros encontramos resultados similares, con una tasa de detección de PSP en un rango de 1.8 a 17% entre 15 endoscopistas. Estos resultados sugieren que la prevalencia de PSP es similar en pacientes sometidos a cribado como también en población mixta (cribado y sintomáticos).
También evaluamos la asociación entre la tasa de detección de PSP y la TDA, mostrando una fuerte correlación (0.769; p = 0.001), similar a lo encontrado por Kahi et al.17 (0.86; p < 0.001), y mayor a lo encontrado por Ijspeert et al.19 (0.55; p = 0.03). Estos resultados sugieren que aquellos endoscopistas con alta TDA realizarían también una mejor evaluación de la mucosa del colon, logrando una más alta tasa de detección de todos los pólipos, incluyendo los PSP. Estos resultados son fortalecidos por dos estudios que muestran una asociación significativa entre la tasa de detección de PS y el tiempo de retirada corregido, lo cual podría indicar una más minuciosa inspección del colon por aquellos endoscopistas con altas tasas de detección de pólipos18,30. Nosotros pensamos que la TDA no puede ser vista como un indicador indirecto de la tasa de detección de PSCS, pues si bien la correlación entre la TDA y la tasa de detección de PSP, así como entre la TDA y la tasa de detección de PSCS fue fuerte, no alcanzó el nivel casi perfecto que sí alcanzó la correlación entre la tasa de detección de PSP y la tasa de detección de PSCS. Esto indica más bien que tanto la TDA como la tasa de detección de PSP de un endoscopista deberían ser lo suficientemente altos para hablar de una colonoscopia de alta calidad. Nuestros resultados son concordantes con un estudio prospectivo que evaluó la correlación de la tasa de detección de PSP y la TDA entre 31 centros, encontrando solo una correlación moderada (0.43; p = 0.03)31.
En conclusión, nuestro estudio demuestra que la tasa de detección de PSP es ampliamente variable entre endoscopistas y tiene una casi perfecta correlación con la tasa de detección de PSCS. Por tanto, la medición de la tasa de detección de PSP, junto con la TDA, parecen ser parámetros que aseguran una colonoscopia de alta calidad. Sin embargo, futuros estudios deberán determinar la relación entre la tasa de detección de PSP y el riesgo de cáncer de intervalo.
Consideraciones éticasLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales, quedando así aprobado por la oficina de Capacitación y Docencia del Policlínico Peruano Japonés, respetándose sus protocolos sobre la publicación de datos del paciente. De igual forma, la atención de los pacientes fue de manera estándar, no llevándose a cabo intervención alguna. Por todos estos motivos, no se solicitó consentimiento informado.
FinanciaciónLos autores declaran que no se recibió patrocinio de ningún tipo para llevar a cabo este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los médicos, enfermeras, personal técnico y administrativo del Servicio de Gastroenterología del Policlínico Peruano Japonés, por su desinteresado apoyo.
Al señor Felix Armando Barrientos Achata, por su apoyo en el análisis estadístico.