Existen diferencias entre el comportamiento clínico con sustento genético y embriológico entre el cáncer de colon derecho/proximal (CCP): ciego, colon ascendente y transverso; y cáncer de colon izquierdo/distal (CCD): colon descendente, sigmoides y recto. Nuestro objetivo es determinar si existe un patrón divergente en las características demográficas, factores de riesgo, estadificación TNM y estadio clínico al momento del diagnóstico entre pacientes con CCP y CCD.
Material y métodosEs un estudio multicéntrico, retrospectivo y analítico. Se analizaron expedientes de dos centros de ciudad Chihuahua con diagnósticos de cáncer colorrectal durante el periodo 2018-2023, confirmados por histopatología y con estadificación TNM. Se agruparon en CCP o CCD, estudiando las características mencionadas.
ResultadosHubo un total 513 casos, 404 fueron utilizados para el estudio. Se encontraron diferencias significativas en las características demográficas de sexo femenino y antecedente de colecistectomía, ambos con mayor frecuencia relativa para el CCP. El 35.6% de pacientes presentaron metástasis a distancia a pesar de una menor edad al momento del diagnóstico. El recto fue el segmento más afectado en el grupo del CCD y el colon ascendente el principal en el CCP. El CCP demostró mayor prevalencia para carcinomatosis peritoneal, mientras que el CCD mostró mayor prevalencia para diseminación a distancia a otros órganos, tanto para metástasis individuales (M1a) como a múltiples sitios (M1b). No se observaron diferencias considerables para mutaciones de KRAS, NRAS o BRAF entre ambos grupos.
ConclusionesEl CCP se asoció al antecedente de colecistectomía y sexo femenino, también demostrando una mayor agresividad por TNM respecto al CCD.
There are differences, with genetic and embryologic support, in the clinical behavior of proximal colon cancer (PCC) (right colon: cecum, ascending colon, and transverse colon) and distal colon cancer (DCC) (left colon: descending colon, sigmoid colon, rectum). Our aim was to determine whether there was a divergent pattern in the demographic characteristics, risk factors, TNM stage, and clinical stage at diagnosis between patients with PCC and those with DCC.
Material and methodsA retrospective, analytic, and multicenter study was conducted. Medical records of patients diagnosed with colorectal cancer, confirmed by histopathology and with TNM staging, within the time frame of 2018-2023, were collected from two hospital centers in the city of Chihuahua. They were divided into the PCC and DCC groups, for evaluating the abovementioned characteristics.
ResultsFrom a total of 513 cases, 404 were included in the study. Significant differences were found in the demographic characteristics of female sex and a history of cholecystectomy, both with a greater relative frequency for PCC. Distant metastasis was present in 35.6% of patients, despite their younger age at diagnosis. The rectum was the most commonly affected segment in the DCC group, as was the ascending colon in the PCC group. There was a greater prevalence of peritoneal carcinomatosis in the PCC group. In contrast, the DCC group had a greater prevalence of distant metastasis to other organs, as both individual metastasis (M1a) and multiple site metastasis (M1b). There were no considerable differences in the KRAS, NRAS, or BRAF gene mutations between the two groups.
ConclusionsPCC was associated with a history of cholecystectomy and female sex and had more aggressive TNM staging, compared with DCC.
El cáncer colorrectal (CCR) ocupa el tercer lugar en frecuencia de nuevo diagnóstico de cáncer a nivel mundial, con más de 1.8 millones de nuevos diagnósticos durante el año 20201. Según información de la Secretaría de Salud, en México se estima que se diagnostican aproximadamente 15 mil casos de cáncer de colon cada año, representando la primera causa de muerte por cáncer en el norte del país2. A su vez, durante el año 2020 el CCR fue la segunda causa de muerte por cáncer en hombres y mujeres en el mundo, con casi un millón de muertes por año o el 10% de todas las muertes secundarias a cáncer1,3. En México, datos del Instituto Nacional de Estadística y Geografía (INEGI) colocan al CCR como la primera causa de muerte por cáncer en hombres y la cuarta en mujeres de 30-59 años; ocupando el tercer lugar en ambos grupos en mayores de 60 años4. En el futuro, datos del Observatorio Mundial del Cáncer (GLOBOCAN, por su abreviatura en inglés) predicen que para el 2040 habrá un incremento en el número de casos de CCR a 3.2 millones por año3.
Tradicionalmente el CCR ha sido considerado como aquella neoplasia maligna que afecta cualquiera de los segmentos del mismo, ya sea el ciego, colon ascendente, transverso, descendente, sigmoides y recto. No obstante, desde la década de los 90 se ha propuesto una diferencia entre el comportamiento clínico y las características del cáncer de colon derecho/proximal (CCP): ciego, colon ascendente y transverso; y cáncer de colon izquierdo/distal (CCD): colon descendente, sigmoides y recto. Esta propuesta se fundamenta en el origen embriológico distinto de ambos segmentos, con el intestino medio originando el primero y el intestino posterior al segundo5. A su vez, se piensa que otras variables, como la carga y el tipo de microbiota específica de cada segmento, suministro vascular, inervación, exposición a ácidos biliares y función fisiológica también influyen en diferente medida al desarrollo de CCP o CCD6,7. La repercusión de estas observaciones es la presencia de dos entidades diferentes, las cuales presentan un comportamiento epidemiológico, biológico, patológico, carcinogénico y pronóstico divergente5,8.
Más aún, esta distinción parece también causar que exista una diferencia en los factores de riesgo para el desarrollo de cáncer entre ambos segmentos; recientemente se ha descrito que el sexo, obesidad, falta de actividad física, edad avanzada y tabaquismo predisponen en distinta medida a la aparición de cáncer entre los segmentos del colon9–11. Asimismo, se ha descrito que a nivel genético también existen diferentes mutaciones y vías carcinogénicas implicadas en el desarrollo de cáncer entre ambos segmentos del colon6,7,9. Por lo tanto, la evidencia actual demuestra que el CCP y distal representan entidades diferentes con sus respectivos factores de riesgo, vías carcinogénicas, edad de presentación y comportamiento clínico, destacando la importancia de un manejo más selectivo para ambos tipos.
Los objetivos del presente trabajo son determinar si existe un patrón divergente en cuanto a las características demográficas, probables factores de riesgo, estratificación TNM y estadificación clínica al momento del diagnóstico entre los pacientes con CCP: ciego, ascendente y transverso; y CCD: descendente, sigmoides y recto.
Material y métodosEl presente es un estudio observacional analítico multicéntrico con modelo de cohorte retrospectiva, verificando su realización con la lista STROBE para estudios observacionales. Se analizaron todos los pacientes que recibieron atención médica y seguimiento bajo diagnóstico de CCR en Hospital Ángeles Chihuahua y Centro Estatal de Cancerología de Chihuahua (CECAN) entre enero del 2018 y diciembre del 2023. Se extrajeron de los expedientes clínicos de cada paciente datos demográficos, antecedente de colecistectomía, TNM patológico, nivel de diferenciación tumoral, estadio clínico, sitios de metástasis a distancia y análisis de mutaciones para KRAS, NRAS y BRAF en los casos metastásicos en los que se realizaron. Los pacientes fueron agrupados como CCP: ciego, colon ascendente y transverso; o CCD: colon descendente, sigmoides y recto, con base en la localización anatómica del tumor primario en el colon.
Para la estadificación uniforme de los casos se utilizó el sistema de TNM y estadio clínico propuestos en la 8.a edición de la American Joint Committee on Cancer (AJCC)12.
Criterios de inclusión y exclusiónSe incluyeron para el estudio a pacientes mayores de 35 años con diagnóstico de CCR con diferenciación tipo adenocarcinoma confirmado por histopatología. Se excluyeron los casos que no contaron con un expediente clínico completo. También se eliminaron aquellos casos que solo hayan recibido el diagnóstico de CCR por colonoscopia sin seguimiento consecuente, o en aquellos en quienes se haya realizado el análisis de piezas quirúrgicas posquimioterapia debido a terapia neoadyuvante.
Adquisición de los datosRespecto a datos demográficos, se registraron las variables: sexo, edad, índice de masa corporal (IMC), antecedente de colecistectomía, tabaquismo y antecedente heredo-familiar de cáncer para CCR u otros sitios. Para corroborar la ausencia de la vesícula biliar se analizaron estudios de imagen o reportes de imagenología de los mismos. Para las características histopatológicas se revisaron los reportes de histopatología definitivos de las muestras de colectomía o resección abdominoperineal. Se identificó de cada tumor su localización anatómica, el grado de diferenciación celular (catalogado como bajo grado (G1 y G2), alto grado (G3 y G4) y no valorable), la estadificación TNM y el estadio clínico. Los casos con metástasis a distancia fueron confirmados por reportes de patología, registrándose particularmente metástasis hepáticas, pulmonares y/o carcinomatosis peritoneal, al ser los sitios descritos con mayor prevalencia para metástasis del CCR13,14. El resto de las metástasis fueron agrupados como «Otros sitios» (p. ej., ovario, hueso, sistema nervioso central, estómago, piel, etc.). Se incluyó el panel de mutación para los genes KRAS, NRAS y BRAF en los pacientes con metástasis a distancia en quienes se haya realizado.
Análisis estadísticoLas variables cualitativas se presentan como número y porcentaje; las variables cuantitativas se resumen en media y desviación estándar. Para la comparación de medias de las variables demográficas entre CCP y CCD se utilizó la prueba de la t de Student para muestras independientes y Chi-cuadrado de Pearson para las variables cualitativas. El nivel de significancia (p) fue de ≤0.05. Se comparó la prevalencia respecto al nivel de diferenciación tumoral, estadio TNM, estadio clínico y análisis para mutaciones de KRAS, NRAS y BRAF entre los casos con CCP y CCD; para esta comparativa se consideró como significativa una diferencia en la prevalencia mayor al 5% entre ambos grupos. Los análisis estadísticos se realizaron en el programa STATA 8.0.
Consideraciones éticasEl presente estudio fue valorado y aprobado por los comités de investigación médica y ética en investigación médica del Hospital Ángeles Chihuahua (Registro CONBIOETICA-08-CEI-001-20160413) y la Facultad de Medicina y Ciencias Biomédicas de la Universidad Autónoma de Chihuahua (Número de registro Cl-014-23). Al tratarse de un estudio de tipo retrospectivo, observacional y analítico, no se practicó intervención en cuanto a los manejos o decisiones tomados sobre los pacientes estudiados, meramente recopilando los datos de los expedientes clínicos. Los pacientes fueron codificados con la finalidad de proteger su anonimato. A su vez, los autores declaran que este artículo no contiene información personal que permita identificar a los pacientes.
ResultadosSe identificaron un total de 513 casos con CCR entre ambos centros dentro del periodo 2018-2023, de los cuales 109 fueron eliminados al no cumplir con los criterios de inclusión establecidos en el apartado de materiales y métodos; quedando un total de 404 casos de CCR de tipo adenocarcinoma para realizar el presente estudio. Las características demográficas globales de la población estudiada se muestran en la tabla 1.
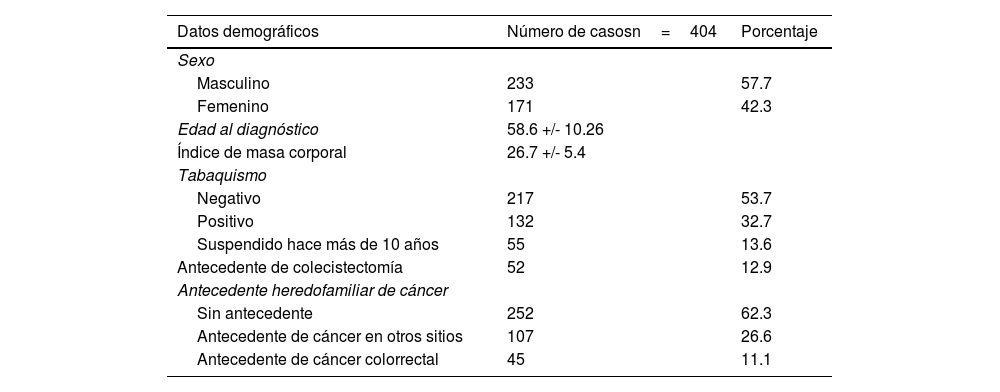
Características demográficas globales de la población de cáncer colorrectal atendida en el Hospital Ángeles Chihuahua y CECAN entre los años 2018-2023
| Datos demográficos | Número de casosn=404 | Porcentaje |
|---|---|---|
| Sexo | ||
| Masculino | 233 | 57.7 |
| Femenino | 171 | 42.3 |
| Edad al diagnóstico | 58.6 +/- 10.26 | |
| Índice de masa corporal | 26.7 +/- 5.4 | |
| Tabaquismo | ||
| Negativo | 217 | 53.7 |
| Positivo | 132 | 32.7 |
| Suspendido hace más de 10 años | 55 | 13.6 |
| Antecedente de colecistectomía | 52 | 12.9 |
| Antecedente heredofamiliar de cáncer | ||
| Sin antecedente | 252 | 62.3 |
| Antecedente de cáncer en otros sitios | 107 | 26.6 |
| Antecedente de cáncer colorrectal | 45 | 11.1 |
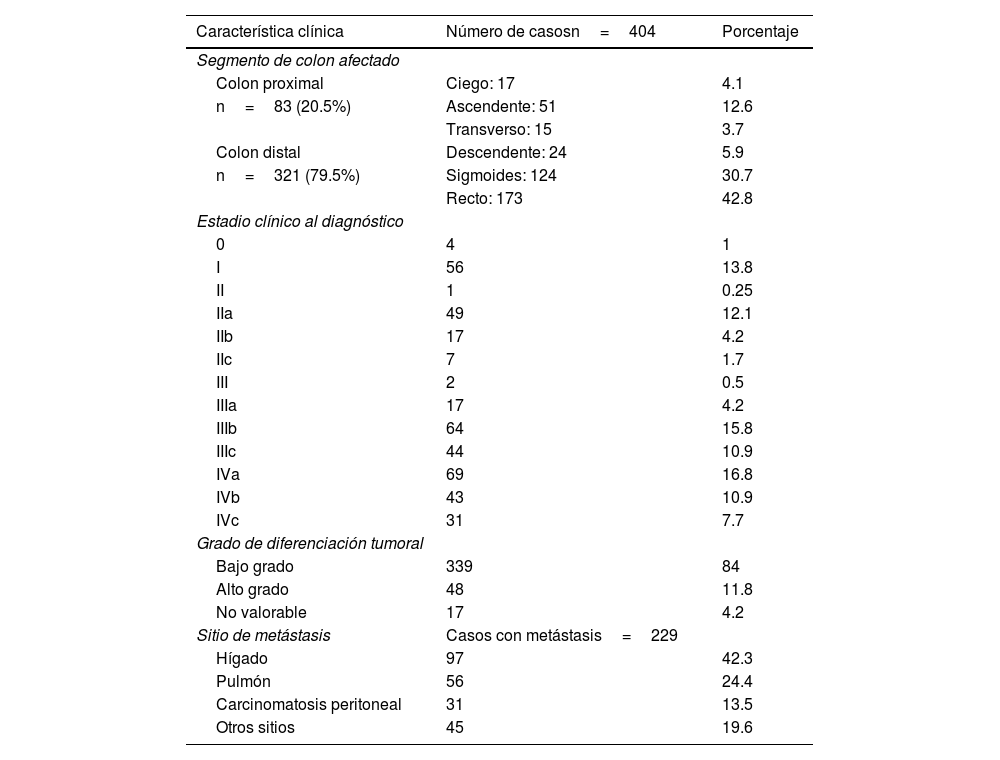
La localización del tumor fue de predominio distal en 321 (79%) de los casos, afectando principalmente al recto y colon sigmoides. Dentro del colon proximal el colon ascendente fue el segmento más prevalente. En 270 (66%) de los casos el diagnóstico se realizó en estadio III-IV; solo 60 (15%) del total estaban en un estadio I o in situ. Un total de 229 registros individuales de metástasis fueron realizados, siendo el hígado el órgano con la mayor prevalencia para implantes a distancia. Las características clínicas globales de la población se muestran en la tabla 2.
Características clínicas globales de la población de cáncer colorrectal atendida en el Hospital Ángeles Chihuahua y CECAN entre los años 2018-2023
| Característica clínica | Número de casosn=404 | Porcentaje |
|---|---|---|
| Segmento de colon afectado | ||
| Colon proximal | Ciego: 17 | 4.1 |
| n=83 (20.5%) | Ascendente: 51 | 12.6 |
| Transverso: 15 | 3.7 | |
| Colon distal | Descendente: 24 | 5.9 |
| n=321 (79.5%) | Sigmoides: 124 | 30.7 |
| Recto: 173 | 42.8 | |
| Estadio clínico al diagnóstico | ||
| 0 | 4 | 1 |
| I | 56 | 13.8 |
| II | 1 | 0.25 |
| IIa | 49 | 12.1 |
| IIb | 17 | 4.2 |
| IIc | 7 | 1.7 |
| III | 2 | 0.5 |
| IIIa | 17 | 4.2 |
| IIIb | 64 | 15.8 |
| IIIc | 44 | 10.9 |
| IVa | 69 | 16.8 |
| IVb | 43 | 10.9 |
| IVc | 31 | 7.7 |
| Grado de diferenciación tumoral | ||
| Bajo grado | 339 | 84 |
| Alto grado | 48 | 11.8 |
| No valorable | 17 | 4.2 |
| Sitio de metástasis | Casos con metástasis=229 | |
| Hígado | 97 | 42.3 |
| Pulmón | 56 | 24.4 |
| Carcinomatosis peritoneal | 31 | 13.5 |
| Otros sitios | 45 | 19.6 |
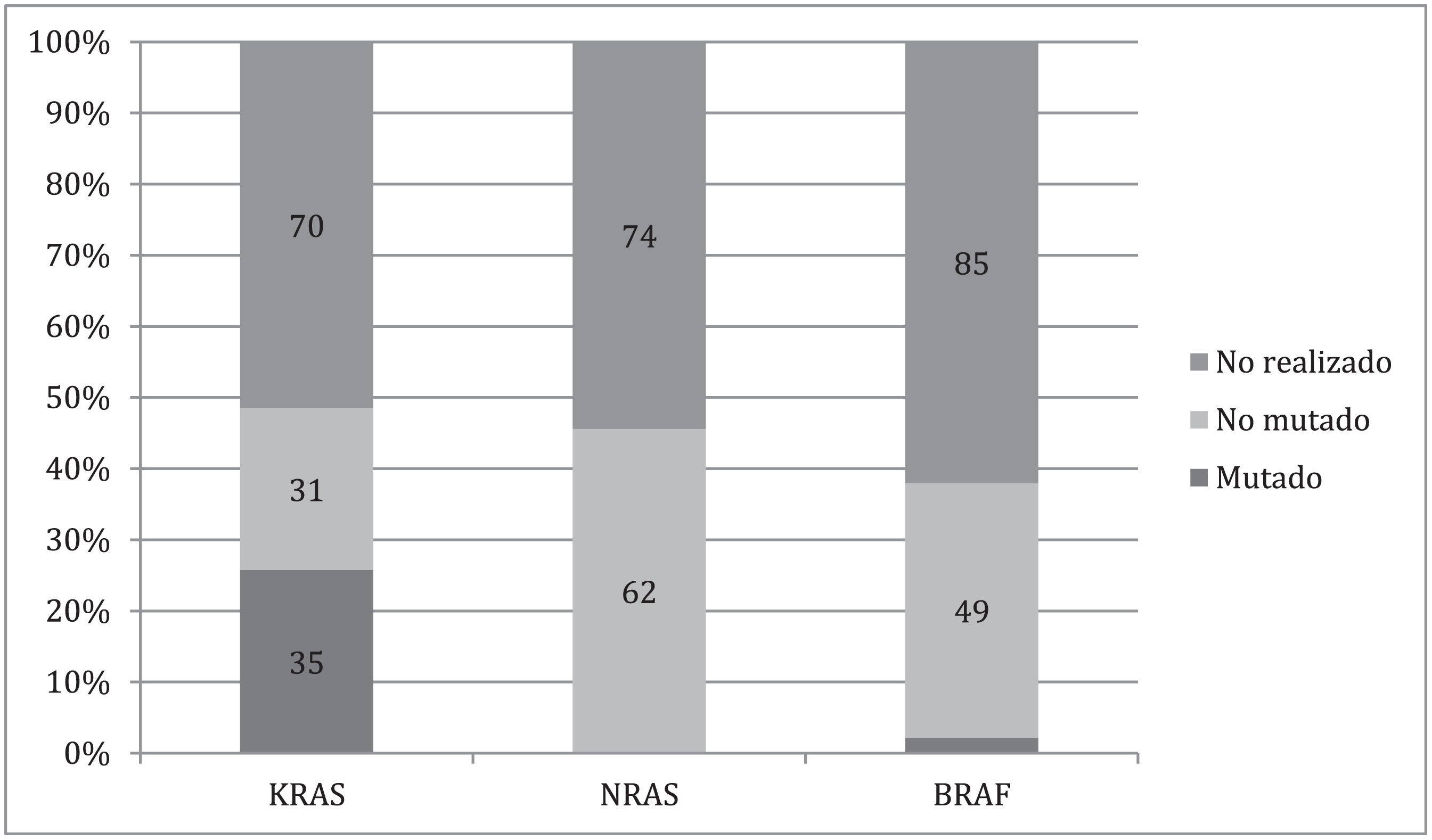
En 35 (25%) de los pacientes con metástasis a distancia se encontró mutación en el gen KRAS, ninguno presentó mutaciones para NRAS y solo 3 (2.2%) de los sujetos tuvieron mutaciones para BRAF. Sin embargo, para los tres genes más de la mitad de los candidatos a recibir la prueba no fueron sometidos a dicho análisis (fig. 1).
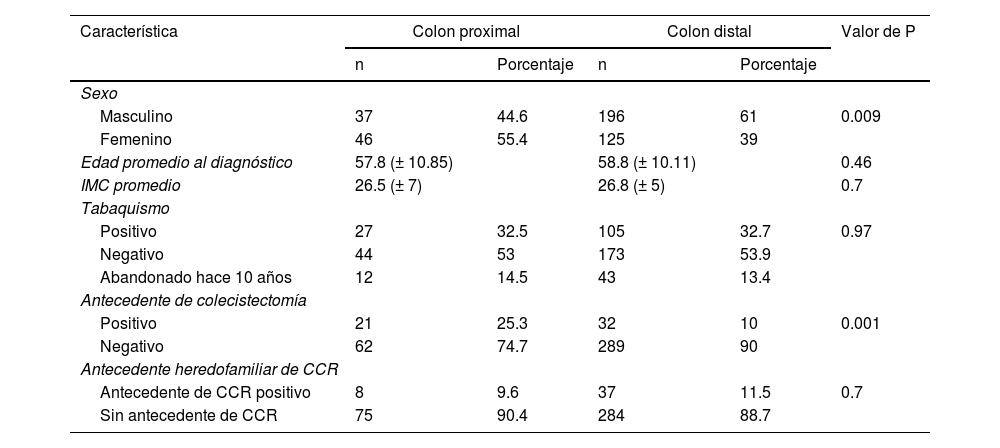
Se observaron diferencias considerables para el sexo y antecedente de colecistectomía respecto a las frecuencias relativas de distintos factores de riesgo para el CCR entre los casos con CCP y CCD. El resto de las características demostraron una distribución proporcional entre ambos grupos (tabla 3).
Diferencias entre las características demográficas y sus frecuencias relativas entre el colon proximal y el colon distal
| Característica | Colon proximal | Colon distal | Valor de P | ||
|---|---|---|---|---|---|
| n | Porcentaje | n | Porcentaje | ||
| Sexo | |||||
| Masculino | 37 | 44.6 | 196 | 61 | 0.009 |
| Femenino | 46 | 55.4 | 125 | 39 | |
| Edad promedio al diagnóstico | 57.8 (± 10.85) | 58.8 (± 10.11) | 0.46 | ||
| IMC promedio | 26.5 (± 7) | 26.8 (± 5) | 0.7 | ||
| Tabaquismo | |||||
| Positivo | 27 | 32.5 | 105 | 32.7 | 0.97 |
| Negativo | 44 | 53 | 173 | 53.9 | |
| Abandonado hace 10 años | 12 | 14.5 | 43 | 13.4 | |
| Antecedente de colecistectomía | |||||
| Positivo | 21 | 25.3 | 32 | 10 | 0.001 |
| Negativo | 62 | 74.7 | 289 | 90 | |
| Antecedente heredofamiliar de CCR | |||||
| Antecedente de CCR positivo | 8 | 9.6 | 37 | 11.5 | 0.7 |
| Sin antecedente de CCR | 75 | 90.4 | 284 | 88.7 | |
CCR: cáncer colorrectal; IMC: índice de masa corporal.
La distribución de prevalencia para el estadio T mostró que 69 (83%) de los casos de CCP fueron diagnosticados en un estadio T3-T4, considerablemente mayor a los 211 (65.7%) casos para el CCD. A su vez, también se encontraron otras diferencias considerables entre el CCP y CCD para N2a-c (20 [24%] vs. 49 [16%] casos, respectivamente) y M1c (14 [18%] vs. 17 [5.6%] casos, respectivamente). Por otro lado, el CCD demostró mayor prevalencia para M1a-b con 94 (29%) casos respecto al CCP con 18 (20%) y también para Tx-T2 (80 [34] vs. 14 [16.8%] casos, respectivamente).
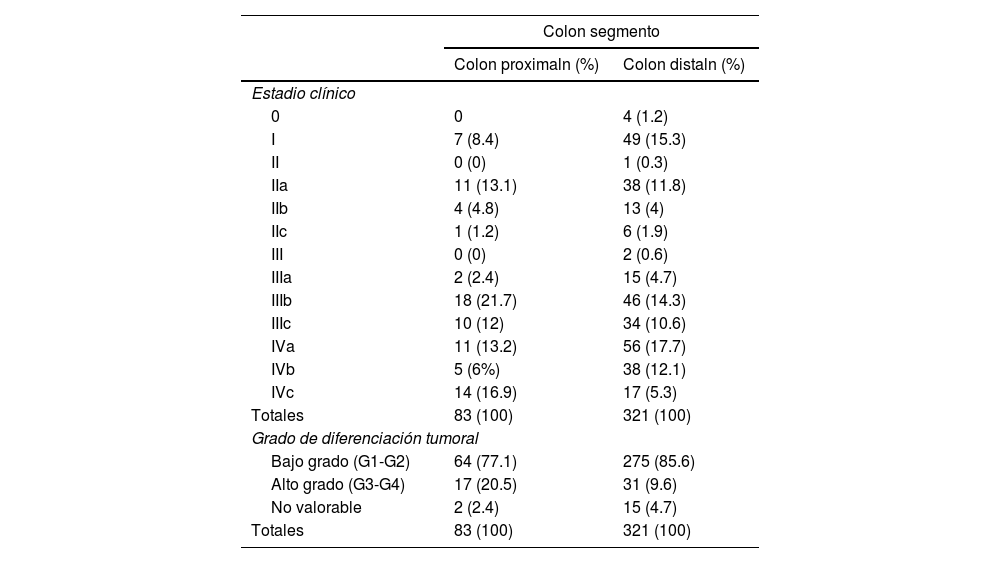
La distribución según la estadificación clínica mostró que el 72% (n=60) de los casos con CCP fueron diagnosticados en un estadio regional/metastásico, frente al 65% (n=208) en el CCD. Respecto a los estadios individuales, las mayores diferencias se observaron en los estadios I, IIIb y IVc. A su vez, con un hallazgo significativo de p=0.03, el colon proximal mostró una mayor frecuencia relativa para diagnóstico en alto grado tumoral con un 20% (n=17) respecto al colon distal con el 9% (n=31) (tabla 4).
Distribución de las prevalencias para la estadificación clínica y el grado de diferenciación tumoral entre el cáncer de colon proximal y el cáncer de colon distal
| Colon segmento | ||
|---|---|---|
| Colon proximaln (%) | Colon distaln (%) | |
| Estadio clínico | ||
| 0 | 0 | 4 (1.2) |
| I | 7 (8.4) | 49 (15.3) |
| II | 0 (0) | 1 (0.3) |
| IIa | 11 (13.1) | 38 (11.8) |
| IIb | 4 (4.8) | 13 (4) |
| IIc | 1 (1.2) | 6 (1.9) |
| III | 0 (0) | 2 (0.6) |
| IIIa | 2 (2.4) | 15 (4.7) |
| IIIb | 18 (21.7) | 46 (14.3) |
| IIIc | 10 (12) | 34 (10.6) |
| IVa | 11 (13.2) | 56 (17.7) |
| IVb | 5 (6%) | 38 (12.1) |
| IVc | 14 (16.9) | 17 (5.3) |
| Totales | 83 (100) | 321 (100) |
| Grado de diferenciación tumoral | ||
| Bajo grado (G1-G2) | 64 (77.1) | 275 (85.6) |
| Alto grado (G3-G4) | 17 (20.5) | 31 (9.6) |
| No valorable | 2 (2.4) | 15 (4.7) |
| Totales | 83 (100) | 321 (100) |
En ambos grupos el análisis de mutaciones para KRAS, NRAS y BRAF no fue realizado a más de la mitad de los casos con metástasis a distancia; a su vez, no se encontraron diferencias significativas en cuanto a la prevalencia para las mutaciones entre ambos segmentos del colon en los casos en los que sí se realizó el estudio.
Discusión y conclusionesLas metas del presente artículo fueron establecer diferencias en las características demográficas, probables factores de riesgo y propiedades patológicas al diagnóstico entre el CCP y el CCD.
El CCR ocurrió con más frecuencia en el sexo masculino, similar a los análisis epidemiológicos de los EE. UU.; estos resultados contrastaron respecto a otros estudios realizados en centro y el sur de México, donde la tendencia parece inclinarse hacia una mayor prevalencia del CCR en el sexo femenino11,15–18; lo que pudiese explicarse por qué la población del norte de México pueda compartir factores de riesgo para el CCR con EE. UU..
La edad promedio al diagnóstico (58 años) fue menor a la reportada en EE.UU.16; y tuvo una diferencia de aproximadamente 5 años menos con respecto a otros reportes epidemiológicos de otros estados de la República Mexicana15,18,19. Igualmente, el mayor IMC promedio de nuestra población difirió respecto a otros análisis de características demográficas del CCR en México, en concordancia con una mayor tasa de sobrepeso reportada en los estados fronterizos del norte de México en el Censo Nacional de Salud15,18,20. A su vez, el antecedente de tabaquismo activo fue positivo en más de un cuarto de la población, un antecedente común en los pacientes con CCR en México15,18. Aunque la prevalencia para antecedente de CCR familiar no ha sido establecida concretamente, una prevalencia baja para este factor de riesgo ha sido documentada15.
El colon distal presentó la mayoría de los casos de CCR en nuestro estudio, similar a la distribución de prevalencia establecida en la literatura entre el colon proximal y distal; a su vez, el recto aportó poco más de la mitad (54%) de los casos para este segmento11,15,18,19,21. Por otro lado, el colon ascendente aportó la mayoría de los casos para el segmento proximal, difiriendo respecto a otros análisis de distribución en donde el ciego presentó mayor prevalencia para ese segmento21.
En cuanto a la distribución del estadio clínico, más de un tercio de los casos (35.6%) presentaron diseminación tumoral a distancia a pesar de una menor edad al momento del diagnóstico, un número significativamente mayor en comparación con estudios epidemiológicos en EE. UU. (22%)11. Esta mayor prevalencia de estadios avanzados de la enfermedad puede ser explicada por la tendencia para un diagnóstico tardío observado en México15,21; hallazgo que podría ser secundario a una menor adherencia a pruebas de tamizaje documentada en toda América Latina22,23. En concordancia con lo descrito por Sierra et al, referente a que la alta mortalidad del CCR en América Latina pudiera originarse en la ausencia de tamizaje y diagnóstico en estadios tempranos24.
La distribución de prevalencia para los sitios de metástasis fue similar para otros patrones de diseminación a distancia observados en otros estudios14, siendo el hígado el más frecuente para implantes tumorales a distancia con el 42.3%. El 80% de los sitios de metástasis se presentaron en el hígado, pulmón o carcinomatosis peritoneal, mismos que son descritos como los sitios más frecuentes para diseminación a distancia en el CCR metastásico13,14.
La literatura estima una prevalencia de mutaciones para los casos metastásicos del 35-38% para KRAS, del 4% para BRAF y del 7% para NRAS25,26. La baja prevalencia observada en nuestro estudio, en lo referente a las mutaciones, se puede explicar por qué más de la mitad de los casos con metástasis no recibieron el análisis para su detección. Este sub-reporte ha sido observado en otros países de América Latina, colocando una amplia población de casos con diseminación a distancia sin oportunidad de recibir quimioterapia dirigida que pudiera resultar efectiva27.
Contrario a lo establecido respecto a una mayor edad al diagnóstico del CCP en comparación con el CCD5,10,28, nuestro estudio encontró una edad menor para el CCP. Lo cual, aunado a un mayor estadio clínico al diagnóstico, puede hacer referencia a una progresión carcinogénica más agresiva en nuestra población. Esta observación puede estar relacionada con el alto consumo de alimentos catalogados como carcinogénicos según la Organización Mundial de la Salud, que ha sido observada y descrita, particularmente en los estados fronterizos del norte de México, según el análisis de Manzanares.Rivera29; pudiendo ser este el origen o un factor contribuyente a la mayor agresividad del CCP observada en nuestro estudio.
En México y América Latina en general hay una escasez de datos sobre diferencias en demografía y factores de riesgo asociados entre ambos segmentos del colon. Nuestros resultados muestran una relación entre el sexo y la distribución anatómica del CCR; con predominio de mujeres en el CCP (55 vs. 44%) y de varones (61 vs. 39%) en el CCD. Apoyando la noción de factores hormonales y genéticos que pudieran participar en su desarrollo5,30,31. En relación con los otros factores de riesgo para CCR, el único con diferencia significativa entre ambos grupos fue la colecistectomía para el CCP (CCP 25 vs. CCD 10%, p 0.001), misma relación que recientemente ha sido estudiada en mayor profundidad32–35. Estos hallazgos respaldan la probable influencia de distintos factores predisponentes para el desarrollo de CCR entre ambos segmentos del colon; el sexo femenino en particular pudiese presentar un aumento en el riesgo de desarrollar CCP posterior a la colecistectomía. La relevancia clínica de estas observaciones requiere ser estudiada a través estudios con diseños más sólidos y con un número mayor de casos o pacientes.
Aunque carecemos de información y caracterización sobre el CCP en América Latina, nuestros resultados fueron similar a la literatura de otros países respecto una mayor tendencia del CCP a ser diagnosticado en un estadio clínico y TNM elevado28,36,37, debido a que los pacientes con CCP en nuestro estudio también demostraron mayor prevalencia para diagnóstico en estadios con diseminación regional y a distancia; estos resultados pudieran surgir como consecuencia de una progresión tumoral local y regional acelerada en nuestra población, o a un retraso en el uso de pruebas de tamizaje para la detección temprana y oportuna del CCP23,38. A su vez, los casos con CCP demostraron mayor prevalencia para desarrollar carcinomatosis peritoneal (M1c), una complicación regional severa que ha sido previamente documentada en este segmento del colon39,40. Mientras que, el CCD mostró mayor prevalencia para diseminación a distancia a otros órganos, tanto para metástasis individuales (M1a) como a múltiples sitios (M1b)14,39.
Similar a la literatura, no se observaron diferencias considerables en la prevalencia para mutaciones de KRAS, NRAS o BRAF entre los casos metástasis de CCP y CCD41,42; aunque la baja prevalencia de los tres genes probablemente estuvo sesgada debido a la falta de realización de estas pruebas en la población de América Latina y el Caribe previamente comentada27,43.
Algunas fortalezas del presente trabajo fueron el origen multicéntrico de la población estudiada y la recopilación objetiva de datos relevantes para el análisis, como lo fueron el estadio clínico, estadio TNM y sitios de metástasis a través de los reportes de histopatología definitivos. Sin embargo, nuestro estudio también contó con las limitaciones esperadas de los estudios de diseño retrospectivo; principalmente la recopilación de datos de forma subjetiva a través del interrogatorio a los pacientes en la historia clínica. Sería de gran relevancia incluir más centros para futuros trabajos relacionados, con la finalidad de incrementar la base poblacional y obtener resultados más concretos. A su vez, el desarrollo de trabajos de modelo prospectivo puede ayudar a fortalecer la recopilación más precisa de datos relevantes para el análisis de las características clínicas y demográficas. Finalmente, un análisis comparativo respecto a la influencia y diferencia que los distintos factores de riesgo tienen entre ambos segmentos de colon sería una oportunidad para fortalecer su relación en la literatura mexicana, particularmente respecto a la colecistectomía como un factor de riesgo para desarrollar CCP.
En resumen, se encontraron diferencias significativas entre el CCP y el CCD respecto al sexo y antecedente de colecistectomía. Más de un tercio de los casos tuvieron metástasis al diagnóstico. El CCP parece mostrar una mayor agresividad en la población de Chihuahua, debido a una menor edad al diagnóstico y mayor proporción de casos diagnosticados en estadios avanzados. Por otro lado, el CCD fue el más prevalente dentro de la población, siendo el recto el sitio para CCR más frecuente. La población de los estados fronterizos del norte de México pudiera beneficiarse de una adherencia más estricta a los programas de tamizaje del CCR, particularmente debido al alto consumo de alimentos con propiedades carcinogénicas y la escasez de su implementación en la población.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sectores comerciales o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.