La diabetes es un problema de salud pública con prevalencias globales estimadas del 10%, y en México, del 12%. Esta enfermedad crónico-degenerativa genera costos significativos. El tratamiento para la diabetes involucra diversos grupos de medicamentos, algunos de los cuales pueden provocar efectos adversos gastrointestinales significativos, como dispepsia, náuseas, vómitos, distensión abdominal, diarrea y estreñimiento. Los medicamentos asociados con mayor frecuencia a dichos efectos adversos son la metformina, la acarbosa y los agonistas GLP-1. Los efectos adversos gastrointestinales impactan en la calidad de vida y en el manejo de los pacientes con diabetes. Factores como la neuropatía visceral, la disglucemia aguda, la disbiosis y el sobrecrecimiento bacteriano intestinal también contribuyen a los síntomas gastrointestinales en pacientes con diabetes, por lo que se deben considerar múltiples opciones etiológicas ante síntomas gastrointestinales y no atribuirlos exclusivamente al uso de antidiabéticos. La individualización del tratamiento, considerando la comorbilidad gastrointestinal y el tipo de fármaco utilizado, es crucial para mitigar los efectos adversos y mejorar la calidad de vida de los pacientes con diabetes. Esta revisión narrativa tiene como objetivo describir los efectos adversos gastrointestinales de los antidiabéticos, así como sus mecanismos fisiopatológicos y las medidas terapéuticas correspondientes.
Diabetes is a public health problem with an estimated worldwide prevalence of 10% and a prevalence of 12% in Mexico. The costs resulting from this chronic-degenerative disease are significant. Treatment for diabetes involves different medication groups, some of which can cause significant gastrointestinal adverse effects, such as dyspepsia, nausea, vomiting, bloating, diarrhea, and constipation. The medications most frequently associated with said adverse effects are metformin, acarbose, and GLP-1 agonists. Gastrointestinal adverse effects negatively impact the quality of life and management of patients with diabetes. The factors of visceral neuropathy, acute dysglycemia, dysbiosis, and intestinal bacterial overgrowth contribute to the gastrointestinal symptoms in patients with diabetes, making it necessary to consider multiple etiologic factors in the presence of gastrointestinal symptoms, and not exclusively attribute them to the use of antidiabetics. Personalized treatment, considering gastrointestinal comorbidity and the type of drug utilized, is essential for mitigating the adverse effects and improving the quality of life in patients with diabetes. The aim of the present narrative review was to describe the gastrointestinal adverse effects of the antidiabetic drugs, their pathophysiologic mechanisms, and the corresponding therapeutic measures.
La diabetes es un problema de salud pública global y nacional, reportándose una prevalencia mundial del 10.5% y una prevalencia en México del 12.6%1-3. La alta prevalencia de esta enfermedad crónica-degenerativa genera importantes costos de salud en México, representando el 14% de las defunciones y generando la diabetes tipo2 un costo medio acumulado por paciente a 10 y 20años de 2,302.51USD y 4,398.7USD, respectivamente4. Actualmente existen 12 grupos de medicamentos aprobados para el manejo de diabetes, y algunos de ellos se han asociado con efectos adversos gastrointestinales significativos; los más frecuentemente implicados son los agonistas GLP-1, la metformina y los inhibidores de la alfa glucosidasa. Dentro de los efectos adversos gastrointestinales descritos destacan síntomas de dispepsia, náusea, vómito, distensión, diarrea y estreñimiento5-14.
La presencia de efectos adversos gastrointestinales asociados a los antidiabéticos impacta de manera global en el paciente con diabetes, ya que pueden aumentar el requerimiento de atención médica, con afección de la calidad de vida por los síntomas desencadenados y modificación de esquemas terapéuticos. Por lo mencionado previamente, surge el interés de realizar una revisión narrativa sobre esta temática, cumpliendo como objetivo describir los efectos adversos gastrointestinales de los antidiabéticos, así como el mecanismo fisiopatológico y las medidas terapéuticas a otorgar.
MetodologíaSe realizó una síntesis de información en el tema de «Efectos adversos gastrointestinales de antidiabéticos» mediante una revisión narrativa. Se realizó una búsqueda electrónica en el motor de búsqueda PubMed® con términos MeSH «Diabetes Mellitus», «Hyperglycemia», «Diabetes Complications», «Hypoglycemic Agents», «Glucagon-Like Peptide-1 Receptor Agonists», «Glycoside Hydrolase Inhibitors», «Acarbose», «Metformin», «Dipeptidyl-Peptidase IV Inhibitors», «Sodium-Glucose Transporter 2 Inhibitors», «Drug-Related Side Effects and Adverse Reactions», «Gastrointestinal Diseases», «Gastroparesis», «Gastric Emptying», «Dysbiosis», «Gastrointestinal Microbiome», «Microbiota», «Constipation», «Diarrhea», «Nausea», «Vomiting», «Gastrointestinal Agents». Se incluyeron artículos de tipo experimentales, ensayos clínicos, revisiones sistemáticas, metaanálisis, guías de práctica clínica, consensos y tres revisiones narrativas, estas últimas haciendo referencia a terminología.
En el periodo de noviembre del 2023 a enero del 2024 se realizaron tres sesiones entre cuatro especialistas en gastroenterología y tres especialistas en endocrinología con la finalidad de revisar y discutir la evidencia científica recopilada.
Factores asociados a la aparición de síntomas gastrointestinales en pacientes con diabetesAunque de manera tradicional los síntomas gastrointestinales son frecuentemente asociados a pacientes que viven con diabetes, la prevalencia reportada en diferentes grupos poblaciones es variable15. Diferentes factores, además de los fármacos propios para el manejo de la enfermedad, pueden ocasionar manifestaciones gastrointestinales, haciendo el abordaje del paciente con diabetes y síntomas gastrointestinales todo un reto diagnóstico. La disfunción neuronal que caracteriza a la diabetes16, la hiperglucemia, las modificaciones dietéticas, entre ellas el uso de edulcorantes, e incluso la mayor predisposición a ciertos trastornos psicológicos16 son algunos de los factores que pueden contribuir de manera independiente o interactuar en conjunto para el desarrollo y progresión de síntomas gastrointestinales en este grupo de pacientes psicológicos16,17.
Neuropatía gastrointestinal diabéticaLa neuropatía gastrointestinal diabética puede afectar cualquier porción del tracto gastrointestinal, manifestándose con alteraciones como gastroparesia, así como estreñimiento e incontinencia fecal secundarios a neuropatía visceral16,18. La hiperglucemia crónica condiciona un microambiente entérico alterado, con incremento del estrés oxidativo, formación de productos finales de la glucosilación avanzada, inflamación y reducción de neurotransmisores y hormonas locales, afectando la vasculatura entérica y la celularidad del músculo liso19. Los cambios previamente descritos afectan tanto las funciones sensoriales, motoras y secretoras del aparato digestivo, lo que contribuye a la amplia gama de alteraciones gastrointestinales mencionadas18.
Dentro de las manifestaciones gastrointestinales más estudiadas de la neuropatía gastrointestinal diabética se encuentra la gastroparesia. De manera clásica, la gastroparesia diabética ha sido descrita como el enlentecimiento de la motilidad gástrica en pacientes con diabetes, asociado mayormente a descontrol hiperglucémico crónico20. La gastroparesia se define como un retraso anormal en el vaciamiento gástrico en ausencia de obstrucción mecánica21. Del 30 al 50% de los pacientes con diabetes de larga evolución presentan retraso del vaciamiento gástrico que puede estar o no asociado a síntomas gastrointestinales, como náusea, vómito, distensión abdominal, saciedad temprana y plenitud posprandial22,23. Sin embargo, la prevalencia de gastropatía diabética es variable según la población y los métodos diagnósticos utilizados en cada estudio24.
Disglucemia agudaLa disglucemia aguda, es decir, los episodios agudos tanto de hiperglucemia como de hipoglucemia, afectan la función motora gastrointestinal y la sensibilidad intestinal25. La hiperglucemia aguda se ha asociado a un retraso en el vaciamiento gástrico o íleo26. Durante los episodios de cetoacidosis diabética, hasta el 46% de los pacientes presentan dolor abdominal, el cual puede explicarse, en gran parte, por el retraso en el vaciamiento gástrico y las anormalidades electrolíticas con las que suelen cursar estos episodios, como la hipokalemia. Por el contrario, las hipoglucemias agudas se han asociado a un incremento en el vaciamiento gástrico27,28. Se ha propuesto que los cambios en el vaciamiento gástrico asociados a la disglucemia aguda son una forma adicional de regulación de la glucosa, en donde la absorción de la glucosa se incrementa o reduce como una respuesta contrarreguladora según los requerimientos de glucosa24.
Disbiosis y sobrecrecimiento bacterianoOtra de las manifestaciones asociadas a la neuropatía gastrointestinal diabética es el enlentecimiento del tránsito intestinal, propiciando el sobrecrecimiento bacteriano intestinal que favorece la malabsorción intestinal y la diarrea crónica15. Además de la neuropatía, existen otros factores que se han asociado al sobrecrecimiento bacteriano en el paciente con diabetes, entre ellos, la reducción de la función exocrina pancreática, así como el uso crónico de fármacos como los opioides29,30.
Uso de edulcorantes artificialesA pesar de que el uso de edulcorantes artificiales como una alternativa al azúcar apareció como una estrategia adecuada para el control glucémico y la reducción de la ingesta calórica, en años recientes su uso se ha vinculado a efectos metabólicos no deseados, entre ellos los gastrointestinales31. De estos, las alteraciones en la motilidad intestinal y los cambios en la microbiota intestinal han sido reportados en mayor medida a través de modelos experimentales; sin embargo, los resultados en ensayos clínicos no han logrado ser concluyentes32.
Disfunción psicológicaTrastornos psicológicos como la ansiedad y la depresión han sido reportados con una alta prevalencia en pacientes con diabetes17. A su vez, estas mismas comorbilidades psicológicas se asocian fuertemente con síntomas gastrointestinales, incrementando su aparición y percepción33. De manera directa, se han descrito niveles elevados de ansiedad, depresión y neurosis en pacientes con diabetes, y su relación con síntomas gastrointestinales ha sido previamente informada, implicando un factor adicional no orgánico de disfunción gastrointestinal asociado a diabetes34,35.
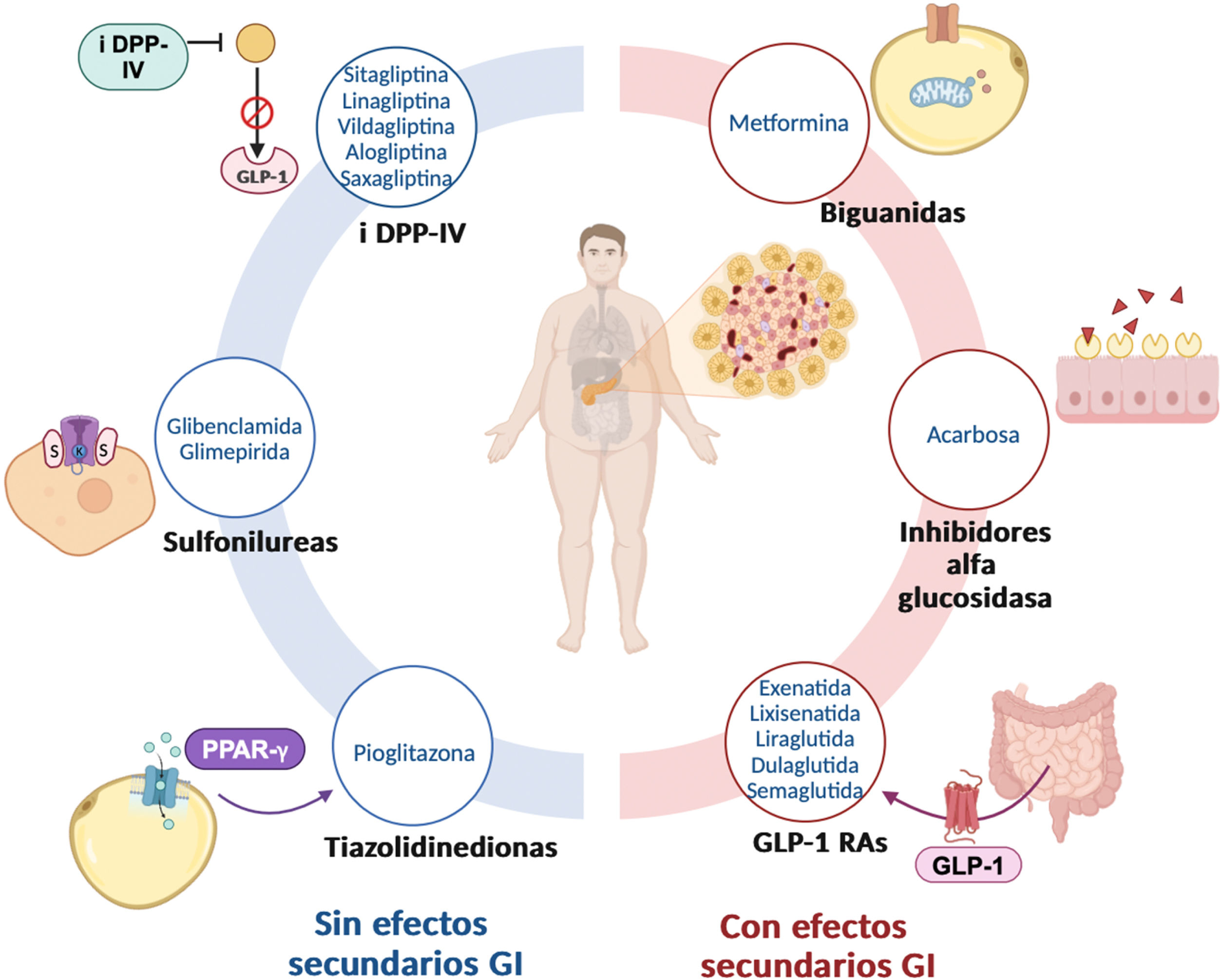
Generalidades farmacológicas de los antidiabéticosEs importante recordar la clasificación farmacológica de los antidiabéticos y reconocer que algunos tienen efectos gastrointestinales, como las biguanidas, los inhibidores alfa glucosidasa y los análogos GLP-1 (fig. 1).
MetforminaLa metformina es una biguanida con mecanismo de acción complejo con múltiples efectos biológicos; sin embargo, el principal mecanismo de acción descrito es mediante el complejo enzimático AMPK (por sus siglas en inglés: Adenosine monophosphate-activated protein kinase). El complejo AMPK regula la actividad de múltiples factores de transcripción implicados en el metabolismo de los lípidos, inflamación, autofagia y gluconeogénesis36. A nivel hepático disminuye la gluconeogénesis por la inhibición del complejo1 mitocondrial, generando un aumento del potencial reducción celular (NADH: NAD), así como en el complejoIV mitocondrial por la inhibición dependiente de la glicerol-3-fosfato deshidrogenasa (mGPHD)37. En el tejido graso pardo esta biguanida disminuye el estado proinflamatorio condicionado por los macrófagos M1 a través del HIF-1 alfa (por sus siglas en inglés: 1 alpha Hypoxia Inducible Factor) restaurando la respuesta betaadrenérgica38. En el tubo digestivo induce una inhibición transitoria de la absorción de la glucosa y la abundancia del transportador sodio-glucosa1 (SGLT1) en la membrana apical de los enterocitos de yeyuno37.
AcarbosaLa acarbosa es un inhibidor de la alfa-glucosidasa, un grupo de medicamentos que forman parte de los antidiabéticos orales que actúan mediante la inhibición competitiva y reversible de la alfa-glucosidasa intestinal39. La alfa-glucosidasa es una enzima intestinal que favorece la absorción de glucosa mediante la degradación enzimática de polisacáridos y disacáridos en dicho monosacárido. A pesar de ser un fármaco con pocos efectos adversos sistémicos, los síntomas gastrointestinales desencadenados se han considerado un problema recurrente con este grupo de medicamentos6,7.
Inhibidores de la dipeptidil peptidasa 4Las incretinas son péptidos intestinales que se secretan posterior al consumo de alimentos y que, en conjunto con la hiperglucemia, estimulan la liberación de insulina y juegan un papel fundamental en la homeostasis de la glucosa. Estos péptidos, dentro de los cuales se incluyen el péptido insulinotrópico dependiente de glucosa (GIP) y GLP1, son los responsables del efecto incretina, que explica por qué el estímulo para la liberación de insulina es más potente al recibir una carga de glucosa por vía oral que por vía intravenosa40,41.
La dipeptidil peptidasa 4 (DPP-4) es la proteína que escinde e inactiva a GLP-1 y GIP en pocos minutos40, por lo cual, los medicamentos que inhiben a esta aminopeptidasa incrementan los niveles circulantes de las incretinas, permitiendo que persista la estimulación de la secreción de insulina dependiente de glucosa en los islotes pancreáticos, a través de receptores membranales en las células β41.
Dentro del grupo de los inhibidores de la DPP-4 (iDDP-4) se encuentran la sitagliptina, la linagliptina, la saxagliptina, la vildagliptina y la alogliptina, entre otros.
A diferencia que otros medicamentos utilizados en el manejo de diabetes, y al igual que los inhibidores SGLT2 (iSGLT2), es poca la evidencia sobre asociación de este grupo farmacológico con sintomatología gastrointestinal42.
Inhibidores del cotransportador sodio-glucosa tipo 2Los cotransportadores de sodio-glucosa (SGLT) 1 y 2 son miembros de la familia de genes SLC5, una subdivisión de una superfamilia de cotransportadores de sodio. El tipo1 es expresado en la membrana del borde en cepillo de los enterocitos del intestino delgado y, en menor medida, en la corteza renal, específicamente en el segmento S3 de la membrana luminal. Por otro lado, los SGLT2 están confinados únicamente a la membrana luminal de los segmentos S1 y S2 del túbulo proximal renal. Los primeros cuatro medicamentos iSGLT2 en ser aprobados fueron la dapagliflozina, la canagliflozina, la empagliflozina y la sotagliflozina. Existe evidencia sobre cambios en la microbiota intestinal en pacientes que se encuentra bajo tratamiento con iSGLT2, pero no existe evidencia que respalde una asociación con efectos adversos gastrointestinales5,43,44.
Análogos del receptor GLP-1Los análogos del receptor el péptido similar al glucagón1 (GLP-1) es un grupo de medicamentos útil en el tratamiento de diabetes, existiendo en disposición de presentación oral y aplicación subcutánea. El mecanismo de acción de estos fármacos es debido a múltiples efectos, como su efecto incretina con aumento de la secreción de insulina por las células beta, mejoría en la sensibilidad de la insulina, disminución de la secreción de glucagón y reducción en la ingesta de alimentos por inducción de saciedad11,45. El efecto de este grupo farmacológico en la pérdida de peso ha generado un impacto global con el mal uso de dicho fármaco por automedicación y, a su vez, aumento de los casos de pacientes con efectos adversos12,46-48.
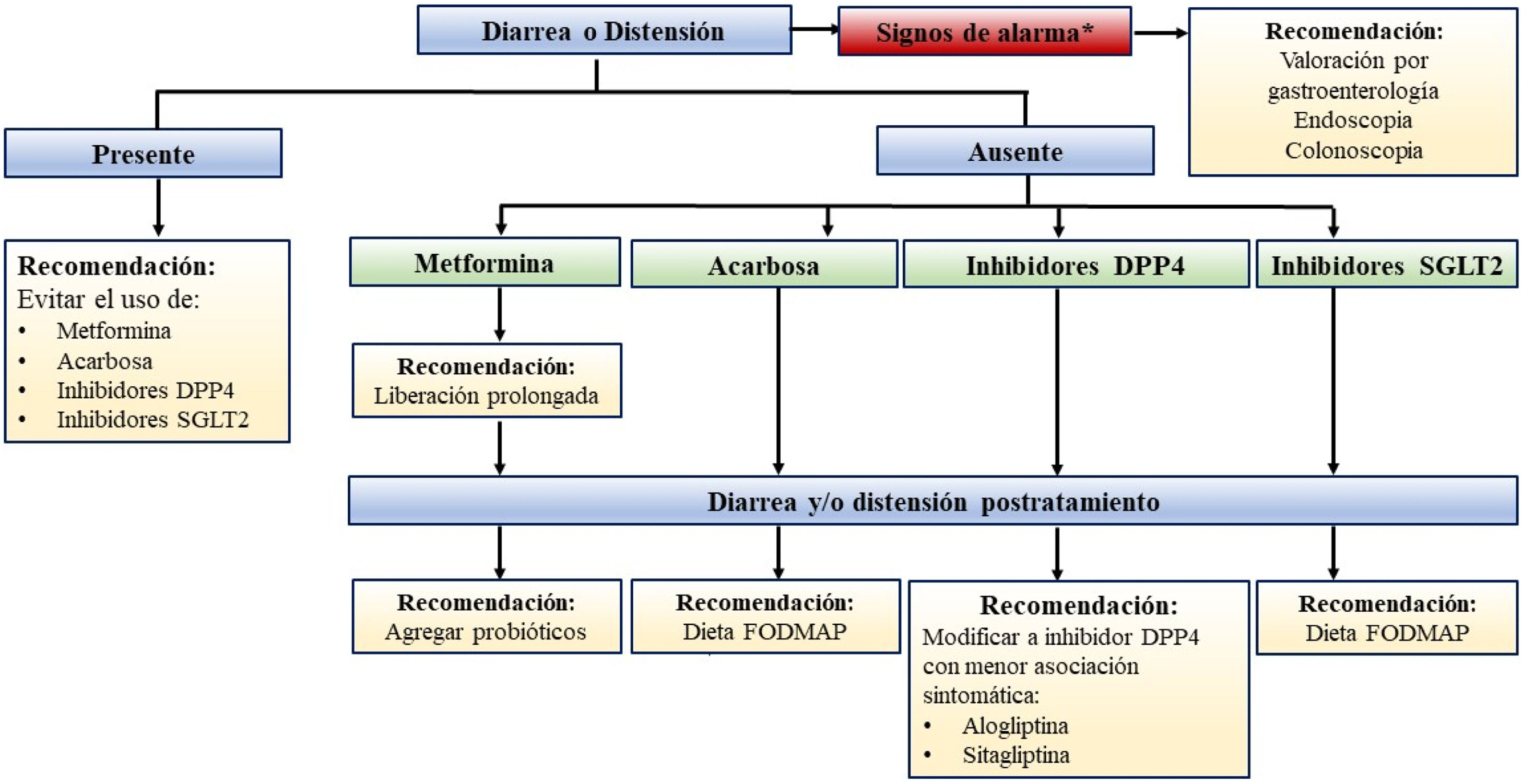
Abordaje de síntomas gastrointestinales en pacientes candidatos y con tratamiento de antidiabéticosAnte la valoración de pacientes con síntomas gastrointestinales que van a iniciar manejo médico para diabetes es importante interrogar si existen síntomas o diagnóstico de dispepsia funcional, gastroparesia, sobrecrecimiento bacteriano intestinal, síndrome de intestino irritable, distensión abdominal o estreñimiento crónico, ya que gran parte de las opciones terapéuticas pueden desencadenar o exacerbar sintomatología como saciedad temprana, plenitud posprandial, náusea, vómito, distensión abdominal, diarrea y estreñimiento49-51.
En el caso de pacientes que acuden a valoración médica por sintomatología que comenzó posterior al inicio de manejo farmacológico debe iniciarse el abordaje inicial de la sintomatología y no asociarla al fármaco como primera posibilidad, buscando de manera dirigida signos de alarma que ameriten la realización de endoscopia o colonoscopia49.
Es importante considerar el grupo farmacológico que se está utilizando, ya que dentro de los diferentes grupos existen distintos fármacos, algunos asociados con mayor sintomatología que otros, motivo por lo que puede modificarse la molécula utilizada antes de la suspensión de dicho grupo farmacológico5,42. De igual manera se deben valorar la dosis inicial y la titulación adecuada del fármaco, ya que en algunos casos la titulación adecuada del fármaco puede disminuir o evitar los efectos adversos gastrointestinales, como es el caso de los agonistas de GLP-152.
Debe valorarse la temporalidad de aparición sintomática, ya que en algunos casos la sintomatología tiende a presentarse en los primeros días de aplicación, beneficiándose en estos casos la aplicación de esquemas profilácticos durante periodos cortos de tiempo48.
Las medidas terapéuticas son individualizadas, dependiendo de las comorbilidades gastrointestinales, de la dieta actual, del síntoma predominante y del grupo farmacológico utilizado (figs. 2 y 3).
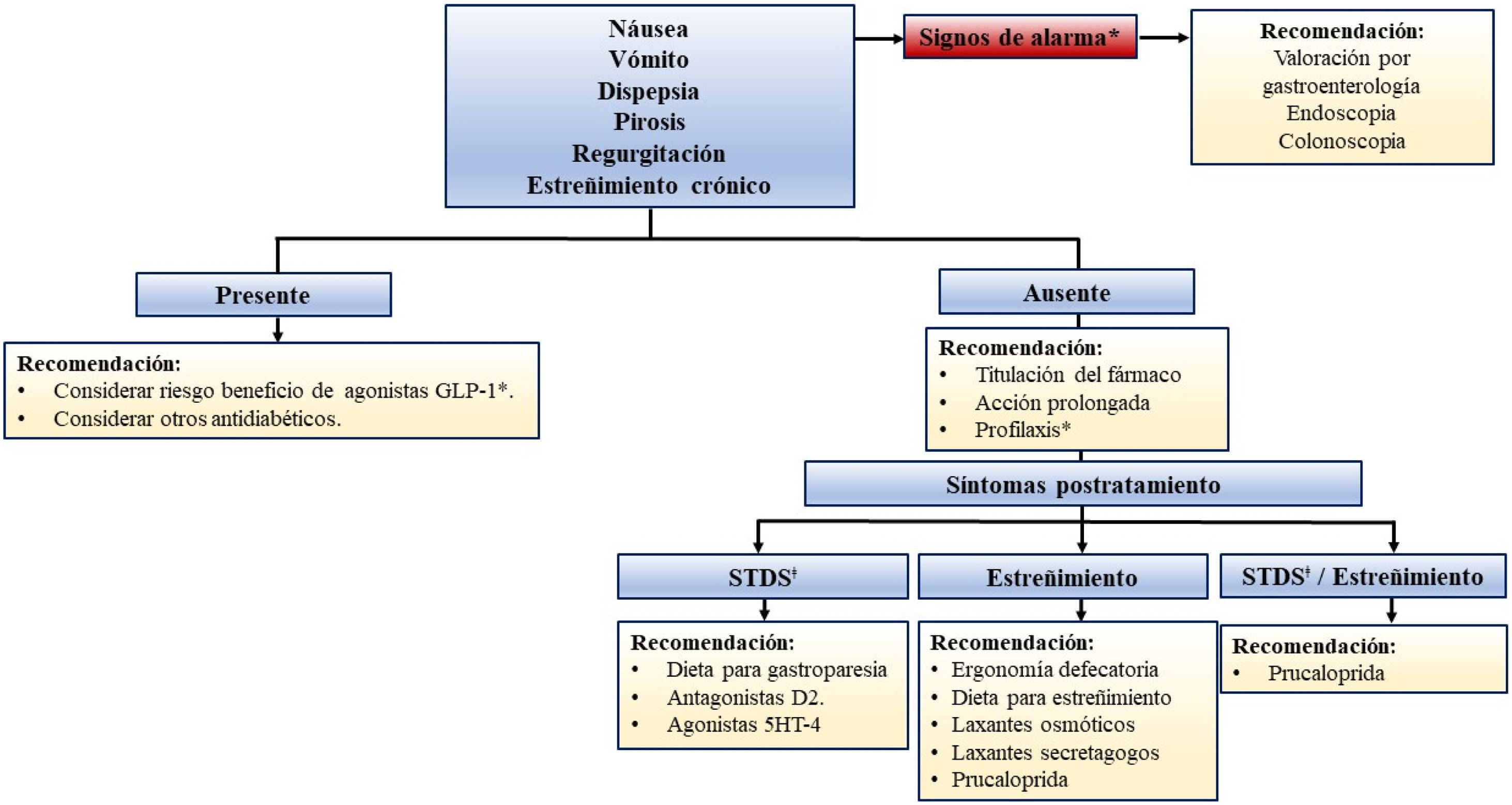
Abordaje de sintomatología gastrointestinal en pacientes candidatos o en tratamiento con agonistas GLP-1.
STDS: síntomas de tubo digestivo superior.
*Antecedente heredofamiliar de cáncer de colon o estómago, >50años, anemia ferropénica, síntomas nocturnos, pérdida de peso, hemorragia de tubo digestivo, vómito persistente, masa epigástrica palpable o disfagia.
¿ Náusea, vómito, dispepsia, pirosis, regurgitación.
La causa de los efectos adversos relacionados con los fármacos utilizados en el manejo de diabetes es multifactorial, influyendo una predisposición genética, el control glucémico, el diagnóstico de gastroparesia diabética, la dosis y la farmacocinética del fármaco utilizado.
MetforminaDebido a que la metformina de liberación prolongada en comparación con la de liberación inmediata se asocia a una menor incidencia de efectos adversos gastrointestinales como náusea, vómito, dispepsia y diarrea, optar por dicha presentación farmacológica es el primer paso en la prevención de los efectos adversos relacionados con este medicamento9,10.
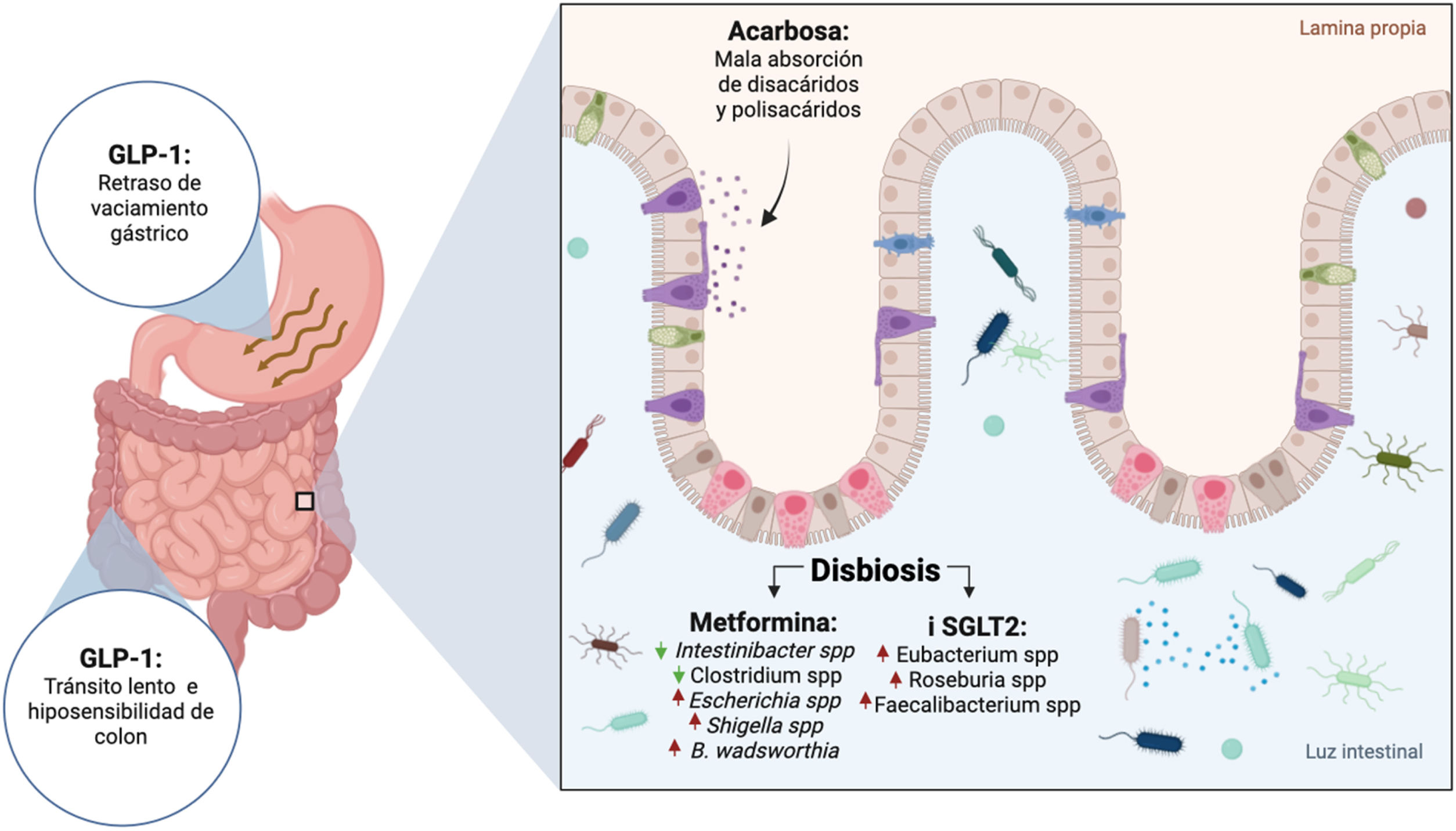
Se desconoce cuál es el mecanismo de acción mediante el cual la metformina desencadena efectos adversos gastrointestinales, pero existe evidencia creciente que apoya que dicho mecanismo fisiopatológico es secundario a disbiosis tras la evidencia de disminución de Intestinibacter spp. y Clostridium spp., así como un aumento en Escherichia/Shigella spp. y Bilophila wadsworthia53-56. Por lo mencionado previamente, se ha propuesto que el manejo conjunto de metformina con prebióticos y probióticos puede reducir el riesgo de efectos adversos gastrointestinales, demostrándose en un ensayo controlado aleatorizado realizado por Dixon et al.57 que la administración dual de prebióticos con metformina genera cambios favorables en el microbiota sin reducir los efectos adversos gastrointestinales.
Respecto al uso de probióticos, en un ensayo controlado aleatorizado realizado por Şahin et al.58 se demostró que los pacientes con uso concomitante de metformina y Bifidobacterium animalis subsp. lactis (BB-12) se asociaron a menor alteraciones del gusto, dolor abdominal, diarrea y distensión abdominal subjetiva en comparación con aquellos que recibieron monoterapia con metformina. De igual manera, en un metaanálisis realizado por Memon et al.59, en el cual se incluyeron 17 ensayos clínicos y un total de 1009 pacientes, se demostró que el uso concomitante de metformina con probióticos se asocia a menos efectos adversos gastrointestinales (OR=0.18, IC95%=0.09-0.38).
AcarbosaA pesar de que se ha demostrado que la acarbosa genera cambios en la composición de la microbiota, la disbiosis y el sobrecrecimiento bacteriano intestinal no son los mecanismos fisiopatológicos en la distensión abdominal y diarrea asociada a la administración de dicho fármaco6,7,60-64. La alteración de la microbiota asociada a acarbosa es un aumento en la densidad en el género Lactobacillus y Bifidobacterium, composición de microbiota que es protectora para sintomatología gastrointestinal64,65. A pesar de la modificación protectora en la microbiota, la acarbosa se asocia a efectos adversos gastrointestinales por generar una mala absorción de disacáridos, oligosacáridos y polisacáridos. A pesar de no existir evidencia sobre dieta baja en FODMAP (Fermentable Oligo-Di-Monosaccharide and Polyol) o selectiva en alguno de sus componentes, sí existe evidencia con respaldo teórico sobre utilizar dicha intervención como una medida terapéutica para tratar o evitar dolor abdominal, distensión y diarrea en este grupo de pacientes66-70.
Inhibidores DPP4A diferencia de otros fármacos utilizados en el manejo para diabetes, los iDPP4 no se asocian con efectos adversos gastrointestinales o tienen una asociación mínima. Los efectos adversos gastrointestinales se atribuyen al aumento en la actividad de GLP-1 que estos medicamentos generan, y no existen medidas terapéuticas para mejorar dicha sintomatología42,71-73. Por lo mencionado previamente, la mejor medida a considerar en este grupo de pacientes es utilizar el fármaco con menor asociación a efectos adversos gastrointestinales. En orden de frecuencia, los iDPP4 con menor asociación sintomática son vildagliptina, alogliptina, sitagliptina, saxagliptina, linagliptina y teneligliptina42.
Inhibidores SGLT2Al igual que los iDPP4, este grupo farmacológico no se ha asociado o tiene una asociación mínima con efectos adversos gastrointestinales; sin embargo, se ha demostrado que sí induce un cambio conformacional de la microbiota intestinal5,43,44,74. Dichos cambios en la microbiota intestinal son el aumento en bacterias productoras de ácidos grasos de cadena corta como Eubacterium, Roseburia y Faecalibacterium, lo que a su vez se asocia a distensión abdominal, diarrea o estreñimiento por modificaciones en el tránsito intestinal43,75,76. Existe poca evidencia para poder implementar medidas terapéuticas o profilácticas en el manejo de sintomatología gastrointestinal asociada a iSGLT2, pero existen fundamentos teóricos que la dieta baja en FODMAP podría ser de utilidad en estos pacientes75-77.
Análogos de GLP-1El primer paso para evitar efectos adversos relacionados a antagonistas GLP-1 es no utilizarlos en pacientes con sospecha de gastroparesia, dispepsia funcional de tipo síndrome de distrés posprandial o estreñimiento crónico para evitar la exacerbación de dichos trastornos46,78.
Una de las primeras consideraciones en el abordaje terapéutico de la náusea y vómito relacionado a agonistas GLP-1 es valorar el control glucémico del paciente, ya que las cifras de glucosa con niveles >288mg/dl se asocian a retraso del vaciamiento gástrico, por lo que los pacientes pueden presentar plenitud posprandial, náusea o vómito por descontrol glucémico y no por efecto adverso del medicamento79-82.
Debido a que uno de los mecanismos fisiopatológicos de dichos efectos adversos es el retraso del vaciamiento gástrico, es importante reforzar las medidas higiénico-posturales y farmacológicas para enfermedad por reflujo gastroesofágico, ya que dicha sintomatología se puede exacerbar durante el tratamiento con agonistas GLP-146,83.
Entre las medidas terapéuticas para mejorar la sintomatología secundaria a retraso del vaciamiento gástrico figuran las medidas dietéticas recomendadas en gastroparesia, como son la dieta de partículas pequeñas, fraccionada y con un contenido de <40g de grasa y 10-12g de fibra por día84-86.
Otras de las recomendaciones es valorar la posología prescrita, ya que los efectos adversos son dosis-dependientes y se pueden presentar con mayor frecuencia en aquellos pacientes en los que no se realiza una titulación progresiva del medicamento52. También es importante considerar el tipo de agonista de GLP-1 que se va a utilizar o se está utilizando, ya que los agonistas de GLP-1 de acción corta se asocian con mayor náusea y vómito que los de acción prolongada, por lo que ante la poca tolerancia a un agonista de GLP-1 de acción corta por náusea y vómito se podría modificar a uno de acción prolongada y valorar la tolerancia previo a la suspensión de dicho grupo farmacológico87-89.
Existe evidencia de manejo farmacológico profiláctico de náusea y vómito relacionado con el uso de GLP-1, y Ellero et al.90 reportan que la administración de antieméticos previo a la aplicación subcutánea de exenatida se asociaba a menor náusea y vómito (16.7% y 6.7% vs. 61.7% y 38.3%, p≤0.001). Los antieméticos estudiados fueron metoclopramida 10mg y ondansetrón 8mg, administrados como dosis única 30minutos previo de la aplicación del agonista GLP-146,83,.
Respecto al manejo farmacológico de la náusea, vómito, saciedad temprana y plenitud posprandial inducido por agonistas GLP-1 podría brindarse manejo dirigido a gastroparesia farmacológica o exacerbación de dispepsia funcional, para lo que se recomienda el uso de antagonistas del receptor dopaminérgico D2 y antagonistas 5HT4. Dentro de los medicamentos mencionados destaca la metoclopramida, con efecto antagonista en receptores dopaminérgicos D2 y serotoninérgico 5-HT3, así como efecto agonista 5-HT4. La dosis recomendada de metoclopramida es de 10mg por vía oral cada 8horas con posología prepandial. De los fármacos antagonistas dopaminérgicos D2 selectivos destaca la domperidona de acción rápida a dosis de 10mg cada 8horas con administración preprandial y domperidona de liberación prolongada a dosis de 60mg por vía oral cada 24horas46,51,79,83,91-93.
El estreñimiento asociado al uso de agonistas GLP-1 tiene un mecanismo fisiopatológico secundario a la disminución del tránsito intestinal, hiposensibilidad colónica y probable aumento de la absorción intestinal de agua, y las recomendaciones para el manejo de esta variedad de estreñimiento secundario son las mismas que para el estreñimiento crónico de tipo tránsito lento o trastorno de hiposensibilidad rectal13,94,95. Se recomienda el uso de las medidas generales, como el uso de dispositivos de apoyo postural defecatorio, tener una adecuada rutina evacuatoria obedeciendo el deseo defecatorio y no utilizar el inodoro por tiempos prolongados, ingesta de >1.5l de agua al día, fibra hidrosoluble 25-30g por día o 14g por 1000kcal, incluir en el desayuno >500kcal94,96. Respecto al manejo farmacológico, se recomienda utilizar laxantes osmóticos como primera línea de manejo, siendo el fármaco de elección el polietilenglicol a dosis de 17g día con titulación. Como segunda línea se recomienda el uso de laxantes de tipo secretagogo, como son el caso de lubiprostona a dosis de 24μg por vía oral cada 12horas o linaclotide a dosis de 145μg por vía oral cada 24horas, prefiriéndose este último por la asociación de lubiprostona, con náusea como efecto adverso. Otra opción farmacológica de segunda línea es el uso de prucaloprida, un agonista serotoninérgico 5-HT4 con dosis establecida de 2mg por vía oral cada 24horas94,97.
La prucaloprida es una buena opción en pacientes con efectos adversos relacionados con agonistas GLP-1, ya que aumenta el vaciamiento gástrico, incrementando la sensibilidad rectal y el tránsito intestinal. Carbone et al.98 demostraron en un ensayo controlado aleatorizado en pacientes con gastroparesia que prucaloprida a dosis de 2mg cada 24horas por 4 semanas mejoró el Gastroparesis Cardinal Symptom Index (1.65±0.19 vs 2.28±0.20, p≤0.0001) y también aumentó el tiempo medio de vaciamiento gástrico con prueba en aliento con ácido octanoico marcado con 13C (98±10 vs 143±11 1 y 26±13 minutos, p=0.005 y <0.001). Los síntomas que demostraron mejoría fueron la náusea, la saciedad temprana y la plenitud posprandial. Respecto a la evidencia del beneficio de prucaloprida en estreñimiento con tránsito lento están los resultados descritos por Emmanuel et al.99 en un ensayo controlado aleatorizado en el que se encontró que dosis de prucaloprida a dosis de 1mg cada 24horas aumentaban la frecuencia de evacuaciones espontáneas (p≤0.001) y el tránsito intestinal (p=0.004), así como también se demostró un aumento en la sensibilidad rectal a la distensión (p=0.01).
ConclusionesLa diabetes es una enfermedad crónico-degenerativa con alta prevalencia global la cual condiciona una alta morbimortalidad con altos costos. Gran parte de la morbilidad y los altos costos en este grupo poblacional son los efectos adversos relacionados con el uso de antidiabéticos. Los afectos adversos gastrointestinales relacionados con antidiabéticos son frecuentes, siendo la metformina, la acarbosa y los agonistas de GLP-1 los fármacos con una asociación bien establecida. La sintomatología depende de la patología comórbida de base y del grupo de fármaco utilizado, siendo los efectos adversos más frecuentes dispepsia con síntomas de tipo síndrome de distrés posprandial, náusea, vómito, distensión, diarrea y estreñimiento.
Es importante conocer y comprender el mecanismo fisiopatológico de dichos efectos adversos, ya que se pueden tomar decisiones en el abordaje diagnóstico-terapéutico de manera dirigida e individualizada (fig. 4).
Existen medidas preventivas para evitar la aparición de síntomas gastrointestinales como la elección del medicamento según los síntomas basales del paciente, así como medidas farmacológicas profilácticas (figs. 2 y 3). También existen medidas terapéuticas específicas según la patología desencadenada, como es el ejemplo de procinéticos en pacientes con gastroparesia inducida por agonistas GLP-1.
A pesar de lo mencionado, es importante identificar signos de alarma que ameriten valoración por expertos en gastroenterología y la intervención de estudio endoscópico, sin atribuir en la totalidad de los casos la sintomatología al uso de antidiabéticos.
FinanciaciónLos autores declaran que no se recibió ningún tipo de financiamiento para este estudio.
Conflicto de interesesBarrientos Ávalos ha sido ponente para laboratorios Eli Lilly y para Silanes. El resto de los autores manifiestan que no hay ningún conflicto de intereses.