La dieta libre de gluten (DLG) es indispensable para los pacientes con enfermedad celíaca (EC). Sin embargo, también se ha descrito que esta dieta aumenta el riesgo de síndrome metabólico (SM). La evidencia respecto a los efectos metabólicos de una DLG en pacientes con sensibilidad al gluten no celíaca (SGNC) y en sujetos asintomáticos se desconoce. El objetivo de este estudio fue evaluar los efectos metabólicos de una DLG durante 6 meses en pacientes con EC, SGNC y controles asintomáticos.
Material y métodosSe realizó un estudio prospectivo en donde de forma basal y a los 6 meses se evaluaron los componentes del SM como obesidad, esteatosis hepática, hiperglucemia e hipertensión arterial.
ResultadosSe incluyeron un total de 66 sujetos (22 EC, 22 SGNC y 22 controles asintomáticos). De forma basal el 10% de los pacientes con EC tuvo obesidad, SM, hipertensión y esteatosis hepática. Después de 6 meses el 20% de los pacientes desarrolló SM y obesidad (p=0.125). En los pacientes con SGNC la obesidad después de la DLG aumentó en un 5%, mientras que el 20% tuvo esteatosis hepática de novo. En el caso de los controles la DLG disminuyó la prevalencia de obesidad en un 10% (30% vs. 20%, p=0.5) sin afectar los otros componentes del SM.
ConclusionesLos beneficios y riesgos metabólicos de una DLG deben considerarse cuando se prescriben este tipo de dietas en las diferentes poblaciones que optan por este tipo de intervención.
It is essential for patients with celiac disease (CD) to be on a gluten-free diet (GFD) but said diet has also been reported to increase the risk for metabolic syndrome. There is no evidence on the metabolic effects of a GFD in patients with nonceliac gluten sensitivity (NCGS) or in asymptomatic subjects. Therefore, the aim of the present study was to evaluate the metabolic effects of a GFD over a 6-month period in patients with CD, patients with NCGS, and in asymptomatic controls (ACs).
Materials and methodsA prospective study was conducted that evaluated metabolic syndrome and its components of obesity, high blood pressure, hepatic steatosis, and hyperglycemia at the baseline and at 6 months.
ResultsA total of 66 subjects (22 CD, 22 NCGS, and 22 AC) were included in the study. At the baseline, 10% of the patients with CD presented with obesity, high blood pressure, hepatic steatosis, and metabolic syndrome. After 6 months, obesity and metabolic syndrome increased by 20% (p=0.125). In the patients with NCGS, obesity increased by 5% after the GFD and 20% of those patients presented with de novo hepatic steatosis. The prevalence of obesity decreased by 10% in the controls after the GFD (30 vs 20%, p=0.5) and none of the other components of metabolic syndrome were affected.
ConclusionsThe metabolic benefits and risks of a GFD should be considered when prescribing said diet in the different populations that opt for that type of intervention.
Las dietas libres de gluten (DLG) han adquirido mucha popularidad en los últimos años, y cada vez más sujetos adoptan este tipo de dieta, aun sin requerirla1. Esto se debe a múltiples factores que incluyen la mayor disponibilidad de alimentos sin gluten, la promoción realizada por las empresas productoras de estos alimentos, el efecto mediático de la prensa y el hecho de que algunas celebridades han adoptado este tipo de dieta por considerarse «más sana» o por pensar que puede ayudar a perder peso2. Lo que es un hecho es que entre 2004 y 2011 la venta de los productos libres de gluten creció anualmente cerca de un 28%, y para 2012 las ventas de estos productos fueron cercanas a los 2.6 billones de dólares3. Curiosamente las ventas se han incrementado en los sujetos que creen que tienen síntomas asociados a la ingesta de gluten (sensibilidad al gluten/trigo no celíaco [SGNC]) pero sin ser necesariamente pacientes con enfermedad celíaca (EC).
No cabe duda de que la DLG es indispensable para el tratamiento de los pacientes que sufren EC o alergia al gluten, ya que se ha demostrado que mejora los síntomas y manifestaciones extraintestinales, corrige y evita deficiencias nutricionales (como anemia por deficiencia de hierro y osteoporosis), además de evitar el desarrollo de neoplasias gastrointestinales, en especial los linfomas4–7. Además, evidencia reciente demuestra que los pacientes con EC después de dejar el gluten aumentan de peso y de índice de masa corporal (IMC)8,9. Sin embargo, también se ha reportado que el uso continuo de este tipo de dieta aumenta el riesgo de síndrome metabólico (SM) y enfermedades cardiovasculares10–13. Al parecer una DLG no supervisada por un experto en nutrición y basada únicamente en productos libres de gluten pueden contener una mayor cantidad de hidratos de carbono y grasas, lo cual aporta más calorías en comparación con sus versiones con gluten14,15. Además, este tipo de dietas podrían ser deficientes en algunas vitaminas y micronutrientes como ácido fólico, magnesio, cinc y vitamina B1216,17. Por otra parte, se ha descrito que el adoptar una DLG puede tener repercusiones en la microbiota intestinal. Se ha informado de que en sujetos con EC que siguen una DLG existe una disminución significativa en la diversidad de la microbiota en cuanto al género de Lactobacillus y Bifidobacterium18, mientras que existe un predominio de Actinobacteria, Bacteroidetes y Firmicutes19. Un estudio de De Palma20 et al., realizado en adultos sanos, describió la presencia de cambios en la microbiota intestinal posterior a una DLG, específicamente los autores encontraron una disminución significativa del género Bifidobacterium y las especies C. lituseburense y F. prausnitzii y aumento de los géneros E. coli y Enterobacteriaceae.
Así pues, la adopción de una DLG fuera del contexto de la EC puede tener repercusiones negativas para la salud. Sin embargo, la evidencia respecto a los efectos metabólicos de una DLG en pacientes con SGNC y en sujetos sanos, cuya finalidad es mantener un estilo de vida «más saludable», se desconoce.
El objetivo de este estudio fue evaluar los efectos metabólicos (peso, glucemia, perfil de lípidos, hipertensión y esteatosis hepática) de una DLG durante 6 meses en pacientes con EC, SGNC y un grupo de controles asintomáticos (CA).
Material y métodosPacientesSe realizó un estudio prospectivo y observacional donde se reclutó de forma consecutiva a sujetos que acudieron para su evaluación por tener síntomas sugestivos de EC o SGNC al departamento de gastroenterología de nuestra institución. Se excluyeron pacientes que ya tuvieran diagnóstico conocido de EC o SGNC y que estuvieran ya llevando una DLG. A todos los sujetos se les realizó en este momento la misma evaluación basal (ver más adelante). El diagnóstico de EC se estableció cuando los pacientes tuvieron positividad para anticuerpos IgA contra la transglutaminasa tisular 2 (IgA-tTG2, Testline Clinical Diagnostics, República Checa) y/o anticuerpos IgG contra el péptido desaminado de gliadina (IgG-DGP, Testline Clinical Diagnostics), presencia de haplotipos HLA-DQ2 y/o DQ8 positivos y atrofia de vellosidades intestinales en biopsias duodenales de acuerdo a la clasificación de Marsh-Oberhüber, en la evaluación inicial21.
Se sospechó de la presencia de SGNC si los sujetos tuvieron serologías y biopsias negativas en su evaluación inicial, pero reportaban síntomas relacionados con la ingestión de gluten. Estos sujetos fueron evaluados por un gastroenterólogo y una nutrióloga, quienes analizaron los síntomas gastrointestinales y/o extraintestinales (distensión abdominal subjetiva, flatulencia, alteración de los hábitos intestinales, cansancio, dolor de cabeza y dolor muscular) y su relación con la ingesta de gluten utilizando el cuestionario GSRS22. El cuestionario GSRS se ha utilizado previamente para evaluar la presencia de síntomas digestivos y manifestaciones extraintestinales en pacientes con SGNC, y su empleo es recomendado por el consenso de Salerno23. A todos los sujetos se les prescribió una DLG por una nutrióloga y se evalúo el apego y la adherencia a través de un registro de alimentos y supervisión semanal, durante al menos 6 semanas. Se consideró el diagnóstico de SGNC si los pacientes tuvieron una reducción>30% en al menos 3 de los síntomas evaluados en el GSRS durante al menos el 50% del tiempo de observación (al menos en 3 de 6 evaluaciones semanales). Para confirmar el diagnóstico de SGNC todos los sujetos estuvieron bajo un desafío de gluten durante 2 semanas (prescrito por la nutrióloga que recomendó al paciente comer al menos 8g de gluten por día) y finalmente se corroboró SGNC si los pacientes reportaron la reaparición de los síntomas evaluados previamente. Para fines de este estudio los pacientes regresaron a una DLG posterior a la fase de reto con gluten del estudio.
Además, se invitó a participar a un grupo de sujetos (controles sin síntomas digestivos [CA]) que consideraron iniciar una DLG de forma voluntaria por los efectos beneficiosos atribuidos a este tipo de dieta. Si bien eran asintomáticos desde el punto de vista digestivo, estos sujetos podían tener obesidad. Los CA fueron sometidos a las mismas evaluaciones basales que los pacientes con EC y SGNC.
ProtocoloEvaluación basalDe forma basal a todos los sujetos se les realizó una evaluación clínica y exploración física con la finalidad de evaluar la existencia de síntomas gastrointestinales y datos de organicidad. Como se mencionó anteriormente, a todos los pacientes se les realizó serología para EC y biopsias duodenales para evaluar atrofia intestinal. Además, a todos los sujetos se les realizó las siguientes evaluaciones metabólicas en ayuno: medición de circunferencia de la cintura abdominal (cm) (de acuerdo al protocolo de la OMS)24, IMC (kg/m2) y presión arterial (mmHg), así como determinación de glucemia (mg/dl), colesterol total (mg/dl), HDL (mg/dl), triglicéridos (mg/dl), aspartato aminotransferasa (AST, UI/ml) y alanina aminotransferasa (ALT, UI/ml).
El diagnóstico de SM se hizo de acuerdo con los criterios de la Asociación Latinoamericana de Diabetes (ALAD)25, la cual define como obesidad abdominal la presencia de un incremento de la circunferencia abdominal (≥94cm en hombres y ≥88cm en mujeres), más 2 de los 4 siguientes criterios: a) elevación de triglicéridos>150mg/dl; b) colesterol HDL<40mg/dl en hombres y<50mg/dl en mujeres; c) presión arterial sistólica (PAS)>130mmHg y/o presión arterial diastólica (PAD)>85mmHg; y d) glucemia anormal en ayuno (glucosa en ayuno>100mg/dl), intolerancia a la glucosa o diabetes. Además se clasificó a los pacientes de acuerdo a los criterios de la OMS en: a) normal (IMC 18.5-24.9kg/m2), sobrepeso (IMC entre 25-29.9kg/m2) y obesidad (IMC≥30kg/m2)26.
El diagnóstico de esteatosis hepática se realizó mediante ultrasonido de acuerdo a criterios previamente establecidos: 1) sin esteatosis; 2) leve (atenuación ligeramente menor a la del bazo); 3) moderada (atenuación pronunciada entre hígado y bazo sin observarse los vasos intrahepáticos); y 4) severa (disminución marcada de la atenuación hepática con un fuerte contraste entre el hígado y los vasos intrahepáticos)27. El procedimiento fue realizado por un mismo ultrasonografista experto.
IntervenciónTodos los sujetos recibieron recomendaciones para llevar una DLG prescrita por una nutrióloga (como se describe previamente) de forma basal y después se les citaba al mes y cada 3 meses durante 6 meses. La adherencia a la dieta se evaluó mediante un cuestionario que consideraba los alimentos consumidos por el paciente en la semana previa a la visita. En caso de duda o recaída sintomática se realizó determinación de los anticuerpos para EC en casos seleccionados.
Evaluación finalAl final de los 6 meses se repitieron todas las evaluaciones basales incluyendo la evaluación clínica, el perfil metabólico y el ultrasonido con el fin de evaluar el desarrollo de obesidad, SM y esteatosis hepática antes y después de la DLG.
Análisis estadísticoSe utilizó estadística descriptiva, y para la comparación entre grupos se utilizó la prueba de Chi cuadrado, la prueba U de Mann-Whitney, ANOVA o Kruskal-Wallis y la prueba de rango con signo de Wilcoxon, cuando estaba indicado. Se calculó también la razón de momios para cuantificar la diferencia estadística entre las variables dicotómicas. Todas las diferencias se consideraron significativas cuando p<0.05. El análisis se realizó con el software SPSS, versión 21.0 (SPSS Inc, Chicago IL, EE. UU.). El tamaño de la muestra se calculó en función del estudio de Tortora et al.10, en donde una DLG en pacientes con EC produce un aumento en la prevalencia de SM del 30% después de un año. Asumiendo este incremento en los 3 grupos el número con respecto a la basal se calculó una n=22 pacientes por grupo. Se obtuvo el consentimiento informado de todos los participantes y el trabajo fue aprobado por el comité de ética institucional. El trabajo recibió patrocinio a través del Fondo del CONACYT, FOSIS 2015-262023.
ResultadosSe incluyeron de forma inicial un total de 66 sujetos: 22 pacientes con EC, 22 pacientes con SGNC y 22 CA. El protocolo fue completado por 60 sujetos (pérdida del 9%); 20 sujetos en cada uno de los 3 grupos evaluados. Dos pacientes con EC se perdieron en el seguimiento por imposibilidad para asistir a sus visitas de seguimiento, mientras que 2 CA y 2 sujetos con SGNC decidieron abandonar el estudio por dificultad en el apego del protocolo.
Las características demográficas de los sujetos evaluados en cada grupo se muestran en la tabla 1. Como se observa, los pacientes con EC tuvieron mayor edad (p=0.028), menor IMC (p=0.001), menores niveles de hemoglobina (p=0.007), colesterol total (p=0.002), HDL (p=0.001), triglicéridos (p=0.04), así como mayores niveles de AST (p=0.020) comparados con los otros grupos. Hubo más hombres en el grupo control (p=0.001), y este fue el grupo con mayor prevalencia de SM de forma basal (30%, p no significativa). No hubo diferencias entre los 3 grupos respecto a la prevalencia de obesidad, EH, SM e hipertensión de forma basal.
Características demográficas y componentes del síndrome metabólico en los 3 grupos
| SGNC n=20 | Control n=20 | EC n=20 | p | |
|---|---|---|---|---|
| Género (F, %) | 90% | 50% | 100% | 0.0001* |
| Edad (años, promedio±DE) | 30±11 | 33.6±13 | 42.3±16 | 0.028** |
| IMC (kg/m2, promedio±DE) | 25.6±3 | 26.7±1.8 | 22.04±2.96 | 0.001** |
| Obesidad (%) | 40% | 30% | 10% | 0.09 |
| Hipertensión (sí, %) | 15% | 10% | 10% | 0.85 |
| Esteatosis hepática (sí, %) | 20% | 10% | 10% | 0.562 |
| Síndrome metabólico (sí, %) | 25% | 30% | 10% | 0.279 |
| Hemoglobina (mg/dl, promedio±DE) | 13.6±1.19 | 13.7±1.62 | 12.5±1.10 | 0.007** |
| Colesterol total (mg/dl, promedio±DE) | 193±50 | 224±76 | 158±34 | 0.002** |
| Colesterol HDL (mg/dl, promedio±DE) | 42.2±5.4 | 50.6±11 | 39.7±4.43 | 0.001** |
| Colesterol LDL (mg/dl, promedio±DE) | 113±17 | 117±29 | 99±28 | 0.09 |
| Triglicéridos (mg/dl, promedio±DE) | 140.7±62 | 172±72 | 93±42 | 0.04** |
| Glucosa (mg/dl, promedio±DE) | 85±10 | 86±8 | 84±5 | 0.12 |
| Alanino aminotransferasa (mg/dl, promedio±DE) | 24±16 | 27.3±13 | 22.7±10 | 0.58 |
| Aspartato aminotransferasa (mg/dl, promedio±DE) | 21.5±8 | 26.9±11 | 29.3±7 | 0.02** |
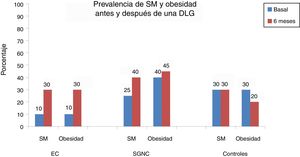
En la tabla 2 y en la figura 1 se observa la prevalencia de SM antes y después de la DLG en los 3 grupos. De forma basal el 10% de los pacientes con EC tuvo obesidad, SM, hipertensión y esteatosis. Después de 6 meses el 20% de los pacientes desarrolló SM y obesidad (p=0.125 [fig. 1]). El IMC se incrementó de forma significativa de 22.04±2.96kg/m2 a 24.5±1.98 después de la DLG (p=0.001). Al finalizar la DLG el 25% de los pacientes con EC tuvieron esteatosis hepática e hipertensión arterial (15%, p=0.125). En los 5 casos con esteatosis hepática esta fue leve. El único parámetro bioquímico alterado después de 6 meses de llevar a cabo una de DLG en los pacientes con EC fue la glucosa (p=0.001).
Componentes del síndrome metabólico antes y después de 6 meses de una dieta libre de gluten en pacientes con enfermedad celíaca
| EC n=20 | p | ||
|---|---|---|---|
| Basal | Final | ||
| Obesidad (%) | 10% | 30% | 0.125 |
| Hipertensión (sí, %) | 10% | 25% | 0.250 |
| Esteatosis hepática (sí,%) | 10% | 25% | 0.250 |
| Síndrome metabólico (sí,%) | 10% | 30% | 0.125 |
| Hemoglobina (mg/dl, promedio±DE) | 12.5±1.10 | 12.9±1.08 | 0.910 |
| Colesterol total (mg/dl, promedio±DE) | 158±34 | 154±34 | 0.434 |
| Colesterol HDL (mg/dl, promedio±DE) | 39.7±4.43 | 38.9±4.5 | 0.430 |
| Colesterol LDL (mg/dl, promedio±DE) | 99±28 | 97±41 | 0.719 |
| Triglicéridos (mg/dl, promedio±DE) | 93±42 | 107±47 | 0.165 |
| Glucosa (mg/dl, promedio±DE) | 84±5 | 92±4 | 0.001* |
| Alanino aminotransferasa (mg/dl, promedio±DE) | 22.7±10 | 24.1±12 | 0.236 |
| Aspartato aminotransferasa (mg/dl, promedio±DE) | 29.3±7 | 32±9 | 0.312 |
Por otra parte, en el caso de los sujetos con SGNC el aumento en la presencia de obesidad antes y después de la DLG fue del 5% (40% vs. 45%, p=1.0), mientras que en el caso del SM fue del 15% (25% vs. 40%, p=0.25). El promedio del IMC antes y después de los 6 meses de DLG fue similar (25.6±4kg/m2 a 25.9±2.34, p=0.87) (tabla 3). El incremento en la prevalencia de hipertensión fue del 10%, mientras que el de esteatosis hepática fue del 20% (20% vs. 40%, p=0.125). De los 8 pacientes con esteatosis hepática 6 tuvieron un grado leve y 2 un grado moderado. Se observó una tendencia, desde el punto de vista estadístico, respecto al incremento en los niveles de glucosa después de llevar a cabo la DLG (p=0.09).
Componentes del síndrome metabólico antes y después de 6 meses una dieta libre de gluten en pacientes con sensibilidad al gluten no celíaca
| SGNC n=20 | p | ||
|---|---|---|---|
| Basal | Final | ||
| Obesidad (%) | 40% | 45% | 1.0 |
| Hipertensión (sí, %) | 15% | 25% | 0.500 |
| Esteatosis hepática (sí,%) | 20% | 40% | 0.125 |
| Síndrome metabólico (sí, %) | 25% | 40% | 0.250 |
| Hemoglobina (mg/dl, promedio±DE) | 13.6±1.19 | 13.27±0.8 | 0.224 |
| Colesterol total (mg/dl, promedio±DE) | 193±50 | 199±49 | 0.226 |
| Colesterol HDL (mg/dl, promedio±DE) | 42.2±5.4 | 43.9±6 | 0.167 |
| Colesterol LDL (mg/dl, promedio±DE) | 113±17 | 116±24 | 0869 |
| Triglicéridos (mg/dl, promedio±DE) | 140.7±62 | 145±84 | 0.841 |
| Glucosa (mg/dl, promedio±DE) | 85±10 | 89±12 | 0.09 |
| Alanino aminotransferasa (mg/dl, promedio±DE) | 24±16 | 27.2±18 | 0.58 |
| Aspartato aminotransferasa (mg/dl, promedio±DE) | 21.5±8 | 23.3±12 | 0.454 |
Finalmente, en el grupo de sujetos control la DLG produjo una disminución en la prevalencia de obesidad en un 10% (30% vs. 20%, p=0.5) y el IMC se redujo significativamente de 26.7±1.8kg/m2 a 25.1±1.76 después de la misma (p=0.001) (tabla 4). Sin embargo, la prevalencia de SM se mantuvo estable a lo largo del estudio, y la prevalencia de hipertensión y esteatosis hepática aumentó en un 5%. En los 3 pacientes con esteatosis hepática el grado de esta fue leve y no se modificó con respecto a su estadio basal. No hubo una modificación significativa en los parámetros bioquímicos, salvo en los niveles del colesterol total (p=0.048).
Componentes del síndrome metabólico antes y después de 6 meses de una dieta libre de gluten en sujetos asintomáticos
| Control n=20 | p | ||
|---|---|---|---|
| Basal | Final | ||
| Obesidad (%) | 30% | 20% | 0.5 |
| Hipertensión (sí, %) | 10% | 15% | 0.125 |
| Esteatosis hepática (sí, %) | 10% | 15% | 1.00 |
| Síndrome metabólico (sí, %) | 30% | 30% | 1.00 |
| Hemoglobina (mg/dl, promedio±DE) | 13.7±1.62 | 13.2±1.9 | 0.319 |
| Colesterol total (mg/dl, promedio±DE) | 224±76 | 188±26 | 0.048* |
| Colesterol HDL (mg/dl, promedio±DE) | 50.6±11 | 51±7 | 0.836 |
| Colesterol LDL (mg/dl, promedio±DE) | 117±29 | 113±22 | 0.496 |
| Triglicéridos (mg/dl, promedio±DE) | 172±72 | 164±55 | 0.444 |
| Glucosa (mg/dl, promedio±DE) | 86±8 | 84±6 | 0.43 |
| Alanino aminotransferasa (mg/dl, promedio±DE) | 27.3±13 | 28.7±12 | 0.193 |
| Aspartato aminotransferasa (mg/dl, promedio±DE) | 26.9±11 | 23.6±9 | 0.104 |
Respecto a la evaluación de síntomas, 18 de los 20 (90%) pacientes con EC reportaron mejoría de dolor o en la distensión abdominal mayor del 50% durante la DLG, mientras que esto se reportó en 15 de los 20 pacientes con SGNC (75%). El apego a la dieta fue del 95% en los pacientes con EC, 80% en los SGNC y de 80% en los controles.
Discusión y conclusionesEn el presente estudio se evaluaron los efectos metabólicos de una DLG en 3 poblaciones que en la actualidad utilizan esta dieta de restricción: los pacientes con EC, los que reportan síntomas con la ingesta de gluten (SGNC) y en una población considerada como «asintomática» desde el punto de vista digestivo, y que optaron por esta dieta por sus supuestos beneficios metabólicos. Si bien existen estudios previos al respecto, nuestro estudio es el primero en evaluar el efecto metabólico de una DLG en sujetos con SGNC y en CA10.
Nuestros resultados demuestran que el impacto metabólico de la DLG es diferente en las 3 poblaciones evaluadas, de tal manera que la recomendación de este tipo de dieta debe adecuarse y advertir a los sujetos de los potenciales riesgos y beneficios de la misma.
La primera observación a destacar es que de forma basal los pacientes con EC tuvieron menor peso y menor estado nutricional (menores niveles de hemoglobina, colesterol y triglicéridos) que los pacientes con SGNC. Este hallazgo es consistente con lo reportado en otros estudios respecto a las deficiencias nutricionales que induce la EC a largo plazo4–7. También es importante destacar que de forma basal los pacientes tuvieron mayores niveles de AST, y que esto, como se reporta en otras series puede ser parte del espectro de las manifestaciones extradigestivas de la EC28.
Respecto a los efectos de 6 meses con una DLG en los pacientes con EC, al igual que en el estudio de Tortora et al.10 y en otras series, este tipo de intervención produjo un aumento significativo en el IMC y la prevalencia de SM8,29. Este incremento de peso es reflejo de la mejoría histológica y de la mayor absorción de nutrientes. Si bien el aumento ponderal es un parámetro de mejoría en los pacientes con EC, existe el riesgo de que si este aumento es de forma no controlada, los pacientes desarrollen obesidad, como ocurrió en el 20% de nuestros pacientes al final de los 6 meses de llevar a cabo la DLG. En un estudio de 389 pacientes adultos con EC que llevaron una dieta sin gluten en promedio por 2.8 años se demostró que el 27% de los pacientes que inicialmente tenía obesidad o sobrepeso ganó aún más peso29. En otro estudio similar la ganancia ponderal secundaria y el sobrepeso en pacientes con EC después de seguir una DLG se presentó en el 82% de los casos8.
Es importante recordar que una DLG incluye la exclusión de la ingesta de una de las principales fuentes de fibra, que es el trigo. De forma natural el trigo contiene almidones de tipo fructano, tales como la oligofructosa y la inulina, los cuales son beneficiosos para la creación de una microbiota saludable, debido que estos compuestos interactúan con las bacterias intestinales en el colon y pueden proteger al intestino de algunas neoplasias, e incluso de afecciones inflamatorias y cardiovasculares30. Los hidratos de carbono no digeribles derivados del trigo disminuyen la glucemia posprandial e insulinemia, reducen los triglicéridos en ayunas y disminuyen el peso corporal. La oligofructosa ha mostrado mejorar el estado inmune, el metabolismo de los lípidos y la absorción de vitaminas y minerales30,31. Recientemente se ha descrito que la transglutaminasa tisular modula hacia abajo (down-regulation) las vías de la inflamación mediadas por los receptores PPAR involucrados en la patogénesis de la resistencia a la insulina. Es probable que una DLG produzca un aumento (up-regulation) de estas vías que están relacionadas con la susceptibilidad para la diabetes mellitus tipo 232. Este podría ser el mecanismo implicado que explica el motivo por el cual la retirada del gluten, en algunos pacientes, pudiera favorecer la hiperglucemia, como fue en el caso de algunos pacientes de nuestro estudio. Hallazgos similares también se reportaron en el estudio de Tortora et al.10. Sin embargo, esta teoría necesita ser evaluada más profundamente. Respecto al perfil de los lípidos, al igual que en otros estudios no encontramos diferencia antes y después de la DLG, esto puede estar en relación con el hecho de que 6 meses de dieta no pueden reflejar por completo este tipo de alteraciones33,34.
Por otra parte, en nuestro estudio encontramos un incremento en la prevalencia de esteatosis hepática después de 6 meses de una DLG en pacientes con EC, tal y como demuestra el estudio reciente de Tovoli et al.35, en donde se demuestra que en una cohorte de 202 pacientes con EC en DLG y 202 controles la prevalencia de esteatosis hepática fue de 34.7% vs. 21.8% (p=0.006). Recientemente se ha descrito que la susceptibilidad para esteatosis hepática en los pacientes con EC está en relación con polimorfismos relacionados con el gen PNPLA3, al igual que en la población general36.
También es importante mencionar que el gluten puede ejercer efectos a favor de mantener la presión arterial dentro de la normalidad. Por ejemplo, se ha descrito que los hidrolizados de gliadina de trigo pueden inhibir la enzima convertidora de angiotensina tipo i,por lo que la ausencia de gluten pudiera predisponer en algunos pacientes al desarrollo de hipertensión arterial, como ocurrió en el 15% de nuestros pacientes con EC37.
La SGNC, a diferencia de la EC, se visualiza como una enfermedad «sintomática» donde no existe ningún riesgo ni complicación; sin embargo, se desconoce cuál es el efecto de la exclusión del gluten de la dieta a largo plazo en estos pacientes. Parece ser más frecuente (6% de la población) que la EC, y aunque se desconocen los mecanismos fisiopatológicos se han descrito alteraciones en la permeabilidad intestinal y producción de interleucinas y otras citocinas que sugieren, a diferencia de lo demostrado en personas con EC, la participación preponderante de la inmunidad innata38. Se postula que además del gluten otras proteínas presentes en los cereales, como los inhibidores de la tripsina-amilasa, la lecitina y las exotoxinas pudieran ser responsables de esta entidad7,29.
Nuestro estudio plantea por primera vez que los pacientes con SGNC que se exponen a una DLG pueden tener algunos efectos metabólicos como un incremento de 20% para desarrollar esteatosis hepática, 15% de SM y 10% de hipertensión arterial. Si bien los cambios no son estadísticamente significativos no dejan de ser interesantes, y debe advertirse a los pacientes con SGNC que se someten a esta dieta. A diferencia de lo observado en los pacientes con EC después de la DLG el cambio en el peso y el porcentaje de pacientes que desarrollaron obesidad fue menor. Aunque los efectos metabólicos de la DLG en los pacientes con SGNC pudieran ser los mismos que los descritos en los pacientes con EC, es probable que siendo una entidad con una fisiopatológica diferente pudiera estar asociada a otros mecanismos. Recientemente se ha descrito que consumir una DLG puede modificar la microbiota intestinal, produciendo así efectos metabólicos deletéreos. En un estudio de 10 voluntarios sanos que consumieron una DLG durante un mes se demostró una disminución significativa de bifidobacterias, lactobacilos, Clostridium lituseburense y Faecalibacterium prausnitzii y un aumento significativo de Enterobacterias y E. coli20. Contrario a este estudio, una mayor ingesta de trigo entero se relaciona con un aumento en la microbiota, que se asocia con efectos beneficiosos para la salud. Por ejemplo, en un ensayo doble ciego, aleatorizado, cruzado consistente en 2 dietas de 3 semanas (con un periodo de lavado de 2 semanas en el medio), 31 mujeres y hombres sanos añadieron a su dieta, ya fuera 48g/día de grano entero de trigo al 100% o 48g/día de cereal con salvado de trigo. Después de 3 semanas de la dieta suplementada con 48g/día de grano entero de trigo, la concentración de bifidobacterias aumentó en un 10%. La adición de salvado de trigo a las dietas habituales de los sujetos no tuvo ningún efecto. Tanto el 100% de grano entero de trigo y el salvado de trigo aumentaron el número de lactobacilos en muestras fecales39.
Finalmente, nuestro estudio mostró cuáles son los efectos de una DLG en un grupo de controles asintomáticos que optaron por este tipo de dieta con el objetivo de tener beneficios metabólicos. El único efecto importante de esta dieta en los CA fue una discreta disminución en el peso, sin ningún cambio significativo en el SM y sus componentes. Los resultados son similares a un estudio realizado tomando como base la encuesta sobre nutrición y salud de los Estados Unidos (NHANES), en donde 155 pacientes que habían elegido una DLG sin ser celíacos se compararon con la población general40. En este estudio se demostró que los sujetos que optan por una DLG como un estilo de vida tuvieron una discreta disminución de peso a lo largo de un año (1.33kg), sin tener ningún otro efecto sobre el desarrollo de SM y riesgo cardiovascular a 10 años. Es importante mencionar que, si bien la disminución del peso pudiera ser una recomendación para optar por esta dieta, su adherencia y los costes que implica deben ser considerados en esta decisión.
Respecto a nuestros resultados y conclusiones es importante considerar las limitaciones de nuestro estudio. Primero, es importante considerar que el estudio se realizó a 6 meses de evaluación y probablemente algunos de los efectos metabólicos evaluados tomen un poco más de tiempo en aparecer. Sin embargo, el seguimiento y la naturaleza de este tipo de estudios es complejo. Por otra parte, aunque los pacientes fueron evaluados respecto a la adherencia de la dieta mediante un cuestionario que evaluaba los alimentos consumidos en la semana previa a las visitas, es probable que existiera trasgresión de la dieta y que no fuera reportada por los pacientes. También es importante mencionar que no se controló la actividad física y ejercicio lo que también pudo haber impactado en el desarrollo de las complicaciones metabólicas de nuestros pacientes. Otra limitación, específicamente en los pacientes con SGNC, es el reconocer que el diagnóstico se realizó en función de una adaptación de protocolo de Salerno5. La realización por completo de este protocolo implica una vigilancia durante 6 semanas y después un reto doble ciego de alimentos con y sin gluten, lo cual en la práctica clínica es muy complejo, e incluso recientemente se ha cuestionado la utilidad de estos criterios41. Sin embargo, en todos nuestros pacientes se descartó razonablemente EC, por lo que creemos que nuestra población es representativa de esta entidad. También debemos de reconocer que nuestros pacientes con SGNC pudieran corresponder al grupo de pacientes con síndrome de intestino irritable que tienen síntomas asociados a la ingesta de gluten u oligosacáridos no fermentables, lo cual en la actualidad aún es controvertido y sigue siendo materia de investigación. Finalmente, es importante mencionar que el diagnóstico de esteatosis hepática fue realizado por un solo radiólogo, por lo que existe el riesgo de sesgo y variabilidad; además de reconocer que en la actualidad pueden existir mejores herramientas para el diagnóstico de esteatosis hepática, como la elastografía hepática.
En conclusión, en este estudio una DLG durante 6 meses aumentó la prevalencia de SM en el 20% de los pacientes con EC, tal y como se describe en otras poblaciones. Por otro lado, en los pacientes con SGNC este incremento fue del 15% y 20% en esteatosis, sin tener cambios importantes en cuanto al peso. En estos pacientes la DLG no proporciona beneficios desde el punto de vista metabólico y sí potencialmente confiere un riesgo. En los sujetos asintomáticos, si bien la DLG produce una disminución de la obesidad del 10%, no se asocia con ningún otro beneficio metabólico. Así pues, los beneficios y riesgos metabólicos de una DLG deben de considerarse cuando se prescriben este tipo de dietas.
FinanciaciónCONACYT, México, FOSIS 2015-262023.
Conflicto de interesesEl Dr. José María Remes-Troche es miembro del consejo asesor de Takeda Pharmaceuticals, Alfa-Wassermann y Almirall. Recibió fondos para la investigación por Sanfer. Es ponente para Takeda, Asofarma, Alfa-Wassermann, Carnot, Almirall y Astra-Zeneca.
Los Dres. Orestes de Jesús Cobos-Quevedo, Xaira Rivera-Gutiérrez, Gildardo Hernández, Elí de la Cruz Patiño y Luis F. Uscanga Domínguez son miembros del consejo asesor de Asofarma.
Véase contenido relacionado en DOI: https://doi.org/10.1016/j.rgmx.2020.01.001, Coss-Adame E. El impacto de la dieta libre de gluten en pacientes con enfermedad celíaca, sensibilidad al gluten no celiaca y controles asintomáticos. Rev Gastroenterol Mex. 2020;85:107–108.