Los nuevos tratamientos oncológicos, particularmente la inmunoterapia (IT) han venido a revolucionar el tratamiento de neoplasias malignas en estadios avanzados. Los inhibidores de los puntos de control son la principal forma de IT y actúan aumentando la actividad de las células T y la respuesta inmunitaria del organismo contra las células neoplásicas. La terapia blanco es otra forma de IT que actúa mediante inhibición de oncogenes o vías de inflamación y angiogénesis tumoral. Sin embargo, estos mecanismos de destrucción tumoral pueden interferir con la tolerancia inmunitaria del huésped o con los mecanismos de reparación tisular epitelial y predisponer a efectos secundarios inmunomediados que pueden afectar múltiples órganos, incluyendo el tracto digestivo. Las manifestaciones gastrointestinales de daño por IT pueden ir desde mucositis de bajo grado hasta ulceración y en algunos casos necrosis y perforación, y pueden afectar cualquier parte del tubo digestivo, con mayor afección del intestino delgado y colon, con un patrón similar al observado en enfermedad inflamatoria intestinal. La manifestación clínica más común es diarrea crónica. El diagnóstico diferencial incluye infecciones enteropatógenas, particularmente por gérmenes oportunistas, efecto secundario de medicamentos, y otros trastornos inflamatorios y malabsortivos. El tratamiento depende de la severidad del daño y puede incluir desde antidiarreicos y rehidratación en forma externa en casos leves, hospitalización, esteroides sistémicos y suspensión temporal de la IT en casos moderados, e inmunosupresores o agentes biológicos, y suspensión definitiva de la IT en casos severos.
Newer oncologic therapies, particularly immunotherapy (IT), have been a game-changer for the treatment of advanced cancer. The so-called checkpoint inhibitors act by increasing T cell activity and individual immune response against neoplastic cells. Targeted therapy is another form of IT that acts by inhibiting oncogenes or tumor-related inflammatory and angiogenesis pathways. However, these tumor-destruction mechanisms may interfere with host self-tolerance or with normal tissue repair mechanisms and increase the risk of immune-related adverse events that may affect multiple organs, including the digestive system. Gastrointestinal toxicity ranges from mild forms of mucositis, ulcerations, and in severe cases, to necrosis and perforation, and may affect any part of the GI tract, with a predominance of enterocolonic damage, similar to that seen in inflammatory bowel disease. The most common clinical manifestation is chronic diarrhea. Differential diagnosis includes opportunistic enteropathogen-associated diarrhea, particularly opportunistic agents, drug adverse effects, and other inflammatory and malabsorptive entities. Treatment varies according to the grade of toxicity and may include antidiarrheal medication and outpatient rehydration in mild cases, systemic steroids, and temporary withdrawal of IT in moderate forms, and immunosuppressant or biologic agents, as well as definitive withdrawal of IT, in severe cases.
A lo largo de la última década la terapia oncológica ha evolucionado desde los tratamientos tradicionales con quimioterapia (QT) a base de fármacos citotóxicos y radioterapia (RT), solas o en combinación, hacia terapias médicas dirigidas a los diferentes mecanismos asociados a oncogénesis. Entre las nuevas formas de tratamiento, la inmunoterapia (IT) y la terapia blanco (TB) han revolucionado la forma como se tratan las neoplasias malignas, al tener el potencial de curación de neoplasias en estadios avanzados1,2. La IT es una forma de terapia biológica que emplea sustancias que aumentan la capacidad del sistema inmunitario para combatir tumores e incluye a los inhibidores de los puntos de control inmunológico (IPC, también llamados «checkpoint inhibitors»), la terapia de transferencia de células T, los anticuerpos monoclonales, y los inmunomoduladores. De estos, los IPC son los más empleados, y su mecanismo de acción es aumentar la respuesta inmunitaria contra células tumorales al bloquear los puntos de control que regulan los mecanismos inmunológicos del organismo3,4. La TB es otra forma de tratamiento oncológico que ataca proteínas que controlan el crecimiento, la división y la diseminación de células tumorales, mediante la aplicación de anticuerpos monoclonales o moléculas pequeñas que actúan sobre receptores y vías de inflamación asociadas a crecimiento celular aberrante, y algunas tienen además la capacidad de inhibir oncogenes4,5. Sin embargo, algunos de los mecanismos de destrucción tumoral inmune o dirigida pueden a su vez interferir con los mecanismos que controlan la tolerancia inmune del huésped, en el caso de la IT, o bien los mecanismos de reparación epitelial, como en la TB, y asociarse a efectos secundarios inmunomediados en diferentes órganos, incluyendo el aparato digestivo6,7. La presente revisión intenta actualizar al gastroenterólogo en este tema emergente que es cada vez más frecuente e incluye las recomendaciones de práctica clínica publicadas por las principales asociaciones médicas expertas en el tema.
Material y métodosSe realizó una revisión de artículos publicados sobre el tema a través de una búsqueda cruzada a través de los portales PubMed Medline e IMBIOMED (desde enero del 2010 hasta junio del 2023) de los siguientes términos (en español y sus respectivas traducciones y abreviaturas en inglés): IT, IPC, TB, daño gastrointestinal (GI), enteritis, colitis, diarrea, efectos secundarios, radiología, endoscopia, colonoscopia, hallazgos histológicos, inmunosupresores y agentes biológicos. Se identificaron los artículos más relevantes al respecto, incluyendo revisiones sistemáticas, metaanálisis y guías clínicas tanto de oncología como de gastroenterología. Se ordenaron las referencias y se realizó la revisión considerando los siguientes apartados: definiciones, epidemiología, fisiopatología, síntomas y signos, métodos diagnósticos, diagnóstico diferencial, tratamiento y, al ser una entidad emergente de la cual no hay referencias nacionales, se incluyó un apartado de recomendaciones de manejo de acuerdo con las guías internacionales de las principales asociaciones publicadas sobre el tema: Society for Immunotherapy of Cancer (SITC), la American Society of Clinical Oncology (ASCO), la European Society for Medical Oncology (ESMO), la National Comprehensive Cancer Network (NCCN) y la American Gastroenterology Association (AGA). De un total de 215 artículos obtenidos en la búsqueda se incluyó la información proveniente de 117. Solo se incluyeron reportes de caso o referencias previas al período de búsqueda para aquellas categorías sin otra publicación posterior disponible. Se excluyeron artículos en población pediátrica, artículos repetidos o que no se pudieron acceder por estar en un idioma diferente del inglés o el español.
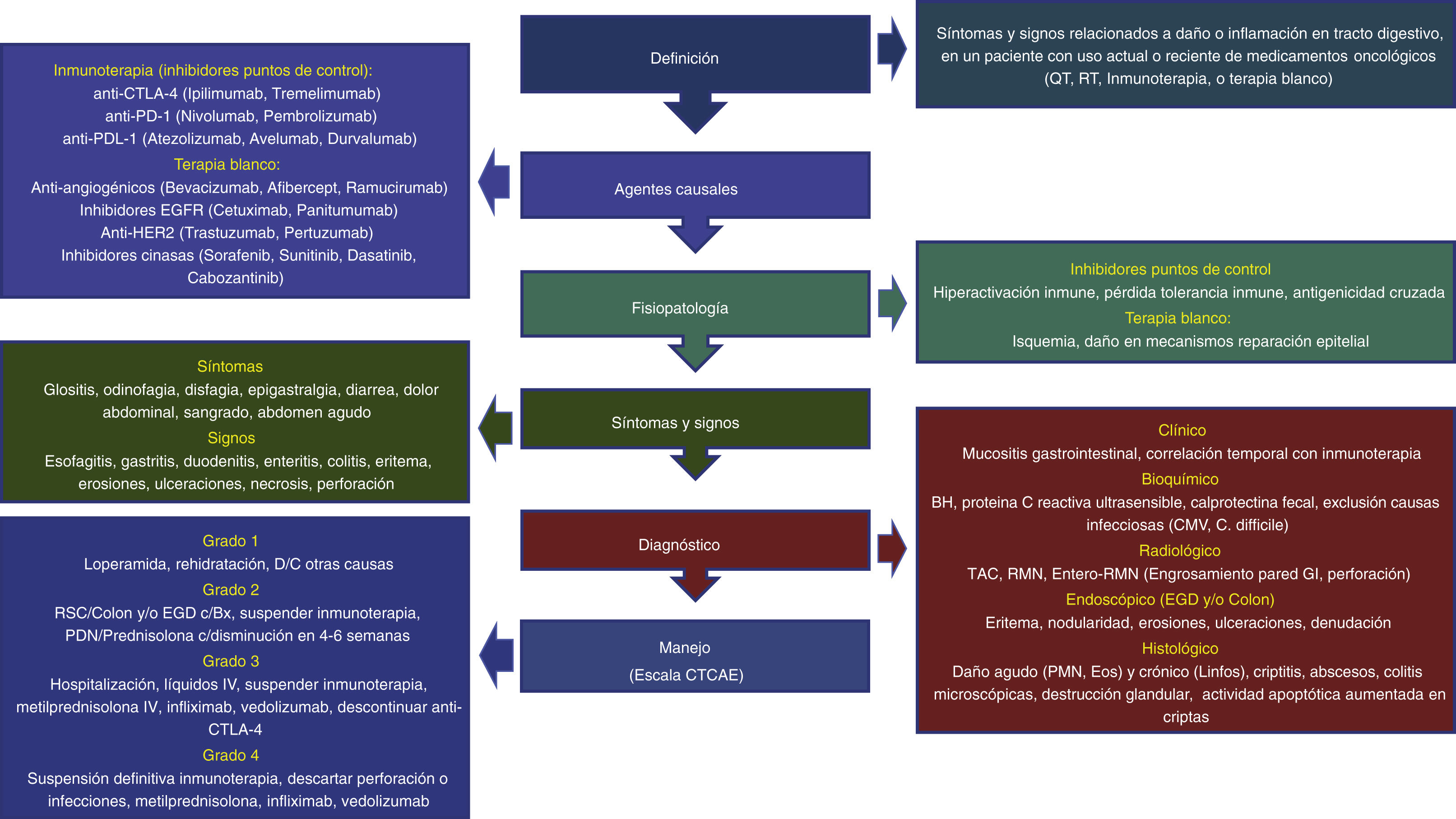
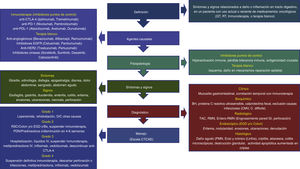
DefinicionesEl término «toxicidad GI por tratamiento oncológico (TGTO)» se ha designado para definir la presencia de síntomas y signos relacionados a daño o inflamación en uno o más segmentos de la pared del tubo digestivo, en un paciente con uso actual o reciente de medicamentos oncológicos, incluyendo (QT), RT o IT, mientras que «toxicidad GI por IT» (TGI) se refiere al daño asociado a esta forma de tratamiento en particular3,4,8-10. Las manifestaciones clínicas varían dependiendo del órgano afectado, así como de la magnitud del daño y van desde síntomas leves en uno o más órganos, hasta inflamación severa asociada a complicaciones que pueden poner en riesgo la vida del paciente. De todas las formas de TGI, la mejor estudiada es la enterocolitis o colitis por IT (ECI), también llamada colitis por IPC (CIPC)3,10,11. Aunque la mayoría de los pacientes con manifestaciones leves son manejados por los equipos de oncología, el gastroenterólogo desempeña un papel muy importante en el diagnóstico diferencial, evaluación de riesgo y el manejo de casos atípicos o refractarios12.
EpidemiologíaSe ha descrito que entre 60-80% (rango 40-100%) de los pacientes que reciben alguna forma de tratamiento oncológico (v. gr., QT, RT, IT, TB o combinaciones), presentan efectos adversos en algún momento del tratamiento3,4,8,9,13,14. A excepción de la RT, cuyo grado de daño se limita al área de exposición, las otras formas de tratamiento pueden afectar órganos en forma sistémica14-16. En el tubo digestivo el daño principal de la IT es inflamación a nivel de la mucosa, término conocido como mucositis, la cual puede manifestarse desde eritema, erosiones, ulceraciones aisladas o difusas en las formas más frecuentes, hasta necrosis, inflamación transmural, estenosis y perforación en las formas más severas. El síntoma más común es diarrea (60-80% de los casos) y los sitios de mayor afección son el intestino delgado (40-60%) y el colon (60-80%), por eso es que la mayoría de las revisiones se enfocan en la ECI/CIPC3,4,11,12,17,18. Se ha descrito que la incidencia de daño GI es mayor cuando se utiliza IT versus uso de QT19. El riesgo de daño mucoso aumenta con el tipo de IT, la dosis, la frecuencia y la duración de uso, terapias de combinación, y uso concomitante de otros medicamentos, particularmente antiinflamatorios no esteroideos (AINE). Un factor independiente de daño GI por IT es el tipo de tumor tratado: se ha descrito que los pacientes con carcinoma hepatocelular tienen mayor prevalencia de efectos adversos inmunomediados y de daño colónico comparados con aquellos con cáncer colorrectal20,21. A su vez, la frecuencia de enterocolitis varía entre 5-16% en usuarios de ipilimumab para cáncer de próstata, pero aumenta al 21% durante el tratamiento para melanoma —incluyendo tasas de perforación colónica de hasta 6,6%, y entre 14-35% durante IT para cáncer renal3,11,22-26. Otros factores de riesgo descritos son edad, origen étnico, factores genéticos, deficiencia de vitamina D, así como la microbiota intestinal y enfermedades previas del paciente, particularmente nefropatía y trastornos autoinmunes. Se ha descrito un riesgo mayor de ECI/CIPC en pacientes con diversas enfermedades autoinmunes, incluyendo artritis reumatoide y psoriasis27. Algunas de las revisiones han reportado que la presencia de enfermedad inflamatoria intestinal (EII) previa es un factor de riesgo para ECI/CIPC y que hasta 36.8% pueden presentar una reactivación de la misma durante el tratamiento con IPC28. Aunque los pacientes con EII previa han sido excluidos de la mayoría de los ensayos clínicos sobre IT, un trabajo reciente reportó tasas de daño GI asociado a IT del 41% y daño severo del 21%29. Las manifestaciones de daño GI pueden ocurrir desde la primera dosis hasta varios meses después de la última infusión, por lo que el efecto biológico deletéreo persiste incluso después de la depuración del medicamento y parece estar relacionado con el mecanismo de acción de la IT en particular, y la interacción de esta con sistema inmunitario del paciente4,11.
FisiopatologíaLos agentes oncológicos pueden dañar el tracto GI por diversos mecanismos, dependiendo del tipo de tratamiento, que van desde alteración en la síntesis de ácido desoxirribonucleico (ADN) (QT)13-15, daño isquémico o por oxidación (RT)13,16, daño por mecanismos inmunes (IPC)3,14,18 o alteraciones en los mecanismos de reparación epitelial (TB)1,5, entre otros.
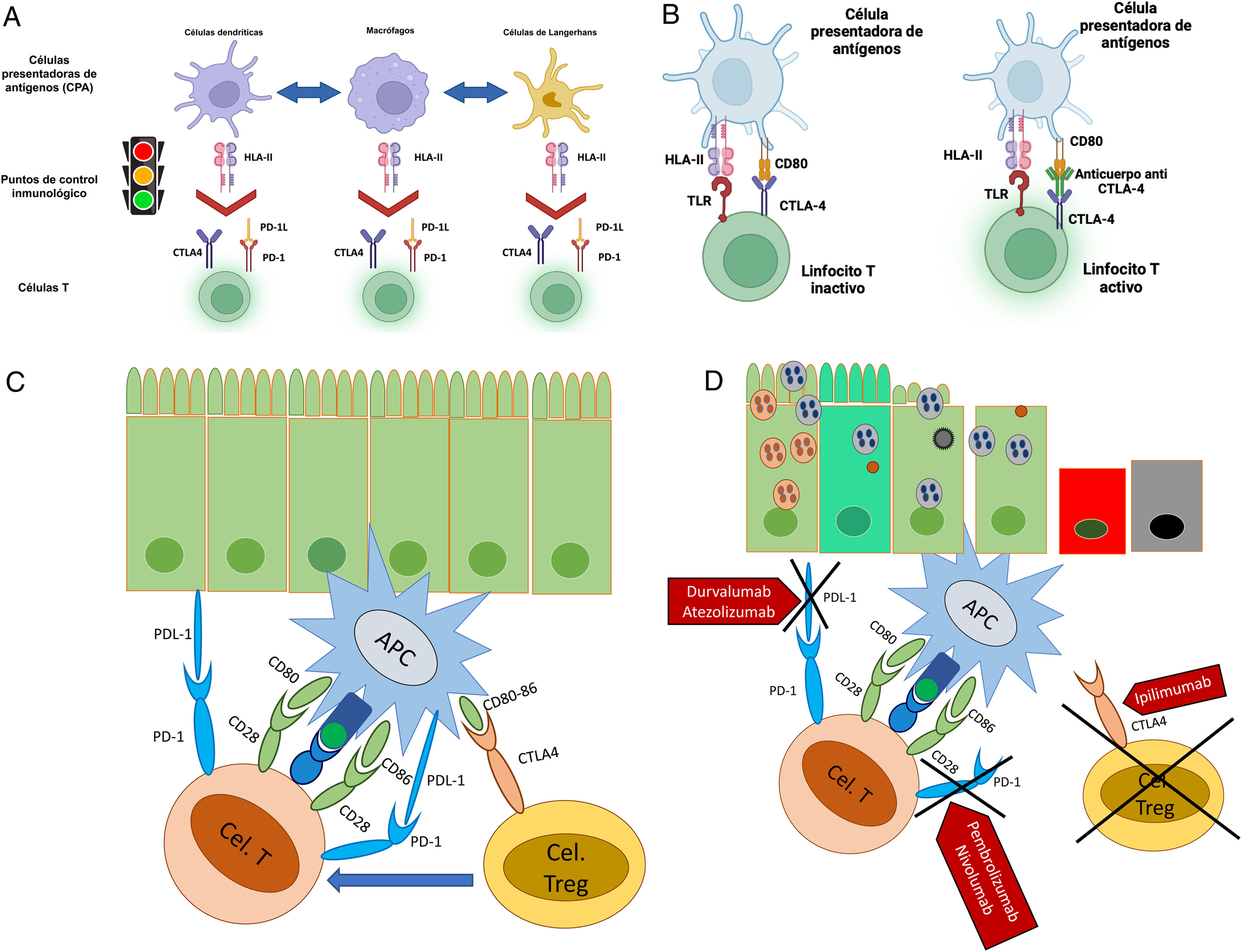
Inhibidores de los IPC: uno de los mecanismos que tiene el organismo para combatir neoplasias es el sistema inmunitario. Las células T son estimuladas a través de la unión del complejo mayor de histocompatibilidad (CMH) y las células presentadoras de antígeno (CPA), particularmente las células dendríticas (CD), con los receptores de células T (RCT), pero además se requiere una señalización de coestimulación o inhibición determinada por unas moléculas llamadas puntos de control inmunológico (PCI). El principal mecanismo que tienen las células neoplásicas para evadir al sistema inmunitario y sobrevivir es inducir un estado de hipofunción de las células T, lo cual logran principalmente mediante la activación de estos PCI, que representan el freno natural que controla la activación de las células T por parte de antígenos mediados por el RCT, el CMH en las CPA y la coestimulación entre el receptor CD28 en las células T y los receptores CD80/86 (también conocidos como B7.1 y B7.2) en las CPA o bien con su ligando B7. Una vez activados, los linfocitos T pueden entonces proliferar y producir citocinas proinflamatorias y desencadenar una respuesta inflamatoria3,4,11,30,31. El mecanismo de acción antitumoral de la IT se centra en aumentar esta respuesta inmunitaria bloqueando los reguladores negativos de inmunidad expresados en las células T o en las CPA3,11,30,31.
Los IPC son anticuerpos monoclonales que bloquean uno de varios PCI distribuidos en 2 vías inmunorreguladoras:
- 1.
Proteína CTLA-4 (cytotoxic T-lymphocyte associated protein), también llamada antígeno CD152: es una proteína de membrana expresada en la superficie de las células T reguladoras (T-reg, también llamadas CD25), algunas células B y timocitos. Tiene homología con el antígeno CD28 de los linfocitos T y sirve como ligando para los receptores CD80 y CD86.
- 2.
Proteína tipo 1 de muerte celular programada (PD-1 o programmed cell death protein), también llamada CD279: es una proteína de receptor de membrana expresada en forma normal en células T citotóxicas, linfocitos B y otras células inmunes como monocitos, células «natural killer» (NK) y CD. Tiene 2ligandos: PD-L1, expresado en linfocitos, endotelio vascular, fibroblastos, células mesenquimatosas, astrocitos, neuronas y queratinocitos, y PD-L2, expresado en las CPA, ambas miembros de la familia B7.
En forma normal estas proteínas de membrana funcionan como puntos de control o factores coinhibidores que limitan la interacción entre las CPA o CD y las células T promueven apoptosis celular de células T activas, y reducen apoptosis en T-reg, lo cual mantiene un estado de inflamación controlado, pero evita la sobreestimulación inmunitaria y, por ende, previene enfermedades autoinmunes. Algunas células tumorales pueden expresar también algunas de estas proteínas1,3,4,11,22,30,31.
Los IPC son anticuerpos monoclonales que pueden bloquear los puntos de control mediante 2 vías:
- 1.
El primer mecanismo es bloqueo de la unión de la proteína CTLA-4 con el receptor CD80/86, pero preservando la unión al receptor CD28 y bloqueo de la unión de las T-reg a las CPA, lo cual previene la señalización inhibitoria en las células T citotóxicas, ocasionando hiperactivación de las mismas, sobrerrespuesta a antígenos luminales, secreción aumentada de interleucinas proinflamatorias, así como pérdida de T-regs. Otro mecanismo de los agentes anti-CTLA-4 es la llamada vía de coestimulación, mediante la cual al tener homología con el receptor CD28, compiten con este por ligandos en los linfocitos T. Esta serie de eventos aumenta la respuesta inmune antitumoral, pero reduce la tolerancia a autoantígenos.
- 2.
El segundo mecanismo es el bloqueo a nivel de la proteína PD-1 o de alguno de sus 2ligandos, PD-L1 y PD-L2. La unión entre PD-1 y sus ligandos en forma normal envía una señal inhibitoria a las células T y a las CPA, reduciendo la actividad transcripcional que regula la producción de citocinas proinflamatorias. Al ser bloqueada esta señalización inhibitoria, se permite la activación descontrolada tanto de las CPA como de las células T citotóxicas, con un resultado similar al del bloqueo CTLA-4: un mayor potencial de destrucción tumoral, pero por el otro remueve la protección contra pérdida de la tolerancia autoinmune, lo cual resulta en daño inmunomediado a diferentes órganos, incluyendo el tracto GI y hepatobiliar (fig. 1)3,11,22-24.
Figura 1.Mecanismo de acción de los inhibidores de los puntos de control. A) Regulación de la activación de las células T por las células presentadoras de antígeno, vía puntos de control inmunológico (imagen cortesía del Dr. José Antonio Velarde Chávez). B) Mecanismo de activación e inhibición de células T vía puntos de control inmunológico (imagen cortesía del Dr. José Antonio Velarde Chávez). C) Pérdida de tolerancia inmune posterior a bloqueo de los puntos de control inmunológico, con daño gastrointestinal inmunomediado.
Algunos investigadores han propuesto 4hipótesis de daño inmunomediado asociado a IPC: 1) inducción de infiltración por células T y daño tisular mediado por complemento al unirse a proteínas de superficie celular expresadas en tejidos normales; 2) promoción de reconocimiento y unión de células T en células que comparten el mismo antígeno tumoral; 3) aumento en producción y liberación de citocinas en tejidos afectados, y 4) aumento en el nivel de autoanticuerpos contra órganos blanco o promoción de formación de autoanticuerpos de novo32.
Los IPC se clasifican de acuerdo con la proteína, ligando o a la vía inmunorreguladora que bloquean, y se dividen en 2 grupos:
- 1.
Agentes anti-CTLA-4 (ipilimumab y tremelimumab).
- 2.
Agentes anti-PD-1 (nivolumab, pembrolizumab, pidilizumab, sintilimab, cemiplimab) y anti-PD-L1 o anti-PD-L2 (atezolizumab, avelumab y durvalumab), que se agrupan usualmente en un solo grupo (anti-PD-1/PDL-1).
Actualmente los IPC se encuentran aprobados para el tratamiento de tumores en estadios avanzados, sin respuesta previa o recurrencia, o asociados a inestabilidad microsatélite:
- -
Nivolumab (melanoma, carcinoma colorrectal con inestabilidad microsatélite, cáncer de pulmón de células no pequeñas, hepatocarcinoma, mesotelioma, melanoma, gastroesofágico, renal, urotelial, linfoma de Hodgkin, escamoso de cabeza y cuello).
- -
Pembrolizumab (mismas indicaciones que nivolumab además de tumores con inestabilidad microsatélite, linfoma de células B grandes, cáncer cervical, gástrico, carcinoma de células de Merkel).
- -
Pidilizumab (linfoma de células B difuso).
- -
Cemiplimab (carcinoma escamoso de piel, basocelular, pulmón de células no pequeñas).
- -
Atezolizumab (melanoma, pulmón de células no pequeñas y pequeñas, cáncer de mama triple marcador negativo, urotelial).
- -
Avelumab (carcinoma renal, urotelial, carcinoma de células de Merkel).
- -
Durvalumab (hepatocarcinoma, colangiocarcinoma, pulmón de células pequeñas y no pequeñas, urotelial).
- -
Ipilimumab (en combinación con nivolumab, cáncer colorrectal metastásico, hepatocarcinoma, carcinoma renal avanzado, mesotelioma, micosis fungoides, pulmón de células no pequeñas, tumores con inestabilidad microsatélite, y solo para melanoma avanzado)1,30,33,34.
El grado de daño tisular en el tracto GI ocasionado por los IPC es parecido al observado en las EII autoinmunes, como colitis ulcerativa y enfermedad de Crohn, pero con diferentes grados de afección tanto gastroduodenal, como enteral y colónico, que puede ir desde edema e inflamación superficial, erosiones y ulceraciones, hasta obstrucción, y enterocolitis necrosante. La mayoría de los factores de riesgo que predisponen al desarrollo de ECI/CIPC involucran mecanismos relacionados con control inflamatorio. Algunas alteraciones genéticas ocasionan anormalidades en las vías de la proteína CTLA-4, un ejemplo es antigenicidad cruzada entre células T antitumorales y antígenos similares en células sanas. El microbioma basal del paciente —con un aparente factor protector relacionado con mayor abundancia de Bacteroidetes y Proteobacteria, y menor de Faecalibacterum prausnitzii—, puede asociarse a cambios pro o antiinflamatorios y puede afectar la expresión de los PCI y la activación de células T efectoras. La predisposición o presencia de enfermedades autoinmunes previas que pueden empeorar o inducirse durante el bloqueo de los PCI y el uso de medicamentos potencialmente enterotóxicos como los AINE son otros factores de riesgo4,11,35-39.
TB: la TB es un nuevo grupo de medicamentos oncológicos cuyo mecanismo de acción es identificación y ataque de ciertos tipos de células cancerosas mediante la inhibición de oncogenes asociados a crecimiento aberrante, o por inhibición de vías selectivas de inflamación y angiogénesis tumoral. Algunos investigadores consideran que la TB es una forma de IT, al usar mecanismos inmunitarios como metas terapéuticas5,39. La TB incluye 2grandes categorías (anticuerpos monoclonales y moléculas pequeñas) y 4grupos de agentes de acuerdo con el sitio de acción:
- 1.
Agentes antiangiogénicos (v. gr., bevacizumab, aflibercept, ramucirumab): son anticuerpos monoclonales cuyo mecanismo de acción es detener las señales de estimulación angiogénica para prevenir flujo sanguíneo hacia los tumores, mediante la inhibición de receptores del factor de crecimiento endotelial vascular. Sus principales indicaciones son en el tratamiento de cáncer pulmonar de células no pequeñas, cáncer colorrectal, ovárico, mama y prostático40,41.
- 2.
Inhibidores de los receptores del EGFR o factor de crecimiento epidermoide (v. gr., cetuximab, panitumumab): son anticuerpos monoclonales que inhiben la señalización de retroalimentación negativa del receptor EGFR e inducen citotoxicidad celular dependiente de anticuerpos mediante activación de células NK. Están indicados para el tratamiento de cáncer colorrectal y epidermoide de cuello42.
- 3.
Agentes antiHER2 (v. gr., trastuzumab, pertuzumab): son anticuerpos monoclonales dirigidos a la porción extracelular del receptor de la proteína HER2 (human epidermal growth factor receptor 2), la cual regula vías asociadas al EGFR y se expresa en diferentes células epiteliales. La sobreexpresión de HER2 se asocia a cáncer de mama más agresivo. Los agentes anti-HER2 inducen citotoxicidad celular dependiente de anticuerpos mediante activación de células NK, en forma similar a los inhibidores EGFR. Sus indicaciones principales son el tratamiento de cáncer de mama avanzado positivo a HER-2 o neoplasias con expresión de este receptor43,44.
- 4.
Inhibidores de cinasas (v. gr., sorafenib, sunitinib, erlotinib, dasatinib, axitinib, cabozantinib): son en su mayoría moléculas pequeñas que inhiben una o más proteincinasas específicas y pueden dividirse en inhibidores de proteincinasa de serina/treonina B-raf (BRAF), de proteínas activadas por mitógenos (MEK), de receptores del factor de crecimiento vascular endotelial (VEGF) o de receptores del factor de crecimiento derivado de plaquetas (PDGFR). Sus indicaciones son el tratamiento de hepatocarcinoma y cáncer renal avanzado (sorafenib, cabozantinib); renal metastásico y tumores estromales gastrointestinales (sunitinib), y leucemia mieloide crónica y aguda linfoblástica (dasatinib)41,45,46.
El mecanismo de daño GI de los agentes de TB varía dependiendo su grupo y mecanismo de acción. Los agentes antiangiogénicos pueden ocasionar, isquemia, necrosis y perforación, los agentes anti-EGFR y anti-HER2 se asocian a alteración en los mecanismos de reparación de la mucosa intestinal, los anti-HER2 pueden además ocasionar daño inmunomediado similar a los IPC, y los inhibidores de cinasa pueden ocasionar daño mucoso mediante disminución en los mecanismos de proliferación, diferenciación y sobrevida del epitelio GI, con un resultado clínico y rango de daño también similar al de los IPC5,37,39,44-46. En muchas ocasiones la IT puede ser combinada con TB para obtener un efecto mayor en tumores en estadios avanzados y, aunque existe mucho menos evidencia que con la IT, se ha descrito que puede haber daño relacionado con la coadministración. Un ejemplo de toxicidad GI por combinación IPC-TB se ha descrito recientemente con la combinación de cabozantinib, que además de ser inhibidor de cinasas, inhibe también receptores de VEGF, expresada en intestino y que, al ser administrado junto con nivolumab, puede asociarse a desarrollo de enterocolitis47.
Síntomas y signosLos síntomas y signos dependen del órgano afectado por el medicamento, así como del tiempo de evolución3,5,11,18,38.
- –
Cavidad oral: se pueden observar diversos grados de mucositis oral, como eritema estomatitis, glositis, úlceras orales, diversas formas de dermatosis oral (v. gr., reacción liquenoide o penfigoide oral, o eritema multiforme), manifestadas clínicamente por disgeusia, dolor en cavidad oral, eritema de la lengua, o dolor al masticar y deglutir.
- –
Daño esofágico: disfagia, odinofagia, dolor retroesternal, náuseas, anorexia.
- –
Daño gastroduodenal: dispepsia (epigastralgia, saciedad temprana, plenitud posprandial, distensión), náuseas/vómito/intolerancia a vía oral, hipo, melena.
- –
Daño enteral y colónico: diarrea aguda y crónica, pérdida ponderal, síndrome anémico, distensión y dolor abdominal, sangrado rectal, urgencia, tenesmo, incontinencia fecal, en casos graves puede manifestarse por síntomas y signos de abdomen agudo asociado a enterocolitis necrosante, oclusión intestinal o perforación colónica.
La presentación clínica más común es diarrea (92%), seguido de dolor abdominal (82%), hematoquecia (64%), fiebre (46%) y vómito48.
La severidad y grado de ECI/CIPC se clasifica de acuerdo con los criterios llamados CTCAE (Common Terminology Criteria for Adverse Effects o Terminología Común para efectos adversos) y, aunque han sido bien definidos para daño colónico, no han sido validados para daño en otros órganos del aparato digestivo. Se dividen en 3 categorías, de acuerdo con el grado de diarrea, severidad de la enterocolitis, así como la presencia de datos de irritación peritoneal, cada una con 5 grados de afección6,7:
- -
Grado 1 CTCAE: síntomas leves, definidos como< 3 evacuaciones líquidas al día con o sin dolor, colitis o entero-colitis asintomática o leve.
- -
Grado 2 CTCAE: 4-6 evacuaciones líquidas, dolor abdominal y moco o sangrado en las heces, síntomas nocturnos.
- -
Grado 3 CTCAE: > 6 evacuaciones al día, con dolor abdominal severo, sangrado, fiebre, íleo y signos peritoneales.
- -
Grado 4 CTCAE: cualquier combinación de síntomas con signos peritoneales, que ponen en peligro la vida.
- -
Grado 5 CTCAE: cuando el paciente muere.
Los IPC pueden ocasionar daño en cualquier parte del tracto GI y el grado de daño puede ser variable. Se ha reportado mucositis oral (30-70%), diferentes grados de gastropatía (83%), duodenitis erosiva (15%), enteritis (yeyunitis o ileítis) erosiva (7-25%), colopatía erosiva/ulcerativa (13-40%), enterocolitis erosiva (30%), enterocolitis severa que requiere suspensión de la IT (2-10%) y enterocolitis necrosante o perforación (0.8-5%), la cual se asocia a una mortalidad global de 1.1%3,4,11,18,25,38.
La frecuencia de diarrea crónica varía dependiendo del tipo de IPC o TB. En general, la mayoría de los estudios, revisiones sistemáticas y metaanálisis han reportado mayor prevalencia de cualquier tipo de daño cuando se administran agentes anti-CTLA-4, incluyendo inicio más temprano de ECI, mayor frecuencia de dolor abdominal, diarrea con sangre, mayor grado de inflamación endoscópica e histológica, y mayor necesidad de hospitalización, uso de esteroides sistémicos y de biológicos, lo cual puede ser explicado porque la vía inducida por CTLA-4 es dependiente de CPA49-51. Varias revisiones sistemáticas con metaanálisis han comparado la incidencia, prevalencia y riesgo de desarrollo de síntomas asociados a ECI/CIPC entre grupos de agentes, siendo menor con agentes anti-PD-1 como nivolumab o pembrolizumab (incidencia 0.004-0.3%, prevalencia 2.9-19%, media 11.5%), intermedia con agentes anti-PD-L1 como atezolizumab (incidencia 0.2-1.2%, prevalencia 11.6-23%) y alta con agentes anti-CTLA-4 como ipilimumab (incidencia 4.9-11.2%, prevalencia 31-92%, media 54%, 10% grado 3-4). La prevalencia y grado de enteritis, colitis o enterocolitis también varía dependiendo del grupo de IT: agentes anti-PD-1 y PD-L1 (global 5-17%, grado 3-4 1%, 2-5% requiere suspensión IT), agentes anti-CTLA-4 (global 35-40%, grado 3-4 5%, 10% requiere suspensión IT) o en terapias de combinación (global 32-56%, grado 3-4 11%, mortalidad 0.8%)3,5,11,18,34,38,49,50. La causa más común de mortalidad en usuarios de IPC es colitis, la cual representa 70% de los decesos35. Un metaanálisis reportó mortalidad global de 5% con IPC en general, con 60% de los casos asociados a agentes anti-CTLA-4, 26% con agentes anti-PD-1 o anti-PD-L1, y 14% en terapias de combinación, con inicio de síntomas y daño GI más temprano26 y un tiempo medio de inicio de 14.5 días para terapia de combinación versus 40 días en monoterapia35. La toxicidad GI de los agentes anti-CTLA-4 parece ser dependiente de dosis, mientras que de los anti-PD-1 y anti-PD-L1 no. Ya se ha comentado que dosis mayores, como las utilizadas para melanoma o cáncer renal, pueden incrementar el riesgo de enterocolitis hasta el 35% y de perforación arriba del 6%3,11,24,25. Los agentes de TB, al igual que los IPC, aumentan el riesgo de daño GI, desde mucositis de bajo grado (riesgo relativo o RR 1.5-4.5)39, siendo menor el riesgo con bevacizumab o aflibercept (RR 1.8, NNH o número necesario para dañar 91, tasa de perforación 1.1%, mortalidad asociada a perforación 8.8%), intermedio con erlotinib (RR 3.2, NNH 143) o sorafenib (RR 2.9-3.3), y mayor con sunitinib (RR 7.7, NNH 111)1,5,41-45. Dasatinib, un inhibidor de tirosincinasa de segunda generación utilizado en leucemia mieloide crónica, se ha asociado a desarrollo de colitis en 17%, de acuerdo con una serie de casos46. Recientemente cabozantinib, otro inhibidor de tirosincinasa, ha sido aprobado para el tratamiento de carcinoma renal en conjunto con nivolumab. El estudio CheckMate evaluó la presencia de efectos secundarios con cada medicamento por separado y en conjunto. Los efectos GI más comunes de la coadministración fueron diarrea (64%), diarrea grado CTCAE-3 (7%) y diarrea grado CTCAE-4 (2%), con tasas de perforación y mortalidad de 0.9%47.
Métodos diagnósticosHallazgos clínicos: ante la sospecha clínica por temporalidad entre uso de cualquier forma de IT e inicio de síntomas compatibles, se debe considerar a la misma como la primera posibilidad etiológica, previa exclusión de enfermedades infecciosas con una presentación clínica similar. Los síntomas solos no correlacionan con los hallazgos endoscópicos, histológicos ni predicen respuesta a tratamiento, por lo que se han propuesto definiciones y criterios por parte de las principales asociaciones americanas y europeas de oncología, las cuales en su mayoría definen a la ECI/CIPC como la presencia de síntomas de daño a órgano blanco GI, en usuarios actuales o recientes de IT, con evidencia radiológica o endoscópica de daño8-10,52-54. No existe una definición consensada para toxicidad por TB, pero en general se utilizan los mismos criterios clínicos, endoscópicos y radiológicos que para IT5,39. El intervalo medio de inicio de diarrea posterior a la primer infusión de IT es de 4-8 semanas, aunque puede ser tan corto como una semana, particularmente en usuarios de ipilimumab u otro agente anti-CTLA-4, o tan largo como varios meses, incluso después de la última infusión34,48. Los pacientes con ECI/CIPC que continúan utilizando IT pueden evolucionar a complicaciones más serias como hemorragia, isquemia, necrosis, megacolon tóxico, enterocolitis necrosante, tiflitis o perforación, en períodos tan cortos como de 5-10 semanas posteriores a la última dosis. La mayoría de las guías describen también el diagnóstico y manejo de toxicidad en otros órganos y sistemas, los cuales no necesariamente correlacionan con la magnitud del daño GI7,12,52-54.
Hallazgos bioquímicos: en formas leves, clasificadas como eventos adversos CTAE grado 1, no se recomienda una evaluación extensa. Para toxicidad grado 2 se sugiere realizar biometría hemática, proteína C reactiva ultrasensible o velocidad de sedimentación globular, química sanguínea, electrolitos séricos, hormona estimulante de la tiroides (TSH) y algunas asociaciones médicas recomiendan además serología para enfermedad celíaca2,8-10,12,52-54. Se debe realizar búsqueda de Clostridioides difficile (C. difficile), citomegalovirus (CMV) y otros agentes asociados a diarrea aguda, para lo cual se puede realizar un panel GI fecal por reacción de polimerasa en cadena (PCR), ya que la mayoría de las veces los coprocultivos son negativos. Dos de los marcadores de daño mucoso enterocolónico más utilizados son la calprotectina y la lactoferrina, 2proteínas derivadas de neutrófilos, que usualmente se elevan a las pocas semanas de inicio de tratamiento con IT a niveles similares a los observados en EII, es decir, por arriba de 150 μg/g, valor que es predictivo de inflamación endoscópica, con una sensibilidad del 70%, e histológica (sensibilidad 90%). La mayoría de laboratorios usan el valor de corte de 50 μg/g para definir positividad en las pruebas cualitativas, pero este no discrimina entre condiciones erosivas y no erosivas, por lo que se recomienda usar el valor cuantitativo. En aquellos casos en los cuales se considera uso de agentes biológicos como infliximab (IFX) u otras formas de inmunosupresión como vedolizumab (VDZ), se deben descartar previamente enfermedades infecciosas latentes, como tuberculosis mediante prueba de QuantiFERON® (Qiagen), PCR para CMV, y serología de virus de hepatitis B y C8-10,12-54.
Hallazgos radiológicos: los estudios de imagen permiten detectar engrosamientos focales de la pared esofágica, gástrica, intestinal o colónica, con una sensibilidad de 79% para la tomografía abdominal (TAC), 83% para resonancia magnética (RM) y 74% para la tomografía con emisión de positrones (PET)55. Las nuevas modalidades como entero-TAC o entero-RM permiten evaluar mejor la extensión y localización del daño, y pueden guiar el abordaje diagnóstico endoscópico superior o inferior. Los hallazgos típicos son engrosamiento mayor de 4mm de la pared intestinal, con reforzamiento tras la administración de contraste intravenoso (IV). Se han descrito diferentes patrones de afección que pueden involucrar tanto intestino delgado proximal, distal o colon, en forma continua o segmentaria56-58. Otros hallazgos menos comunes son distensión colónica, atenuación de la grasa pericólica y prominencia de vasos mesentéricos56. La TAC o la RM permiten además identificar si el paciente tiene alguna complicación más seria, como fistulización, obstrucción, neumatosis, neumoperitoneo, megacolon o perforación intestinal, esta última con una prevalencia de 0.9-1.7%, y tasas de mortalidad del 25% a 60 días55-58. Los hallazgos tomográficos de engrosamiento enteral o colónico predicen la presencia de inflamación colónica en biopsias (valor predictivo positivo [VPP] 96%), así como necesidad de esteroides para resolución sintomática (VPP 92%)59.
Hallazgos endoscópicos: aunque no existen hallazgos endoscópicos específicos de TGTO, tanto la esofagogastroduodenoscopia (EGD) o la colonoscopia permiten excluir otras causas no oncológicas de síntomas o inflamación mucosa similar y evalúan el tipo, distribución, grado y extensión del daño por tratamiento oncológico, que puede clasificarse en 4 grados, de acuerdo con el puntaje endoscópico de la Clínica Mayo12:
- -
Grado 0: hallazgos normales.
- -
Grado 1: eritema, disminución en el patrón vascular, friabilidad leve.
- -
Grado 2: inflamación no ulcerativa (v. gr., eritema difuso, exudado, nodularidad, edema, pérdida del patrón vascular, friabilidad y erosiones).
- -
Grado 3: ulceraciones en parches, continuas o profundas, estenosis, áreas de denudación y necrosis.
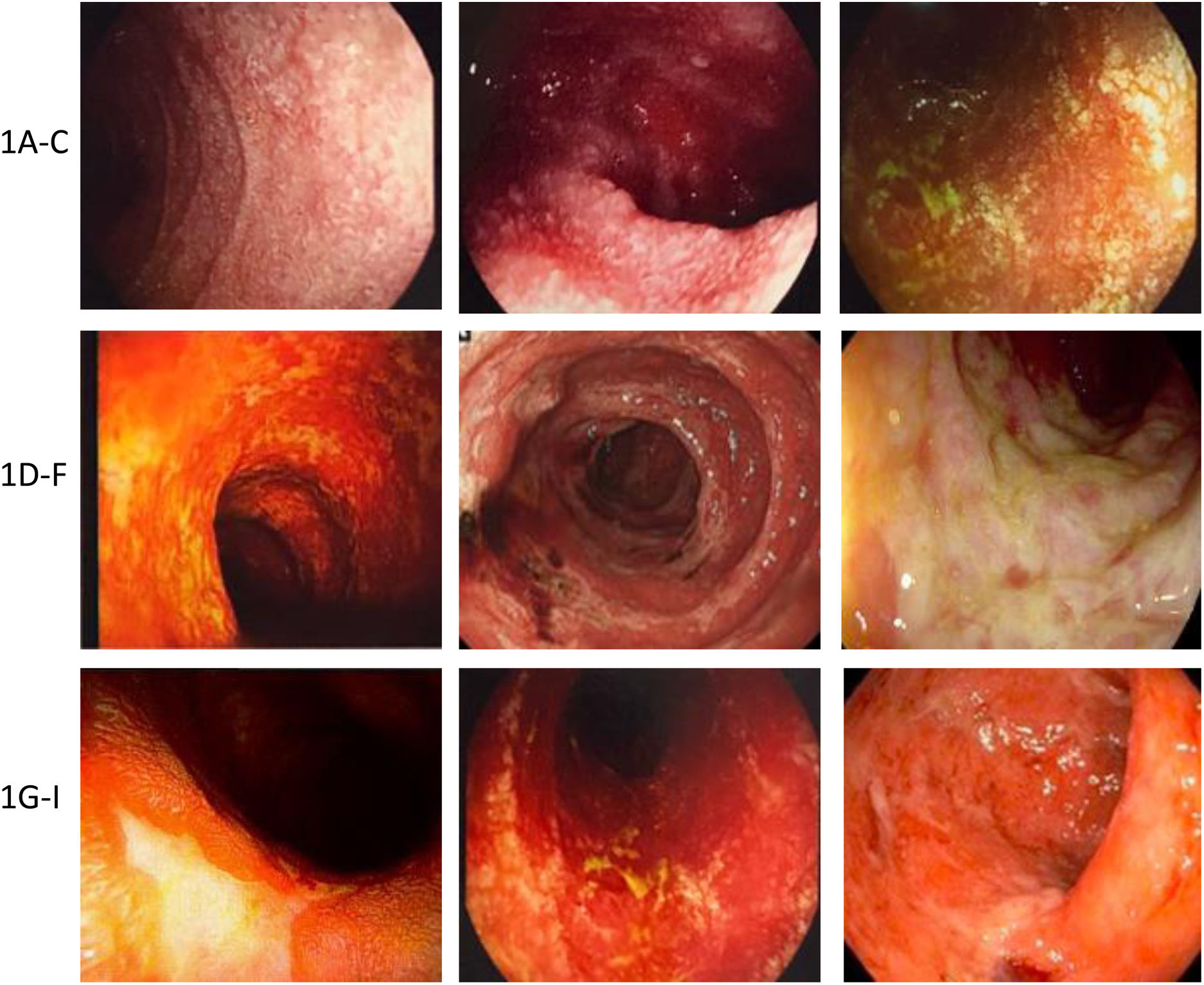
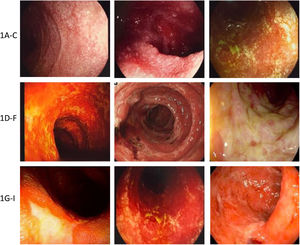
El daño endoscópico puede limitarse a un órgano o abarcar la totalidad del tracto GI3,11,17,33,60-62 (fig. 2).
Ejemplos de daño a mucosa gastrointestinal mediada por inmunoterapia. A-C) Ejemplos de daño duodenal (mucosa granular, pérdida del patrón vascular, atrofia y erosiones). D-F) Ejemplos de daño en mucosa colónica (colitis ulcerosa, úlceras excavadas necróticas, y necrosis y seudomembranas). G-I) Ejemplos de daño en íleon terminal (úlceras, edema, atrofia y friabilidad, y úlceras necróticas).
Las manifestaciones endoscópicas más comunes por órgano de origen son:
- 1.
Esófago: erosiones, aspecto nodular o granular de la mucosa, ulceración, denudación, estenosis.
- 2.
Estómago y duodeno: eritema, erosiones, hemorragias subepiteliales, ulceraciones, pérdida del patrón vascular, friabilidad, denudación mucosa, duodenopatía granular, nodular, erosiva o ulcerativa.
- 3.
Intestino delgado y colon: eritema, pérdida del patrón vascular, friabilidad, erosiones, ulceraciones de diferentes formas y tamaños, denudación, seudomembranas, necrosis, con imágenes similares a las observadas en EII.
La necesidad de realización de endoscopia o colonoscopia sigue los lineamientos de acuerdo con la sintomatología y siempre se recomienda la evaluación del íleon terminal durante una colonoscopia17,60-65. Un estudio retrospectivo mostró prevalencia de enfermedad ulcerosa en 40% de usuarios de IPC y el 42% de inflamación no ulcerosa62. En 2de las primeras series publicadas de estudios endoscópicos en pacientes con agentes anti-CTLA-4, la lesión más frecuente fue ulceración mucosa (79%), seguido de erosiones (13%), con afección rectosigmoidea en 95-97%, pancolitis en 66% y distribución en parches en 55%, por lo que en la mayoría de los casos una rectosigmoidoscopia (RSC) o colonoscopia corta con biopsias puede ser suficiente para documentar el diagnóstico, particularmente en aquellos casos en los que existe mayor riesgo de perforación colónica asociada al daño por IT63,64. Uno de los 2estudios reportó además de daño colónico, 60% de lesiones erosivas en el tubo digestivo proximal, particularmente daño gastroduodenal63. En otro estudio que incluyó a pacientes con diarrea y colitis grado 3-4, el 27% tuvo ulceraciones, 36% daño mucoso no ulcerativo y en 36% los estudios fueron normales60. Un estudio en usuarios de ipilimumab reportó daño ulcerativo en 40% de los casos, con afección del hemicolon izquierdo en el 42%, pancolitis en el 40%, daño ileocolónico en 14% y daño confinado a íleon terminal en el 2%35. La realización de endoscopia temprana, a menos de 30 días del inicio de los síntomas, se ha asociado a menor requerimiento de esteroides, biológicos y hospitalización60, y la severidad de daño endoscópico e histológico son fuertes predictores de uso de esteroides66. En el análisis multivariado la duración de la IT y hallazgos endoscópicos de severidad predijeron necesidad de uso de IFX o VDZ60. Un estudio que evaluó toxicidad por dasatinib reportó tasas de hasta 83.3% de erosiones colónicas, y pérdida del patrón vascular en 100% de los pacientes46. No hay estudios comparativos de daño endoscópico entre IPC y TB, pero la mayoría de las series reportan mayor extensión y grado de afección con IT, particularmente cuando se utilizan agentes anti-CTLA-435,62.
Diagnóstico histopatológico y variantes histológicas: los hallazgos histopatológicos de daño por IT son inespecíficos y pueden variar dependiendo del sitio de daño y el tiempo de evolución3,11,61. Aunque no se han descrito criterios diagnósticos específicos, en forma general, los hallazgos inflamatorios se dividen en 5 subgrupos: inflamación aguda activa, crónica activa, microscópica linfocítica, parecida a la enfermedad de injerto contra huésped, y hallazgos mixtos (normal, parecido a colitis isquémica, necrosis y actividad apoptótica aumentada, y cambios inflamatorios no específicos)3,62,67, y los puntajes histológicos de actividad se han adaptado de otras formas de EII. A nivel gástrico el patrón más común es inflamación mucosa y submucosa, linfocitosis intraepitelial y en formas más severas microabscesos, reacción granulomatosa, fibrosis y actividad apoptótica aumentada65,68. En intestino delgado existe linfocitosis intraepitelial y disminución o atrofia del tamaño de las vellosidades, patrón similar al observado en enfermedad celíaca, pero a diferencia de esta puede observarse un patrón mixto con neutrófilos o erosiones, además de actividad apoptótica aumentada en casos severos. En el colon en casos tempranos el patrón agudo puede mostrar infiltración por neutrófilos o eosinófilos y criptitis neutrofílica. Tras varias semanas de uso el patrón es de daño combinado agudo (neutrófilos, eosinófilos) y crónico (linfoplasmocitario), con infiltrados inflamatorios difusos, similares a los observados en colitis microscópicas, plasmocitosis basal, microabscesos y distorsión de criptas, similares a los observados en la EII. Un estudio comparó los hallazgos histopatológicos de colitis asociada a ipilimumab con pacientes con CUCI y observaron hallazgos significativamente diferentes: menor plasmocitosis basal y distorsión de criptas, pero mayor proporción de cuerpos apoptóticos en el grupo con IT69. Hasta en 10-12% de los casos se ha reportado daño histológico similar al observado en colitis microscópicas, tanto linfocíticas —particularmente con agentes anti-CTLA-4—, como colagenosas, mayormente con agentes anti-PD-1 y anti-PD-L170-72. En casos leves la estratificación de infiltración en menos de 5, 5-20 y > 20 linfocitos por cada 100 colonocitos es apropiada para la evaluación de colitis microscópica, la cual parece ser más común como hallazgo inflamatorio persistente posterior a un episodio de ECI/CIPC73,74. En casos severos puede haber áreas extensas de necrosis y destrucción glandular, así como mayor actividad apoptótica en el epitelio de las criptas. Un panel internacional de expertos ha propuesto que la presencia de cuerpos apoptóticos en 10 criptas consecutivas es altamente indicativo de daño por IT73. También se han descrito con menor frecuencia otros hallazgos, como metaplasia de células de Paneth, penfigoide buloso, cambios reparativos o cambios similares a los observados en colitis isquémica, con atrofia de criptas, cambios epiteliales reactivos, y fibrosis de lámina propria72,75,76. La inmunohistoquímica (IHQ) puede diferenciar el tipo de daño en pacientes con IT combinada. Aunque por histología convencional los hallazgos son muy similares entre los diferentes IPC, en daño por agentes anti-PD-1 la IHQ muestra predominancia de células T reguladoras en lamina propia, mientras que en daño por anti-CTLA-4 se observa un predominio de células T CD8+11,72,77,78.
Diagnóstico diferencialTodas aquellas causas infecciosas no inflamatorias e inflamatorias con presentación clínica similar, incluyendo infecciones oportunistas (VIH, Cryptosporidium, Isospora), o no oportunistas (C. difficile, CMV, Cyclospora cayetanensis, Salmonella spp., Campylobacter, Shigella, Yersinia, Escherichia coli O157.H7, SARS-CoV-2, Giardia, norovirus, rotavirus, enterovirus y adenovirus, entre otros) deben ser excluidas. Una cohorte retrospectiva en 105 pacientes oncológicos que recibieron IT y desarrollaron diarrea reportó una prevalencia de 21.9% de causas infecciosas de diarrea79. Se deben considerar también efectos secundarios de otros medicamentos, incluyendo antibióticos, AINE, RT, QT o micofenolato mofetil (MMF). Los AINE pueden ocasionar daño mucoso ulcerativo y no ulcerativo a lo largo del tracto GI a través de su efecto inhibitorio sobre la ciclooxigenasa, lo cual ocasiona disminución en el flujo sanguíneo mucoso, producción de moco y motilidad intestinal, y con manifestaciones tan diversas como enterocolitis microscópicas y eosinofílicas hasta erosiones y ulceraciones, particularmente gastroduodenales y enterales, con infiltración linfocítica o gastropatía reactiva, aunque el único hallazgo patognomónico es la presencia de estenosis tipo diafragma15,48. La RT puede inducir daño agudo o crónico a través de mecanismos como endotelitis, esclerosis microvascular, generación de especies reactivas de oxígeno, muerte celular mitótica y fibrosis de la pared intestinal, y la inflamación afecta únicamente áreas expuestas16. Entre los agentes de QT los taxanos (v. gr., paclitaxel, doxitaxel) son inhibidores de mitosis que alteran la polimerización de proteínas llamadas tubulinas, ocasionando daño a los microtúbulos y protofilamentos involucrados en el movimiento cromosómico. Los aductos de platino (v. gr., cisplatino, oxaliplatino) reaccionan con las bases de ADN, ribonucleico y proteínas, ocasionando desconfiguración y apoptosis. Los antimetabolitos citotóxicos (v. gr., metotrexato, doxorrubicina, 5-fluorouracilo, capecitabina, gemcitabina e irinotecan) ocasionan daño enterocolónico interrumpiendo la síntesis de ADN al evitar la división celular o por liberación de especies reactivas de oxígeno, las cuales liberan factores de señalización como caspasas, β-catenina y factor nuclear kappa-beta (NF-κβ), ocasionando alteraciones en la permeabilidad, enteropatía por pérdida de proteínas, daño isquémico y apoptosis, este último asociado a vasoconstricción prolongada o trombosis, y daño a la reserva de células precursoras. Finalmente, los agentes alquilantes (v. gr., melfalán, clorambucilo, mecloretamina, ifosfamida, carmustina, micomicina C, dacarbazina) bloquean la división celular mediante alquilación de los componentes del ADN14,15. MMF es un agente inmunosupresor utilizado en trastornos autoinmunes y en pacientes receptores de órganos. Además de diarrea dependiente de dosis, este medicamento puede inducir colitis erosiva con criptitis neutrofílica y apoptosis de enterocitos48. Además de efectos secundarios de medicamentos, se debe tomar en cuenta también en el diagnóstico diferencial la coexistencia con otros trastornos malabsortivos e inflamatorios, particularmente enfermedad de injerto vs. huésped cuando esté indicado, ya que es común observar formación de cuerpos apoptóticos en intestino o colon en esta afección48. Otras causas de diarrea crónica como insuficiencia pancreática y endocrinopatías, primarias, o bien secundarias a IT, pueden inducir síntomas similares3,8-10,48,52–54. Es importante recordar que la IT puede manifestarse con efectos secundarios en otros órganos y sistemas, que a su vez pueden ocasionar síntomas digestivos. Algunos de los esquemas más recientes pueden combinar diferentes grupos de IT debido a resistencia, pérdida del efecto (v. gr., agente anti-CTLA-4 como ipilimumab con agente anti-PD-1 como nivolumab) o para algunos tipos de cáncer metastásicos como melanoma. Estas combinaciones, así como las combinaciones IPC-TB pueden también aumentar la tasa de efectos secundarios22,47,76,80.
TratamientoLa forma de tratamiento depende del grado de severidad, la duración previa de la IT, así como las enfermedades y los medicamentos concomitantes. La escala de severidad CTCAE permite evaluar el grado potencial de daño y sus complicaciones, y todas las guías se rigen por esta escala. Se debe valorar el estado de hidratación, nutricional, buscar datos de toxicidad sistémica en otros órganos, así como la presencia de signos peritoneales. En casos de sospecha o confirmación de etiología infecciosa, se deben administrar antimicrobianos dirigidos al agente patógeno causal3,4,8-10,12,52-54.
La mayoría de las guías establecen el tratamiento de ECI/CIPC, pero debido a que el daño esofágico o gástrico tiene una fisiopatología e histología similares, la terapia de daño por IPC en estas áreas anatómicas puede seguir los mismos lineamientos. La ECI/CIPC se comporta en forma parecida a la EII, tanto desde el punto de vista de síntomas, fisiopatología, hallazgos endoscópicos e histopatológicos, con daño mucoso GI mediado por daño inmunitario, que responde la mayoría de las veces a esteroides e inmunosupresores, de manera que las opciones de tratamiento van dirigidas —en forma similar a la EII—, al control de esta sobrerrespuesta inmunitaria (fig. 3):
- -
Esteroides sistémicos: los corticosteroides inhiben los sistemas inmunitarios innato y adaptativo mediante varios mecanismos: inhiben la producción de citocinas proinflamatorias a partir de células T, como interleucina 2 (IL-2) e interferón gamma (IFN-γ), inhiben la maduración de CD, inducen apoptosis en células T activadas y aumentan la expresión de PD-1 en células T CD4+ y CD8+ suprimiendo sus funciones. Los glucocorticoides (hidrocortisona, prednisona, prednisolona, metilprednisolona) disminuyen el número de macrófagos, monocitos, células T y eosinófilos circulantes, disminuyen la expresión de moléculas del CMH clase III, la permeabilidad vascular, la expresión de moléculas de adhesión, y la producción de prostaglandinas e interleucinas proinflamatorias. Son el tratamiento de primera elección para ECI/CIPC, particularmente los de acción intermedia como prednisona o metilprednisolona, a dosis de 1-2mg/kg/día, con reducción paulatina en 4-6 semanas en forma similar al tratamiento de inducción de EII. Como medida única, son efectivos en 59% de los pacientes y, al combinarse con agentes biológicos, la efectividad aumenta a 81% (IFX) y 85% (VDZ)31,81-82. Solo un estudio ha evaluado el uso de esteroides de acción local en forma profiláctica junto con IT, como budesonida en ECI, pero no mostró beneficio83 a menos que el diagnóstico histológico sea compatible con colitis microscópica74.
- -
Derivados 5-ASA: los derivados de aminosalicilatos, como mesalazina o sulfasalazina, poseen efectos antiinflamatorios sobre la mucosa colónica al inhibir la ciclooxigenasa y lipooxigenasa, lo que disminuye la síntesis de prostaglandinas y leucotrienos. Son un grupo de medicamentos muy útiles para formas leves a moderadas en EII. Han sido utilizados en ECI/CIPC, con resultados conflictivos, y la mayor parte de evidencia es empírica al extrapolar resultados de los estudios de EII84. Un estudio retrospectivo reportó efectividad similar a colestiramina en grados leves de diarrea y colitis85, pero no hay estudios en formas severas de enterocolitis.
- -
Infliximab (IFX): es un anticuerpo monoclonal quimérico dirigido contra el factor de necrosis tumoral alfa (TNF-α) que ha mostrado ser altamente efectivo en EII para inducción de remisión y mantenimiento. Al ser la ECI/CIPC una enfermedad mediada por mecanismos inmunológicos, la mayoría de los pacientes responden a corticosteroides, pero 1 de cada 3 son refractarios a este tipo de terapia, y pueden evolucionar rápidamente a formas severas y complicaciones potencialmente mortales. Este agente anti-TNF empezó a ser utilizado en forma empírica en ECI/CIPC que no respondía a esteroides con respuestas similares a las observadas en EII y con mejoría sintomática significativa tras una o 2infusiones. Algunas series de casos empezaron a reportar mejoría con 3 dosis o a dosificación mayor. Los estudios iniciales reportaban tasas de mejoría del 81% al combinarse con esteroides. Actualmente ya existe evidencia que apoya el uso de 3 dosis para aumentar la posibilidad de remisión histológica y reducir el riesgo de recurrencia, con rango de efectividad de entre el 54 y el 100%, con una media del 88% a 7 días de la primera dosis. La dosis ensayada es la misma que en EII: IFX a dosis inicial de 5mg/kg/dosis en semanas 0, 2 y 6, con escalada potencial a 10mg/kg/dosis en caso de no respuesta, y cada 8 semanas en casos seleccionados31,82,86-94.
- -
VDZ: es un anticuerpo monoclonal IgG1 que se une específicamente a la integrina α4-β7 en las células T activadas e inhibe su entrada en el tejido intestinal al bloquear la interacción con la molécula 1 de adhesión celular (MaDCAM-1), expresada en las células endoteliales intestinales. Se ha evaluado como alternativa al uso de IFX, al inicio en reportes de casos95,96, y posteriormente en al menos 3 estudios prospectivos, y 2revisiones sistemáticas, a la misma dosis y esquema utilizados en EII (300mg IV en infusión IV en semanas 0, 2 y 6, y en casos persistentes o seleccionados, cada 8 semanas), con tasas de remisión clínica entre el 86 y el 100%, media del 89%, el 86% sostenida, con remisión endoscópica e histológica del 54 y el 29%, respectivamente50,82,97-99. En 2revisiones sistemáticas con metaanálisis recientes VDZ se asoció a hospitalizaciones más cortas, menores tasas de readmisión, y menores tasas de recurrencia50,82. Un solo estudio ha comparado las tasas de remisión y retiro total de esteroides tras la administración de IFX o VDZ. En este estudio IFX fue superior en tasas de remisión a 2 semanas (100% vs. 83%), pero VDZ se asoció a mayores tasas de retiro total de esteroides a 4 semanas (50% vs. 7.4%)100. Actualmente las guías de ASCO y NCCN lo presentan como la primera alternativa al uso de IFX en casos de resistencia, falla a tratamiento, efectos secundarios o contraindicaciones al uso de agentes anti-TNF8,9, y la de la AGA las propone como opciones equivalentes que pueden ser intercambiables en caso de fallo a la terapia previa12.
- -
Terapias de combinación y mantenimiento: en casos donde a pesar de la suspensión de IT existe una respuesta subóptima al tratamiento convencional incluyendo un agente biológico, puede ser necesario cambiar a otro agente o bien combinarlo con otro inmunosupresor. La evidencia al respecto es escasa, pero un estudio retrospectivo reciente demostró que la administración temprana de «terapia inmunosupresiva selecta», definida como esteroides sistémicos + IFX o VDZ en forma prolongada, se asoció a menores tasas de hospitalización, menor falla al bajar o suspender esteroides, y menor duración de síntomas. En aquellos pacientes con ECI/CIPC severa que han respondido a un agente biológico y que requieren continuar IT, una alternativa es continuar el biológico en forma conjunta. Dos estudios han mostrado superioridad de esta estrategia comparada con reinicio de IT sin inmunosupresor, con menor recurrencia de colitis, mayor duración de tratamiento con IT, y mayor probabilidad de uso de terapias combinadas cuando se utilizan 2IPC o bien la combinación IPC+ TB101-103. Sin embargo, existen consideraciones de seguridad asociadas a un potencial riesgo mayor de infecciones y de malignidad cuando se utilizan en forma prolongada, por lo que la recomendación general en la mayoría de los casos es inducción de remisión y una vez obtenida, disminución de dosis y eventualmente suspensión. En casos muy seleccionados, y como opinión de expertos, ya que la evidencia es escasa, se puede considerar coterapia por tiempo prolongado tras considerar riesgos y beneficios de la misma91,104,105.
- -
Otros agentes biológicos: algunos otros agentes biológicos efectivos en EII refractaria como ustekinumab, un bloqueador de receptores de IL-12/23106, o tofacitinib, un inhibidor de Janus cinasa (JAK)107, han demostrado también efectividad en ECI/CIPC refractaria a esteroides en reportes de casos. Tocilizumab es un anticuerpo monoclonal anti-IL-6 utilizado en artritis reumatoide (AR) y una forma emergente de inmunosupresión en EII, pero su evidencia de eficacia en ECI/CIPC es limitada, e incluso se ha reportado perforación intestinal en uso previo prolongado de esteroides en AR108. Otros agentes como adalimumab no han sido evaluados en ECI/CIPC31,91.
- -
Otros inmunosupresores: los inhibidores de calcineurina, tacrolimús y ciclosporina, se unen a la calcineurina formando un complejo intracelular que suprime la liberación de citocinas, particularmente IL-2, TNF-α e IFN-γ, e inhiben la activación de células T. La evidencia en ECI/CIPC proviene de series de casos, con tasas de respuesta del 72%109,110 y tanto la SITC como la ESMO las consideran como alternativas a IFX/VDZ31,52,53. Ciclosporina demostró ser efectivo en un reporte de caso de ECI refractaria a IFX, pero no hay evidencia adicional111. Azatioprina es un inmunosupresor análogo de purina que a pesar de ser efectiva como ahorrador de esteroides en EII, no ha sido evaluada en ECI/CIPC31.
- -
Trasplante de microbiota fecal (TMF): otras líneas de investigación encaminadas a corregir la disbiosis asociada a enfermedades oncológicas y sus tratamientos se encuentran en curso. Se sabe que la microbiota puede afectar la respuesta clínica a IT y es uno de los factores epidemiológicos asociados en la ECI/CIPC3,4,11. En 2018 Wang reportó 2casos de ECI/CIPC refractaria exitosamente tratados mediante TMF112 y otro reporte de caso similar fue publicado recientemente113. Evidencia preliminar en estudios animales o en pacientes en fase 1 o 2 parecen indicar que intervenciones que modifican la microbiota tienen el potencial de afectar vías inflamatorias relacionadas con respuesta o con desarrollo de efectos secundarios asociados a IT, pero ninguna guía los considera actualmente como opciones de tratamiento en formas agudas114.
Las recomendaciones de tratamiento de TGI de la SITC, ASCO, ESMO, NCCN y AGA varían en algunos puntos, que se resumen a continuación8,12,52-54.
Grado CTCAE-1:
- -
Manejo sintomático, rehidratación oral o IV (AGA), dieta blanda, sin lácteos y baja en fibra (ESMO).
- -
En forma general no es necesario un abordaje diagnóstico extenso (ASCO).
- -
Loperamida 2-4mg c/6-8h vía oral (VO), máximo 16g/día (AGA, ESMO).
- -
En forma general se puede continuar con la IT (ESMO).
- -
Si la diarrea persiste por >14 días o empeora en 3-5 días, se debe realizar RSC o colonoscopia o EGD + biopsias, y considerar prednisolona IV 0.5-1mg/kg/día (AGA, ESMO).
- -
En caso de daño gastroduodenal por IPC se recomiendan antieméticos y en caso de no mejoría, realizar endoscopia (SITC).
Grado CTCAE-2:
- -
Se recomienda descartar causas infecciosas antes de iniciar tratamiento con esteroides incluyendo C. difficile, SARS-CoV-2 y agentes asociados a inmunosupresión (AGA, ASCO, ESMO, SITC).
- -
Se debe medir calprotectina o lactoferrina fecal cuantitativas, para estratificar requerimiento de endoscopia (AGA, ASCO, ESMO, SITC).
- -
Considerar descartar enfermedad celíaca (SITC).
- -
RSC/colonoscopia + biopsias o EGD + biopsias, con base en sintomatología superior o inferior (ESMO, ASCO, NCCN).
- -
Se debe suspender temporalmente IT (AGA, ESMO, ASCO, NCCN).
- -
Confirmación endoscópica e histológica de ECI/CIPC antes de iniciar esteroides sistémicos (AGA).
- -
Considerar estudios de imagen abdominal si existe predominio de dolor, fiebre o sangrado, pero no deben ser realizados rutinariamente en caso de diarrea (AGA).
- -
Budesonida y mesalazina son inefectivas como profilaxis o tratamiento de ECI/CIPC, pero pueden utilizarse en casos de colitis microscópica asociada a IT (AGA).
- -
Prednisona (PDN)/prednisolona a dosis 0.5-1mg/kg/día (ESMO).
- -
PDN/prednisolona a dosis 1mg/kg/día (ASCO).
- -
PDN/prednisolona a dosis 1-2mg/kg/día (NCCN).
- -
PDN 0.5-2mg/kg o equivalente con descenso en 4-6 semanas en caso de mejoría (AGA).
- -
Si hay respuesta: disminuir esteroides en 4-6 semanas, suspensión temporal de la IT, con reinicio una vez resuelto el cuadro (AGA, ASCO, SITC, ESMO), considerar suspensión definitiva de agentes anti-CTLA-4 (ESMO, ASCO).
- -
Si no hay mejoría en 2-3 días, aumentar dosis de esteroide oral a 2mg/kg/día o cambiar a metilprednisolona 1-2mg/kg/día (ESMO) o 2mg/kg/día (ASCO), o cualquier esteroide IV (AGA).
- -
Descartar enfermedades infecciosas latentes.
- -
IFX o VDZ 1 dosis y reevaluar, en caso de remisión bajar dosis de esteroides y reiniciar IT, en caso de mejoría parcial continuar IFX/VDZ y repetir colonoscopia (AGA).
- -
IFX 5mg/kg/dosis, con repetición si es necesario a las 2 semanas (ESMO), 5-10mg/kg/dosis 0, 2 y 6 semanas (ASCO, NCCN) o VDZ 300mg IV 0, 2 y 6 semanas si no hay respuesta al esteroide (NCCN).
Grado CTCAE-3 o deterioro:
- -
Hospitalización en caso de deshidratación, fiebre o síntomas sistémicos, líquidos IV (ASCO, ESMO), aislamiento por contacto (ESMO).
- -
Descartar perforación intestinal mediante TAC o infección por C. difficile (citotoxinas A, B y glutamato deshidrogenasa fecal) (AGA, ESMO, ASCO, NCCN, SITC).
- -
Prednisona o equivalente 1-2mg/kg/día (ASCO) o hidrocortisona 100mg IV cada 6-8h, o metilprednisolona IV 1-2mg/kg/día (NCCN), reevaluar en 72h, si hay mejoría hacia grado 1 CTCAE: reducción paulatina de esteroides en 4-8 semanas (AGA, ASCO, NCCN).
- -
Si no hay mejoría en 3-5 días: iniciar metilprednisolona IV, o IFX IV 5mg/kg/dosis (SITC), 5-10mg/kg/dosis (ASCO), a 0, 2 y 6 semanas, o VDZ 300mg IV 0, 2 y 6 semanas en casos refractarios (falla tras 2 dosis de IFX) o en caso de contraindicación de IFX (ASCO, AGA).
- -
Considerar otros inmunosupresores como MMF 500-1000mg/día si no hay mejoría con esteroides (ESMO).
- -
Documentar curación endoscópica e histológica (la presencia de ulceraciones persistentes durante el tratamiento con esteroides, lo cual ocurre hasta en 56% de pacientes con ipilimumab, puede predecir la necesidad de suspensión definitiva de IT o uso de agentes biológicos). Si hay remisión endoscópica suspender biológico, o considerar coadministración junto con IT, si hay remisión parcial, continuar biológico y pueden reiniciarse agentes anti-PD-1/PD-L1 (AGA).
- -
Considerar suspensión definitiva de agentes anti-CTLA-4 (AGA, ASCO, ESMO).
Grado CTCAE-4:
- -
Se recomienda suspender cualquier forma de IT en forma definitiva (AGA, ASCO, ESMO, SITC).
- -
Todos los pacientes deben ser hospitalizados, con líquidos IV, descartar perforación, megacolon o infecciones.
- -
Iniciar metilprednisolona IV 1-2mg/kg/día, si hay mejoría: disminuir en 4-8 semanas, y si no hay mejoría, iniciar IFX 5mg/kg/dosis IV (SITC), 5-10mg/kg/dosis (ASCO), 0, 2 y 6 semanas, o VDZ 300mg IV a 0, 2 y 6 semanas en casos refractarios (falla tras 2 dosis de IFX) o en caso de contraindicación de IFX (ASCO, SITC).
- -
Considerar combinación con otro agente inmunosupresor en caso de persistencia de síntomas (v. gr., MMF 1-2g/d VO, tacrolimús 0.1-0.2mg/k/día VO, ciclosporina 3-4mg/k/día IV) (ESMO).
- -
Considerar profilaxis contra Pneumocystis jirovecii (ESMO).
Deterioro durante cualquier fase:
- -
Realizar nueva evaluación mediante RSC para documentar daño endoscópico o histológico persistente o empeoramiento del mismo.
- -
Descartar colitis por CMV, colitis pseudomembranosa por C. difficile, colitis por tuberculosis (ASCO, ESMO, SITC, AGA).
- -
Todos los pacientes con ECI/CIPC deben ser evaluados con pruebas de función hepática para descartar daño hepatobiliar por IT, y repetir la medición antes de reiniciar la IT si esta se suspendió (AGA).
- -
Seguimiento cercano y tratamiento intensivo en caso de deterioro con uso de agentes anti-CTLA-4, los cuales pueden asociarse a deterioro temprano (AGA).
- -
Considerar IFX o VDZ (ASCO, ESMO, SITC).
- -
En cualquier fase en caso de sepsis o perforación, suspender cualquier terapia inmunosupresora, incluyendo esteroides, y dar tratamiento quirúrgico definitivo.
Recurrencia: entre el 33 y el 50% de los pacientes que reinician IT después de haberse suspendido por colitis o diarrea inmunomediada experimentan la misma sintomatología inflamatoria115. Los factores de riesgo son: uso inicial de agentes anti-PD-1-PD-L1 (RR 3.45), requerimiento temprano de inmunosupresores (RR 3.22), duración prolongada de síntomas durante el episodio inicial (RR 1.01) y el promedio de inicio de síntomas es de 49 días tras el reinicio de IT. El riesgo disminuye en pacientes que reintroducen solo un inhibidor PD-1 o PD-L1 (18-21%). Las guías de AGA, ASCO y ESMO recomiendan suspensión definitiva de agentes anti-CTLA-4 en daños por grado 3 y de cualquier IPC para cualquier evento grado 48,10,12,52-54.
Tratamiento enterocolitis asociada a TB: todas las guías previamente referidas describen el tratamiento para daño GI por IT. El tratamiento de daño GI por TB ha sido menos evaluado. Cuando se administra en forma conjunta algún agente de IT junto con TB y el paciente presenta síntomas GI, los lineamientos siguen las guías de IT/IPC y se suspenden temporalmente en forma conjunta ambos tratamientos47. En forma general, cuando se administra TB sola tanto el riesgo como grado de daño mucoso es menor y la recomendación es suspender el tratamiento, descartar complicaciones infecciosas y potencialmente quirúrgicas, rehidratación oral o IV, corrección de electrolitos, antidiarreicos, y en caso necesario antibióticos de amplio espectro al igual que con IT. Sin embargo, a diferencia de la IT, hay menor evidencia de mejoría con esteroides u otro tipo de inmunosupresores, a menos que el paciente haya recibido terapia de combinación con uno o 2IPC junto con la TB, que el paciente haya recibido agentes anti-EGFR o anti-HER2, en los cuales puede haber daño inmunomediado, o bien se presenten complicaciones que pongan en riesgo la vida del paciente, como ulceración enterocolónica severa, sin datos de infección sobreagregada, en cuyo caso un curso de esteroides similar al utilizado en IT puede ayudar a inducir remisión de la inflamación5,47.
Conclusiones- -
La IT con los IPC inmunitario y la TB, representa una nueva forma de tratamiento oncológico asociada a mayores tasas de curación y sobrevida en tumores avanzados, pero puede asociarse a efectos adversos gastrointestinales, particularmente mucositis en cualquier parte del tubo digestivo, con inicio de síntomas desde el inicio del tratamiento, hasta semanas después de su suspensión.
- -
Los mecanismos de daño asociados a IT son: sobreestimulación inmune (IPC), isquemia y alteración en los mecanismos de reparación epitelial, y en algunos casos, daño inmunomediado (TB).
- -
Las manifestaciones clínicas, radiológicas y endoscópicas varían dependiendo el órgano de origen y la magnitud del daño, y van desde cambios inflamatorios leves incluyendo erosiones o ulceraciones, hasta complicaciones más serias como enterocolitis, megacolon, necrosis y perforación intestinal.
- -
El diagnóstico requiere la asociación temporal entre uso de IT e inicio de síntomas, hallazgos radiológicos y endoscópicos característicos, y descartar otras condiciones, particularmente infecciosas, con síntomas similares. Los hallazgos histopatológicos son variables pueden imitar otras condiciones como colitis microscópicas y enfermedad inflamatoria intestinal, y la presencia de apoptosis se considera diagnóstica.
- -
El tratamiento de enteritis o colitis por IT depende del grado de afección puede incluir suspensión temporal o definitiva del medicamento, particularmente agentes anti-CTLA-4, además de rehidratación, esteroides orales o IV, o agentes biológicos, antiintegrinas u otros inmunosupresores en formas más severas. Se debe vigilar estrechamente a los pacientes por deterioro potencial, con reevaluaciones periódicas y modificación del manejo con base en mejoría o progresión.
No se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.