La inmunoterapia con inhibidores de puntos de control inmunitario (ICP) ha revolucionado el manejo del cáncer avanzado, sin embargo, el uso generalizado de estos medicamentos ha llevado al aumento en la incidencia de eventos adversos inmunomediados, siendo el hígado uno de los órganos más frecuentemente afectados.
La afectación hepática asociada con la administración de inmunoterapia se denomina hepatitis inmunomediada (HIM), cuya incidencia y características clínicas han sido descritas por distintos autores, frecuentemente se manifiesta como elevaciones leves en las aminotransferasas evidenciadas en la analítica de rutina que regresan a la normalidad de forma espontánea, aunque puede tratarse de una transaminasemia grave que lleve a la suspensión definitiva del tratamiento.
El objetivo de la siguiente revisión fue describir los conceptos más actuales sobre la epidemiología, el diagnóstico, los factores de riesgo y la evolución de la HIM, así como la incidencia de esta en los diferentes tipos de cáncer más frecuentes incluyendo el carcinoma hepatocelular y algunas recomendaciones respecto al tratamiento de acuerdo con las guías más actuales.
Immunotherapy with immune checkpoint inhibitors (ICIs) has revolutionized advanced cancer management. Nevertheless, the generalized use of these medications has led to an increase in the incidence of adverse immune-mediated events and the liver is one of the most frequently affected organs.
Liver involvement associated with the administration of immunotherapy is known as immune-mediated hepatitis (IMH), whose incidence and clinical characteristics have been described by different authors. It often presents as mild elevations of aminotransferase levels, seen in routine blood tests, that spontaneously return to normal, but it can also manifest as severe transaminitis, possibly leading to the permanent discontinuation of treatment.
The aim of the following review was to describe the most up-to-date concepts regarding the epidemiology, diagnosis, risk factors, and progression of IMH, as well as its incidence in different types of common cancers, including hepatocellular carcinoma. Treatment recommendations according to the most current guidelines are also provided.
La inmunoterapia ha revolucionado el tratamiento oncológico en los últimos años, los inhibidores de puntos de control inmunitario o «checkpoint» (ICP) son anticuerpos monoclonales que bloquean los reguladores a la baja de la inmunidad potenciando la inmunidad anti-cáncer del huésped, esta activación del sistema inmune conduce al desarrollo de diversos eventos adversos inflamatorios, siendo el hígado uno de los órganos más frecuentemente afectados1. El daño hepático secundario a la administración de inmunoterapia se conoce como hepatitis inmunomediada (HIM), se presenta en aproximadamente el 15% de los pacientes1–7, y se caracteriza por elevación de aminotransferasas que aparece en la analítica de rutina usualmente en el tercer ciclo de tratamiento8,9. El espectro de la HIM varía desde elevaciones leves en las aminotransferasas que regresan a la normalidad de forma espontánea hasta elevaciones de aminotransferasas mayores a 20 veces el límite superior de la normalidad (LSN), que representan un riesgo para la vida. El manejo de los pacientes con HIM se establece en función de la gravedad, requiriendo incluso la suspensión del tratamiento en los casos graves. Con la reciente aprobación de nuevos tratamientos oncológicos se espera un aumento en los casos de HIM, lo que lleva a la necesidad de establecer pautas de tratamiento adecuadas utilizando escalas de gravedad que evalúen con mayor precisión la función hepática, sobre todo en aquellos pacientes con enfermedad hepática subyacente en quienes las escalas de evaluación de gravedad actuales podrían sobreestimar la gravedad del daño hepático. El objetivo es describir los conceptos más actuales sobre la epidemiología, el diagnóstico, los factores de riesgo y la evolución de la HIM, así como la incidencia de esta en los diferentes tipos de cáncer más frecuentes incluyendo el carcinoma hepatocelular (CHC) y algunas recomendaciones respecto al tratamiento de acuerdo con las guías más actuales.
Concepto de inmunoterapia en cáncerEl cáncer es considerado como una enfermedad del genoma. Los principales mecanismos involucrados en la división celular y la replicación del ADN son susceptibles a errores que pueden comprometer la integridad genética dando como resultado el desarrollo de células neoplásicas10,11. Existen mecanismos supresores de tumores intrínsecos y extrínsecos que tienen como finalidad el reconocimiento y la eliminación de las células malignas12. Las células del sistema inmune innato y adaptativo tienen la capacidad de eliminar a las células neoplásicas infiltrándose en el microambiente tumoral (TME, por sus siglas en inglés, Tumor microenvironment) e identificando a las células tumorales mediante el reconocimiento de antígenos asociados a tumores (TAA, por sus siglas en inglés, Tumor-associated antigens)12–14. La inmunoterapia tiene como objetivo potenciar los mecanismos inmunológicos para eliminar a las células malignas14. Los ICP son anticuerpos monoclonales que aumentan la inmunidad anti-cáncer mediante el bloqueo de los reguladores a la baja de la inmunidad tales como: la proteína asociada a linfocitos T citotóxicos 4 (CTLA-4), la proteína de muerte celular programada 1 (PD-1) y el ligando 1 de muerte programada (PD-L1), lo cual conduce a una mejoría de la función de las células T y recuperación de la actividad anti-tumoral del huésped1.
Proteína asociada a linfocitos T citotóxicosLa proteína asociada a linfocitos T citotóxicos 4 (CTLA-4) fue el primer punto de control inmunitario identificado15 el cual se expresa principalmente en las células T, sus ligandos CD80 y CD86 se encuentran en la superficie de las células presentadoras de antígenos (CPA) teniendo afinidad a ambas proteínas homologas (CD28 y CTLA-4). Dependiendo del receptor, la interacción de estos ligandos da como resultado una respuesta coestimuladora o coinhibidora (dependiente de CD28 y CTLA-4, respectivamente)16,17. Al unirse a sus ligandos, CTLA-4 se fosforila para activar las vías de la fosfoinosítida 3-quinasa (PI3K, por sus siglas en inglés, Phosphoinositide 3-kinases) lo cual conduce a dos eventos canónicos: 1) la desfosforilación de la cadena CD3ζ, limitando la señalización del receptor de célula T (TCR, por sus siglas en inglés, T-cell receptor) y 2) la inhibición de la vía de transcripción de la IL-2, lo cual disminuye la diferenciación y activación de linfocitos T18–20.
Proteína de muerte celular programada 1 y el ligando 1 de muerte programadaLa PD-1 se expresa principalmente en las células T activadas tanto por la vía TCR como por la estimulación de citocinas como: IL-2, IL-7, IL-15 e IL-2121,22. La unión de PD-1 con sus ligandos en las CPA desencadena una respuesta anérgica con producción deficiente de citocinas pro-inflamatorias, así como una menor sobrevida de las células inmunitarias mediante la disminución de la transcripción de proteínas de supervivencia celular como Bcl-XL21. La interacción de PD-1 y el PD-L1 es uno de los mecanismos tumorales de inmuno-evasión más importantes13,23. Debido a la activación del sistema inmune, los ICP pueden producir una amplia variedad de efectos adversos inflamatorios denominados eventos adversos inmunomediados (irAE, por sus siglas en inglés) que pueden afectar a casi cualquier órgano, especialmente la piel, el hígado, el sistema endocrino y el tracto gastrointestinal24,25.
Hepatitis inmunomediadaConceptoEl hígado es uno de los órganos más frecuentemente afectados en la inmunoterapia para el cáncer, probablemente como consecuencia de su particular microambiente inmunológico. El daño hepático ocasionado por el tratamiento con ICP se denomina «daño hepático inmunomediado ocasionado por ICP» (ILICI, por sus siglas en inglés) o HIM1. Es un tipo único de lesión hepática inducida por medicamentos (DILI, por sus siglas en inglés)24, distinto al DILI directo o idiosincrático, y es secundario a la acción del fármaco en el sistema inmune9. La patogénesis de la HIM parece tener un origen multifactorial, en general, la activación inmune inducida por el ICP conlleva no solo a una respuesta anti-tumoral mediada por células T, sino también a una pérdida de la tolerancia periférica a las células del paciente26. Se ha propuesto que las células T activadas como consecuencia de la administración de ICP, son secuestradas por el hígado mediante de la unión de la integrina α4β1 y LFA-1 expresadas por las células T CD8+ activadas, con las moléculas de adhesión VCAM-1 e ICAM-1, respectivamente (expresadas por las células endoteliales y de Kupffer de los sinusoides hepáticos). En el sinusoide hepático, las células T activadas inducen la expresión y la secreción de TNF-α por las células de Kupffer a través de la activación de Fas por Fas ligando y la secreción de IFN-gamma, este aumento en la secreción de TNF-α induce la apoptosis de los hepatocitos mediada por Fas e IFN-gamma27.
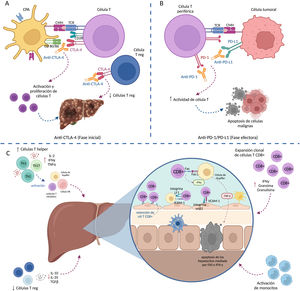
La figura 1, describe los eventos fisiopatológicos asociados con el desarrollo de HIM1,27–29. La HIM se presenta con mayor frecuencia como daño hepatocelular, con elevación de alanina aminotransferasa (ALT) o aspartato aminotransferasa (AST) con o sin elevación de bilirrubina8, aunque en algunos pacientes puede presentarse como daño colestásico o mixto24, aparece usualmente entre las 6 a 14 semanas después del inicio del tratamiento con ICP lo que suele corresponder con uno a 3 ciclos de tratamiento8,9. La secuencia de eventos fisiopatológicos recogidos en la figura 1 son:
A) Fase inicial: el bloqueo de CTLA-4 (expresado en las células T y células T reg) contrarresta la inhibición de la respuesta inmune, conduciendo a la activación y a la proliferación de las células T, y reduciendo el número de células T reg en el TME.
B) La unión de PD-1 (expresado en las células T periféricas) a PD-L1 (expresado por las células tumorales y las células inmunes) regula a la baja la actividad de la célula T (evasión inmune), por lo que el bloqueo con anti-PD1/PD-L1 aumenta la actividad de la célula T destruyendo las células tumorales.
C) Mecanismos que contribuyen al desarrollo de HIM: 1) expansión de células T cooperadoras (Th1 y Th17), 2) disminución de células T reguladoras, 3) activación de monocitos, 4) expansión clonal de células T CD8+ y 5) retención de T CD8+ activadas en el hígado. La retención de T CD8+ conduce a la secreción de IFN gamma por las células T CD8+ mediada por la interacción Fas/FasL que induce la secreción de TNF-α por las células de Kupffer que conlleva a la apoptosis de los hepatocitos.
EstadificaciónLas elevaciones leves en ALT o AST pueden ser transitorias y regresar a la normalidad de forma espontánea a pesar de continuar con el tratamiento, este fenómeno se denomina «adaptación», es por esto que la mayoría de los casos de elevación leve (ALT>1-3 veces el LSN) y asintomática de transaminasas sin elevación de la bilirrubina total, no representan casos clínicamente significativos de HIM y son más adecuadamente denominados «elevaciones en las transaminasas séricas»24.
De acuerdo con la Sociedad Europea para la Oncología Médica (ESMO), el Grupo de Trabajo para el Manejo de la Toxicidad de la Sociedad para la Inmunoterapia del Cáncer (SITC) y los Criterios de Terminología Común para los Eventos Adversos (CTCAE), la HIM se clasifica en 4 grados dependiendo del nivel de elevación de transaminasas y bilirrubina total (tabla 1)8,30,31. Esta escala de gravedad es la que tradicionalmente se ha utilizado en los ensayos clínicos llevados a cabo en oncología, por lo que está globalmente aceptada como útil. Sin embargo, dista notablemente de ser una escala precisa en la determinación de la gravedad de un proceso inflamatorio hepático. En primer lugar, no considera el tiempo de protrombina o el INR en la evaluación de la gravedad de la HIM, parámetro fundamental en la evaluación de la función hepática y clave en la decisión terapéutica como se describe en este apartado. En segundo lugar, desliga la elevación de bilirrubina de la elevación de transaminasas en grado 4 (según su escala). Este hecho sobrevalora la elevación de las transaminasas como marcador de gravedad del cuadro, puesto que la elevación aislada de transaminasas no traduce a disfunción hepática. Por lo descrito, entre otros motivos que iremos desarrollando en este artículo, es probable que CTCAE no deba ser la piedra angular sobre la que debe sustentarse el tratamiento de estos pacientes.
IncidenciaLa HIM es el tercer irAE más frecuente, después de la toxicidad dermatológica (44-68%) y gastrointestinal (35-50%)32. Se presenta en hasta el 3-16% de los pacientes durante el tratamiento con ICP en monoterapia2–7, mientras que la incidencia de elevaciones de transaminasas (AST o ALT) grado 3 o superior varia del 0 al 6% con el tratamiento anti-PD-1 o anti-PD-L12,6,7, y puede aumentar hasta el 12% con anti-CTLA-45. Los inhibidores de CTLA-4 (ipilimumab y tremelimumab) presentan las mayores tasas de hepatotoxicidad, mientras que la monoterapia con anti-PD-1 (nivolumab y pembrolizumab) tiene la incidencia de HIM más baja26,33. Se ha reportado que la incidencia de elevación de aminotransferasas (AST o ALT) es mayor en pacientes que reciben tratamiento combinado (anti-PD-1 o anti-PD-L1+anti-CTLA-4), con incidencias que varían desde el 9 al 17%4,7,34, aunque en algunas series de pacientes que recibieron tratamiento combinado en tumores no hepatocarcinoma, se han reportado incidencias de hasta el 37%35. Una reciente revisión sistemática y metaanálisis, reportó una incidencia de elevación de transaminasas de cualquier grado del 12% y del 3.5% para elevaciones de transaminasas grado 3 o superior en pacientes con inmunoterapia combinada36. La insuficiencia hepática aguda grave y la muerte son poco frecuentes, con una incidencia del 0.4%, particularmente con inhibidores de CTLA-437.
Historia naturalEl espectro clínico de la HIM varia desde elevaciones leves de las aminotransferasas clínicamente asintomáticas hasta la insuficiencia hepática aguda grave24. El cuadro clínico más frecuente es una hepatitis asintomática (46%)38, con elevación de transaminasas objetivada en la analítica de rutina realizada antes de cada ciclo de tratamiento26, regularmente se presenta entre la 6-14 semana después del inicio del tratamiento con ICP, lo que suele corresponder a 1-3 ciclos de tratamiento8,9. En un reciente estudio retrospectivo que incluyó 164 pacientes, la media de tiempo de diagnóstico de la hepatitis fue de 61 días38. Un porcentaje considerable de pacientes pueden presentar fiebre/anorexia (17.1%), náusea/vómito (14%), malestar general, dolor abdominal en cuadrante superior derecho o lumbosacro (11.6%), ictericia, coluria, anorexia o aparición de hematomas con mínimos impactos o mialgias/artralgias26,38. Parámetros de laboratorio como la bilirrubina total, el tiempo de protrombina y el factor V aportan información pronóstica30. La HIM usualmente resuelve en 4-6 semanas con el tratamiento adecuado30. En un estudio retrospectivo de 6 instituciones internacionales y 169 pacientes, de los cuales 30% tuvieron HIM grado 2 y 45% grado 3, la media de tiempo para lograr mejoría de un grado fue de 13 días y de 52 días para lograr la resolución completa, la mayoría de estos pacientes recibieron tratamiento con glucocorticoides (92%), casi en una cuarta parte de los pacientes (23%) se requirió de una segunda línea de inmunosupresión, 5 pacientes fallecieron por complicaciones de hepatitis o del tratamiento de la misma y en más de la mitad de los pacientes (58.6%) no se logró restablecer el tratamiento37,38.
Hepatitis inmunomediada en tumores sólidos no carcinoma hepatocelularMelanomaLa inmunoterapia es el tratamiento estándar del melanoma no resecable estadios III y IV. La primera línea de tratamiento incluye la administración de un anti-PD-1 (nivolumab o pembrolizumab) en monoterapia, o la combinación de anti-PD-1/anti-CTLA-4 (nivolumab+ipilimumab) y en aquellos con mutación BRAF-V600, está indicada la inhibición de BRAF (vemurafenib, dabrafenib o encorafenib) en combinación con un inhibidor MEK (cobimetinib, trametinib o binimetinib)39. Ipilimumab en monoterapia había sido el estándar de tratamiento del melanoma avanzado hasta hace algunos años. La incidencia de alteración de las enzimas hepáticas de cualquier grado con el tratamiento del melanoma metastásico con ipilimumab en monoterapia a dosis de 3mg/kg es del 3.8%40, mientras que aumenta hasta el 16% cuando la dosis es de 10mg/kg, en su mayoría grados 3 y 4 (37 y 50%, respectivamente)5. La frecuencia de elevación de aminotransferasas (AST o ALT) con nivolumab en monoterapia es del 3.8% y aumenta hasta el 15 al 17% cuando se administra en combinación con ipilimumab 34. La frecuencia de HIM reportada en el tratamiento con pembrolizumab (10mg/kg/cada 3 semanas) es del 1.8% 41.
Cáncer de pulmónEl cáncer de pulmón es el segundo cáncer más común a nivel mundial y la causa más frecuente de mortalidad por cáncer42, el subtipo más común (85%), corresponde al cáncer de pulmón de células no pequeñas (NSCLC, por sus siglas en inglés)43. El enfoque del tratamiento del NSCLC, depende del estadio, histología, alteraciones genéticas y condiciones del paciente, alrededor del 30% de los pacientes tendrán una enfermedad localmente avanzada (T3-T4, N2-N3, estadio IIIA-C)44. En pacientes con enfermedad avanzada sin alteraciones genéticas que puedan ser objetivo de una terapia dirigida (EGFR, ALK, RET, BRAF, ROS1, NTRK, MET y KRAS), el estándar de tratamiento es la combinación de quimio-inmunoterapia con anti-PD-1 (nivolumab o pembrolizumab) o anti-PD-L1 (atezolizumab) en monoterapia o en combinación con un anti-CTLA-4 (ipilimumab/nivolumab)43. La incidencia de alteración de las aminotransferasas (AST o ALT) de cualquier grado con la administración de pembrolizumab para el tratamiento del NSCLC avanzado varía del 6 al 7%, mientras que la incidencia de hipertransaminasemia grado 3 o superior es del 1%45, y solo en el 0.6 al 1% cumplen criterios de HIM46, en cambio, hasta el 10% de los pacientes tratados con atezolizumab en combinación con carboplatino y paclitaxel presentan hepatitis47. La incidencia de HIM con el tratamiento combinado se ha reportado de hasta el 6% con la administración de nivolumab/ipilimumab, con una media de inicio de 3.6 meses y con resolución en hasta el 75% de los casos48.
Carcinoma colo-rectalEl carcinoma colo-rectal (CRC, por sus siglas en inglés) es el cuarto cáncer más común a nivel mundial42. La inmunoterapia con pembrolizumab (anti-PD-1) es el tratamiento de primera línea para el CRC metastásico con altos niveles de inestabilidad microsatélite y deficientes en reparación de desajustes, denominados dMMR/MSI-H por sus siglas en inglés49,50, este grupo de pacientes representa el 15% de todos los CRC51.
En el reciente estudio fase III KEYNOTE-177 (pembrolizumab vs quimioterapia), la administración de pembrolizumab en pacientes con CRC metastásico dMMR/MSI-H, demostró una mejoría en la supervivencia libre de progresión, la incidencia de elevación de AST de cualquier grado en este estudio fue del 10%, solo en el 1% de los casos fue grado 3, mientras que hasta el 3% de los pacientes presentaron HIM52. El bloqueo dual nivolumab/ipilimumab también ha demostrado beneficio clínico en este grupo de pacientes, con una mayor incidencia de eventos adversos hepáticos, siendo del 15% para cualquier grado y del 4% para los grados 3-4, con una media de inicio de 6.4 semanas53.
Hepatitis inmunomediada en el tratamiento del carcinoma hepatocelularEl CHC es el séptimo cáncer más común en el mundo42,54 y la tercera causa más frecuente de mortalidad por cáncer55. Aproximadamente el 60% de los pacientes son diagnosticados en estadios avanzados56. Con el advenimiento de las nuevas terapias sistémicas, la supervivencia de los pacientes en estadios avanzados ha mejorado significativamente55.
La inhibición de la angiogénesis es un componente importante en el tratamiento del CHC, dentro de los fármacos que inhiben el factor de crecimiento endotelial vascular (VEGF), se encuentran: los inhibidores de tirosin-kinasa (TKI) como el sorafenib, lenvatinib, cabozantinib o regorafenib y los anticuerpos como bevacizumab y ramucirumab57. Se ha demostrado que los TKI se asocian con un aumento en el riesgo de elevación de AST, ALT, FA y bilirrubina de cualquier grado (RR que varía del 1.2 al 1.57) y con elevaciones de AST y ALT grado 3 o 4 (RR: 1.61-1.66)58. Sorafenib, fue la primera terapia dirigida en mostrar eficacia en los pacientes con CHC avanzado59, después de sorafenib, diversos agentes han sido aprobados como tratamiento de primera línea (lenvatinib) y segunda línea (cabozantinib, regorafenib, ramucirumab y pembrolizumab)60.
La alteración de la analítica hepática es frecuente en el tratamiento sistémico del CHC, la incidencia de elevación de aminotransferasas (AST o ALT) de cualquier grado con la administración de sorafenib para el tratamiento del CHC avanzado ha sido reportada del 5 al 17% y del 2 al 8% para los grados 3 o 47,61–63, además la incidencia de elevación de bilirrubina se ha reportado del 7.8 al 14%7,61,63. La frecuencia de elevación de AST con la administración de lenvatinib es similar a la de sorafenib siendo del 14% para elevaciones de cualquier grado y del 5% para el grado 3 o superior 63. En la actualidad las combinaciones atezolizumab/bevacizumab (anti-PD-L1/inhibidor de VEGF) y durvalumab/tremelimumab (anti-PD-L1/anti-CTLA-4), son el tratamiento de primera línea del CHC avanzado (estadio BCLC-C)64. Ambos tratamientos han demostrado mejorar la supervivencia de forma significativa en comparación con sorafenib7,61, y en el caso de atezolizumab/bevacizumab también la supervivencia libre de progresión y la tasa de respuesta al tratamiento61. Hasta el 20% de los pacientes tratados con atezolizumab/bevacizumab presentan elevaciones en las aminotransferasas (AST o ALT) de cualquier grado, mientras que solo el 4% presentan elevaciones de AST grado 3 o superior61,65. La incidencia de elevación de aminotransferasas (AST o ALT) con la administración de durvalumab/tremelimumab es del 9.3 al 12.4% para transaminasemia de cualquier grado y del 2.6 al 5.2% para las elevaciones de transaminasas grado 3 o 47. La tabla 2 resume la incidencia de elevación de aminotransferasas con los distintos tratamientos utilizados en el CHC y otros tumores sólidos66–69.
Incidencia de elevación de aminotransferasas en el tratamiento oncológico
| Tipo | Grupo | Fármaco | Indicación (1) | Hipertransaminasemia(AST o ALT) |
|---|---|---|---|---|
| Inhibidores de la VEGF | TKI | Sorafenib | CHC | 5-17% (7,61-63) |
| Lenvatinib | CHC | 14% (63) | ||
| Cabozantinib | CHC | 29-33% (62) | ||
| Regorafenib | CHC | 8-13% (66) | ||
| Anticuerpos | Bevacizumab | CHC | 38% (67) | |
| Ramucirumab | CHC | 51% (68) | ||
| Inhibidores de checkpoint | Anti-PD-1 (proteína de muerte celular programada-1) | Nivolumab | Melanoma, NSCLC, CEG, CCR, CRC, LH | 3.8-12% (4,34) |
| Pembrolizumab | Melanoma, NSCLC, CRC, LH, CEG, CHC, Cáncer de endometrio o cervical | 1.8-7% (41,45) | ||
| Anti-PD-L1 (ligando de muerte celular programada-1) | Atezolizumab | CHC0,0NSCLC0,0 melanoma, cáncer urotelial | 13% (65) | |
| Durvalumab | CHC, NSCLC | 11.3-14.4% (7) | ||
| Anti-CTLA-4 (Antígeno-4 asociado al linfocito T citotóxico) | Ipilimumab | Melanoma, CCR, CRC, CHC, NSCLC, CEG | 3.8% (dosis de 3mg/kg) (40)16% (dosis de 10mg/kg) (5) | |
| Tremelimumab | CHC | 55-70% (69) | ||
| Combinaciones | Ipilimumab+nivolumab | Melanoma, NSCLC, CRC, CEG | 6-17% (4,34,48) | |
| Atezolizumab+bevacizumab | CHC | 14-20% (61,65) | ||
| Durvalumab+tremelimumab | CHC | 9.3-12.4% (7) |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; CCR: carcinoma de células renales; CEG: cáncer esófago-gástrico; CHC: carcinoma hepatocelular; CRC: carcinoma colo-rectal (acrónimo en inglés); LH: linfoma Hodgkin; NSCLC: cáncer de pulmón de células no pequeñas (acrónimo en inglés); TKI: inhibidores de la tirosina cinasa; VEGF: factor de crecimiento endotelial vascular (acrónimo en inglés).
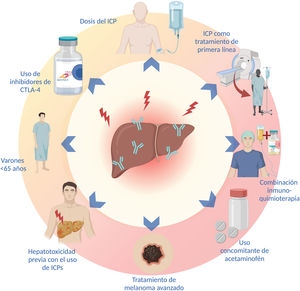
El sexo, la edad, el tipo y la dosis de ICP, los tratamientos combinados, el uso concomitante de otros fármacos y el tipo de malignidad son algunos factores que aumentan el riesgo de presentar hepatotoxicidad asociada al tratamiento con ICP. Se ha reportado que la HIM es más frecuente en mujeres (p=0.038)70, sin embargo, otros estudios han encontrado una mayor incidencia de hepatotoxicidad en varones menores de 65 años71. En efecto, los pacientes <65 años parecen tener casi 5 veces más riesgo de HIM en comparación con pacientes mayores de 70 años, probablemente asociado con la inmunosenescencia que caracteriza a los pacientes mayores71. Por otro lado, no se ha demostrado que los pacientes con enfermedades inmunes pre-existentes tengan una mayor frecuencia de HIM en comparación con la población general72.
Se ha descrito que la incidencia de HIM es mayor con la administración de inhibidores de CTLA-4 (ipilimumab y tremelimumab)26. En una reciente revisión sistemática y metaanálisis, se demostró que los inhibidores de CTLA-4 se asocian con mayor riesgo de hepatotoxicidad de cualquier grado (OR: 1.24; IC 95%: 0.75-2.05; p=0.39) y de hepatotoxicidad grado 3 o superior (OR: 1.93; IC 95%: 0.84-4.44; p=0.12)33. A su vez, el uso de inhibidores PD-1 se ha asociado con mayor incidencia de irAE grado 3 o superior en comparación con la inhibición de PD-L1 (OR: 1.58; IC 95%: 1.00-2.54)2. Además del tipo de ICP, el riesgo de HIM se correlaciona con la dosis del medicamento, se ha demostrado que la incidencia de irAE es mayor con dosis más elevadas de ipilimumab5,40. Los pacientes tratados con combinaciones de ICP y aquellos que reciben ICP como tratamiento de primera línea también presentan mayor riesgo de HIM (p<0.001 y p=0.018, respectivamente)70.
Una reciente revisión sistemática y meta-análisis demostró que la combinación inmuno-quimioterapia presenta mayor incidencia de irAE que las combinaciones de anti-PD1 o anti-PD-L1 con inhibidores de VEGF y las combinaciones de ICP (anti-PD1 o anti-PD-L1 con anti-CTLA-4), hasta el 25% de los pacientes tratados con combinaciones de inmuno-quimioterapia presentan elevación de las aminotransferasas de cualquier grado, aunque solo el 2-4% son grado 3 o superior36. Además del tratamiento combinado, el uso de fármacos como el acetaminofén, se ha asociado con dos veces mayor riesgo de hepatotoxicidad71.
El tipo de malignidad parece tener un impacto en el riesgo de desarrollar HIM, se ha reportado que existe una mayor probabilidad de desarrollar hepatotoxicidad en el tratamiento del melanoma avanzado en comparación con otros tipos de cáncer (OR: 5.66; IC 95%: 4.39.7.29; p<0.00001 vs. OR: 2.71; IC 95%: 2.04-3.29; p<0.00001)33. No se ha demostrado que la presencia de una enfermedad hepática subyacente o el CHC confieran un mayor riesgo de desarrollar HIM26,73,74, aunque sí se ha demostrado un aumento en el riesgo de desarrollar ascitis y encefalopatía en pacientes con Child-Pugh-B≥7 puntos74.
El riesgo de presentar un irAE es mayor en pacientes que han presentado irAE con anterioridad, sin embargo, esto no predice la aparición del mismo irAE al cambiar el tipo de ICP26,72, la tasa de recurrencia del mismo irAE asociado con la descontinuación del tratamiento después de reiniciar el mismo ICP es del 28.8%, por lo que reiniciar mismo el tratamiento puede ser considerado en pacientes seleccionados con una monitorización adecuada75. En la figura 2 se enlistan los factores de riesgo para el desarrollo de hepatotoxicidad más frecuentes.
Diagnóstico y diagnóstico diferencialLa analítica hepática es la prueba de primera línea para el diagnóstico de HIM, todos los pacientes que recibirán tratamiento con ICP deben de ser evaluados de manera rutinaria para detectar el desarrollo de hepatitis con transaminasas séricas, FA y bilirrubina antes de cada ciclo de tratamiento30, en los estudios de imagen (tomografía computada) de pacientes con elevación marcada de las transaminasas (ALT>1000UI/l), se pueden encontrar hallazgos inespecíficos como hepatomegalia leve, edema y linfadenopatías periportales76. Debido a la falta de marcadores específicos, el diagnóstico de exclusión es crítico. Se deben excluir otras causas de daño hepático como el uso de medicamentos hepatotóxicos, consumo de alcohol, hepatitis virales, enfermedades metabólicas, enfermedad vascular y progresión tumoral8,30,77.
Las pruebas específicas incluyen: serologías para virus hepatotropos (hepatitis A, B, C y E) y no hepatotropos (Epstein-Barr, citomegalovirus y herpes simple), estudios de imagen para evaluar el árbol biliar y la vasculatura hepática como el ultrasonido hepático o la tomografía computada y/o resonancia magnética en casos de elevación de FA y/o bilirrubina, la tomografía computada puede ser de utilidad en la evaluación de la progresión tumoral (metástasis hepáticas)78.
Aunque la mayoría de las guías recomiendan la biopsia hepática, actualmente no es recomendada como estrategia de cuidado estándar debido a que proporciona hallazgos inespecíficos, sin embargo, pudiera ser de utilidad en el diagnóstico diferencial de hepatitis grave8,30.
En pacientes con tratamiento anti-PD-1/PD-L1, el hallazgo histológico más frecuente es la hepatitis lobular, con infiltrados inflamatorios consistentes en linfocitos e histiocitos y solo algunas células plasmáticas, más de la mitad de los pacientes pueden presentar daño al conducto biliar, con colangitis linfocítica o distrofia ductal79, la necrosis confluente es poco frecuente en la hepatitis por anti-PD-1 (nivolumab)80. Por otro lado, en la biopsia de pacientes con hepatitis por anti-CTLA-4 (ipilimumab) se observa con mayor frecuencia una hepatitis granulomatosa asociada con actividad lobular inflamatoria (panlobular y en zona 3) y necrótica, incluyendo granulomas con anillo de fibrina y endoteliosis de la vena central76,79,81.
La HIM comparte algunas características histológicas con el DILI y la hepatitis autoinmune, como el daño lobular y la inflamación portal, sin embargo; en la hepatitis por ICP la necrosis confluente es poco frecuente en comparación con la hepatitis autoinmune y el DILI. Además, la plasmocitosis característica de la hepatitis autoinmune y la infiltración eosinofílica o los tapones biliares observados en DILI son menos prominentes en la HIM.
En la inmunotinción de pacientes con hepatitis por ICP, se puede observar la presencia de una gran cantidad de linfocitos CD3+ y CD8+, mientras que la cantidad de células B CD20+ y células T CD4+ es menor en comparación con la hepatitis autoinmune o el DILI80.
TratamientoConceptos generales sobre terapéutica en hepatitis inmunomediadaEl manejo de los pacientes que presentan HIM se estructura en función de la gravedad y habitualmente, la gravedad del cuadro se titula en función del CTCAE. Pero tal y como se ha mencionado previamente, la falta de precisión de la gravedad de la que adolecen las guías actuales hace más oportuno el uso de la ley de Hy en el diagnóstico de la HIM grave. La ley de Hy se ha demostrado como una herramienta con alta sensibilidad y especificidad en la predicción de hepatotoxicidad mediada por fármacos. Esta ley está compuesta por 3 puntos: a) Una mayor incidencia de disfunción hepática en pacientes que presenten elevación de ALT o AST 3 veces o más por encima del LSN en pacientes tratados con fármacos potencialmente hepatotóxicos respecto a pacientes tratados con fármacos no hepatotóxicos o placebo; b) Pacientes que presenten ALT o AST>3×LSN junto con elevación de bilirrubina total >2LSN sin evidencia de colestasis (definida por elevación de FA); c) Ausencia de cualquier causa alternativa que pueda explicar la elevación conjunta de ALT o AST y bilirrubina total. La presencia de estos puntos indica una lesión hepatocelular potencialmente muy grave, asociándose a una incidencia de muerte/necesidad de trasplante hepático de alrededor del 10%82. Considerando lo descrito, probablemente es más adecuado utilizar los criterios de gravedad de la US Drug-Induced Liver Injury Network83 o los criterios del International DILI Expert Working Group84, mucho más adecuadas para la valoración de la gravedad del daño hepático (tabla 3).
Criterios de gravedad de la HIM
| US Drug-induced Liver Injury Network (DILIN) | |
| 1 Leve | Elevación de la ALT y/o FA, pero bilirrubina total <2.5mg/dl e INR<1.5 |
| 2 Moderado | Elevación de la ALT y/o FA y bilirrubina total ≥2.5mg/dl o INR≥1.5 |
| 3 Moderado/grave | Elevación de la ALT, FA, bilirrubina total, y/o INR y necesidad de ingreso hospitalario o prolongación del ingreso como consecuencia del DILI |
| 4 Grave | Elevación de la ALT y/o FA y bilirrubina total ≥2.5mg/dl y al menos uno de los siguientes:Insuficiencia hepática (INR≥1.5, ascitis o encefalopatía hepática)Fracaso de órganos secundario a DILI |
| 5 Fatal | Muerte o trasplante secundario a DILI |
| International DILI Expert Working Group | |
| 1 Leve | ALT≥5×LSN o FA ≥ 2×LSN y bilirrubina total <2×LSN |
| 2 Moderado | ALT≥5×LSN o FA ≥ 2×LSN y bilirrubina total <2×LSN o síntomas relacionados con el cuadro inflamatorio hepático |
| 3 Grave | ALT≥5×LSN o FA ≥ 2×LSN y bilirrubina total ≥2×LSN o síntomas relacionados con el cuadro inflamatorio hepático y al menos uno de los siguientes criterios:INR≥1.5Ascitis y/o encefalopatía hepática, duración <26 semanas y ausencia de cirrosisFallo orgánico secundario a DILI |
| 4 Fatal/trasplante | Muerte o trasplante secundario a DILI |
ALT: alanina aminotransferasa; DILI: lesión hepática inducida por fármacos (acrónimo en inglés); FA: fosfatasa alcalina; HIM: hepatitis inmunomediada; INR: razón normalizada internacional (acrónimo en inglés); LSN: límite superior de la normalidad.
Como se ha descrito previamente, la escala CTCAE (tabla 1) carece de la precisión suficiente para una adecuada valoración de la gravedad. Sin embargo, su amplia difusión e implantación han hecho que las recomendaciones de tratamiento se hagan, en general, en base a estos criterios.
Los pacientes que presentan HIM grado 1 no requieren un tratamiento específico, ni tampoco la suspensión del tratamiento oncológico77. Estos pacientes pueden ser manejados de manera ambulatoria realizando controles analíticos quincenales78,85. Si bien en el grado 1 existe un amplio consenso, las recomendaciones en la HIM grado 2 varían sustancialmente entre grupos y guías clínicas, fundamentalmente por la escasez de evidencia científica. Por un lado, algunos grupos proponen realizar control clínico y analítico periódico (cada 3 a 5 días) sin iniciar tratamiento inmunosupresor o considerar el uso de prednisona (0.5-1mg/kg/día)35,77,85, mientras que otros recomiendan la iniciar el tratamiento de la forma más precoz posible78,86. A pesar de estas divergencias, la evidencia —aunque todavía escasa— apunta a que estos pacientes presentan una buena evolución clínica sin iniciar manejo inmunosupresor35,87.
Considerando esta variabilidad, aquí entra en juego la importancia de una correcta evaluación de la situación hepática, más allá de lo que recoge la escala CTCAE. De hecho, se podría recomendar un control bioquímico estrecho en los pacientes que presenten HIM grado 2 sin disfunción hepática. Este control clínico y analítico debería ser periódico y con una frecuencia semanal, iniciando tratamiento inmunosupresor en aquellos pacientes que presenten deterioro de la función hepática durante el seguimiento.
El manejo de los pacientes con HIM grado 3 o superior es complejo. Actualmente, las guías clínicas de oncología y los protocolos de actuación recogidos en la gran mayoría de los ensayos clínicos indican invariablemente iniciar tratamiento inmunosupresor en todos los pacientes que presenten grado 3 o superior. Cabe recordar que HIM grado 3 no implica disfunción hepática, puesto que ya se consideraría como tal un paciente que presente unas transaminasas de alrededor de 200UI/l (5 veces el límite superior de la normalidad, asumiendo el límite en 40UI/l. Este valor puede variar en función del laboratorio), aunque no presente disfunción hepática. Estas cifras de transaminasas reflejan una situación de necroinflamación hepática, pero no necesariamente una urgencia médica. De hecho, estos valores no son infrecuentes en la consulta diaria de hepatología, sin requerir un manejo terapéutico urgente en muchos de los casos. Es por esto y por la rigidez de las recomendaciones de los ensayos de oncología por lo que todos los pacientes eran invariablemente tratados y, por ende, no se disponía hasta ahora, de suficiente información respecto a la evolución de los pacientes no tratados. Sin embargo, esto ha cambiado en los últimos años. En un estudio retrospectivo publicado en el año 2020 se puso de manifiesto que los pacientes con HIM grado 3 y 4 no tratados tenían una evolución comparable a los tratados88, en este trabajo se incluyeron 100 pacientes, en los cuales se diagnosticó HIM grado 3 en 85 y grado 4 en 15. Del total de pacientes, 67 fueron tratados con corticoterapia mientras los 33 restantes no lo fueron. No se identificaron diferencias en ninguna característica clínica, terapéutica ni demográfica. La única diferencia observada de manera estadísticamente significativa fue que los pacientes que no recibieron tratamiento se recuperaron antes —entendiendo como recuperación alcanzar un valor de ALT <a grado 1— que aquellos pacientes que recibieron corticoides. Por estos y otros datos, parece razonable suspender temporalmente el tratamiento oncológico, no iniciar tratamiento inmunosupresor y realizar controles periódicos cada 48-72h en aquellos pacientes en buenas condiciones generales, sin compromiso orgánico y sin disfunción hepática35,77,85,89.
En aquellos pacientes con INR>1.5, bilirrubina ≥2.5mg/dl, que presenten deterioro analítico progresivo o que no presenten una clara mejoría tras 7 días de monitorización, se debe iniciar tratamiento inmunosupresor.
La piedra angular del tratamiento de HIM es la corticoterapia. Las dosis recomendadas oscilan entre 0.5 a 1mg/kg/día. A pesar de que diferentes documentos de consenso y guías de manejo ocasionalmente recomiendan hasta dosis de 2mg/kg/día (en HIM grado 4)77, no hay evidencia de que dosis muy elevadas sean eficaces. A este respecto, un pequeño estudio británico en el que se incluyeron 21 pacientes identificó que dosis superiores a 60mg/cada 24h no ofrecían ninguna ventaja respecto a dosis menores, exponiendo además a mayor riesgo de efectos secundarios a los pacientes con dosis más altas90. Además, un estudio reciente de una gran cohorte multicéntrica de pacientes en el que se incluyeron 215 casos de HIM grado 3 o superior mostró no solo que los pacientes que recibían dosis elevadas de corticoides (>1.5mg/kg/día) no presentaban una mejor evolución clínica o mayor velocidad de recuperación, sino que además existía un mayor riesgo de desarrollo de complicaciones infecciosas y de diabetes esteroidea91. Tras el inicio del tratamiento, se puede iniciar la retirada progresiva al objetivar mejoría analítica. Si bien no existe un consenso claro de cómo deben ser retirados los corticoides, se recomienda una retirada progresiva de 10mg semanal hasta la suspensión, que debe llevarse a cabo durante las primeras 4 a 8 semanas85.
Tratamiento en pacientes con carcinoma hepatocelularLa mayor parte de los pacientes con CHC tienen una cirrosis subyacente, hecho relevante de cara a la graduación de la gravedad y, posiblemente, al manejo. Muchos de estos pacientes presentan unos valores de transaminasas basales elevados, por lo que la aplicación estricta de la escala CTCAE puede sobrevalorar la gravedad —con las limitaciones ampliamente descritas en este documento— y, en consecuencia, el manejo terapéutico.
La elección del tratamiento y las dosis son similares a los pacientes con tumores sólidos distintos al CHC. Sin embargo, aunque no existe evidencia suficiente al respecto todavía, parece razonable iniciar tratamiento —y, por lo tanto, no realizar monitorización— en aquellos pacientes que presenten HIM grado 3 o superior, puesto que su reserva funcional hepática basal se ve limitada por la enfermedad hepática subyacente y, por ende, probablemente presenten un mayor riesgo de descompensación.
Pacientes refractarios a tratamiento convencionalNo existe un consenso en la definición de falta de respuesta al tratamiento. En general, se considera HIM refractaria aquella que no presenta mejoría analítica o empeora a pesar del tratamiento esteroideo adecuado. No está claramente definido el tiempo necesario para definir falta de respuesta, oscilando habitualmente entre los 378 y 785 días desde que se inicia el tratamiento corticoideo. Si bien no se dispone de herramientas con capacidad predictiva del fracaso de primera línea, parece que la presencia de una enfermedad hepática subyacente o hiperbilirrubinemia en el momento del diagnóstico de HIM se asocian con mayor riesgo de refractariedad al tratamiento esteroideo92. No parece que el tratamiento oncológico impacte en el riesgo de fracaso terapéutico.
El fármaco más estudiado y del que se dispone de más evidencia como segunda línea es el micofenolato de mofetilo (MMF). El MMF es un profármaco del ácido micofenólico, que actúa inhibiendo la inosina monofosfato deshidrogenasa. Esta enzima es necesaria para la producción de purinas durante la proliferación y es especialmente importante en los linfocitos. La dosis habitualmente utilizada es la misma que en hepatitis autoinmune, es decir, 1g/cada 12h. Un reciente estudio demostró que la adición de MMF al tratamiento esteroideo es capaz de inducir respuesta en más del 80% de los pacientes con hepatitis refractaria a esteroides (ausencia de respuesta clínica y biológica a una dosis de esteroides sistémicos ≥1mg/kg/día)92, las recomendaciones más recientes sugieren iniciar MMF en pacientes con hepatitis persistente grave a pesar de 3 días de tratamiento esteroideo77. Se debe tener en cuenta que un efecto secundario grave del tratamiento es la mielosupresión, por lo que se debe realizar un control analítico estrecho.
Otra alternativa a MMF es el tacrolimus, fármaco cuyo efecto inmunosupresor es consecuencia de la inhibición de la calcineurina, ejerciendo su efecto sobre las células T y B. La evidencia es escasa y mayoritariamente en forma de casos clínicos o series de casos. Se debe titular la concentración plasmática del fármaco para evitar la aparición de efectos secundarios graves, entre los que destaca la nefro y neurotoxicidad. No existe tampoco consenso en cuanto al objetivo de los niveles plasmáticos a alcanzar para potenciar su efecto inmunosupresor minimizando la toxicidad, por lo que en general se sugiere utilizar los mismos límites que se usan en la hepatitis autoinmune.
En aquellos casos refractarios a las segundas líneas habituales o en aquellos que progresan rápidamente a insuficiencia hepática aguda grave, considerando además que habitualmente estos pacientes no son candidatos a trasplante hepático debido a la presencia de una enfermedad oncológica diseminada, se han evaluado otras alternativas terapéuticas. Entre ellas destaca la globulina antitimocítica, tratamiento que se mostró eficaz en una serie de casos clínicos publicados en los últimos años. Si bien no hay una estructura terapéutica establecida, los pacientes fueron tratados con dos ciclos de timoglobulina a razón de 1.5mg/kg93,94. Otra alternativa potencial son los recambios plasmáticos, realizando 5 sesiones de recambio separadas cada una de ellas por un intervalo de 48h95. No obstante, la falta de información sólida en este ámbito traduce que no se puede generalizar una recomendación terapéutica, por lo que la implementación de estas alternativas de tratamiento debe ser considerada con precaución y evaluada de manera individual.
Retratamiento con hepatitis inmunomediada previaAl contrario de la concepción clásica, la recurrencia de HIM en pacientes retratados con inmunoterapia es infrecuente. De hecho, se ha descrito que solo alrededor del 29% de los pacientes desarrollan un nuevo episodio de HIM de cualquier grado tras la reintroducción de la inmunoterapia75. Los regímenes basados en anti-CTLA-4 en inmunoterapia parecen asociarse a un mayor riesgo de recaída, sin embargo, su combinación con anti-PD1/anti-PDL1 no se asocia con mayor riesgo de recidiva. El uso en monoterapia de estos últimos no parece asociarse con mayor riesgo de recurrencia75.
A pesar de lo infrecuente, las guías internacionales recomiendan la suspensión definitiva del tratamiento oncológico en aquellos pacientes que desarrollen grado 3 o superior. En los últimos años se han publicado varios trabajos que confirman que la reintroducción del tratamiento en estos pacientes es segura, con una incidencia de recidiva de HIM en pacientes con HIM grave (grado 3 o superior) comprendida entre el 25 y 35%88. Un estudio retrospectivo llevado a cabo en EE. UU. en el que 31 pacientes con hepatitis grado 3 y grado 4 fueron retratados con inmunoterapia (con el mismo ICP u otro) mostró una incidencia del 26% de recidiva de HIM, siendo la mayoría de ellos grado 3 y apareciendo en una mediana de tiempo de 27 días tras la reintroducción del tratamiento88.
Como particularidad, en este estudio se incluyeron tanto pacientes que habían sido tratados con corticoides como pacientes que no recibieron tratamiento inmunosupresor. En línea con los resultados de este trabajo, se ha publicado recientemente un estudio multicéntrico español96 en el que se describe la recurrencia en aproximadamente el 35% de los pacientes, cifras similares al trabajo previo. Además, en este trabajo se observó una mayor de recurrencia en aquellos pacientes que presentaban un background autoinmune, definido como la presencia de otra enfermedad autoinmunitaria y/o la presencia de anticuerpos antinucleares.
La importancia respecto a la reintroducción de la inmunoterapia no radica únicamente en lo que se puede hacer o no, sino en ofrecer a los pacientes herramientas terapéuticas eficaces en el tratamiento de una enfermedad oncológica que suele encontrarse en estadios avanzados. Si se contraindica el uso de inmunoterapia por haber presentado un episodio de HIM previo, probablemente se limite sustancialmente el arsenal terapéutico para estos pacientes y, por lo tanto, se incrementa el riesgo de progresión de la enfermedad, deterioro de calidad de vida y muerte. En base a lo expuesto, el retratamiento es una opción que debe ser reevaluada en todos los pacientes con HIM, teniendo en cuenta además las alternativas terapéuticas disponibles, la situación oncológica y funcional, así como el deseo del propio paciente.
ConclusionesExisten muchas preguntas por resolver respecto al manejo más adecuado de los efectos secundarios graves en los pacientes sometidos a tratamiento con ICP. Y entre estas cuestiones, como hemos visto, se encuentran algunos tan críticamente importantes como la graduación de la enfermedad, la necesidad o no de tratamiento en función de la gravedad de la toxicidad y la enfermedad de base, la posibilidad de reintroducción de la inmunoterapia después de un acontecimiento adverso grave o el riesgo potencial de recidiva de esta toxicidad. Además, y tal y como hemos visto en esta revisión, la patología de base de los pacientes tratados con inmunoterapia también influirá en el tipo y gravedad de estos efectos secundarios. Pero más allá del desarrollo o no de una HIM, otros aspectos como el riesgo de reactivación del VHB o del VHC (mucho menor este), la potencial reactivación de algunas infecciones latentes como la tuberculosis y la interacción con fármacos indicados por la patología de base de algunos pacientes (inmunosupresores, biológicos y otras terapias) hacen que la complejidad de la inmunoterapia sea cada día mayor, lo que hace que el desafío en el manejo de los EA graves requieren un esfuerzo multidisciplinario y colaborativo, y si es posible, el desarrollo de unidades interdisciplinares que ofrezcan un diagnóstico integral y un manejo rápido y adecuado de estos pacientes. Una educación correcta tanto de los pacientes como de los profesionales implicados en el cuidado de los efectos secundarios relacionados con el tratamiento con ICP, el seguimiento proactivo y un manejo precoz y multidisciplinar de estos efectos se correlacionan con mejores resultados globales para los pacientes, es decir, con menores probabilidades de interrupción del tratamiento inmunoterápico y, finalmente, una mayor posibilidad de supervivencia97.
En resumen, un manejo multidisciplinario con experiencia tanto en el control de las comorbilidades concomitantes como en el manejo de los efectos secundarios, puede incrementar la eficacia global del tratamiento en estos pacientes, para muchos de los cuales la inmunoterapia será una de sus últimas (o la última) alternativa terapéutica98.
FinanciaciónLos autores declaran que no se recibió ningún tipo de financiación para este estudio.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.