Identificar personas con alto riesgo de neoplasia avanzada colorrectal puede ayudar en la prevención de cáncer de colon. Por otro lado, estudios previos han observado que algunos pacientes pueden tener neoplasia avanzada proximal sin hallazgos distales.
ObjetivoDeterminar los factores relacionados a neoplasia avanzada y neoplasia avanzada proximal colorrectal en una población latinoamericana.
Material y métodosEstudio analítico, observacional, transversal y prospectivo. Se incluyó a pacientes sometidos a colonoscopia en el Policlínico Peruano Japonés entre enero y julio del 2012. Se definió neoplasia avanzada como la presencia de lesiones ≥ 10mm en tamaño, con componente velloso o displasia de alto grado o carcinoma. El límite entre el colon proximal y distal fue el ángulo esplénico.
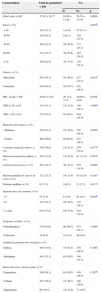
ResultadosSe incluyó a 846 pacientes. Se detectó neoplasia avanzada en 108 pacientes (12.8%). Se detectó neoplasia avanzada proximal en 55 pacientes (6.7%), de los cuales 42 (76.4%) tuvieron el colon distal sin neoplasias. El análisis multivariado encontró como factores relacionados a neoplasia avanzada a la edad, en intervalos 50-59 (p=0.019), 60-69 (p=0.016) y ≥ 70 años (0.002) y el género masculino (p=0.003). Al evaluar neoplasia avanzada proximal, el análisis multivariado encontró a la edad en intervalo de 60-69 años (p=0.039) y la neoplasia avanzada distal (p=0.028) como relacionados. La curva ROC estableció un corte de edad de 60 años para realizar colonoscopia de inicio en lugar de sigmoidoscopia.
ConclusionesLa edad y el género están relacionados con neoplasia avanzada, mientras que la edad y la neoplasia avanzada distal están relacionadas a neoplasia avanzada proximal.
Identifying persons at high risk for advanced colorectal neoplasia can aid in the prevention of colon cancer. Previous studies have shown that some patients can present with proximal advanced neoplasia with no distal findings.
AimsTo determine the factors related to advanced neoplasia and advanced proximal colorectal neoplasia in a Latin American population.
Material and methodsA prospective, cross-sectional, observational, analytic study was conducted. It included patients that underwent colonoscopy at the Policlínico Peruano Japonés within the time frame of January and July 2012. Advanced neoplasia was defined as the presence of lesions ≥ 10mm with a villous component, high-grade dysplasia, or carcinoma. The splenic flexure was the limit between the proximal and distal colon.
ResultsA total of 846 patients were included in the study. Advanced neoplasia was detected in 108 patients (12.8%) and advanced proximal neoplasia in 55 patients (6.7%), 42 (76.4%) of whom had no neoplasia in the distal colon. Factors related to advanced neoplasia found in the multivariate analysis were age, at the intervals of 50-59 (p=0.019), 60-69 (p=0.016), and ≥ 70 years (0.002) and male sex (p=0.003). In the evaluation of advanced proximal neoplasia, the multivariate analysis identified the 60-69 year age interval (p=0.039) and advanced distal neoplasia (p=0.028) as factors related to advanced proximal disease. The ROC curve established the age cut-off point at 60 years for initially performing colonoscopy, rather than sigmoidoscopy.
ConclusionsAge and sex are related to advanced neoplasia, whereas age and advanced distal neoplasia are related to advanced proximal neoplasia.
El cáncer de colon es el tercer cáncer más común en hombres y el segundo más común en mujeres en el mundo, con más de 1.2 millones de nuevos casos y más de 600,000 muertes anualmente1.
El cribado de cáncer de colon en la población general puede reducir la mortalidad por cáncer colorrectal. Las guías internacionales recomiendan realizar dicho cribado a partir de los 50 años a través de pruebas tales como la detección de sangre oculta en heces, la sigmoidoscopia y la colonoscopia2. Sin embargo, no hay buena adherencia a estas recomendaciones. Una de las principales barreras para el cribado es la falta de riesgo percibido por parte de los pacientes y aún de los médicos de atención primaria3,4. El riesgo de cáncer colorrectal o, en general, de neoplasia avanzada (NA) varía de acuerdo con varios factores, incluyendo edad5–9, sexo6–10, historia familiar de cáncer de colon6,8,9,11, fumar8,9,12,13, obesidad7,9,14, diabetes mellitus15, etc. La información acerca de estos factores es fácil de obtener y podría ser usada para identificar pacientes con alto riesgo de NA, quienes se beneficiarían más con el cribado.
La sigmoidoscopia flexible es un método simple para el cribado de cáncer de colon. No solo disminuye la incidencia de cáncer colorrectal, sino que reduce la mortalidad. Un estudio aleatorizado grande reportó que la sigmoidoscopia por sí sola realizada en pacientes entre los 55 y 64 años redujo la incidencia de cáncer colorrectal en el 33% y redujo la mortalidad por cáncer colorrectal en el 43% durante un período de seguimiento medio de 11,2 años16. El adicionar a la sigmoidoscopia una prueba de sangre oculta en heces anual no reporta un beneficio extra, o este es mínimo17,18, más bien puede disminuir la participación en el cribado19,20.
Pero, a pesar de la fuerte evidencia de los beneficios clínicos de la sigmoidoscopia, este procedimiento no permite la evaluación del colon proximal. Se debe realizar una colonoscopia complementaria si el resultado de la sigmoidoscopia indica la presencia de neoplasia distal, especialmente si es mayor de 1cm, si tiene histología vellosa o si están presentes múltiples neoplasias, pues estos son factores de riesgo para neoplasia avanzada proximal (NAP)5,21-27. La prevalencia de NAP oscila entre el 1,7 y el 5,4% de acuerdo con los estudios publicados5,22,23,27,28. Sin embargo, del 60 a 70% de los pacientes con NAP no presentan neoplasia distal5,22,29-31. Por lo tanto, estos pacientes con NAP podrían no ser detectados si la colonoscopia es realizada solo sobre la base de los hallazgos de la sigmoidoscopia previa. Idealmente, la exploración del colon proximal debería ser selectivamente realizada en pacientes con alto riesgo de NAP, basada en un modelo predictivo más fuerte, que incluya los hallazgos de la sigmoidoscopia y factores de riesgo clínico. Sin embargo, pocos estudios han tocado este tópico21,23,25,29,30,32,33. El objetivo del presente estudio fue determinar los factores relacionados con NA y NAP colorrectal.
Material y métodosEl trabajo fue aprobado por la Oficina de Capacitación, Investigación y Docencia del Policlínico Peruano Japonés. Es un estudio analítico, observacional, de corte transversal y prospectivo. Se incluyó a todos los pacientes ambulatorios que acudieron para colonoscopia al servicio de Gastroenterología del Policlínico Peruano Japonés entre enero y julio del 2012. El Policlínico Peruano Japonés es una institución privada que atiende pacientes, en su gran mayoría, ambulatorios. Un total de 14 gastroenterólogos experimentados realizaron los procedimientos. Las colonoscopias fueron realizadas con equipos marca Olympus, modelos CF-H 180, CF-Q 160 ZL, CF-H 150 y CF-Q 150, y marca Fujinon, modelo EC-590 WL. Todos los procedimientos fueron grabados y archivados. Fueron excluidos los pacientes menores de 16 años y aquellos en los cuales no se contó con la información del estudio anatomopatológico. Todos los pacientes recibieron instrucciones verbales y por escrito para la preparación intestinal, empleándose el sistema de dosis dividida para todos los procedimientos. Los purgantes empleados para la preparación intestinal fueron el polietilenglicol (PEG), en la forma de 105g de PEG 3350 cada sobre, y el fosfato sódico (45ml cada frasco, 48g de fosfato de sodio monobásico y 18g de fosfato de sodio dibásico por cada 100ml). Así, si el examen fue en la mañana, se indicó tomar 3 sobres de PEG en la noche previa y uno en la mañana, o un frasco de fosfato sódico en la noche previa y otro en la mañana. Si el examen fue en la tarde, se indicó tomar 2 sobres de PEG en la noche previa y 2 sobres en la mañana del día del examen, o un frasco de fosfato sódico en la noche previa y el otro frasco en la mañana del examen.
Antes del procedimiento, los pacientes fueron encuestados, recogiéndose la siguiente la información de las siguientes variables:
- 1.
Datos demográficos: edad, sexo, peso, talla, índice de masa corporal (IMC), grado de instrucción;
- 2.
Historia médica personal, incluyendo antecedentes (diabetes mellitus, desorden cerebro vascular, cirrosis, uso de antidepresivos/ansiolíticos, consumo actual de tabaco, número de deposiciones por semana, cirugía abdominal, historia personal de colonoscopia previa, pólipos y cáncer de colon, historia familiar de cáncer de colon).
- 3.
Indicación para la colonoscopia: diagnóstica (paciente con síntomas tales como dolor abdominal, hematoquecia, rectorragia, diarrea crónica, estreñimiento o anemia en estudio), cribado o seguimiento (pospolipectomía o resección quirúrgica por cáncer de colon).
- 4.
Características de la preparación intestinal: uso de PEG o fosfato sódico, adición de laxante.
- 5.
Efectos adversos experimentados durante la preparación: náuseas, vómitos, dolor abdominal, distensión abdominal, irritación anal, trastorno del sueño.
Igualmente, durante el procedimiento se recogieron datos de las siguientes variables relacionadas con la colonoscopia: hora de inicio, incluyendo tiempo de retirada del colonoscopio, hallazgos del procedimiento y calidad de la preparación intestinal. El momento de la colonoscopia se clasificó en: «mañana», cuando la colonoscopia se inició entre las 08.00 am y las 11:59 am, o «tarde» cuando empezó entre las 12:00 pm y las 06:00 pm. La calidad de preparación intestinal fue registrada por el endoscopista a cargo del procedimiento y categorizada como excelente (adecuada visualización de todo el colon sin lavado y succión), buena (adecuada visualización de más del 90% del colon con líquidos claros que requieren mínima succión y mínimo o ningún lavado), regular (insatisfactoria visualización de todo o parte del colon con líquido oscuro y heces líquidas que necesitan succión y lavado) y pobre (insatisfactoria visualización de todo o parte del colon con líquido oscuro y heces que necesita succión y lavado y la necesidad de considerar una reevaluación) basada en la predefinida escala de Aronchick34,35. Para propósitos del estudio, redefinimos el nivel de preparación como «óptimo» (excelente o buena) o «subóptimo» (regular o pobre). Posterior al procedimiento, en caso de encontrarse lesiones elevadas, se obtuvieron los resultados del estudio histológico correspondiente.
La colonoscopia fue realizada por gastroenterólogos experimentados, en forma convencional. Se definió colonoscopia completa cuando el colonoscopio alcanzó el ciego. Durante la colonoscopia se determinaron la localización y el tamaño de todos los pólipos antes de ser removidos. El tamaño fue medido comparando la lesión con la pinza de biopsia abierta o en base al juicio clínico. La localización de las lesiones se determinó sobre la base del juicio clínico del gastroenterólogo.
Se determinó como límite entre colon proximal y distal al ángulo esplénico, el cual fue considerado proximal22,23,29,31,36,37. Se definió NA como la presencia de lesiones de más de 10mm en tamaño, con componente velloso o con displasia de alto grado o carcinoma8,23,29,37. Se definió cáncer como la invasión de células malignas por debajo de la muscularis mucosae 31. Para efectos del análisis, adenomas serrados tradicionales, lesiones serradas sésiles y pólipos serrados mixtos fueron categorizados como adenomas tubulares9. Los pólipos menores de 10mm de tamaño que no fueron extirpados fueron considerados no neoplásicos9. En el caso de pacientes con más de una lesión, ya sea en el colon proximal o distal, se usó la lesión más avanzada para subsecuente clasificación.
Los datos fueron reportados como frecuencias absolutas y relativas para variables discretas o nominales y como el promedio ± desviación estándar (DE) y rango para las variables continuas. Dichos datos fueron ingresados y analizados usando el paquete estadístico SPSS versión 16.0 y el programa Excel para la construcción de tablas. Se construyeron tablas 2 ×2 para hacer cruces de variables. Cada variable fue evaluada para estudiar su asociación con la presencia de NA y NPA. Para las variables categóricas se utilizó la prueba de la chi al cuadrado o la prueba exacta de Fisher, en tanto que para las variables continuas se utilizó la prueba U de Mann-Whitney. La edad fue evaluada como variable continua y categórica (< 40, 40-49, 50-59, 60-69 y ≥ 70). El IMC fue categorizado como ≥ 30 (obeso) y<de 30 (no obeso). Las variables encontradas significativamente asociadas a NA y NAP en el análisis univariado, pasaron a análisis multivariado usando regresión logística.
Los pacientes con colonoscopia incompleta fueron excluidos del análisis de factores de riesgo para NAP.
ResultadosDurante el período de estudio se efectuaron un total de 846 colonoscopias que cumplían los criterios de inclusión. La edad media fue de 57.67 años, con una DE de±14.77, el 71.6% fueron mayores de 50 años y el 64.9% fueron mujeres; 119 (14.1%) fueron obesos (IMC ≥ 30). La indicación más frecuente para el examen fue diagnóstica (59.1%); 112 (13.2%) tuvieron historia familiar de cáncer de colon, en tanto que 291 (34.4%) se habían realizado colonoscopia previa. De las 846 colonoscopias, en 822 (97.1%) se alcanzó intubación cecal. En el 54.1% de las colonoscopias, el tiempo de retirada del colonoscopio fue mayor o igual a 6 min. En 6 colonoscopias, algunos pólipos menores de 10mm no fueron removidos pues, a juicio del endoscopista, eran de aspecto hiperplásico y estaban ubicados en el recto.
Se detectó algún tipo de neoplasia colónica durante las colonoscopias en 243 pacientes (28.7%). De ellas, 223 correspondían a adenomas (26.4%) y 20 (2.4%) a cáncer; 108 pacientes (12-8%) presentaron NA (tabla 1).
El análisis univariado encontró como factores relacionados a NA en el total de pacientes a la edad (p=0.002) y el género masculino (p=0.012) (tabla 2).
Factores relacionados a NA-análisis univariado
| Características | Total de pacientesN=846 | NA | ||
|---|---|---|---|---|
| Sí | No | p | ||
| Edad, años ± DE | 57.67 ± 14.77 | 63.69 ± 13.20 | 56.79 ± 14.79 | 0.000c |
| Edad, n (%) | 0.002b | |||
| < 40 | 102 (12.1) | 5 (4.6) | 97 (13.1) | |
| 40-49 | 138 (16.3) | 9 (8.3) | 129 (17.5) | |
| 50-59 | 199 (23.5) | 28 (25.9) | 171 (23.2) | |
| 60-69 | 213 (25.2) | 30 (27.8) | 183 (24.8) | |
| ≥ 70 | 194 (22.9) | 36 (33.4) | 158 (21.4) | |
| Género, n (%) | ||||
| Masculino | 297 (35.1) | 50 (46.3) | 247 (33.5) | 0.012a |
| Femenino | 549 (64.9) | 58 (53.7) | 491 (66.5) | |
| IMC, media ± DE | 26.02 ± 4.02 | 26.13 ± 3.75 | 26.00 ± 4.06 | 0.629c |
| IMC ≥ 30, n (%) | 119 (14.1) | 15 (13.9) | 104 (14.1) | 1.000a |
| IMC < 30, n (%) | 727 (85.9) | 93 (86.1) | 634 (85.9) | |
| Momento del examen, n (%) | ||||
| «Mañana» | 350 (41.4) | 43 (39.8) | 307 (41.6) | 0.805a |
| «Tarde» | 496 (58.6) | 65 (60.2) | 431 (58.4) | |
| Consumo actual de tabaco, n (%) | 330 (39.0) | 51 (47.2) | 279 (37.8) | 0.077a |
| Historia personal de pólipos, n (%) | 101 (11.9) | 14 (13.0) | 87 (11.8) | 0.847a |
| Colonoscopia previa, n (%) | 291 (34.4) | 36 (33.3) | 255 (34.6) | 0.888a |
| Historia familiar de cáncer de colon, n (%) | 112 (13.2) | 19 (17.6) | 93 (12.6) | 0.201a |
| Diabetes mellitus, n (%) | 62 (7.3) | 9 (8.3) | 53 (7.2) | 0.817a |
| Deposiciones por semana, n (%) | ||||
| 1-3 | 67 (7.9) | 6 (5.6) | 61 (8.3) | 0.620b |
| 4-6 | 155 (18.3) | 20 (18.5) | 135 (18.3) | |
| 7 o más | 624 (73.8) | 82 (75.9) | 542 (73.4) | |
| Purgante recibido, n (%) | ||||
| Polietilenglicol | 770 (91.0) | 98 (90.7) | 672 (91.1) | 1.000a |
| Fosfosoda | 76 (9.0) | 10 (9.3) | 66 (8.9) | |
| Calidad de preparación intestinal, n (%) | ||||
| Óptima | 405 (47.9) | 47 (43.5) | 358 (48.5) | 0.386a |
| Subóptima | 441 (52.1) | 61 (56.5) | 380 (51.5) | |
| Indicación para colonoscopia, n (%) | ||||
| Diagnóstica | 500 (59.1) | 61 (56.5) | 439 (59.5) | 0.297b |
| Cribado | 257 (30.4) | 31 (28.7) | 226 (30.6) | |
| Seguimiento | 89 (10.5) | 16 (14.8) | 73 (9.9) | |
DE: desviación estándar; NA: neoplasia avanzada.
El análisis multivariado confirmó a la edad, en los rangos 50-59 (p=0.019), 60-69 (p=0.016) y > 70 años (0.002) y el género masculino (p=0.003) (tabla 3).
Factores relacionados a NA-análisis multivariado
| OR | IC del 95% | p | |
|---|---|---|---|
| Edad, años | |||
| < 40 | 1.000 | - | - |
| 40-49 | 1.283 | 0.415-3.964 | 0.665 |
| 50-59 | 3.264 | 1.216-8.758 | 0.019 |
| 60-69 | 3.330 | 1.247-8.890 | 0.016 |
| ≥ 70 | 4.698 | 1.775-12.436 | 0.002 |
| Género | |||
| Masculino | 1.898 | 1.252-2.878 | 0.003 |
| Femenino | 1.000 | - | - |
NA: neoplasia avanzada.
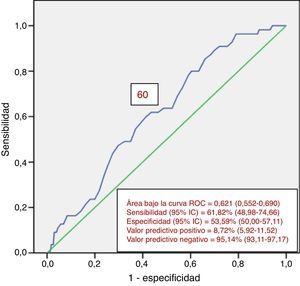
Entre los 822 pacientes con examen completo del colon, 99 (12.0%) presentaron NA. De ellos, 55 presentaron NA en el colon proximal. De este grupo con NAP, 42 (76.4%) no tuvieron lesión neoplásica en el colon distal. Pese a ello, los hallazgos en el colon distal pueden predecir la presencia de NAP (tabla 4). La presencia de ≥ 3 neoplasias no avanzadas distales o alguna NA distal aumentó el riego de NAP en casi 2.5 veces. El análisis univariado encontró a la edad (p=0.047) y la presencia de NA distal (p=0.018) como factores significativamente relacionados con la presencia de NAP (tabla 5). El análisis multivariado confirmó la edad en el intervalo de 60-69 años (p=0.039) y la presencia de NA distal (p=0.028) como significativamente asociados a la presencia de NAP (tabla 6). La curva ROC generada a partir de la edad y la presencia de NAP (fig. 1) mostró un área bajo la curva de 0.621 y el punto de corte de 60 años fue el que mejor discriminó la necesidad de realizar una colonoscopia de inicio en vez de una sigmoidoscopia.
Riesgo de NAP de acuerdo con los hallazgos distales (n=822)
| Hallazgos distales | N.° de pacientes | NAP=55 | OR (IC del 95%) | |
|---|---|---|---|---|
| N.° de pacientes | % | |||
| No neoplasia distal | 692 | 42 | 6.1 | Referencia |
| 1-2 neoplasias no avanzadas distales | 73 | 5 | 6.8 | 1.028 (0.397-2.664) |
| ≥ 3 neoplasias no avanzadas distales o alguna NA distal | 57 | 8 | 14.0 | 2.494 (1.117-5.570) |
| NA distal | 52 | 8 | 15.4 | 2.797 (1.245-6.281) |
NA: neoplasia avanzada; NAP: neoplasia avanzada proximal.
Factores relacionados a NAP-análisis univariado
| Características | Pacientes con intubación cecalN=822 | NAP | ||
|---|---|---|---|---|
| Sí | No | p | ||
| Edad, años ± DE | 57.39 ± 14.67 | 63.29 ± 11.93 | 56.96 ± 14.77 | 0.003d |
| Edad, n (%) | 0.047c | |||
| < 40 | 101 (12.3) | 2 (3.6) | 99 (12.9) | |
| 40-49 | 136 (16.5) | 4 (7.3) | 132 (17.2) | |
| 50-59 | 195 (23.7) | 15 (27.3) | 180 (23.5) | |
| 60-69 | 208 (25.3) | 19 (34.5) | 189 (24.6) | |
| ≥ 70 | 182 (22.1) | 15 (27.3) | 167 (21.8) | |
| Género, n (%) | ||||
| Femenino | 532 (64.7) | 31 (56.4) | 501 (65.3) | 0.231a |
| Masculino | 290 (35.3) | 24 (43.6) | 266 (34.7) | |
| IMC, media±DE | 26.02±3.99 | 26.56±3.82 | 25.98±4.01 | 0.243a |
| IMC ≥ 30, n (%) | 114 (13.9) | 8 (14.5) | 106 (13.8) | 1.00a |
| IMC < 30, n (%) | 708 (86.1) | 47 (85.5) | 661 (86.2) | |
| Momento del examen, n (%) | ||||
| «Mañana» | 342 (41.6) | 21 (38.2) | 321 (48.9) | 0.695a |
| «Tarde» | 480 (58.4) | 34 (61.8) | 446 (51.1) | |
| Consumo actual de tabaco, n (%) | 317 (38.6) | 26 (47.3) | 291 (37.9) | 0.219a |
| Historia personal de pólipos, n (%) | 100 (12.2) | 9 (16.4) | 91 (11.9) | 0.440a |
| Colonoscopia previa n (%) | 284 (34.5) | 23 (41.8) | 261 (34.0) | 0.305a |
| Historia familiar de cáncer de colon, n (%) | 109 (13.3) | 11 (20.0) | 98 (12.8) | 0.187a |
| Diabetes mellitus, n (%) | 58 (7.1) | 4 (7.3) | 54 (7.0) | 1.000b |
| Deposiciones por semana, n (%) | ||||
| 1-3 | 66 (8.0) | 2 (3.6) | 64 (8.3) | 0.381c |
| 4-6 | 153 (18.6) | 9 (16.4) | 144 (18.8) | |
| 7 o más | 603 (73.4) | 44 (80.0) | 559 (72.9) | |
| Purgante recibido, n (%) | ||||
| Polietilenglicol | 750 (91.2) | 51 (92.7) | 699 (91.1) | 1.000b |
| Fosfosoda | 72 (8.8) | 4 (7.3) | 68 (8,9) | |
| Calidad de preparación intestinal, n (%) | ||||
| Óptima | 395 (48.1) | 26 (47.3) | 369 (48.1) | 1.000a |
| Subóptima | 427 (51.9) | 29 (52.7) | 398 (51.9) | |
| Indicación para colonoscopia, n (%) | ||||
| Diagnóstica | 489 (59.5) | 30 (54.5) | 459 (59.8) | 0.120c |
| Cribado | 250 (30.4) | 15 (27.3) | 235 (30.6) | |
| Seguimiento | 83 (10.1) | 10 (18.2) | 73 (9.5) | |
| Presencia de NA distal, n (%) | 52 (6.3) | 8 (14.5) | 44 (5.7) | 0.018b |
DE: desviación estándar; NA: neoplasia avanzada; NAP: neoplasia avanzada proximal.
Factores relacionados a NAP-análisis multivariado
| OR | IC del 95% | p | |
|---|---|---|---|
| Edad, años | |||
| < 40 | 1.000 | - | - |
| 40-49 | 1.486 | 0.267-8.287 | 0.651 |
| 50-59 | 3.920 | 0.876-17.533 | 0.074 |
| 60-69 | 4.762 | 1.085-20.903 | 0.039 |
| ≥ 70 | 4.143 | 0.925-18.565 | 0.063 |
| Presencia de NA distal | 2.499 | 0.742-3.884 | 0.028 |
NA: neoplasia avanzada; NAP: neoplasia avanzada proximal.
Nuestro estudio confirma resultados de estudios previos, en los que se evidencia que la edad y el género masculino son factores asociados a NA.
Nosotros preferimos estudiar la NA y no cáncer para el análisis, dado que estudios previos indican que este es el objetivo de estudio más adecuado para el cribado por colonoscopia5-10,13,28. Aunque se han desarrollado previamente algunos modelos predictores solo para cáncer38-40, tanto este como la neoplasia avanzada son importantes objetivos de estudio del cribado de cáncer de colon, lo cual permitirá disminuir la mortalidad por cáncer colorrectal. La detección temprana y el tratamiento del cáncer colorrectal están asociados a una reducción en la mortalidad por cáncer colorrectal9, pero una detección y remoción de los adenomas, especialmente los avanzados, está asociada, además, con una reducción en la incidencia de cáncer colorrectal41,42.
Se encontró que la edad y el sexo son factores de riesgo importantes para el desarrollo de neoplasia colorrectal avanzada. Los hombres tienen casi 2 veces más riesgo de desarrollar neoplasia avanzada comparado con las mujeres. También hubo una asociación significativa entre la edad y la neoplasia avanzada. En particular, en pacientes mayores de 70 años el riesgo aumentó más de 4 veces con respecto a los menores de 40 años. Se ha observado una mayor prevalencia de neoplasia colorrectal asociada a la edad en estudios previos13,26. Otros factores, tales como la historia familiar de cáncer colorrectal, el consumo de tabaco y el IMC, no estuvieron relacionados a neoplasia colorrectal avanzada en nuestro estudio, a diferencia de lo encontrado por Kaminski et al.9.
La sigmoidoscopia flexible es generalmente bien tolerada, fácil de realizar, económica y segura16. Por tanto, la sigmoidoscopia es un test inicial adecuado para el cribado a gran escala del cáncer colorrectal. Sin embargo, la sigmoidoscopia no puede evaluar el colon proximal, por ello se han realizado estudios para identificar factores relacionados con neoplasia proximal, que podrían ser usados para identificar a pacientes que requerirían una colonoscopia complementaria. Se han identificado como factores de riesgo para NAP, los hallazgos en el colon distal (neoplasia grande o neoplasia con histología avanzada) y algunas características clínicas (edad, sexo masculino, obesidad, consumo de alcohol o tabaco, antecedentes familiares de cáncer de colon)21-23,27,29–33,37.
En el presente estudio se evaluaron también los factores relacionados con NAP. Para dicho análisis, solo se tomaron en cuenta las colonoscopias en las cuales se logró la intubación del ciego31. Se encontró que la edad y la presencia de NA distal estuvieron relacionadas, no así el sexo. En el caso de la edad, se aprecia que por encima de los 60 años es preferible realizar una colonoscopia de inicio en vez de una sigmoidoscopia, por el alto riesgo de encontrar NAP en este grupo de pacientes. En lo que respecta a NA distal, esta incrementó el riesgo de NAP en 2,5 veces, concordando con los hallazgos de Leung et al.31, quienes hallaron un aumento de riesgo de 3,9 veces en ese grupo de pacientes. Otros hallazgos en el colon distal, como las neoplasias no avanzadas, no alcanzaron significación estadística en cuanto a su relación con NAP, esto debido quizá al pequeño tamaño de la muestra estudiada.
En este estudio, el 6.1% de los pacientes con colon distal sin neoplasia tuvieron NAP. Alternativamente, el 76.4% de los pacientes con lesión avanzada proximal no tuvieron neoplasia en el colon distal. Estos resultados guardan relación con reportes previos13,22,29,31,32. De estos hallazgos se puede deducir que 3 cuartos de lesiones colónicas avanzadas podrían ser perdidas por la sigmoidoscopia si no se hiciera colonoscopia en pacientes con colon distal sin neoplasia.
En el presente trabajo, se definió NA tal como ha sido definido en la mayoría de estudios previos, incluyendo los adenomas con tamaño >1cm5,9,13,25,26,29–31,33,37. Dado que la determinación del tamaño de un pólipo puede estar sujeta a una amplia variabilidad interobservador, una definición más rigurosa, sin considerar el tamaño, como la propuesta por Imperiale et al.22, puede prevenir esta discrepancia. Por ello se puede afectar la tasa de detección de neoplasia avanzada en este estudio comparado con el de Imperiale et al.
Entre las limitaciones del estudio debemos mencionar el pequeño tamaño de la muestra, lo cual probablemente provocó que no se hayan identificado otros factores de riesgo para neoplasia avanzada, tales como la historia familiar de cáncer de colon, el consumo de tabaco, la obesidad y la diabetes mellitus. Por otro lado, no tomamos en cuenta otros factores de riesgo, tales como el uso de aspirina. Igualmente, nuestros factores de riesgo solo predicen la detección de neoplasia avanzada en el momento de la evaluación, y no el riesgo futuro de desarrollar neoplasia colorrectal avanzada o muerte por cáncer colorrectal. De otro lado, hemos tomado en cuenta para el estudio tanto a pacientes sintomáticos como asintomáticos, al igual que Dodou y de Winter24 y Chung et al.25, lo cual puede distorsionar las comparaciones con otros estudios que solo evaluaron pacientes para cribado5-9,13,21–23,29,30,33,37 o sintomáticos31,36.
En conclusión, diremos que en nuestro estudio se encontró que la edad y el género están relacionados con la presencia de NA colorrectal, en tanto que la edad y la presencia de NA distal están relacionadas con la presencia de NAP. En particular, pacientes mayores de 60 años requerirían una colonoscopia de inicio en vez de una sigmoidoscopia para la evaluación del colon. Son necesarios futuros estudios con mayor tamaño de muestra para encontrar otros factores relacionados y establecer un score para identificar individuos con alto riesgo de presentar NA colorrectal.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoLos autores declaran que no se recibió patrocinio de ningún tipo para llevar a cabo este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.
Al señor Felix Armando Barrientos Achata, por su apoyo en el análisis estadístico.
Véase contenido relacionado en DOI: http://dx.doi.org/10.1016/j.rgmx.2015.09.001, Blancas Valencia JM. ¿Debemos olvidar la rectosigmoidoscopia para eldiagnóstico de neoplasia avanzada colorrectal? Rev Gastroenterol Méx. 2015;80(4):237–8.