Se ha reportado una asociación entre el uso prolongado de inhibidores de la bomba de protones (IBP) y el desarrollo de tumores neuroendocrinos gástricos (TNE-G), la cual aún es controversial. El objetivo fue determinar esta asociación en nuestra población e identificar los factores de riesgo para el desarrollo de los TNE-G.
Material y métodosEstudio de casos y controles, se incluyeron pacientes con diagnóstico histopatológico de TNE-G, los controles fueron pacientes evaluados con endoscopia superior pareados por edad, sexo e indicación del estudio endoscópico. Se consideró uso prolongado de IBP cuando se utilizó por más de 5 años.
ResultadosSe incluyeron en el estudio 33 pacientes con TNE-G y 66 controles. En el grupo de casos 18 (54.5%) son mujeres y en el grupo control 39 (59%). La mediana de edad es de 55 (rango mínimo-máximo: 24-82) años en el grupo de casos y 54 (rango mínimo-máximo: 18-85) años en el grupo control. En el grupo de los TNE-G se encontró una proporción mayor de pacientes con atrofia gástrica (p<0.0001) y gastritis atrófica autoinmune (p=0.0002) con respecto al grupo control. En el análisis univariado no se encontró asociación entre los TNE-G y el uso de IBP de forma prolongada, sexo, consumo de tabaco, enfermedad por reflujo gastroesofágico, infección por Helicobacter pylori, diabetes mellitus ni enfermedades autoinmunes.
ConclusionesNo se encontró asociación entre el uso de IBP por más de 5 años y el desarrollo de TNE-G. La presencia de atrofia gástrica y gastritis atrófica autoinmune se asociaron al desarrollo de TNE-G.
An association between long-term use of proton pump inhibitors and the development of gastric neuroendocrine tumors has been reported, but it is still a subject of debate. The aims of the present study were to determine the presence of this association in a Mexican population and to identify the risk factors for developing gastric neuroendocrine tumors.
Materials and methodsA case-control study was conducted, in which the cases were patients with a histopathologic diagnosis of gastric neuroendocrine tumor and the controls were patients evaluated through upper endoscopy. The controls were paired by age, sex, and endoscopic examination indication. Proton pump inhibitor use was considered prolonged when consumption was longer than 5 years.
ResultsThirty-three patients with gastric neuroendocrine tumor and 66 controls were included in the study. Eighteen (54.5%) patients in the case group were women, as were 39 (59%) of the patients in the control group. The median age of the patients in the case group was 55 years (minimum-maximum range: 24-82) and it was 54 years (minimum-maximum range:18-85) in the control group. A greater number of patients in the gastric neuroendocrine tumor group presented with gastric atrophy (p<0.0001) and autoimmune atrophic gastritis (p=0.0002), compared with the control group. No association between gastric neuroendocrine tumor and prolonged proton pump inhibitor use, sex, smoking, gastroesophageal reflux disease, Helicobacter pylori infection, diabetes mellitus, or autoimmune diseases was found in the univariate analysis.
ConclusionsThe results of our study showed no association between proton pump inhibitor use for more than 5 years and the development of gastric neuroendocrine tumor. The presence of gastric atrophy and autoimmune atrophic gastritis was associated with gastric neuroendocrine tumor development.
Los tumores neuroendocrinos gástricos (TNE-G) son neoplasias poco frecuentes1. Estos tumores proceden de las células similares a las enterocromafines del estómago y se han clasificado en 4 tipos de acuerdo a su fisiopatología y comportamiento biológico. Los tipos 1 y 2 se asocian a hipergastrinemia y son de bajo grado de malignidad, el tipo 2 se relaciona con el síndrome de Zollinger-Ellison y la neoplasia endocrina múltiple tipo 1 (NEM-1). Los tipos 3 y 4 son independientes de gastrina y son más agresivos, generan metástasis de forma temprana y muestran un índice de proliferación (Ki-67) elevado1,2. En un análisis epidemiológico de más de 50 años realizado en los Estados Unidos de América (EUA) se demostró que la incidencia de los TNE-G ha aumentado en décadas recientes, esto se ha explicado por el advenimiento y la mejora de los equipos endoscópicos3,4.
Se ha reportado una asociación entre el uso prolongado de inhibidores de bomba de protones (IBP) y el desarrollo de TNE-G, la cual parece ser secundaria a la hipergastrinemia que ocasionan estos fármacos; además se ha observado regresión neoplásica al suspenderlos5–9. Brunner et al. publicaron un estudio de 142 pacientes en tratamiento con pantoprazol (40-160mg/d) durante 15 años y no encontraron aumento en el riesgo de desarrollar TNE-G10. El objetivo de este estudio consiste en determinar la asociación entre el uso prolongado de IBP y los TNE-G e identificar los factores de riesgo para su desarrollo.
Material y métodosEs un estudio de casos y controles realizado en un centro de tercer nivel, el Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán (INCMNSZ) fue autorizado por el comité de investigación y el comité de ética en investigación de esta institución. Se incluyeron los pacientes con TNE-G atendidos en el período comprendido entre enero del 2000 y diciembre del 2014, se recolectó información del expediente clínico y de los archivos de patología y endoscopia gastrointestinal. El diagnóstico definitivo se basó en el resultado histopatológico e inmunohistoquímico. Se excluyeron los pacientes con expedientes incompletos.
Los controles fueron pacientes del INCMNSZ evaluados con endoscopia superior y sin TNE-G, recolectados en el mismo período de tiempo que los casos. Los controles se parearon por edad, sexo e indicación del estudio endoscópico. Se utilizaron 2 controles por cada caso.
Se consideró uso prolongado de IBP cuando se utilizó por más de 5 años, sin importar el tipo de IBP, la dosis o si el uso fue continuo o intermitente. Se recolectaron las características demográficas de los participantes, antecedente de tabaquismo, diagnóstico de diabetes mellitus, enfermedad por reflujo gastroesofágico o enfermedades autoinmunes, presencia de atrofia gástrica o infección por Helicobacter pylori, tipo y etapa del TNE-G, así como el tratamiento empleado.
Análisis estadísticoLos datos son expresados como medianas y rango mínimo-máximo o proporciones. Se utiliza la prueba de U de Mann-Whitney para comparar medianas y χ2 o prueba exacta de Fisher para comparar proporciones, se considera una p<0.05 como estadísticamente significativa. Se realizó análisis univariado para determinar los factores asociados al hallazgo de TNE-G. Se utilizó el paquete estadístico para las ciencias sociales (SPSS®, versión 20.0, Chicago, IL, EE. UU.).
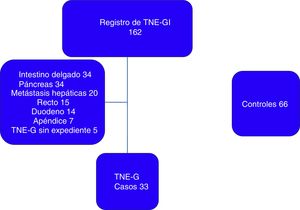
ResultadosDe un total de 162 pacientes potencialmente elegibles para el diagnóstico de TNE-G se excluyeron 124 por localización diferente a la gástrica y 5 por expediente incompleto, se incluyeron en el estudio 33 pacientes con TNE-G (fig. 1). Se recolectaron 66 controles. En el grupo de casos 18 (54.5%) son mujeres y en el grupo control 39 (59%) pertenecen al sexo femenino, la mediana de edad es de 55 (rango mínimo-máximo: 24-82) años en el grupo de casos y 54 (rango mínimo-máximo: 18-85) años en el grupo control.
La principal indicación para la endoscopia superior en ambos grupos fue la dispepsia y el reflujo gastroesofágico. En el grupo de los TNE-G se encontró una proporción mayor de pacientes con atrofia gástrica (p<0.0001) y gastritis atrófica autoinmune (p=0.0002) con respecto al grupo control. En el análisis univariado no se encontró asociación entre los TNE-G y el uso de IBP de forma prolongada, sexo, consumo de tabaco, enfermedad por reflujo gastroesofágico, infección por Helicobacter pylori, diabetes mellitus ni enfermedades autoinmunes (tabla 1).
Variables de comparación entre casos y controles
| Indicación | Casos N=33 (%) | Controles N=66 (%) | Valor de p |
|---|---|---|---|
| Sexo femenino | 18 (54.5) | 39 (59) | 0.666 |
| Edad (mediana, rango min-máx) | 55 (24-82) | 54 (18-85) | 0.726 |
| Tabaco | 18 (55) | 25 (38) | 0.114 |
| ERGE | 7 (21) | 17 (26) | 0.618 |
| IBP>5 años | 6 (18) | 17 (26) | 0.400 |
| Diabetes mellitus | 5 (15) | 14 (21) | 0.470 |
| Helicobacter pylori | 8 (24) | 20 (30) | 0.527 |
| Gastritis atrófica autoinmune | 8 (24) | 1 (2) | 0.0002 |
| Atrofia gástrica | 24 (73) | 4 (6) | <0.0001 |
| Otros autoinmunes | 13 (39) | 23 (35) | 0.657 |
| Dispepsia/ERGE | 19 (58) | 38 (58) | >0.05 |
| Hemorragia digestiva | 4 (12) | 8 (12) | >0.05 |
| Anemia | 8 (24) | 16 (24) | >0.05 |
| Pérdida ponderal | 1 (3) | 2 (3) | >0.05 |
| Poliposis gástrica | 1 (3) | 2 (3) | >0.05 |
IBP: inhibidores de la bomba de protones; ERGE: enfermedad por reflujo gastroesofágico.
Negrita: significa que la diferencia es estadísticamente significativa.
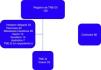
En el grupo de los TNE-G, 14 (42%) pacientes correspondieron al tipo 1, 6 (18%) al tipo 2 y 5 (15%) al tipo 3; en 8 (25%) casos el tipo no fue determinado. No se presentaron pacientes con tipo 4. En 30 (91%) pacientes se encontró etapa clínica I y en 3 (9%) etapa clínica II. En 23 (70%) pacientes el tratamiento fue endoscópico, en 12 (37%) fueron tratados en una sesión y en 11 (33%) en varias sesiones, 9 (27%) requirieron tratamiento quirúrgico y uno (3%) no recibió tratamiento (fig. 2).
DiscusiónEn este reporte se evaluaron 33 casos de TNE-G atendidos en un centro de referencia. No se encontró asociación entre el uso prolongado de IBP y los TNE-G, lo cual coincide con los resultados de estudios previos. La presencia de atrofia gástrica y gastritis atrófica autoinmune se asoció a un aumento en el riesgo de desarrollar TNE-G. Existen 2 estudios publicados con anterioridad de esta misma población, ambos tuvieron como objetivo identificar las características clínicas de estos pacientes. El primero fue publicado en 2005 e incluyó 13 pacientes y se determinó que la mayoría de estos tumores fueron del tipo 1 y de bajo grado de malignidad11,12. El segundo se publicó en 2012, incluyó 31 casos con TNE-G, la localización gástrica se documentó en 12 (38.7%) pacientes, siendo la más frecuente9,13.
La atrofia gástrica y la gastritis atrófica autoinmune, disminuyen el número de células parietales y la producción de ácido, causando un estado de hipergastrinemia. De forma similar, los IBP inhiben la producción de ácido, provocando hipergastrinemia, hiperplasia y displasia de las células similares a las enterocromafines, formación de microcarcinoides y, finalmente, aparición de TNE-G, lo que se conoce como la hipótesis de la gastrina14,15.
Una revisión reciente de Cochrane documentó que el tratamiento a largo plazo con IBP se asocia a hiperplasia de las células similares a las enterocromafines (RM: 5.01: IC 95%: 1.54-16.26; p=0.007); sin embargo, no encontró relación con la aparición de neoplasias. Estudios previos han reportado hallazgos similares, lo cual puede ser secundario al tamaño de la muestra o al seguimiento de los pacientes. Los TNE-G tienen una prevalencia muy baja, reportada en 0.17/10,000 habitantes, por lo que se requieren estudios con una muestra muy grande para hallar asociaciones. En los casos reportados, la aparición de los TNE-G ha ocurrido después de 12 o más años de tratamiento con IBP, la mayor parte de los estudios publicados no cuentan con un seguimiento tan largo16.
Las 2 principales limitaciones de este estudio son su diseño retrospectivo y su muestra pequeña. Numerosos sesgos pueden alterar los resultados debido al diseño; en particular, la prevalencia de los TNE-G puede haber sido infraestimada. Se consideró uso prolongado de IBP cuando se empleó por más de 5 años, sin importar el IBP específico, la dosis o si el uso fue continuo o intermitente, lo que produce una muestra heterogénea. Por otro lado, este manuscrito incluye 14 años de estudio de una rara enfermedad y reporta una de las muestras más grandes que existen en la población mexicana17,18.
En conclusión, en este estudio no se encontró una asociación entre el uso de IBP por más de 5 años y los TNE-G. La presencia de atrofia gástrica y gastritis atrófica autoinmune se asociaron al desarrollo de TNE-G.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo/estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.