La enfermedad celiaca (EC) es una enteropatía autoinmune asociada a la ingestión de gluten. En las familias extendidas de pacientes celiacos en estrecha convivencia, los factores genéticos y ambientales compartidos pueden predisponer a EC.
ObjetivoProporcionar evidencia sobre factores genéticos y ambientales implicados en el desarrollo de la EC en una familia extendida de un paciente pediátrico.
MétodosSe evaluaron historial clínico, condiciones ambientales, peso y talla de los participantes y se les tomó una muestra de sangre periférica. Se genotipificaron los haplotipos HLA-DQ2/DQ8 mediante qPCR y se cuantificaron por ELISA los anticuerpos IgA antigliadinas y antitransglutaminasa.
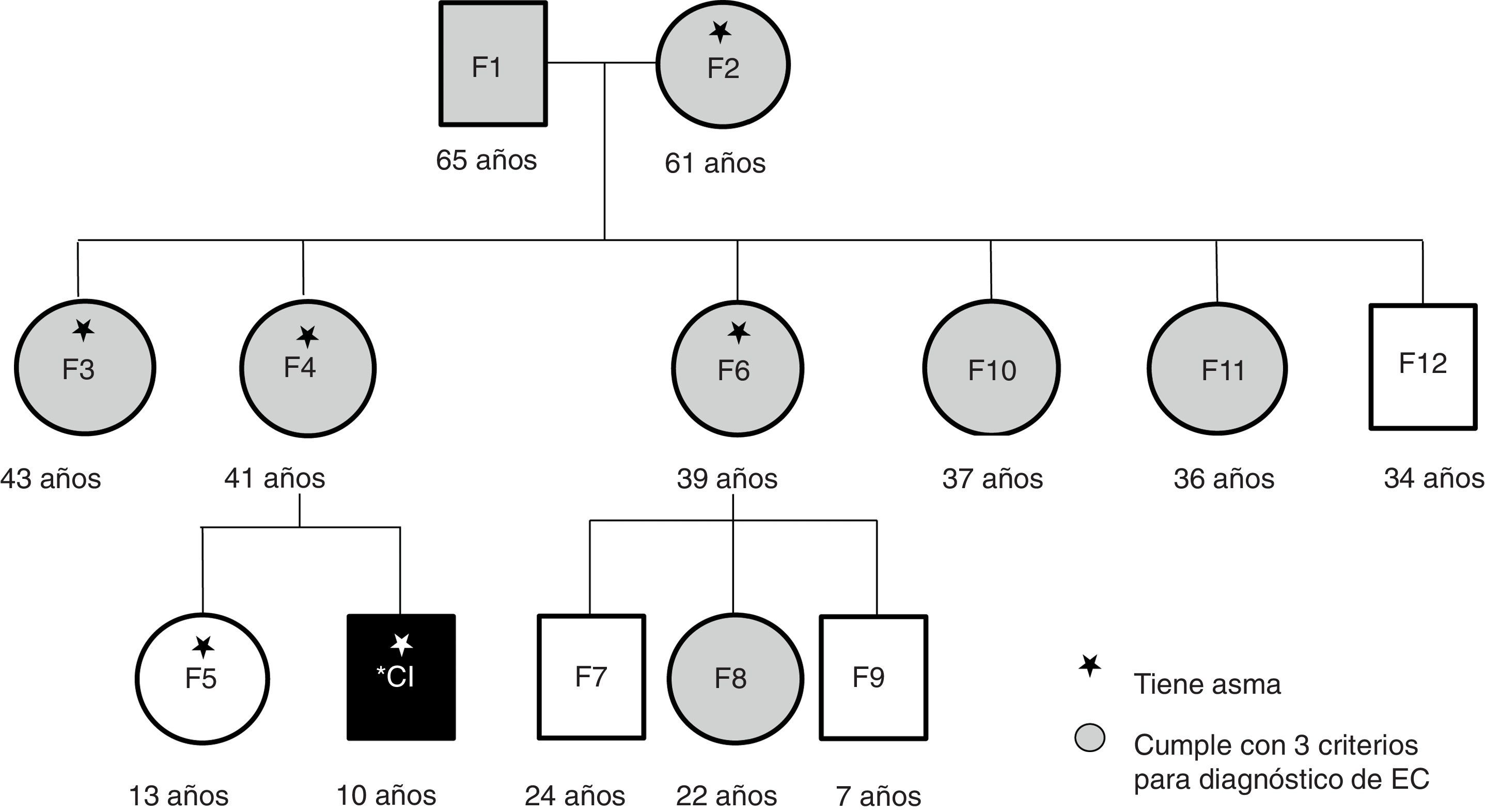
ResultadosParticiparon 12 familiares maternos del caso índice, que tenían estrecha convivencia vecinal. Ocho presentaron HLA-DQ2 heredado del abuelo, 7/12 y 9/12 fueron positivos para los anticuerpos IgA antigliadinas e IgA antitransglutaminasa, respectivamente. Los principales síntomas intestinales referidos por los participantes fueron distensión abdominal, exceso de gases, estreñimiento y reflujo gastroesofágico. Los síntomas extraintestinales más frecuentes fueron fatiga, estrés y ansiedad. Además, 6/13 participantes tuvieron asma bronquial.
ConclusiónLa familia extendida convive estrechamente, comparte la predisposición genética, condiciones ambientales y el asma, que podrían haberlos predispuesto a la EC.
Celiac disease (CD) is an autoimmune enteropathy associated with gluten ingestion. In extended families of celiac patients that live in close proximity of one another, shared genetic and environmental factors can predispose them to CD.
AimThe aim of this study was to provide evidence about the genetic and environmental factors involved in the development of CD in the extended family of a pediatric patient.
MethodsThe medical history, environmental conditions, and participant weight, height, and peripheral blood samples were evaluated. The HLA-DQ2/DQ8 haplotypes were genotyped through qPCR testing and the IgA anti-gliadin and anti-transglutaminase antibodies were quantified using the ELISA test.
ResultsTwelve close-living maternal relatives of the index case participated in the study. Eight of them presented with the HLA-DQ2 haplotype, inherited from the grandfather, and 7/12 and 9/12 were positive for IgA anti-gliadin and IgA anti-transglutaminase antibodies, respectively. The main intestinal symptoms stated by the participants were abdominal bloating, excess flatulence, constipation, and gastroesophageal reflux. The most frequent extra-intestinal symptoms were fatigue, stress, and anxiety. In addition, 6/13 participants had bronchial asthma.
ConclusionThe extended family living in close proximity of one another shared a genetic predisposition, environmental conditions, and asthma, which could have predisposed them to celiac disease.
La enfermedad celiaca (EC) es una enteropatía autoinmune desencadenada por el consumo de gluten en personas genéticamente predispuestas. Su prevalencia estimada en México es de 1:1681, similar a la encontrada en poblaciones amerindias (1:167)2 y caucásicas (1:100-1:200)3. Los síntomas de la EC pueden ser intestinales, como diarrea y síndrome de malabsorción, que provocan pérdida de peso y falla en el crecimiento; o extraintestinales, como dolor de cabeza, anemia, dermatitis herpetiforme y osteoporosis4. La variabilidad de las manifestaciones clínicas dificulta el diagnóstico.
La genética de riesgo dada por los haplotipos HLA-DQ2/DQ8 explica del 30 al 50% de la EC5, en cuyo desarrollo intervienen además factores ambientales. Los familiares de personas con EC, debido a la genética y a la historia en común, tienen mayor riesgo de desarrollarla. En los de primer y segundo grado, el riesgo de padecer EC se incrementa en 5.6-10% y 2.3-5%, respectivamente6,7. Por esto, algunos autores han propuesto implementar estrategias para la detección de EC en este grupo de alto riesgo, con lo que se podría disminuir la morbimortalidad relacionada8,9.
En un entorno tradicional, como en el que conviven muchas familias mexicanas, en la misma área física, además de compartir genética, se comparten condiciones ambientales que pueden incrementar el riesgo de EC. En este contexto, el objetivo del estudio fue proporcionar evidencia sobre factores genéticos, ambientales, enfermedades y tratamientos implicados en el desarrollo de la EC en una familia extendida de un niño que la padece.
Materiales y métodosParticipantesEl estudio se llevó a cabo en Hermosillo, en el estado de Sonora (México). Se incluyeron 12 familiares de primer y segundo grado de un niño con EC (caso índice). El niño, actualmente de 10 años de edad, fue diagnosticado con EC por síntomas agudos, biopsia y anticuerpos, desde los 2 años de edad. El protocolo de investigación fue aprobado por el Comité Institucional de Bioética (CE/016/2014) y se obtuvo el consentimiento informado de cada uno de los participantes, firmado por los padres en caso de los menores de 18 años.
Se entrevistó a los participantes sobre su historia clínica; en el caso de los niños, la madre aportó la información. Se midió el peso y la talla y se calculó el índice de masa corporal. El estado nutricional de los adultos se clasificó según los puntos de corte de la Organización Mundial de la Salud10, mientras que para los niños se calculó el puntaje Z de índice de masa corporal para la edad11.
Se obtuvo una muestra de sangre venosa de cada participante. Una fracción se utilizó para el análisis de haplotipos de riesgo y el resto se centrifugó para obtener suero y analizar anticuerpos.
Extracción de ADN y genotipificaciónEl ADN genómico se extrajo de las muestras de gotas de sangre seca siguiendo el protocolo descrito por Aguayo-Patrón et al.12. Para el análisis de haplotipos de riesgo, se utilizaron iniciadores previamente diseñados para los alelos DQA1*0501 y DQB1*0201 (DQ2) y DQA1*0301 y DQB1*0302/3 (DQ8)13. Se realizaron reacciones dúplex en PCR en tiempo real y la identificación de los alelos se hizo mediante el análisis de las curvas de disociación12.
Análisis de anticuerposEn las muestras de suero, se evaluaron anticuerpos IgA antigliadinas y antitransglutaminasa mediante ensayo inmunoabsorbente ligado a enzima o ELISA, siguiendo una técnica antes descrita14. Se calcularon los índices de anticuerpos empleando los valores de absorbancia obtenidos respecto a la absorbancia promedio de la población sana, y los valores mayores de 1.0 fueron considerados positivos.
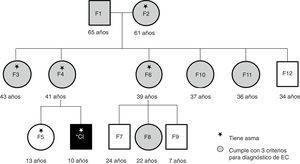
ResultadosIncluyendo el caso índice, participaron 13 personas en este estudio: los abuelos maternos, la madre, la hermana, 4 tías, un tío y 3 primos. Ocho de los participantes fueron del sexo femenino y tuvieron una mediana de edad de 36 años (fig. 1). Los 13 familiares convivían en un entorno de familia extendida tradicional mexicana, habitando casas contiguas o muy cercanas a la de los abuelos. Compartían el ambiente, las costumbres de crianza, de alimentación, el estilo de vida y el tratamiento de las enfermedades.
Los abuelos maternos migraron de una zona rural hacia la ciudad de Hermosillo. La segunda generación (madre y tíos del caso índice) vivió su niñez en la zona rural, en un ambiente de granja. Todos refieren haber sido amamantados, pero al mismo tiempo recibieron leche de vaca o cabra. Además, 2 participantes tuvieron nacimientos complicados, por no contar con servicios de salud adecuados en la zona rural. Al padre del caso índice, se le analizaron anticuerpos específicos y haplotipos cuando se diagnosticó al niño, con resultados negativos, no asociados a EC, por lo que no se incluyó en este estudio.
La tercera generación (caso índice, hermanos y primos) nació en la ciudad de Hermosillo, en un ambiente no urbanizado por completo. No todas las casas contaban con servicio de drenaje ni piso de concreto; además, dentro de los hogares y patios tenían mascotas tales como gatos, perros, gallinas y caballos. En el momento del estudio contaban ya con un mejor acceso a servicios de salud y medicamentos, pero incidían frecuentemente en prácticas de automedicación. Los padres compartían los medicamentos para el tratamiento de enfermedades similares de sus hijos y de ellos mismos, la mayoría de las veces sin completar las dosis o los ciclos adecuados. Todos los miembros de la generación más joven nacieron por cesárea, y ninguno recibió amamantamiento exclusivo durante 6 meses.
A pesar de conocer el diagnóstico del caso índice desde hacía 8 años, la mayoría de los miembros de esta familia no eran conscientes del riesgo en el que se encontraban de desarrollar EC. La mayoría de los adultos atribuían sus síntomas a la edad o la menopausia. Además, como dato relevante obtenido de la historia clínica, 6 de los participantes refirieron diagnóstico médico de asma bronquial (fig. 1).
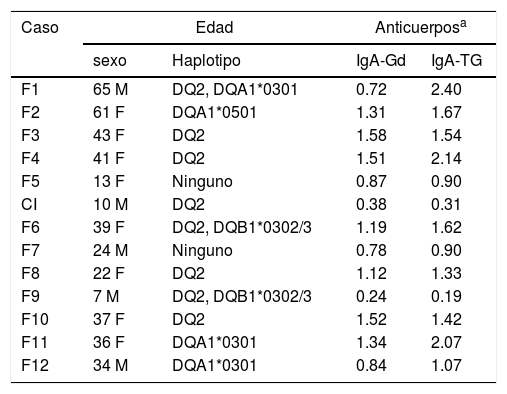
Al analizar la genética de riesgo, se encontró que 9 de los 13 participantes presentaron el haplotipo HLA-DQ2 o alguno de sus alelos (DQA1*0501), en 2 casos, en combinación con el alelo DQB1*0302 del HLA-DQ8. En otros 2 casos no se encontraron los alelos de predisposición a EC (tabla 1). El análisis de anticuerpos arrojó títulos positivos en 7 participantes para IgA antigliadinas, mientras que para IgA antitransglutaminasa, 9 resultaron positivos. En ambas pruebas, el caso índice tuvo títulos por debajo de 1.0. Esto es debido a que sigue una dieta exenta de gluten desde hace 8 años, como tratamiento para la EC (tabla 1).
Haplotipos y títulos de anticuerpos de la familia extendida del caso índice
| Caso | Edad | Anticuerposa | ||
|---|---|---|---|---|
| sexo | Haplotipo | IgA-Gd | IgA-TG | |
| F1 | 65 M | DQ2, DQA1*0301 | 0.72 | 2.40 |
| F2 | 61 F | DQA1*0501 | 1.31 | 1.67 |
| F3 | 43 F | DQ2 | 1.58 | 1.54 |
| F4 | 41 F | DQ2 | 1.51 | 2.14 |
| F5 | 13 F | Ninguno | 0.87 | 0.90 |
| CI | 10 M | DQ2 | 0.38 | 0.31 |
| F6 | 39 F | DQ2, DQB1*0302/3 | 1.19 | 1.62 |
| F7 | 24 M | Ninguno | 0.78 | 0.90 |
| F8 | 22 F | DQ2 | 1.12 | 1.33 |
| F9 | 7 M | DQ2, DQB1*0302/3 | 0.24 | 0.19 |
| F10 | 37 F | DQ2 | 1.52 | 1.42 |
| F11 | 36 F | DQA1*0301 | 1.34 | 2.07 |
| F12 | 34 M | DQA1*0301 | 0.84 | 1.07 |
F: femenino; IgA-Gd: anticuerpos IgA antigliadinas; IgA-TG: anticuerpos IgA antitransglutaminasa; M: masculino.
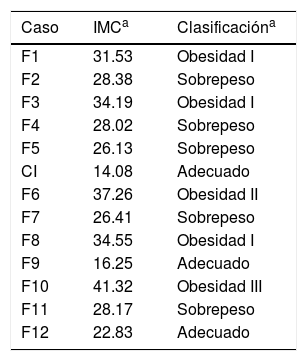
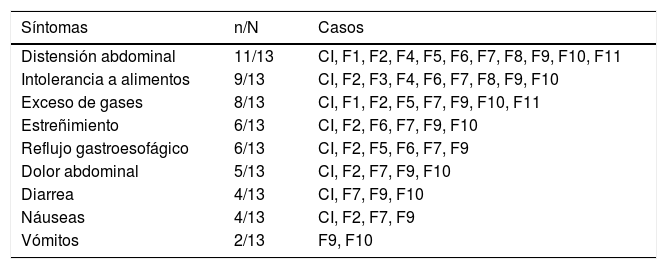
De acuerdo con el índice de masa corporal, exceptuando al caso índice, a F9 y a F12, los participantes tuvieron algún grado de sobrepeso u obesidad (tabla 2). Los síntomas intestinales asociados a EC fueron más recurrentes en los familiares estudiados que los extraintestinales. En la tabla 3 se muestra que el síntoma más frecuente fue la distensión abdominal (11/13 participantes), seguido de intolerancia a alimentos (9/13 participantes) y exceso de gases (8/13 participantes). Además, los participantes F3 y F10 refirieron distensión y dolor abdominal después de consumir alimentos con maíz.
Estado de nutrición de la familia extendida del caso índice
| Caso | IMCa | Clasificacióna |
|---|---|---|
| F1 | 31.53 | Obesidad I |
| F2 | 28.38 | Sobrepeso |
| F3 | 34.19 | Obesidad I |
| F4 | 28.02 | Sobrepeso |
| F5 | 26.13 | Sobrepeso |
| CI | 14.08 | Adecuado |
| F6 | 37.26 | Obesidad II |
| F7 | 26.41 | Sobrepeso |
| F8 | 34.55 | Obesidad I |
| F9 | 16.25 | Adecuado |
| F10 | 41.32 | Obesidad III |
| F11 | 28.17 | Sobrepeso |
| F12 | 22.83 | Adecuado |
CI: caso índice; IMC: índice de masa corporal.
Síntomas intestinales de la familia extendida del caso índice
| Síntomas | n/N | Casos |
|---|---|---|
| Distensión abdominal | 11/13 | CI, F1, F2, F4, F5, F6, F7, F8, F9, F10, F11 |
| Intolerancia a alimentos | 9/13 | CI, F2, F3, F4, F6, F7, F8, F9, F10 |
| Exceso de gases | 8/13 | CI, F1, F2, F5, F7, F9, F10, F11 |
| Estreñimiento | 6/13 | CI, F2, F6, F7, F9, F10 |
| Reflujo gastroesofágico | 6/13 | CI, F2, F5, F6, F7, F9 |
| Dolor abdominal | 5/13 | CI, F2, F7, F9, F10 |
| Diarrea | 4/13 | CI, F7, F9, F10 |
| Náuseas | 4/13 | CI, F2, F7, F9 |
| Vómitos | 2/13 | F9, F10 |
CI: caso índice.
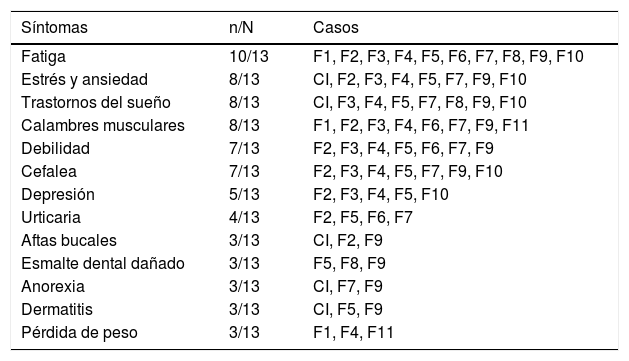
En relación con los síntomas extraintestinales, los participantes presentaron con mayor frecuencia fatiga (10/13 participantes), estrés, ansiedad, trastornos del sueño y calambres musculares (8/13 participantes). Otros signos clínicos, como urticaria, aftas bucales, esmalte dental moteado, dermatitis y pérdida de peso, fueron referidos con menor frecuencia (3 a 4/13 participantes) (tabla 4).
Signos y síntomas extraintestinales de la familia extendida del caso índice
| Síntomas | n/N | Casos |
|---|---|---|
| Fatiga | 10/13 | F1, F2, F3, F4, F5, F6, F7, F8, F9, F10 |
| Estrés y ansiedad | 8/13 | CI, F2, F3, F4, F5, F7, F9, F10 |
| Trastornos del sueño | 8/13 | CI, F3, F4, F5, F7, F8, F9, F10 |
| Calambres musculares | 8/13 | F1, F2, F3, F4, F6, F7, F9, F11 |
| Debilidad | 7/13 | F2, F3, F4, F5, F6, F7, F9 |
| Cefalea | 7/13 | F2, F3, F4, F5, F7, F9, F10 |
| Depresión | 5/13 | F2, F3, F4, F5, F10 |
| Urticaria | 4/13 | F2, F5, F6, F7 |
| Aftas bucales | 3/13 | CI, F2, F9 |
| Esmalte dental dañado | 3/13 | F5, F8, F9 |
| Anorexia | 3/13 | CI, F7, F9 |
| Dermatitis | 3/13 | CI, F5, F9 |
| Pérdida de peso | 3/13 | F1, F4, F11 |
CI: caso índice.
La familia extendida en estudio, como es aún costumbre en algunos lugares de México, vive en casas contiguas o cercanas a la de los abuelos. Así, además de compartir genética, comparten ambiente, costumbres de crianza y estilo de vida. Las prácticas de alimentación durante la infancia, infecciones microbianas y sus tratamientos pueden influir en la composición de la microbiota, afectar la barrera intestinal y eventualmente detonar la EC15. Esto es importante no solo durante la niñez, sino que puede tener repercusiones en la edad adulta16. De tal forma, los miembros de la familia en estudio compartían el riesgo ambiental para EC.
La mayoría de los participantes presentaron el haplotipo HLA-DQ2 heredado del abuelo (tabla 1), mientras que en nuestra población el haplotipo HLA-DQ8 es el más común en los casos de EC. El mayor riesgo es para HLA-DQ8 (1:9) solo o en combinación con el alelo DQB1*0201 del HLA-DQ2 (1:6), mientras que el HLA-DQ2 tiene un riesgo de 1:2717. Por el contrario, en población europea el 88% de los casos con EC presenta el haplotipo HLA-DQ2 o sus variantes18, con un riesgo promedio de 1:105. Aunque el fenotipo de los participantes es de población mestiza, el del abuelo es caucásico.
El 75% de los familiares en el estudio presentó títulos positivos para IgA antitransglutaminasa tisular (9/13 participantes). Esto es muy superior al 47% con serología positiva que describen Rodrigo et al.19, en un caso familiar. Si se considera que en población mexicana el 0.6% presenta serología positiva para EC1, se puede inferir el alto riesgo de padecer EC en los familiares de los celiacos. De tal forma, se ha descrito una prevalencia combinada del 7.5% en familiares de primer grado y del 2.3% en aquellos de segundo grado7.
En cuanto a los indicadores antropométricos, en general los familiares, al igual que el caso índice, presentaron talla baja. Dos de los adultos varones tuvieron una estatura por debajo del promedio regional (162.7 y 165 vs. 166.5cm)20, mientras que la estatura promedio de las mujeres fue muy inferior al promedio regional (131.04 vs. 155.7cm)21. Se ha descrito que niños con EC de baja talla no alcanzan su máxima estatura en la edad adulta22, relacionándose inversamente con el tiempo de diagnóstico23. Es decir, aunque en apariencia eran asintomáticos, posiblemente los participantes en nuestro estudio padecieron alguna forma menos aguda de EC desde su niñez, lo que pudo afectar su desarrollo. Al caso índice, aunque fue diagnosticado a los 2 años de edad con EC clásica, no se le dio un seguimiento dietético adecuado sino hasta los 6 años.
Por lo que respecta a los síntomas, la mayor parte de los participantes refirieron con mayor frecuencia los gastrointestinales, como distensión abdominal, intolerancia a alimentos, exceso de gases y estreñimiento, lo cual coincide con los encontrados en adultos mexicanos con EC24. Los síntomas extraintestinales fueron menos recurrentes, con fatiga, cefalea, dermatitis y anorexia en los primeros lugares.
No se tomaron biopsias duodenales a los familiares para confirmar el diagnóstico de EC debido a que aunque es el estándar de oro, es un procedimiento invasivo y costoso. Por ello, se ha propuesto el análisis serológico como una opción viable, ya que cuenta con alta sensibilidad y especificidad (98-100%)4. Catassi y Fasano25 proponen que el diagnóstico de EC puede confirmarse si un caso cuenta con al menos 4 de los 5 criterios siguientes: signos y síntomas típicos de EC, serología positiva, genética de riesgo, atrofia de las vellosidades intestinales (determinadas por biopsia) y respuesta a la dieta sin gluten. Así, la mayoría (8/12) de los familiares del caso índice (con diagnóstico previo de EC) presentan indicadores clínicos y serológicos, que corresponden a los primeros 3 criterios enlistados; faltaría evaluar su respuesta a la dieta sin gluten, para considerarlos celiacos.
Un dato interesante de este estudio es que 6/13 de los familiares, incluyendo al caso índice, tenían diagnóstico de asma bronquial, posiblemente asociada a condiciones genéticas y ambientales compartidas. Aunque ha sido poco estudiada la relación entre la EC y el asma, hay evidencia de su asociación. Según Tang et al.26, los linfocitos intraepiteliales de biopsias de celiacos expresan más la fosfolipasa A2 citosólica que sus contrapartes sanas. Además, el receptor NKG2D expresado en linfocitos es capaz de activar la vía citosólica intracelular de las p-cPLA2 en presencia o no de IL-15, y mediar la liberación de ácido araquidónico. Este ácido es el sustrato de las 5-lipooxigenasas y de la leucotrieno C4 sintasa, que conduce a la producción de cisteinil leucotrienos, responsable de la destrucción de los enterocitos. Dicha sobreproducción de leucotrienos induce la inflamación de mucosas y causa la mayoría de las condiciones inflamatorias que previamente se han asociado con alergias y asma27. Así, podría ser que el padecer asma sea un factor de riesgo para desencadenar la EC.
Algunos de los participantes en el estudio (caso índice, F3, F5) habían sido tratados con montelukast para el asma bronquial, pero lo interrumpieron por recomendación médica y actualmente siguen tratamiento con loratadina o clorfenamina. Montelukast es un fármaco inhibidor de los cisteinil leucotrienos para el tratamiento de los síntomas de asma. Su actividad se ha comprobado in vitro en linfocitos intraepiteliales, suprimiendo la citotoxicidad de NKG2D e inhibiendo la producción de cisteinil leucotrienos26. Aunque no ha sido aprobado para el tratamiento de la EC, este fármaco es capaz de bloquear las células T CD8+, responsables de causar daño intestinal. Por eso se encuentran en ensayo clínico en fase ii la eficacia y la seguridad del fármaco para el tratamiento de la EC28.
Algunos estudios epidemiológicos también han explorado la relación entre asma y EC. En una cohorte de niños italianos se encontró un incremento en el riesgo de desarrollar EC en aquellos que previamente habían sido diagnosticados con asma (IRR 1.37, IC 95% 1.09-1.71). El uso de antibióticos, que se ha relacionado con ambas enfermedades, no fue un factor de confusión en la asociación29. Al contrario, en una cohorte de población danesa se concluyó que no hay un incremento en el riesgo de padecer asma si los padres tienen EC30. Por esto, se podría considerar el asma como un factor predisponente para EC y no viceversa. Sin embargo, se requieren más estudios para sustentar la relación entre EC y los mecanismos inflamatorios desencadenados por el asma.
La familia en estudio, naturalmente, comparte la genética y los antecedentes hereditarios que predisponen a padecer EC. Además, al tener un patrón de convivencia muy estrecho, también comparte factores ambientales que pudieran incrementar el riesgo de desarrollar EC. El haplotipo HLA-DQ2 y costumbres de crianza, alimentación y tratamiento de enfermedades pudieran ser factores determinantes en el riesgo incrementado de EC que presentó la familia estudiada. Además, otro factor implicado en el desarrollo de EC en varios de los participantes fue el asma, que a través de mecanismos inflamatorios pudiera desencadenar la EC y que, hasta ahora, ha sido poco estudiado.
Así, se puede concluir que los familiares del niño celiaco, con genética de riesgo, conviven estrechamente compartiendo condiciones ambientales y patrones culturales y varios padecen asma bronquial; estos factores influyeron para que una mayoría presentara indicadores de EC.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónR. Sigala-Robles y S. V. Aguayo-Patrón recibieron apoyo del Consejo Nacional de Ciencia y Tecnología (CONACYT), becas: 394851 y 377998, respectivamente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Véase contenido relacionado en DOI: https://doi.org/10.1016/j.rgmx.2018.03.001, Remes-Troche JM. ¿Doctor, porqué soy celíaco si soy mexicano? Rompiendo un paradigma más de la enfermedad celíaca en México. Rev Gastroenterol Méx. 2018;83:77-8.