«Pólipos serrados» es el término utilizado para describir lesiones epiteliales del colon y recto que demuestran un patrón de «dientes de sierra» de la superficie y epitelio de las criptas. La llamada vía serrada describe la progresión de adenomas serrados sésiles y adenomas serrados tradicionales a cáncer colorrectal. Esta vía está bien reconocida como un mecanismo de carcinogénesis alternativo, el cual representa el 15-30% de los casos de cáncer colorrectal, explicando además una proporción significativa de los casos de cáncer colorrectal de intervalo. Por tal motivo, debido a su comportamiento incierto y usualmente agresivo, los pólipos serrados son un tema de suma relevancia en el cribado de cáncer colorrectal. Nuestro objetivo fue revisar la historia, nomenclatura actual, fisiopatología, características morfológicas, tratamiento y vigilancia de los pólipos serrados.
“Serrated polyps” is the term used for epithelial lesions of the colon and rectum that have a “sawtooth” pattern on the polyp's surface and crypt epithelium. The so-called serrated pathway describes the progression of sessile serrated adenomas and traditional serrated adenomas to colorectal cancer. Said pathway is well recognized as an alternative mechanism of carcinogenesis and accounts for 15-30% of the cases of colorectal cancer. It also explains a large number of the cases of interval colorectal cancer. Thus, due to their usually aggressive and uncertain behavior, serrated polyps are of the utmost importance in colorectal cancer screening. Our aim was to review the history, current nomenclature, pathophysiology, morphology, treatment, and surveillance of serrated polyps.
El término «pólipos serrados» es utilizado para describir lesiones epiteliales del colon y recto que demuestran un patrón histológico de «dientes de sierra» de la superficie del pólipo y el epitelio de las criptas1. Anteriormente, todas las lesiones que presentaban dichas características eran considerados pólipos hiperplásicos (PH)2. En las décadas recientes los pólipos colorrectales se han dividido generalmente en 2 tipos: PH y adenomas. Los adenomas eran considerados el único precursor del cáncer colorrectal (CCR), y los PH eran considerados lesiones sin potencial maligno2. Sin embargo, reportes de hace 3 décadas describieron la asociación de los PH con el potencial de transformación maligna. En 1990 Longacre y Fenoglio-Preiser especificaron un tipo de pólipo colorrectal mixto que compartía características de adenoma y PH, presentando características arquitectónicas, aunque no citológicas, de PH, y lo llamaron «adenoma serrado tradicional», haciendo énfasis en el potencial neoplásico de esas lesiones3. En 1996 Torlakovic et al. describieron por primera vez las lesiones que ahora conocemos como adenomas serrados sésiles, las cuales se caracterizan por presentar una arquitectura anormal sin displasia citológica4.
Actualmente, los diferentes perfiles morfológicos y moleculares de dichas lesiones serradas y su potencial para la transformación maligna son bien conocidos. La llamada vía serrada describe la progresión de los adenomas serrados y los adenomas serrados tradicionales hacia CCR. Dicha vía está bien identificada como un mecanismo alternativo de carcinogénesis colorrectal, que suma entre el 15% y el 30% de los casos de cáncer colorrectal5. Además, la falta de identificación de dichas lesiones serradas podría explicar una proporción significativa de CCR de intervalo6,7.
La nomenclatura actual de los pólipos serrados, de acuerdo con la última clasificación de la Organización Mundial de la Salud (OMS), se divide en PH, adenomas serrados sésiles/pólipos (ASS/P) y adenomas serrados tradicionales (AST)8. La diferenciación precisa de estas lesiones es crucial debido a su diferente potencial para transformación maligna9. A diferencia de los PH, los cuales son las lesiones serradas más comunes (80-90%) en el colon y el recto, se piensa que los ASS/P y AST tienen potencial de transformación maligna. Los ASS/P suman entre el 8%y el 20% de las lesiones serradas en el colon y el recto, y por lo tanto son considerados los más relevantes de las lesiones serradas, dada la rareza de los AST10,11.
Subtipos de lesiones serradasPólipos hiperplásicosLos PH verdaderos son el subtipo de lesión serrada más común. Suman entre el 70% y el 95% de todos los pólipos serrados12, y entre el 25% y 30% de todos los pólipos de colon13 y se caracterizan por su carencia de potencial maligno. Los PH predominan en el colon distal y usualmente son menores de 5mm. Endoscópicamente son lesiones planas o ligeramente elevadas, transparentes o pálidas10,11 (fig. 1A). Histológicamente se caracterizan por criptas rectas, con patrón «serrado» normalmente restringido a la mitad superior14 (fig. 1B).
A. Apariencia endoscópica de un pólipo hiperplásico. Se caracteriza por una lesión plana o ligeramente elevada que es transparente o pálida. B. Apariencia histológica de un pólipo hiperplásico, con criptas alargadas, un mayor número de células que en la mucosa normal, estructura y maduración conservadas, número normal de células calciformes y de absorción, con distribución nuclear y basal regular. Se puede observar un tipo inflamatorio crónico de predominancia linfocítica en la lámina propria.
Los PH también se subclasifican como PH microvesiculares, PH ricos en células caliciformes y PH pobres en mucina, con base en el tipo de patrón de mucina15. El subtipo microvesicular es el más común, conformando 60% de todos los PH12. Histológicamente se caracterizan por células columnares con múltiples vacuolas citoplásmicas pequeñas (microvesicular)16.
Adenoma serrado sésil/pólipoLos ASS/P son los más relevantes de las lesiones serradas, no solo por su potencial maligno, sino también por su difícil detección. Normalmente están ubicados en el colon derecho y suman aproximadamente entre el 5% y el 25% de todos los pólipos serrados12,13 y entre el 1,7% y 9% de todos los pólipos de colon17,18. La presencia de un ASS/P se asocia con el sexo femenino y un mayor número de pólipos en el examen colonoscópico17,19.
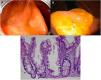
La experiencia y las técnicas endoscópicas de imagen mejorada son necesarias para la detección y resección adecuada de los ASS/P20. Endoscópicamente, miden>10mm de forma usual, son planos y ligeramente elevados, con márgenes indistintos. Su color es similar al de la mucosa circundante, con una superficie similar a una nube, el patrón vascular de la mucosa subyacente está interrumpido y frecuentemente están cubiertos por una capa de moco amarillo10,14,21 (figs. 2A y B). Histológicamente, los ASS/P presentan arquitectura de cripta distorsionada, con un patrón serrado marcado en la base de las criptas. Las criptas basales están dilatadas y se extienden lateralmente en forma de L o T invertida llenas de moco, con la presencia de células maduras arriba de la muscularis mucosae9,14 (fig. 2C).
Adenoma serrado sésil/pólipo. A. Pólipo serrado sésil mayormente plano en el colon derecho. Nótese la coloración similar a la del colon normal adyacente, la escasez de vasos sanguíneos en la superficie de la lesión y la acumulación de desechos amarillos en los bordes. B. Pólipo serrado sésil en el colon derecho. Nótese la prominente «cubierta de moco amarillo». C. Apariencia histológica de un adenoma serrado sésil/pólipo. Tiene arquitectura de cripta distorsionada, con patrón serrado marcado en la base de las criptas; las criptas basales están dilatadas (imágenes endoscópicas tomadas con autorización de: Rex D. Serrated Polyps in the Colon. Gastroenterol Hepatol 2014;10(10). La imagen histológica fue tomada con autorización: Kuo E. Adenoma serrado sésil. [consultado 2 Jul 2020]. Disponible en: http://www.pathologyoutlines.com/topic/colontumorsessileserrated.html.
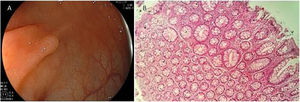
Aunque los AST presentan riesgo de transformación maligna, son las lesiones de tipo serrada menos frecuentes. Aproximadamente suman el 1% de todos los pólipos colorrectales13 y se ubican normalmente en el colon distal. Endoscópicamente, con imagen de banda angosta (NBI, por sus siglas en inglés), aparecen como lesiones superficiales o protuberantes, y en ocasiones pedunculadas y usualmente son>5mm con vasos dilatados13,22. Histológicamente los AST se caracterizan por un patrón de crecimiento velloso y protuberante13. La presencia de criptas ectópicas perpendiculares al eje de las estructuras vellosas, atipia citológica y citoplasma eosinófilo prominente son sus características principales23 (fig. 3).
Sección histológica de un adenoma serrado tradicional, con patrón de crecimiento viliforme protuberante con sierras tipo corte.Tomada de: Kuo E, González R. Adenoma serrado tradicional [consultado 2 Jul 2020]. Disponible en: http://www.pathologyoutlines.com/topic/colontumortraditionalserratedadenoma.html.
Las tablas 1 y 2 presentan resúmenes respectivos de las principales características endoscópicas, clínicas e histopatológicas de los pólipos serrados.
Principales características clínicas y endoscópicas de los pólipos serrados
| Pólipos hiperplásicos | ASS/P | AST | |
|---|---|---|---|
| Frecuencia | Muy común | Común | Raro |
| Predominancia por sexo | No | Mujer | No |
| Localización predominante | Colon izquierdo y recto | Colon derecho | Colon izquierdo y recto |
| Tamaño | <5mm | >10mm | >5mm |
| Apariencia endoscópica | Planos o ligeramente elevados, transparentes o pálidos | Sésiles, discretos, de márgenes amarillos. Cubiertos por una capa de moco | Sésiles |
| Potencial de malignidad | No | Sí | Sí |
ASS/P: adenoma serrado sésil/pólipo; AST: adenoma serrado tradicional.
Principales características histopatológicas de los pólipos serrados95,96
| Pólipos hiperplásicos(microvesiculares) | ASS/P | AST | |
|---|---|---|---|
| Arquitectura de cripta | Criptas rectas | Arquitectura de cripta distorsionada | Patrón de crecimiento protuberante y viliforme |
| Serraciones | Limitados a mitad superior de criptas | Localizados en la base de la cripta | Serraciones tipo hendidura |
| Cripta basal | Angosta | Dilatada y lateralmente extendida (L o T invertida) | Focos de cripta ectópicos |
| Ramificación de cripta | No | Sí | No |
| Zona proliferativa | Localizados en el tercio basal | No en su locación usual en la base de las criptas | Criptas posicionadas anormalmente, con bases no asentadas en la muscularis mucosae |
| Maduración celular | Maduración de la base de la cripta a la superficie | Base de la cripta | Pérdida de orientación hacia la muscularis mucosae |
| Característica principal | Criptas rectas con serración superior | Crecimiento invertido y base de cripta dilatada | Serraciones tipo hendicura, criptas ectópicas, células con citoplasma eosinofílico |
ASS/P: adenoma serrado sésil/pólipo; AST: adenoma serrado tradicional.
La vía serrada está reconocida como la segunda vía más importante hacia el CCR, después de la vía adenoma-carcinoma. Respecto a los pólipos serrados y el CCR la biología es heterogénea, culminando en 2 vías serradas postuladas principales hacia el CCR: la vía de mutación BRAF y la vía de mutación KRAS.
La vía de mutación BRAF se caracteriza por niveles elevados del fenotipo metilador de islas CpG (CIMP), lo cual lleva al silenciamiento del gen reparador de disparidades hMLH1, y resulta en una elevada inestabilidad microsatelital (MSI-H) y la consecuente evolución a displasia, displasia de grado alto y finalmente a CCR (mutación BRAF/CIMP-elevado/MSI-H)24. Los carcinomas colorrectales que siguen la vía mutación BRAF/CIMP-elevado/MSI-H conforman la mayoría de los CCR esporádicos no asociados a síndrome con MSI-H, representando aproximadamente el 12-15% de todos los CCR7.
Al contrario, la vía de mutación KRAS se caracteriza por un nivel bajo de metilación de islas CpG, sin desactivación del gen reparador de disparidades hMHL1, y con estabilidad microsatelital (mutación KRAS/CIMP-bajo/MSS). Por lo tanto, el principal estímulo hacia la carcinogénesis en dichos casos es la mutación de genes supresores, como es el caso con SLIT-2 y p537,25. El carcinoma colorrectal que sigue la vía de mutación KRAS/CIMP-bajo/MSS representa aproximadamente el 5% de todo el CCR26.
Correlacionando las características histológicas de los pólipos serrados con sus características moleculares genéticas, los ASS/P y los AST parecen ser 2 entidades genéticas distintas. Predominantemente, los ASS/P con displasia presentan mutación BRAF, mientras que los AST tienen la mutación KRAS27.
Correlación histológica con imagen endoscópicaA diferencia de los adenomas, cuya incidencia es alrededor del 30-40% en la población general, las lesiones serradas se encuentran solamente en el 5-8%. Sin embargo, podrían ser subestimadas debido a la dificultad para identificarlas en una colonoscopia de tamizaje de rutina28,29.
En general, los ASS/P pueden diferenciarse de los PH por la presencia de una cubierta de moco y criptas dilatadas (patrón de cripta abierta tipo ii)22,30. Sin embargo, varias características endoscópicas específicas, como bordes indistintos, una superficie en forma de nube, forma irregular y puntos oscuros dentro de las criptas, en endoscopia de luz blanca de alta resolución y NBI, han ayudado a identificar la histología ASS/P con un alto grado de precisión21.
La distinción entre ASS/P no malignos y ASS/P con displasia es de la mayor relevancia. La técnica NBI ha demostrado ser de mucho valor, tanto para identificar las características de alto riesgo de malignidad en lesiones serradas, al igual que para incrementar la detección de lesiones serradas en el colon proximal31. La detección de vasos irregulares por medio del magnificación por NBI tiene 100% de sensibilidad, 99% especificidad, 86% valor predictivo positivo y 100% valor predictivo negativo para identificar la coexistencia de cáncer con ASS/P30. Otras características, como tamaño de lesión (OR: 1,9 para displasia por cada incremento de 10mm en el tamaño de lesión), incremento de edad (OR: 1,69 por década), patrón de criptas (adenomatoso) de Kudo III, IV o V, y el componente 0-Is de la clasificación de París han demostrado correlacionar bien con displasia32.
Cánceres de intervaloLos cánceres de intervalo se definen como CCR diagnosticado dentro de 5 años de una colonoscopia de cribado. Aproximadamente son el 2-6% de todo el CCR33,34.
Se han identificado varios factores como causa de los cánceres de intervalo. Pólipos no identificados debido a una preparación inadecuada del colon, examen incompleto del colon, resección incompleta de pólipos y lesiones no identificadas (p.ej.: ASS/P), localizadas predominantemente en el colon derecho, son los factores principales asociados con el CCR de intervalo33.
Existe evidencia de que el CCR esporádico puede surgir de lesiones ASS/P. En primer lugar, el CCR de intervalo ocurre 3 veces más frecuentemente en el colon derecho, en comparación con el cáncer esporádico33. Además, el cáncer de colon de intervalo está asociado 4 veces más con disfunción de gen reparador de disparidades que el cáncer esporádico35,36. Estos datos sugieren un posible origen serrado de mutación BRAF7. Además de los factores previamente mencionados, los cánceres CIMP-H y MSI-H presentan crecimiento o evolución acelerados, con transformación maligna en menos de 10años desde el último examen de colonoscopia13.
Progresión a malignidadLa tasa de lesiones serradas que progresan a carcinoma no está clara y puede diferir, dependiendo de la ocurrencia de MSI-H. Entre las lesiones serradas con potencial maligno la tasa de displasia es más alta en AST (9,3%) en comparación con ASS/P (2%)37. La aparición reportada de displasia de alto grado y carcinoma en adenomas serrados es entre 2% y 3,2%37,38, lo cual es menor a la tasa de 9,3% en adenomas convencionales37.
Se ha reportado un riesgo de 5% de cáncer serrado posterior a una resección endoscópica de adenoma serrado índice39. El hecho de que la tasa de progresión a carcinoma no serrado es mayor cuando no hay resección de adenomas convencionales (14,3%), sugiere que la tasa de transformación neoplásica para adenomas serrados no resecados es mayor a 5%39.
Respecto al tiempo de progresión a malignidad, en un reporte de caso se demostró una rápida progresión de ASS/P a carcinoma invasivo temprano en un lapso de 8 meses40. Sin embargo, un estudio que analizó 106 pólipos serrados, de los cuales la mayoría eran del colon derecho y precedían a 91 adenocarcinomas MSI, demostraron una progresión más lenta, con un promedio de intervalo de tiempo de 7,3 años entre polipectomía y el desarrollo del adenocarcinoma subsecuente (rango 1,2-19,3 años)41. A pesar de que no existe evidencia clara de la proporción y tasa de progresión, el potencial de malignidad de las lesiones serradas ha sido bien documentado, conformando una proporción significativa de los casos totales de CCR. Por lo tanto, las lesiones serradas deberían ser consideradas un objetivo importante de prevención de CCR, para impactar la incidencia de CCR derecho.
Cáncer metacrónico y sincrónicoEn pacientes con lesiones serradas (PH, ASS/P o AST), la ocurrencia de CCR serrado metacrónico sucedió en el 5% de los casos, después de un promedio de 14,25 años tras el examen inicial39. Existe debate respecto a la cuestión de si las lesiones serradas incrementan el riesgo de neoplasia metacrónica en comparación con adenomas convencionales. Algunos reportes demostraron un riesgo de neoplasia metacrónica en el 2-5% de los pacientes con lesiones serradas39,42, lo cual no fue significativamente diferente de la tasa de CCR en pacientes con adenoma convencional (2,2%)39. Otros estudios reportaron un riesgo significativamente más alto de neoplasia metacrónica en pacientes con ASS/P (12,5%) que en pacientes con PH (1,8%) y adenomas (1,8%)43.
La asociación entre lesiones serradas y neoplasia sincrónica es más clara18,44. La tasa de lesiones serradas adicionales (ASS/P, ASS/P con displasia y AST) en pacientes con resección de ASS/P inicial fue 18%, en comparación con 5% en una población control45. Los PH proximales y grandes (≥10mm), así como los ASS/P proximales y grandes (≥10mm), han sido asociados con neoplasia avanzada sincrónica18. La tasa de neoplasia avanzada sincrónica es de aproximadamente 17,8% en PH y ASS/P proximales, en comparación con 8% en pólipos no proximales, y la tasa de neoplasia avanzada sincrónica es de aproximadamente 27% en pólipos grandes (PH y ASS/P)>10mm, en comparación con pólipos más pequeños (8,6%)18.
Factores de riesgo para lesiones serradasMuchos factores han sido asociados con un mayor riesgo para pólipos serrados, entre ellos etnicidad, historia familiar y factores modificables como el estilo de vida y la dieta. En conexión con la raza/etnicidad el riesgo para pólipos serrados (en el colon izquierdo) es menor en afroamericanos (RR: 0,65; IC 95%: 0,50-0,85) e hispánicos (RR: 0,33; IC 95%: 0,20-0,55), en comparación con blancos46. Una historia familiar de CCR o pólipos está asociada con lesiones serradas en el colon derecho46,47.
Los principales factores modificables de estilo de vida asociados con lesiones serradas son obesidad y tabaquismo46,48. Un índice de masa corporal ≥30 estuvo asociado con un incremento de 27% en el riesgo para lesión serrada en el colon izquierdo, en comparación con peso normal. El tabaquismo en activo incrementó el riesgo de lesiones serradas izquierdas (RR: 2,18; IC 95%: 1,80-2,65) y de lesiones serradas izquierdas avanzadas (RR: 3,42; IC 95%: 1,91-6,11), en comparación con no fumar46. El alto consumo de alcohol (≥14bebidas/semana) también estuvo asociado significativamente con una riesgo incrementado de neoplasia (OR: 2,65; IC 95%: 1,37-5,15)48. Entre los factores dietéticos el consumo elevado de grasas incrementó el riesgo de lesiones serradas en el colon derecho e izquierdo (RR: 1,27; IC 95%: 1,03-1,56) y en el colon izquierdo (RR: 1,45; IC 95%: 1,01-2,10). El consumo de carnes rojas incrementó significativamente el riesgo de pólipos serrados izquierdos avanzados (RR: 1,93; IC 95%: 0,97-3,84)46.
Respecto al tratamiento, el uso de ácido acetilsalicílico (81mg) redujo el riesgo de lesiones serradas no avanzadas en el colon derecho. Una dosis más alta de ácido acetilsalicílico (325mg) ofreció un efecto protector para lesiones avanzadas en el colon derecho46. El consumo de fibra de cereal>4,2g por día (RR: 0,65; IC 95%: 0,43-0,98) y la ingesta de vitamina D>645U por día (RR: 0,61; IC 95%: 0,39-0,97) también estuvieron asociados con un riesgo disminuido de neoplasia avanzada48.
Síndrome de poliposis serradaEl síndrome de poliposis serrada (SPS) se caracteriza por el desarrollo de múltiples pólipos serrados a lo largo del colon. Desde la publicación de la cuarta edición de los criterios de la OMS para el diagnóstico de SPS en 201015, la comprensión del SPS ha mejorado considerablemente, resultando en una actualización de los criterios de diagnóstico de 2010, incorporado en la quinta edición de la clasificación de Tumores del sistema digestivo de la OMS en 20198. Los siguientes son los criterios actualizados para el diagnóstico de SPS:
- I.
Un número≥5 lesiones serradas/pólipos proximales al recto, todos de tamaño≥5mm, con al menos 2≥10mm.
- II.
Más de 20 lesiones serradas/pólipos de cualquier tamaño distribuidos a lo largo del intestino grueso, con al menos≥5 proximales al recto.
La actualización de 2019 de los criterios de diagnóstico de SPS hizo varios cambios importantes, de los cuales el más notable fue la eliminación del criterio ii (2010), mientras que el criterio i (2010) y el criterio iii (2010) tuvieron modificaciones menores. Los criterios de 2010 solamente incluían pólipos proximales al colon sigmoides, mientras que el criterio i de 2019 incluye ahora pólipos serrados en el colon sigmoides. Además, todos los pólipos serrados en el criterio i de 2019 deben ser≥5mm, con lo que se excluye a los pólipos serrados diminutos para el diagnóstico de SPS (tabla 3).
Criterios de diagnóstico para SPS de la Organización Mundial de la Salud 2010 y 201997
| 2010 | 2019 | |
|---|---|---|
| Criterio I. ≥5 pólipos serrados proximales al colon sigmoides con 2 o más>10mm | → | Criterio I. ≥5 lesiones serradas/pólipos proximales al recto, todos ≥5mm de tamaño, con al menos 2≥10mm |
| Criterio II. Cualquier cantidad de pólipos serrados proximales al colon sigmoides en un individuo con un pariente de primer grado con SPS | ||
| Criterio III.> 20 pólipos serrados de cualquier tamaño dispersos a lo largo del colon | → | Criterio II.> 20 lesiones serradas/pólipos de cualquier tamaño distribuidos a lo largo del intestino grueso, con≥5 proximales al recto |
SPS: síndrome de poliposis serrada.
A pesar de que la clasificación proporciona criterios de diagnóstico estandarizados, y permite la comparación entre estudios, es hasta cierto punto arbitraria y restrictiva. En consecuencia, pacientes con 5 pólipos serrados, de los cuales solamente uno es>10mm de diámetro, o pacientes con 10 o 20 pólipos serrados<10mm, no entran en la definición de SPS. Sin embargo, a pesar de que este subgrupo no cumple completamente los criterios de la OMS para SPS, aún tienen importancia clínica.
Un estudio retrospectivo realizado en la Cleveland Clinic and the Genomic Medicine Institute analizó pacientes con pólipos serrados, reconociendo 3 patrones fenotípicos: pólipos serrados sésiles grandes (>10mm) en el colon derecho (fenotipo derecho 48%), múltiples pólipos hiperplásicos pequeños en el colon izquierdo (fenotipo izquierdo 16%) y un tercer fenotipo con características de los 2 tipos previos (fenotipo mixto 37%)49. Los 3 fenotipos tuvieron una incidencia similar al CCR (derecho 27%, izquierdo 28% y mixto 21%), donde el fenotipo derecho presentó más ASS/Ps y una tendencia a desarrollar CCR a menor edad49.
La prevalencia de SPS es baja (<0,1%) en programas de tamizaje de colonoscopia18,50. En una población seleccionada con prueba inmunoquímica fecal positiva la prevalencia fue naturalmente más alta (0,34-0,66%)51,52. Los pacientes con SPS y sus familiares presentan mayor riesgo de CCR, con una incidencia de entre el 7% y el 70%6,53–55 y un riesgo de cáncer de intervalo de entre el 2% y 7%6,53,56. Los principales factores predictivos de CCR en pacientes con SPS son el número de ASS/P proximales y la presencia de displasia de alto grado en una ASS/P proximal53.
A diferencia de otros síndromes de cáncer colorrectal hereditarios, como el síndrome de Lynch y la poliposis adenomatosa familiar, el SPS no tiene un patrón de herencia mendeliano simple57. De manera interesante se ha reportado que el CCR en pacientes con SPS sigue tanto la vía serrada como la vía tradicional de adenoma-carcinoma56. Los pacientes con SPS y sus familiares también presentan riesgo elevado de neoplasia extracolónica (próstata, piel, leucemia/linfoma, mama, pulmón, etc.)49.
Detección de lesiones serradasLa colonoscopia es el método preferido y más preciso para detectar pólipos de colon58. Debido a la progresión relativamente lenta de los pólipos serrados, su detección y resección endoscópica puede detener su progresión a cáncer. A pesar de esto, los programas de vigilancia colonoscópica han tenido un impacto positivo en la disminución de la incidencia de CCR solamente en el colon izquierdo, mientras que la incidencia y mortalidad asociadas con el colon derecho no han cambiado59. La falta de impacto en la incidencia del CCR derecho se asume por la falta de identificación de ASS/P en el colon derecho durante colonoscopias de cribado59.
Se han realizado varias intervenciones para mejorar las tasas de detección de lesiones serradas60. Técnicas endoscópicas de imagen mejorada, como la cromoendoscopia y la endoscopia magnificada han mejorado la detección de PH61–63. Las colonoscopias de alta resolución no han demostrado una mejoría en la detección de lesiones serradas64,65. La cromoendoscopia ha demostrado mejorar la detección de PH del 23% al 45% en todo el colon, y del 9% al 16% en el colon derecho58. El índigo carmín, el agente de tinción más común en la cromoendoscopia del colon, delimita las lesiones más claramente, en particular los pólipos hiperplásicos proximales planos. Por otro lado, el espray de ácido acético, en combinación con NBI, ha delineado los ASS/P con mayor precisión, lo que ha permitido una resección completa66. De manera interesante se ha reportado que la mezcla de ácido acético-índigo carmín mejora la visibilidad del margen de la lesión, por medio de del blanqueamiento de la superficie de la lesión67. Sin embargo, se requiere de estudios prospectivos de visibilidad/detección antes de que se pueda dar una recomendación sólida.
La cromoendoscopia (NBI, FICE o iSCAN) ha sido utilizada para mejorar las tasas de detección de lesiones serradas. Sin embargo, en un metaanálisis donde se comparó NBI vs. endoscopia de luz blanca no se encontró mejoría en la tasa de detección de adenoma68. El uso de FICE en un estudio prospectivo multicéntrico no mostró ventaja sobre la endoscopia de luz blanca en términos de la tasa de detección de adenoma general e identificación de PH69. El uso de LASEREO, imagen de luz azul (BLI por sus siglas en inglés) e imagen de color vinculado (LCI por sus siglas en inglés), mejoró la precisión diagnóstica de las lesiones serradas en colon y recto, en comparación con la endoscopia de luz blanca por sí sola70. Aunque el uso de LBI y LCI fue superior a la endoscopia con luz blanca, se requieren más estudios para determinar cuál de ellas es superior70. La utilización de iSCAN no estuvo asociada con una mejoría en la detección de adenoma o en la prevención de pólipos no detectados71. En un estudio aleatorizado controlado donde se comparó la tasa de detección de ASS/P entre iSCAN 1 y colonoscopia con luz blanca de alta definición estándar no se encontró diferencia72. No encontramos estudios que compararan específicamente efectos diferentes del iSCAN respecto a la detección de lesiones serradas.
Otra intervención, como el mayor tiempo de retirada (por encima de 6minutos), ha demostrado mejorar la tasa de detección de pólipos serrados, con un beneficio máximo a los 9minutos73,74. Se ha descrito que la realización de retroflexión en el colon derecho es un técnica segura que mejora modestamente las tasas de detección de pólipo y adenoma75. A diferencia de reportes sobre la mejoría en la tasa de detección de adenomas por preparación intestinal, esta no ha tenido impacto en la mejoría de la tasa de detección de lesiones serradas. Se ha encontrado una tasa de detección de pólipos serrados del 8,8% en pacientes con excelente preparación intestinal, en comparación con 8,9% en pacientes con preparación intestinal adecuada76. Otros factores, como el entrenamiento formal en gastroenterología, un mayor volumen de procedimientos, y de manera interesante una menor cantidad de años en la práctica (≤9 años desde la finalización del entrenamiento) han tenido una influencia positiva en la detección de lesiones serradas77.
La NBI permite la identificación de ASS/P al identificar su forma irregular y puntos oscuros dentro de las criptas, lo cual indica dilatación de cripta, que es una característica histológica de los ASS/P78,79. Por otro lado, la cromoendoscopia magnificada permite diferenciar ASS/P con displasia o carcinoma de aquellos sin displasia, por medio de la identificación de características endoscópicas, como morfologías semipedunculadas, dobles elevaciones, depresiones centrales y enrojecimiento, al igual que por la presencia de patrones de cripta iiil, iv, vi o vn78,79.
Más recientemente la inteligencia artificial (redes neurales convolucionales) que utilizan modelos de aprendizaje profundo, con equipos de entrenamiento de vídeo/imagen, ha mejorado la detección y caracterización de pólipos por colonoscopia80,81. Esta tecnología emergente ha mostrado un alto nivel de precisión para detectar ASS/P, con un área bajo la curva de 0,94, un valor predictivo positivo de 0,93 y un valor predictivo negativo de 0,9682.
Resección endoscópica de lesiones serradasLa resección completa de lesiones serradas es el objetivo principal para prevenir el desarrollo de CCR. Las técnicas de resección para manejar lesiones de colon son las mismas que se utilizan para adenomas convencionales. La polipectomía con asa fría es una técnica segura para la resección de pólipos sésiles diminutos y tiene una tasa de recuperación de pólipos alta (98-100%)83,84. La técnica preferida para lesiones serradas mayores, superficiales, elevadas o con poca definición es la resección endoscópica de la mucosa, con inyección submucosa previa (inyección y corte)85,86. Variaciones de técnicas de resección endoscópica de la mucosa, como la inyección-levantamiento-corte, la resección endoscópica de la mucosa asistida por capuchón y la resección endoscópica de mucosa con ligadura han tenido buenos resultados85,87.
La postura establecida de la British Society of Gastroenterology respecto a pólipos serrados en colon y recto es realizar la resección de lesiones complejas (lesiones grandes en el colon derecho) en centros que cuenten con operadores de experiencia en el reconocimiento y manejo endoscópico de dichas lesiones60. Esta recomendación se apoya en los resultados de varios estudios que demuestran un alto riesgo de resecciones endoscópicas incompletas y complicaciones asociadas con la resección de pólipos sésiles grandes en el colon derecho88–90. Los endoscopistas que intentan tratar dichas lesiones deben lograr la competencia y los estándares establecidos en las directrices internacionales del manejo de pólipos colorrectales no pediculados grandes90.
Posterior a la resección fragmentada de lesiones serradas grandes>20mm, y antes de enrolar a los pacientes en un programa de vigilancia largo, de inicio se recomienda una revisión endoscópica a los 3-6 meses y un año posteriores a la resección de la lesión inicial, con la finalidad de examinar el sitio de la polipectomía en busca de recurrencia91.
Vigilancia de lesiones serradasLa recomendación de seguimiento de vigilancia por intervalos está basada en el riesgo intrínseco lesión-paciente60. Los pacientes con pólipos serrados que cumplen con los criterios para SPS son casos de alto riesgo. Una vez que las lesiones han sido resecadas, el intervalo de tiempo recomendado para la colonoscopia de vigilancia en pacientes con SPS es cada uno o 2 años. En pacientes con lesiones de alto riesgo, como ASS/Ps grandes>10mm, o asociados con displasia o AST92, se recomienda la colonoscopia de vigilancia en 3 años93,94. Los PH o lesiones serradas<10mm, sin displasia asociada, son consideradas de bajo riesgo. No existe evidencia que sustente la indicación de vigilancia colonoscópica, a menos que la lesión cumpla con los criterios para SPS respecto a tamaño, localización o número60. En la tabla 4 se muestra un resumen de los intervalos de vigilancia recomendados para lesiones serradas.
Recomendación de vigilancia posterior a resección de pólipo serrado7,60
| Riesgo | Descripción de lesiones | Intervalo de vigilancia |
|---|---|---|
| Lesiones de bajo riesgo | Pólipos hiperplásicos* | Sin vigilancia |
| ASS/P<10mm sin displasia* | <3 pólipos ------- 5 años≥3 pólipos ------- 3 años | |
| Lesiones de alto riesgo | ASS/P≥10mm o displasia | 3 años** |
| AST | ||
| SPS | Múltiples pólipos serrados que cumplen los criterios para SPS | 1-2 años |
ASS/P: adenoma serrado sésil/pólipo; AST: adenoma serrado tradicional; SPS: síndrome de poliposis serrada.
Posterior a la resección fragmentada de lesiones serradas grandes>20mm, se recomienda la revisión endoscópica en 3-6 meses y, nuevamente un año posterior a la resección de la lesión índice, con la finalidad de examinar el sitio de polipectomía en busca de recurrencia, antes de enrolar a los pacientes en un programa de vigilancia más largo.
Los autores declaran que la presente revisión cumple con las normas vigentes de investigación bioética, y debido a su naturaleza narrativa no se requirió la autorización del comité de ética. Los autores declaran que esta revisión no contiene información personal alguna que pudiera identificar a pacientes.
FinanciaciónNo recibimos financiación alguna con relación a la preparación de este manuscrito.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.










![Adenoma serrado sésil/pólipo. A. Pólipo serrado sésil mayormente plano en el colon derecho. Nótese la coloración similar a la del colon normal adyacente, la escasez de vasos sanguíneos en la superficie de la lesión y la acumulación de desechos amarillos en los bordes. B. Pólipo serrado sésil en el colon derecho. Nótese la prominente «cubierta de moco amarillo». C. Apariencia histológica de un adenoma serrado sésil/pólipo. Tiene arquitectura de cripta distorsionada, con patrón serrado marcado en la base de las criptas; las criptas basales están dilatadas (imágenes endoscópicas tomadas con autorización de: Rex D. Serrated Polyps in the Colon. Gastroenterol Hepatol 2014;10(10). La imagen histológica fue tomada con autorización: Kuo E. Adenoma serrado sésil. [consultado 2 Jul 2020]. Disponible en: http://www.pathologyoutlines.com/topic/colontumorsessileserrated.html.](https://static.elsevier.es/multimedia/03750906/0000008600000003/v1_202106240736/S0375090621000446/v1_202106240736/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w97o/wdEXW47bqlyT1CqG6R0=)
![Sección histológica de un adenoma serrado tradicional, con patrón de crecimiento viliforme protuberante con sierras tipo corte.Tomada de: Kuo E, González R. Adenoma serrado tradicional [consultado 2 Jul 2020]. Disponible en: http://www.pathologyoutlines.com/topic/colontumortraditionalserratedadenoma.html.](https://static.elsevier.es/multimedia/03750906/0000008600000003/v1_202106240736/S0375090621000446/v1_202106240736/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w97o/wdEXW47bqlyT1CqG6R0=)


