La enfermedad por reflujo gastroesofágico (ERGE) por su elevada prevalencia, fisiopatología compleja y su espectro amplio de manifestaciones clínicas requiere de un diagnóstico y tratamiento de precisión.
ObjetivoEn esta revisión de expertos latinoamericanos se hacen recomendaciones de buena práctica clínica para el uso racional de las pruebas diagnósticas y la prescripción de un tratamiento personalizado de la ERGE.
MétodosLas recomendaciones de buena práctica clínica se generaron por un grupo de expertos en la ERGE de Latinoamérica. Se realizó una revisión detallada de la literatura, y se emitieron recomendaciones sobre el diagnóstico y el tratamiento de la ERGE después de 3 discusiones en grupo.
ResultadosVeintidós expertos en la ERGE elaboraron 30 recomendaciones de buena práctica clínica para la indicación apropiada de pruebas diagnósticas y tratamiento médico de los fenotipos de la enfermedad, el manejo de la ERGE refractaria, indicaciones de tratamiento quirúrgico y endoscópico, y el control de la ERGE en obesidad, embarazo, adulto mayor y el papel de la infección por Helicobacter pylori y agonistas de GLP-1.
ConclusionesLa fenotipificación del paciente con la ERGE con el uso apropiado de pruebas diagnósticas permite la prescripción de un tratamiento personalizado. Las recomendaciones establecidas en este documento pueden contribuir a mejorar la calidad de atención del paciente con la ERGE.
Due to its elevated prevalence, complex pathophysiology, and broad spectrum of clinical manifestations, gastroesophageal reflux disease (GERD) requires precision diagnosis and treatment. The aim of this Latin American expert review was to provide good clinical practice recommendations for the rational use of diagnostic tests and the personalized treatment of GERD.
MethodsGood clinical practice recommendations were developed by a group of Latin American experts in GERD. A thorough review of the literature was conducted, and recommendations on the diagnosis and treatment of GERD were issued after three group discussions.
ResultsTwenty-one experts on GERD formulated 30 clinical recommendations for appropriately indicating diagnostic tests for disease phenotypes and their medical treatment, refractory GERD management, endoscopic and surgical treatment indications, the control of GERD in obesity, pregnancy, and older adults, as well as the role of Helicobacter pylori infection and GLP-1 agonists.
ConclusionsDetermining GERD phenotypes in patients through the appropriate use of diagnostic tests enables personalized treatment to be prescribed. The recommendations established in this document may contribute to improving the quality of care of patients with GERD.
La enfermedad por reflujo gastroesofágico (ERGE) se define por la presencia de síntomas o lesiones causadas por el retorno del contenido gástrico al esófago, que incomodan al paciente y alteran su calidad de vida1. La ERGE es muy prevalente en la población general y afecta a uno de cada 5 adultos2.
Su fisiopatología es multifactorial siendo los principales mecanismos: 1) Pérdida de la barrera antirreflujo secundaria a relajaciones transitorias e incompetencia del esfínter esofágico inferior (EEI) o presencia de hernia hiatal; 2) Motilidad esofágica anormal; 3) Secreción salival disminuida; 4) Pobre resistencia del epitelio esofágico; 5) Vaciamiento gástrico retrasado, y 6) Reflujo duodenogastroesofágico3. Sus manifestaciones clínicas son variadas e incluyen síntomas esofágicos como pirosis y regurgitación y extraesofágicos como tos, laringitis, asma. También puede complicarse con estenosis, esófago de Barrett y cáncer1. Por ello, actualmente disponemos de pruebas diagnósticas que permiten fenotipificar al paciente y establecer un tratamiento de precisión. El presente documento tiene como objetivo dar recomendaciones actualizadas de buena práctica clínica para el diagnóstico y el tratamiento de la ERGE basadas en la revisión de la literatura y las opiniones de los expertos latinoamericanos.
MétodosEn esta revisión latinoamericana participaron especialistas seleccionados con base en su reconocida trayectoria académica, docente, de investigación y asistencial cuya área de interés es la ERGE. Participaron 22 gastroenterólogos de diversos países de Latinoamérica (LATAM): México, Guatemala, Costa Rica, Honduras, República Dominicana, Colombia, Venezuela, Ecuador, Perú, Brasil, Chile y Argentina. Se hizo una extensa revisión de la literatura publicada en los últimos 20 años sobre la ERGE, pruebas diagnósticas y tratamiento. Los expertos se dividieron en 5 grupos de trabajo para revisar las publicaciones y elaborar recomendaciones sobre: 1) Manifestaciones clínicas: síntomas típicos, extraesofágicos y complicaciones de la ERGE; 2) Indicaciones de pruebas diagnósticas; 3) Tratamientos de precisión basados en fenotipos endoscópicos y por medición del reflujo gastroesofágico; 4) Tratamiento endoscópico y quirúrgico de la ERGE, y 5) La ERGE en poblaciones especiales. La versión 1.0 de las recomendaciones realizadas por cada uno de los grupos fue discutida y votada por todos los expertos en una reunión virtual. La versión 2.0 fue revisada y corregida por cada uno de los autores en forma individual y enviadas al coordinador general (MAV) quien se encargó de editarlas e incluirlas en la versión 3.0. El mismo proceso se llevó a cabo con la versión 3.0. Esta última fue sometida a una revisión final por todos los participantes para su aprobación y se generó el documento que aquí se presenta.
Manifestaciones clinicas: síntomas típicos, extraesofágicos y complicaciones de la enfermedad por reflujo gastroesofágicoRecomendación 1. Los síntomas típicos como pirosis y regurgitación, o atípicos como dolor torácico y las manifestaciones extraesofágicas de asma, laringitis, tos y erosiones dentales, sugieren el diagnóstico de la ERGE y requieren de pruebas que demuestren objetivamente la presencia de esta enfermedad.
Los síntomas típicos de reflujo incluyen la pirosis definida por la sensación de quemadura retroesternal que asciende del epigastrio al cuello y la regurgitación, que es el retorno sin esfuerzo del contenido gástrico hacia la boca, acompañado de sabor ácido o amargo. Estos 2 síntomas tienen sensibilidad del 30 al 76% y especificidad del 62 al 92% lo cual permite hacer un diagnóstico presuntivo de la ERGE y requieren de una evaluación con pruebas objetivas para establecer el diagnóstico de certeza4. Deben estar presentes en intensidad leve al menos 2 días de la semana, y cuando son moderados a graves, al menos una vez por semana. Ocurren principalmente después de las comidas y su presentación nocturna conlleva a alteraciones del sueño y deterioro de la calidad de vida5. El dolor torácico puede ser un síntoma de la ERGE. Su semiología es indistinguible del dolor por cardiopatía isquémica y por ello requiere primero de una evaluación cardiovascular exhaustiva que descarte un origen cardiaco antes de considerarlo como manifestación de la ERGE6.
La sialorrea, eructos, hipo y disfagia son otros síntomas que pueden ser debidos a la ERGE, sin embargo, no son característicos de la enfermedad. La disfagia es un signo de alarma y siempre requiere de una evaluación diagnóstica precisa.
La ERGE puede presentarse clínicamente con síntomas extraesofágicos. Las manifestaciones extraesofágicas que tienen una asociación establecida con la ERGE son tos, laringitis, asma bronquial y erosiones dentales. La otitis media, sinusitis o fibrosis pulmonar son manifestaciones que posiblemente están asociadas a la ERGE. Estas manifestaciones siempre requerirán de pruebas objetivas para poder ser atribuidas a la ERGE (tabla 1).
Síntomas y complicaciones de la ERGE
| Síntomas típicos | Síntomas atípicos | Síntomas extraesofágicos | Complicaciones |
|---|---|---|---|
| Pirosis | Dolor torácico | Tos | Hemorragia |
| Regurgitación | Laringitis | Estenosis | |
| Asma bronquial | Esófago de Barrett | ||
| Erosiones dentales | Adenocarcinoma | ||
| Globus | |||
| Ronquera/carraspeo | |||
| Fibrosis pulmonar | |||
| Sinusitis |
ERGE: enfermedad por reflujo gastroesofágico.
Recomendación 2. Son complicaciones de la ERGE la estenosis esofágica, las úlceras esofágicas, la hemorragia digestiva, el esófago de Barrett y el adenocarcinoma del esófago, y deben sospecharse en sujetos con factores de riesgo establecidos, tales como el sexo masculino, edad mayor de 50 años, obesidad, consumo de tabaco y síntomas de más de 5 años de duración.
La esofagitis erosiva (EE) es la complicación más común de la ERGE y ocurre en aproximadamente el 30% de los pacientes. El esófago de Barrett (EB), con su potencial carcinogénico, es la complicación más grave de la ERGE de larga evolución y está presente entre el 1-5% de los pacientes con síntomas de la ERGE que son sometidos a una endoscopia. La presencia de disfagia, pérdida de peso o manifestaciones de hemorragia digestiva como hematemesis o melena son datos de alarma que obligan a sospechar complicaciones en un paciente con ERGE.
La obesidad central es un factor de riesgo de tener la ERGE y desarrollar algunas de sus complicaciones7. La obesidad ha sido implicada en un espectro de enfermedades esofágicas relacionadas con el reflujo que van desde la EE, el EB, hasta el adenocarcinoma de esófago (ACE)8. La obesidad promueve la ERGE por alteraciones de la anatomía y fisiología de la unión gastroesofágica. Un estudio realizado en población japonesa que incluyó un total de 2,608 personas, el área de grasa visceral se asoció con la presencia de esofagitis por reflujo tanto en hombres como en mujeres. El tabaquismo y los niveles séricos de triglicéridos también se asociaron con la presencia de esofagitis en los hombres. Sin embargo, no se demostró una asociación significativa entre el área de grasa visceral y la gravedad de la esofagitis o la presencia de EB. En los hombres, el consumo de alcohol se asoció tanto con la gravedad de la esofagitis como con la presencia de EB9.
Uso racional de pruebas diagnósticasPrueba terapéutica con los inhibidores de la bomba de protonesRecomendación 3. En pacientes con síntomas típicos, sin datos de alarma recomendamos una prueba con los inhibidores de la bomba de protones (IBP) a dosis estándar por 2 a 4 semanas y en casos de dolor torácico no cardiaco por 4 a 8 semanas.
La presencia de síntomas típicos y la mejoría de los mismos con fármacos antisecretores como los IBP condujo al uso de la llamada prueba con IBP como herramienta diagnóstica de la ERGE, en lugar de realizar pruebas objetivas en pacientes jóvenes (edad <45 años) y sin síntomas de alarma10. La prueba consiste en administrar un IBP por un tiempo determinado y se define como positiva cuando el paciente tiene una mejoría sintomática mayor al 50%. La prueba fue descrita originalmente con omeprazol, pero al ser validada con otros IBP pasó a llamarse «prueba con IBP»11–14. Esta prueba puede realizarse con una dosis estándar, o con dosis doble de IBP (tabla 2). No hay una estandarización en cuanto a la duración de la misma. Se ha utilizado de una a 8 semanas.
Dosis de IBP utilizadas en la ERGE
| Tipo de IBP | Dosis estándar | Dosis doble |
|---|---|---|
| Omeprazol | 20mg | 20mg/2 veces al día |
| Pantoprazol | 40mg | 40mg/2 veces al día |
| Esomeprazol | 40mg | 40mg/2 veces al día |
| Lanzoprazol | 30mg | 30mg/2 veces al día |
| Rabeprazol | 20mg | 20mg/2 veces al día |
| Dexlansoprazol | 60mg | No se utiliza |
| Ilaprazol | 20mg | 20mg/2 veces al día |
ERGE: enfermedad por reflujo gastroesofágico; IBP: inhibidores de la bomba de protones.
El rendimiento diagnóstico varía dependiendo de la dosis, de la duración y del síntoma predominante, aunque en forma general tiene una sensibilidad del 71-79% (IC 95%: 72-84%) y una especificidad del 45% (IC 95%: 4-49%), utilizando como estándar de referencia la endoscopia y monitorización de pH4. La mayoría de las guías sugieren que el IBP debe indicarse 30 a 60min antes del desayuno por un período de 2 a 4 semanas para los síntomas típicos de la ERGE, sin datos de alarma, y durante 4-8 semanas para dolor torácico funcional (DTF). Se considera una prueba positiva si existe una reducción del 50% o más de los síntomas15. Aún no existe evidencia de la eficacia de que los bloqueadores de ácido competitivos de potasio (P-CAB) como vonoprazan, tegoprazan o fexuprazan usados en una prueba terapéutica.
Recomendación 4. Recomendamos realizar pruebas diagnósticas en pacientes con falla al tratamiento con IBP o P-CAB, en los pacientes con manifestaciones extraesofágicas y en los candidatos a cirugía antirreflujo.
Recomendamos la realización de pruebas confirmatorias cuando existe necesidad de un diagnóstico definitivo de la ERGE, es decir, en los pacientes sin respuesta o respuesta incompleta a la terapia con IBP o P-CAB, en aquellos que son candidatos a cirugía antirreflujo y en los casos con síntomas como tos, eructo excesivo y sospecha de rumiación14.
Cuando el paciente presenta síntomas de la ERGE sin respuesta a terapia antisecretora y no tiene evidencia objetiva de reflujo4, se requiere la realización de pruebas diagnósticas para confirmar o descartar la presencia de reflujo y fenotipificar al paciente16. En este grupo existe la posibilidad de que la refractariedad a tratamiento se deba a un trastorno de la trastornos de la interacción cerebro intestino (TICI), dado que más del 60% de los pacientes que no responden a una prueba terapéutica con antisecretores no se demuestra la ERGE en pruebas objetivas17.
Recomendamos la realización de pruebas diagnósticas de entrada, antes del inicio de terapia antisecretora, para manifestaciones extraesofágicas como tos, asma o laringitis especialmente cuando no hay coexistencia de síntomas típicos de reflujo18. Los síntomas como tos y molestias faríngeas tienen una baja probabilidad de deberse a la ERGE y muchas veces se presentan por mecanismos multifactoriales14. El realizar pruebas diagnósticas de entrada pareciera ser una estrategia más costo efectiva que el tratamiento empírico con fármacos antisecretores, dado el alto número necesario a tratar17.
Recomendamos la realización de pruebas diagnósticas en todo paciente candidato a cirugía antirreflujo. Consensos recientes recomiendan que la evaluación preoperatoria debe incluir endoscopia digestiva alta, esofagograma, manometría esofágica de alta resolución y estudio del pH sin uso de terapia antisecretora, independientemente de que haya evidencia objetiva de reflujo en la endoscopia19,20.
EndoscopiaRecomendación 5. Recomendamos realizar endoscopia en pacientes con síntomas de la ERGE y datos de alarma o con riesgo para esófago de Barrett, en aquellos que no responden al tratamiento con IBP o P-CAB o presenten recurrencia de síntomas al suspender la terapia antisecretora.
La nueva versión del Consenso de Lyon 2.0 especifica que el diagnóstico concluyente de la ERGE se establece cuando en la endoscopía se encuentra: a) esofagitis grado B, C o D de la clasificación de Los Ángeles, b) esófago de Barrett comprobado por biopsias o c) estenosis péptica21. Debido a la variabilidad interobservador, los diferentes consensos de expertos establecen que la esofagitis grado A de Los Ángeles no es evidencia definitiva de la ERGE14.
Dado que la cicatrización de la mucosa ocurre con el uso fármacos antisecretores en aproximadamente el 80% de los pacientes22, la probabilidad de encontrar una EE significativa se reduce en gran medida si la endoscopia se realiza después de 8 semanas de tratamiento con estos medicamentos. Para maximizar el rendimiento diagnóstico, la endoscopia debe realizarse de 2 a 4 semanas después de la interrupción del tratamiento antisecretor en la ERGE no probada. Si la endoscopia se realiza muy pronto, es posible que no se observe esofagitis o que sea muy leve, lo que puede no representar con precisión el fenotipo de la ERGE. Durante el tiempo que el paciente deje de tomar los fármacos antisecretores (2 a 4 semanas previas a la endoscopia) se puede recomendar el uso de antiácidos para el alivio de los síntomas de reflujo6.
Cuando existe EE grave (grado C/D de Los Ángeles), se recomienda repetir la endoscopia después de un tratamiento con IBP a doble dosis por 8 semanas para evaluar la cicatrización de la mucosa y descartar EB, lo cual puede ser difícil de detectar cuando existe inflamación grave4. La persistencia de lesiones inflamatorias (esofagitis de grado B, C y D de la clasificación de Los Ángeles) y/o de lesiones fibróticas (estenosis péptica) en la endoscopia mientras se recibe un tratamiento antisecretor optimizado, es indicativo de la ERGE refractaria23 (fig. 1).
Durante el procedimiento endoscópico se debe realizar una evaluación completa la cual incluye: 1) Evaluar la presencia de EE según la Clasificación de Los Ángeles; 2) Describir el hiato diafragmático utilizando la Clasificación de Hill; 3) Medición de la longitud axial de la hernia hiatal, y 4) Inspección del EB. En la Clasificación de Hill el hiato diafragmático se debe describir observando la válvula gastroesofágica en retrovisión y con insuflación gástrica, siendo los grados I y II normales; los grados III y IV se han asociado de forma independiente a una pobre respuesta terapéutica con los IBP y a la presencia de EE5,24.
Es importante resaltar que, en países con alta incidencia de cáncer gástrico, la endoscopia debe realizarse ante la presencia de signos de alarma como baja de peso, anemia, edad mayor de 45 años, melena e historia familiar de cáncer gástrico.
Medición del reflujo gastroesofágicoRecomendación 6. En los pacientes con síntomas típicos de reflujo que no responden a la administración de IBP o P-CAB, recomendamos realizar medición del reflujo con cápsula inalámbrica o pH-impedancia de 24h sin tratamiento antisecretor.
En los pacientes con síntomas típicos de reflujo que no responden apropiadamente a la administración de antisecretores, la endoscopia alta es normal en el 70% de los casos25. En estos, la medición ambulatoria del reflujo es obligado para establecer el diagnóstico de la ERGE. Actualmente, contamos con la medición de 24h a través de un catéter de pHmetría o pH-impedancia, el cual se coloca a 5cm por encima del EEI, identificado con manometría. Por otro lado, la pHmetría con cápsula inalámbrica permite la evaluación de la exposición ácida durante 96h, disminuyendo así la variabilidad diaria26,27. La cápsula se coloca en el momento de la endoscopia, a 6cm por encima de la unión gastroesofágica. Esta metodología permite un tiempo de evaluación mayor, mejor tolerancia para el paciente y menor interferencia con las actividades diarias. La definición de ERGE con esta técnica es más conservadora y surge de ensayos clínicos controlados y aleatorizados. Se considera ERGE cuando la exposición ácida es mayor o igual al 6% en al menos 2 días, y se excluye la ERGE cuando esta es menor al 4% en los 4 días, siendo esta definición muy apropiada, ya que es un predictor para suspender los IBP14,28.
Desafortunadamente esta tecnología está poco disponible en América Latina29. En la actualidad está a disposición en Argentina, Brasil y Venezuela, por lo que los clínicos utilizan frecuentemente la pH-impedancia de 24h. En relación con la definición actual de las métricas que ofrecen estas tecnologías para el diagnóstico de ERGE, la más utilizada es el tiempo de exposición al ácido (TEA) mayor al 6% para hacer diagnóstico positivo y menor al 4% para excluir el diagnóstico14. En el 12% no se logra establecer un diagnóstico con base a esta métrica, ya que el TEA se encuentra entre el 4-6% (área indeterminada).
Es importante considerar que en los pacientes con pirosis que tienen una endoscopía negativa y TEA normal, presentan un trastorno funcional esofágico30. Estos trastornos se clasifican en hipersensibilidad al reflujo y pirosis funcional de acuerdo a los índices de asociación sintomática como el índice de síntomas o la probabilidad de asociación sintomática. Categorizar adecuadamente a estos pacientes permite administrar el tratamiento apropiado, mejorar la calidad de vida y disminuir significativamente los costos en salud (fig. 1).
Recomendación 7. Recomendamos realizar pH-impedancia de 24h sin tratamiento antisecretor cuando los síntomas de la ERGE no probado están asociados a eructos frecuentes, sospecha de rumiación, o a manifestaciones extraesofágicas.
En los pacientes que presentan regurgitación como síntoma dominante de la ERGE, se debe tener en cuenta la presencia de confusores tales como los eructos supragástricos y la rumiación31.
En relación con los eructos debemos considerar que pueden ser parte de la fisiopatología de la ERGE, sin embargo, cuando se tornan frecuentes, es importante discernir si son gástricos o supragástricos32. Estos últimos son un desorden del comportamiento que consiste en la aspiración de aire secundario a una contracción diafragmática y una expulsión rápida del mismo, este acto puede inducir reflujo simultáneamente29. La pH-impedancia de 24h es el método diagnóstico de elección, ya que permite evaluar el movimiento del aire, a diferencia de los estudios que solamente permiten la determinación de pH33. Establecer el diagnóstico de eructos supragástricos es fundamental para prescribir un tratamiento específico con respiración diafragmática, terapia cognitivo conductual y rehabilitación fonoaudiológica34.
Por otro lado, en los casos de rumiación, que se definen clínicamente como un ascenso de contenido alimentario hacia la boca en el periodo posprandial, la pH-impedancia puede ser un método de utilidad para sospecharlos, aunque la manometría esofágica con impedancia usando un protocolo posprandial es el método de elección para su diagnóstico35. La detección de este cuadro conlleva un tratamiento específico a través de terapia cognitivo conductual y ejercicios de respiración36.
Las manifestaciones extraesofágicas como tos, disfonía y carraspeo son síntomas cuya evaluación es un desafío, sobre todo cuando se presentan de manera aislada, dado que tienen causas multifactoriales. Cuando se requiere evaluar la ERGE como un mecanismo causal, la pH-impedancia de 24h, es más sensible que la pHmetría aislada, ya que la medición simultánea de la impedancia permite la detección del número de episodios de reflujo, independientemente de la exposición ácida y la asociación sintomática37. Además, permite la evaluación de la impedancia basal nocturna media, que es un parámetro que se correlaciona con el daño mucoso secundario a la ERGE. Por otro lado, la asociación sintomática es la que permitirá evaluar la asociación causal con eventos como la tos. Para lograr una adecuada precisión, se recomienda utilizar un dispositivo acústico o acústico y manométrico para evaluar los episodios de tos durante la medición ambulatoria del reflujo.
Recomendación 8. Recomendamos realizar pH-impedancia de 24h con antisecretores en los casos de la ERGE probada con persistencia de síntomas a pesar de tratamiento óptimo.
En aquellos casos en los cuales se realizó el diagnóstico de la ERGE a través de pHmetría con cápsula inalámbrica o con catéter o pH-impedancia de 24h, y el paciente persiste sintomático a pesar de un tratamiento antisecretor óptimo, la pH-impedancia de 24h es la única herramienta diagnóstica útil. En estos casos la prueba debe hacerse bajo tratamiento antisecretor29 (fig. 1). En la medición del reflujo con tratamiento antisecretor, los episodios de reflujo ácido se vuelven débilmente ácidos o no ácidos, por lo que no es posible la detección a través de la pHmetría, pero sí a través de la pH-impedancia38. En estos casos, la pH-impedancia permite discernir si el paciente no logra controlar el reflujo apropiadamente o si los antisecretores controlan el reflujo y sin embargo el paciente presenta un trastorno funcional23.
Recomendación 9. En los pacientes con tiempo de exposición ácida no concluyente de la ERGE recomendamos evaluar las siguientes métricas:
- -
Impedancia basal nocturna
- -
Número de episodios de reflujo
- -
Presencia de hernia hiatal por manometría
En aquellos pacientes en los cuales la medición del reflujo gastroesofágico no es concluyente de la ERGE (TEA entre el 4-6%), se pueden utilizar otras métricas que nos ayuden a sustentar el diagnóstico. Una de ellas es impedancia basal nocturna media, la cual nos permite establecer la integridad de la mucosa y se determina a través de la pH-impedancia de 24h/durante 3 periodos/de 10min durante la noche. Existen distintos valores de impedancia basal nocturna establecidas por diferentes investigadores. En el consenso de Lyon 2.0 se estableció un punto de corte de <1500Ohms para apoyar el diagnóstico de la ERGE y de >2500Ohms para descartarlo14,39.
El número de episodios de reflujo es otro parámetro que apoya la ERGE cuando es mayor de 80 episodios y la descarta cuando es menor a de 40 en 24h. Esta métrica es también un predictor de respuesta al tratamiento cuando se mide bajo medicación con IBP40 (fig. 1).
El PSPW, que es la onda peristáltica después de un evento de reflujo ha sido descartada como una métrica adecuada para apoyar el diagnóstico de la ERGE y solo se utiliza en estudios de investigación. Finalmente, la presencia de hernia hiatal en endoscopia y manometría, el EEI hipotensivo, las alteraciones en la peristalsis esofágica y la asociación sintomática también son hallazgos que apoyan el diagnóstico de la ERGE14.
Esofagograma, vaciamiento gástricoRecomendación 10. No recomendamos la realización de esofagograma ni vaciamiento gástrico para el diagnóstico de la ERGE.
En la era de la endoscopia, pHmetría y manometría de alta resolución (MAR) el esofagograma ha sido desplazado en el diagnóstico y manejo de la ERGE. En un estudio de Saleh et al., se evaluaron a 20 pacientes con esofagograma, comparándolos con pH-impedancia, para el diagnóstico de ERGE. Encontraron una sensibilidad del 46%, especificidad del 44%, un valor predictivo positivo (VPP) del 50% y un valor predictivo negativo (VPN) del 40%, por lo que actualmente el esofagograma, no tiene un rol en el diagnóstico de la ERGE41. La presencia de reflujo en el esofagograma se correlaciona pobremente con la monitorización del pH esofágico, es por esta razón que las guías de la ERGE del American College of Gastroenterology y el Consenso de Lyon no lo recomiendan como herramienta diagnóstica. También, el panel de expertos en el Consenso Latinoamericano de la ERGE, recomendaron no usar el esofagograma para diagnóstico de la ERGE con un nivel de acuerdo del 100%6,29,42. Este estudio puede ser útil en la evaluación de la anatomía del esófago y las estenosis esofágicas y es un estudio obligado ante la sospecha de esófago corto.
Estudios previos han demostrado que los pacientes con la ERGE tienen tasas más lentas de vaciamiento gástrico en comparación con sujetos controles, pero la prevalencia difiere debido a las variaciones en la metodología. Recientemente Buckles et al.43 evaluaron el vaciamiento gástrico por gammagrafía en los pacientes con la ERGE y concluyeron que: el retraso en el vaciamiento gástrico es frecuente tanto a los 120 como a los 240min después de la ingesta de una comida sólida y que los síntomas por sí solos no son un predictor útil de esta fisiopatología. El conocimiento de este subgrupo de pacientes puede ser importante en las estrategias de tratamiento y la terapia a largo plazo.
Manometría esofágicaRecomendación 11. La manometría esofágica de alta resolución es una prueba complementaria para apoyar el diagnóstico de la ERGE. Está indicada en la evaluación preoperatoria de cirugía antirreflujo y en los pacientes con falla después de la fundoplicación.
Previamente, la utilidad de la MAR en la ERGE se limitaba a la localización del EEI para la correcta colocación de los catéteres de pH y para excluir trastornos mayores como la acalasia en los pacientes candidatos a cirugía antirreflujo44. Recientemente, la MAR ha sido considerada como una prueba complementaria. La presencia de una morfología anormal de la unión esofagogástrica (tipo III o con hernia hiatal), una barrera esofagogástrica incompetente (presión basal disminuida o integral contráctil de la unión esofagogástrica disminuida) o la presencia de hipomotilidad esofágica según la Clasificación de Chicago v4.0 (motilidad esofágica inefectiva o contractilidad ausente) son factores que se asocian a un TEA anormal o a la presencia de EE y pueden ser parámetros de utilidad en el caso de diagnósticos no concluyentes de ERGE. Recientemente se ha desarrollado el puntaje de Milán para evaluar la probabilidad de tener la ERGE usando la MAR. Diversos estudios han mostrado que la presencia de hernia hiatal, una integral contráctil de la integral contráctil de la unión esofagogástrica disminuida y la presencia de motilidad esofágica inefectiva se asocian con ERGE. Además, la maniobra dinámica durante la MAR denominada elevación de la pierna a 45° (Straight Leg Raise en inglés), permite evaluar los cambios de la presión intraabdominal e intraesofágica con respecto a un basal. Esta maniobra es predictora de TEA anormales3. Un aumento de la presión intraesofágica de >11mmHg predice TEA>6% con una sensibilidad del 79% y una especificidad del 85%19. El puntaje de Milán, que incluye todas las variables anteriores en un nomograma indica que puntajes <60 tienen un riesgo de la ERGE del 10% y valores >210 un riesgo de reflujo del 90%45.
Por último, la MAR es una prueba diagnóstica que debe ser realizada en todo paciente candidato a cirugía antirreflujo o que presenta síntomas después de fundoplicación (FPL). Un consenso recientemente desarrollado entre cirujanos y gastroenterólogos (Consenso de Padua) le da un valor importante a esta prueba. La evaluación de la motilidad esofágica es esencial para excluir trastornos motores que puedan contraindicar una cirugía, como una acalasia u obstrucción al flujo de salida y que impliquen un cambio en la estrategia de tratamiento. Junto a ello se ha desarrollado una clasificación postoperatoria para interpretar los hallazgos a la MAR luego de una FPL laparoscópica4.
Pruebas diagnósticas en manifestaciones extraesofágicasRecomendación 12. En los pacientes con manifestaciones extraesofágicas sin síntomas típicos, recomendamos investigar causas de síntomas laringo-faríngeos diferentes al reflujo. Se recomienda la investigación de la ERGE mediante pH-impedancia sin antisecretores. No recomendamos la esofagogastroduodenoscopia, la laringoscopia, ni el esofagograma para el diagnóstico de laERGE en estos pacientes.
Existe un amplio diagnóstico diferencial en el paciente con síntomas laringo-faríngeos crónicos aislados, como los síndromes de tos y laringe hipersensibles, fonotrauma, trastornos alérgicos, diversas neumopatías incluyendo trastornos eosinofílicos broncopulmonares, síndrome de goteo retronasal, tos psicógena, globus, efecto secundario de medicamentos (inhibidores de enzima convertidora de angiotensina, antagonistas de receptores de angiotensina II, fentanilo, sitagliptina, calcioantagonistas, latanoprost), neuropatía asociada a infección previa por el virus SARS-CoV-2, e incluso trastornos funcionales laríngo-faríngeos46. En estos pacientes, al comparar el rendimiento diagnóstico de las diferentes técnicas de medición del reflujo gastroesofágico, la pH-impedancia posee amplias ventajas: detecta reflujos ácidos, ligeramente ácidos y no ácidos, así como el número total de reflujos, permite medir la impedancia basal nocturna, e identificar sobreposición con trastornos funcionales47–49. La medición por pH inalámbrico puede ser útil cuando los catéteres transnasales no son tolerados o en caso de alta sospecha de un resultado negativo, pero no ofrece superioridad con respecto a la pH-impedancia en la evaluación de síntomas extraesofágicos. El uso de otras pruebas como pH-metría faríngea tipo Restech o pepsina salival no se recomiendan al tener una sensibilidad baja (<40%) y pobre correlación sintomática y con hallazgos en la pH-impedancia49. No se recomienda la endoscopia en estos pacientes dado que posee una sensibilidad del 20-35% para el diagnóstico de la ERGE en los pacientes con manifestaciones extraesofágicas46. La laringoscopia tiene una sensibilidad del 86%, una especificidad del 9% y una precisión diagnóstica del 44% al compararse contra la medición del TEA mediante pH-metería con impedancia. Los hallazgos laríngeos de eritema, edema, hiperplasia linfoide de laringe posterior, ulceraciones, estenosis subglótica, pólipos de cuerdas vocales, granuloma, leucoplaquia, no son específicos, no correlacionan con el TEA, no predicen respuesta a IBP ni a FLP, y pueden observarse en trastornos alérgicos, infecciosos o población sana50.
Tratamiento de precisión basado en fenotipos endoscópicos y por medición de la enfermedad por reflujo gastroesofágicoModificaciones al estilo de vidaRecomendación 13. Recomendamos a todos los pacientes con la ERGE bajar de peso en caso de sobrepeso y obesidad, evitar fumar y no consumir los alimentos que el paciente identifique como inductores de sus síntomas. Los pacientes con reflujo nocturno, deben cenar temprano, elevar la cabecera de la cama o dormir del lado izquierdo.
Tradicionalmente, se ha recomendado a los pacientes con la ERGE seguir dietas restrictivas. Sin embargo, la evidencia que respalda esta práctica es limitada, ya que muchos estudios sobre el impacto de la dieta en síntomas son de diseño no controlado, con muestras pequeñas y de calidad metodológica deficiente, además de estar frecuentemente asociados a otras intervenciones terapéuticas, lo que complica su interpretación6. Se ha documentado que ciertos alimentos pueden disminuir el tono del EEI, como la menta, el chocolate, el café, el alcohol y las grasas, mientras que otros pueden ejercer un efecto irritante directo sobre la mucosa esofágica, como los alimentos picantes y los cítricos51. Sin embargo, estos hallazgos no siempre se correlacionan con los resultados de pHmetría ni con la mejora sintomática tras su eliminación52. La recomendación actual es que la dieta debe individualizarse en función de los síntomas de cada paciente5,51.
Además, se ha observado que prolongar el intervalo entre la cena y la hora de acostarse, evitando la ingesta de alimentos en las 2-3 horas previas al sueño, puede contribuir a la reducción de los síntomas nocturnos51,52.
Varios ensayos clínicos han demostrado que dormir con la cabecera elevada 15- 20cm reduce significativamente el TEA, el número de episodios de reflujo prolongado y mejora la calidad del sueño52,53. Un ensayo clínico aleatorizado evidenció que dormir sobre el costado izquierdo y utilizando una cuña que eleva el torso y la cabeza del paciente aproximadamente 23cm, mejora la exposición nocturna al ácido en un 87%54. Por tanto, es razonable recomendar a los pacientes con síntomas nocturnos que utilicen dispositivos como cuñas, almohadas especiales o que eleven la cabecera de la cama con libros o ladrillos a unos 20cm, además de esperar 2 a 3h después de la cena para ir a acostarse.
En individuos con obesidad hay una mayor exposición esofágica al ácido que correlaciona con una mayor intensidad de los síntomas. La pérdida de peso en personas con sobrepeso ha demostrado ser efectiva para disminuir tanto los síntomas de la ERGE como la exposición esofágica al ácido, mientras que el aumento de peso se asocia con un mayor riesgo de complicaciones55.
Varios estudios han evidenciado que dejar de fumar mejora los síntomas de la ERGE. Aquellos sujetos que abandonaron el tabaquismo durante un año experimentaron una mejoría sintomática del 44%, en comparación con el 18% de quienes continuaron fumando56. Dado que los beneficios de dejar de fumar y perder peso trascienden la ERGE, estas recomendaciones son aplicables de manera general a todos los pacientes, no solo a los que padecen la ERGE.
Tratamiento de la enfermedad por reflujo no erosivaRecomendación 14. Los IBP y los P-CAB son fármacos de elección en el tratamiento de los pacientes con la enfermedad por reflujo no erosiva. Se debe iniciar con dosis estándar durante 4 semanas. En la terapia de mantenimiento se recomienda la dosis mínima necesaria para el control de síntomas, considerando el esquema intermitente o el tratamiento a demanda.
Los IBP son la alternativa con mayor calidad de evidencia en el tratamiento de los pacientes con enfermedad por reflujo no erosiva (ERNE). En un metaanálisis que incluyó de 17 ensayos controlados aleatorizados con 6072 pacientes, los IBP fueron significativamente superiores a los antagonistas de receptores H2 de la histamina (ARH2) y placebo en el control de síntomas de la ERNE57. Si bien se ha reportado que la respuesta a IBP podría ser superior en los pacientes con EE, es posible que esto se relacione con que se diagnostique como ERNE a los pacientes sin evidencia objetiva de ERGE. En un metaanálisis que comparó la respuesta a IBP en los pacientes con ERNE, definido como endoscopia negativa y pH-metría positiva, y los pacientes con EE, la remisión sintomática fue similar en ambos grupos58.
Los P-CAB son una opción más reciente para el manejo de enfermedades relacionadas con el ácido, que debe considerarse según su disponibilidad y aprobación en cada país. En un estudio contra placebo que evaluó tegoprazan en sujetos con ERNE, se observaron diferencias significativas en el control de síntomas típicos en favor del tratamiento en dosis de 50 y 100mg por día59. Otro estudio que evaluó P-CAB en los pacientes con ERNE, evidenció que 10mg diarios de vonoprazan durante 4 semanas fueron superiores al placebo para la remisión de pirosis60. Los P-CAB también han sido evaluados en ERNE sin respuesta a IBP. En un estudio pequeño con 26 pacientes, se administró vonoprazan durante 12 semanas después un tratamiento inefectivo con IBP, el cambio de medicación se asoció con mejoría significativa de síntomas61.
La dosis de inicio y mantenimiento han sido tema de análisis en distintas publicaciones; si bien se recomienda iniciar con dosis estándar durante un mes, la dosis de mantenimiento es controversial por la alta tasa de recidiva sintomática después del tratamiento, y por la tendencia a utilizar terapia antisecretora durante períodos cortos debido al riesgo de efectos adversos62–64.
En los pacientes con ERNE se ha propuesto el tratamiento de mantenimiento con esquema intermitente o a demanda con IBP62. En los pacientes con períodos de recaída sintomática al suspender el tratamiento, la terapia intermitente se recomienda en períodos de 2 a 4 semanas. En casos de tratamiento a demanda, el IBP se utiliza hasta que remitan los síntomas62. Para ambas estrategias se puede iniciar con dosis estándar y luego disminuir hasta encontrar la mínima dosis necesaria para el control sintomático. En los pacientes con ERNE, el tratamiento a demanda con dosis estándar parece no ser inferior al tratamiento continuo63.
Los P-CAB también han sido evaluados como tratamiento a demanda. En un ensayo contra placebo, se utilizó vonoprazan en los pacientes con ERNE; la respuesta fue significativamente superior en el grupo de tratamiento inclusive con la mitad de la dosis de vonoprazan64.
Terapia adyuvanteRecomendación 15. Recomendamos el uso de alginatos, antiácidos y protectores de la mucosa en el manejo de los síntomas ocasionales. Los ARH2 se usan por períodos cortos, para el alivio de síntomas nocturnos que no se controlan con IBP.
Los alginatos forman una barrera protectora contra el reflujo a nivel de la unión esofagogástrica justo por arriba de la bolsilla de ácido. Se utilizan en los pacientes con síntomas después de las comidas, por la noche y en aquellos con hernia hiatal. Los antiácidos se recomiendan para el alivio temporal de los síntomas y no deben usarse como tratamiento a largo plazo4,6,65. El bioadhesivo que contiene condroitin sulfato y ácido hialurónico Esoxx-One®, es un protector de la mucosa que usado en combinación con IBP mejora los síntomas en los pacientes con ERGE no erosiva66. La dosis por la noche de ARH2 evitan la fuga ácida nocturna mediada por histamina en los pacientes con la ERGE tratados con doble dosis de IBP. Por su tolerancia o taquifilaxia, solo se recomiendan por períodos cortos de 2 a 4 semanas, en aquellos pacientes con síntomas nocturnos que no se controlan con doble dosis de IBP.
Recomendación 16. Los procinéticos solo están indicados en los pacientes con síntomas de retraso del vaciamiento gástrico. El baclofeno se recomienda cuando la regurgitación es el síntoma predominante.
El uso de procinéticos en combinación con IBP no ha mostrado ser más efectivo que el tratamiento solo con IBP en la ERGE. Están indicados solamente en aquellos pacientes con la ERGE y síntomas de gastroparesia como náusea, vómito, llenura o saciedad temprana. Los agonistas del neurotransmisor del ácido gamma-aminobutírico (GABA B) disminuyen el número de las relajaciones transitorias del esfínter esofágico inferior (RTEEI). El baclofeno está indicado en los pacientes con síntomas predominantes de eructos y regurgitación que no responden a la monoterapia con IBP. Producen mareo, confusión y otros eventos adversos sobre el sistema nervioso central4,6,65.
Tratamiento de la enfermedad por reflujo gastroesofágico erosivaRecomendación 17. En el tratamiento inicial de la ERGE erosiva recomendamos el uso de IBP o P-CAB a dosis estándar por 8 semanas. En los pacientes con EE grave debe usarse doble dosis de IBP por 8 semanas. En el tratamiento de mantenimiento se usan dosis estándar de IBP o la mitad de la dosis de P-CAB de manera continua.
Los IBP y los P-CAB son los fármacos antisecretores de elección en la EE6. Los IBP se utilizan a dosis estándar una vez al día por 8 semanas en los casos de esofagitis A y B. En los casos de esofagitis graves (C y D) se debe prescribir la doble dosis de los IBP de liberación retardada. Con estos esquemas se logra la cicatrización de la esofagitis en más del 80% de los casos. Los P-CAB han mostrado un efecto inhibidor del ácido más rápido, potente y sostenido67–69. No se han demostrado diferencias significativas entre IBP y P-CAB en el control sintomático del reflujo, pero los P-CAB son más efectivos que los IBP en cicatrizar la esofagitis particularmente en los casos graves67–71. Se utilizan a dosis estándar por 8 semanas68–71. Consensos y recomendaciones de expertos ubican a los P-CAB como una opción equivalente a los IBP en esofagitis leve y como la mejor alternativa farmacológica para esofagitis grave5. Para el tratamiento de mantenimiento de la EE, se recomienda usar la dosis de IBP estándar que produjo la cicatrización de la esofagitis. Los P-CAB a mitad de la dosis estándar ha mostrado ser efectiva para el tratamiento de mantenimiento de la EE5,72. El tratamiento a demanda en esofagitis grado A con IBP o P-CAB es un esquema costo efectivo73.
Tratamiento médico del esófago de BarrettRecomendación 18. Recomendamos tratamiento continuo con IBP en los pacientes con esófago de Barrett para el control de los síntomas y para prevenir la progresión a displasia o adenocarcinoma esofágico.
Existe evidencia sobre el efecto de la supresión ácida prolongada particularmente con el uso de lBP, sobre la disminución del riesgo de adenocarcinoma y displasia de alto grado en los pacientes con EB. Por ejemplo, en un metaanálisis y revisión sistemática que incluyó 7 estudios, con 2813 pacientes, reportó que el uso de IBP se asoció a una reducción del 71% de riesgo de adenocarcinoma y/o displasia de alto grado (RM ajustado: 0.29; IC 95%: 0.12-0.79). También se estudiaron los ARH2, sin encontrarse efecto significativo74. Por otro lado, con el advenimiento de los P-CAB es probable que en un futuro estos medicamentos, por su efecto más potente y prolongado, puedan recomendarse para el manejo del EB.
Por otra parte, fármacos como las estatinas75, los inhibidores de la COX276, la aspirina77, también han sido estudiados como probables medicaciones quimiopreventivas de EB, con resultados más heterogéneos y sin alcanzar nivel de evidencia suficiente como para ser considerados en las recomendaciones de manejo del EB.
Tratamiento de la enfermedad por reflujo gastroesofágico refractaria y sobreposición con trastornos funcionales esofágicosConceptos clavesLa persistencia de síntomas de la ERGE a pesar del tratamiento médico no necesariamente indica un diagnóstico de la ERGE refractaria. Hasta el 30% de los pacientes con síntomas de la ERGE pueden persistir con síntomas a pesar de recibir tratamiento con IBP23. Las causas de esta aparente falla terapéutica pueden deberse a múltiples factores que incluyen: falta de adherencia al tratamiento, administración incorrecta de IBP, diferencias farmacogenéticas (como polimorfismos en CYP2c19), y diagnósticos incorrectos (esofagitis eosinofílica [EEo]). De acuerdo con las definiciones actuales, es crucial identificar y clasificar a los pacientes con «falla terapéutica» en 2 grupos principales23,78,79:
- 1.
Pacientes con síntomas persistentes de la ERGE sin diagnóstico previo: Estos pacientes asumen tener ERGE y no responden al tratamiento, pero no tienen evidencia objetiva de la ERGE (mediante estudios endoscópicos o fisiológicos). En estos casos, se recomienda realizar los estudios necesarios para confirmar el diagnóstico antes de reiniciar el tratamiento.
- 2.
Pacientes con síntomas persistentes de la ERGE con diagnóstico previo: Estos pacientes tienen evidencia objetiva de ERGE (EE, exposición anormal al ácido esofágico, etc.) pero continúan con síntomas a pesar del tratamiento. Es esencial revisar la adherencia al uso de IBP y descartar otras causas de fracaso terapéutico. Si se descartan otras causas, se debe reevaluar a los pacientes mientras están en tratamiento con IBP.
La ERGE refractaria se define como la presencia de evidencia objetiva de la ERGE (EE, TEA anormal, o numerosos episodios de reflujo en pH-metría) a pesar de tratamiento con dosis doble de IBP durante 8 semanas. Esta definición se basa en consensos de expertos y su costo/beneficio no está bien establecido14,79,80.
Estudios recientes han mostrado que existen parámetros fisiológicos que se han obtenido durante la pH-impedancia en los pacientes con doble dosis de IBP y que predicen la respuesta al tratamiento de la ERGE refractaria. El estudio más importante es el de Gyawali et al. en donde se demuestra que un TEA>0.5% y >40 episodios de reflujo detectado por impedancia son parámetros que pueden predecir respuesta al tratamiento quirúrgico hasta en el 79% de los pacientes con la ERGE refractaria, en especial si el síntoma que persiste es la regurgitación80.
Recomendación 19. En los pacientes con síntomas de la ERGE persistentes, recomendamos las siguientes medidas para optimizar el tratamiento:
- a)
Comprobar la adherencia al tratamiento y la correcta dosificación de IBP en relación con las comidas
- b)
Utilizar dosis doble o dividir la dosis de IBP
- c)
Cambiar a un IBP diferente
- d)
Optar por el uso de P-CAB
- e)
Usar tratamientos adyuvantes
La adherencia al tratamiento médico es crucial para lograr un control efectivo de los síntomas y prevenir complicaciones a largo plazo. Estudios han demostrado que la adherencia óptima al tratamiento con IBP no solo mejora la supresión del ácido gástrico, sino que también reduce la frecuencia de recaídas y la necesidad de intervenciones adicionales. Además, la correcta adherencia a la dosificación recomendada, especialmente la ingesta en ayunas maximiza la eficacia del tratamiento al evitar la degradación prematura del fármaco en el estómago81. Es importante mencionar que existen versiones modificadas de los IBP, como formulaciones de liberación prolongada (dexlansoprazol) y de segunda generación (con vidas medias más largas, como ilaprazol), que pueden no requerir estrictamente su administración en ayunas. Sin embargo, la recomendación general para todos los IBP es tomarlos preferiblemente en ayunas82.
Diversos estudios han demostrado que el aumento de la dosis de IBP mejora significativamente el control de los síntomas y la supresión del ácido gástrico. Un estudio japonés mostró que duplicar la dosis de rabeprazol de 10 a 20mg resultó en una mejora significativa en el control de los síntomas en un 74% de los pacientes en comparación con el 45% de aquellos que continuaron con la dosis estándar (p<0.001)83. Así mismo, un metaanálisis reciente de 25 estudios con 592 sujetos encontró que la dosis estándar de pantoprazol (40mg) tomada/2 veces al día mantuvo el pH intragástrico por encima de 4 durante un promedio del 68% del día 3, mientras que esomeprazol 40mg/2 veces al día mantuvo el pH por encima de 4 durante un 88% del tiempo84. Estas evidencias subrayan la importancia de ajustar la dosis de IBP para optimizar el manejo de la ERGE refractaria.
Administrar la dosis total diaria divida en 2 tomas es otra estrategia útil. Un estudio demostró que el uso de esomeprazol 20mg/2 veces al día, en lugar de 40mg una vez al día, mejoró significativamente la supresión ácida desde la primera dosis, alcanzando su máximo beneficio al segundo día85. Otro estudio encontró que dividir la dosis de pantoprazol (20mg/2 veces al día) mantuvo el pH intragástrico por encima de 4 durante un promedio del 68% del día 3, mientras que esomeprazol 40mg/2 veces al día lo mantuvo por un 88% del tiempo. Estos resultados destacan la efectividad de la dosificación dividida en los pacientes con la ERGE refractaria, proporcionando una opción valiosa para aquellos que no responden adecuadamente a la dosificación convencional86.
La estrategia de cambiar de IBP se basa en la variabilidad individual en la respuesta a diferentes IBP debido a factores como el metabolismo y la farmacocinética. Un estudio realizado por Fass et al. evaluaron la eficacia de dexlansoprazol en los pacientes con la ERGE refractaria que no respondían a otros IBP82. En este estudio, 142 pacientes fueron cambiados a dexlansoprazol 30mg después de un período de selección de 6 semanas. Los resultados mostraron que la pirosis se controló en el 88% de los casos después del cambio, en comparación con aquellos que continuaron con placebo. Este estudio subraya la importancia de considerar un cambio de IBP en los pacientes que no responden adecuadamente a un tratamiento inicial, ofreciendo una alternativa efectiva para mejorar el control de los síntomas y la calidad de vida.
Los P-CAB representan una nueva clase terapéutica ya que actúan bloqueando de manera reversible los canales de potasio en las células parietales, ofreciendo una inhibición más rápida y sostenida de la secreción ácida en comparación con los IBP87. Vonoprazan es uno de los P-CAB más estudiados y ha demostrado ser efectivo en el control de la ERGE refractaria. Un estudio realizado en 124 pacientes japoneses mostró que 20mg de vonoprazan normalizaban la exposición esofágica al ácido en un 46%, mejorando los síntomas y promoviendo la cicatrización de la mucosa en comparación con los IBP convencionales88. Tegoprazan, otro P-CAB, ha sido aprobado y registrado en LATAM y ha mostrado mejorar significativamente los síntomas de reflujo nocturno y la calidad del sueño en comparación con esomeprazol89. Fexuprazan, un nuevo P-CAB, también ha demostrado eficacia en el manejo de la ERGE. Estos estudios destacan los P-CAB como una opción prometedora para los pacientes con la ERGE refractaria, ofreciendo una alternativa eficaz cuando los IBP tradicionales no proporcionan el alivio necesario.
El alginato de sodio forma un gel viscoso que actúa como una barrera física para la «bolsa de ácido», reduciendo la exposición del esófago al ácido y aliviando los síntomas residuales o de difícil control en los pacientes con ERGE79,90. Un estudio demostró que la adición de una formulación bioadhesiva de ácido hialurónico y sulfato de condroitina mejoró significativamente los síntomas y la calidad de vida en los pacientes con respuesta parcial a los IBP66. Aunque la evidencia sobre su eficacia en la ERGE refractaria es limitada, los alginatos pueden ser particularmente útiles en el manejo de la pirosis posprandial y los episodios nocturnos. Estos hallazgos sugieren que antiácidos, alginatos y protectores de mucosa pueden desempeñar un papel importante como terapia adyuvante en los pacientes con la ERGE refractaria, mejorando el control de los síntomas y la calidad de vida.
Recomendación 20. Recomendamos el uso de neuromoduladores y terapias psicológicas en los pacientes con pirosis funcional e hipersensibilidad al reflujo.
En casos de hipersensibilidad al ácido o coexistencia de la ERGE con trastornos funcionales (pirosis funcional), se debe optimizar el tratamiento antisecretor y usar neuromoduladores y terapias psicológicas concomitantemente. Los neuromoduladores, como los antidepresivos tricíclicos (p. ej., amitriptilina, trazodona) y los inhibidores selectivos de la recaptación de serotonina (ISRS), han mostrado reducir significativamente los síntomas al disminuir la percepción del dolor esofágico y mejorar la calidad de vida del paciente91. Un estudio realizado por van Oudenhove et al. encontró que el uso de citalopram, un ISRS, redujo los síntomas de pirosis funcional en comparación con el placebo92. Además, el uso de neuromoduladores también ha sido respaldado por la evidencia de su efectividad en la reducción de la hipersensibilidad esofágica, al modificar las vías neurológicas que medían la percepción del dolor. Estos tratamientos no solo abordan los síntomas físicos, sino que también tienen un impacto positivo en las comorbilidades psicológicas frecuentemente asociadas con estos trastornos, como la ansiedad y la depresión, mejorando así el bienestar general del paciente.
Por otro lado, recientemente un panel de 15 expertos, compuesto por 10 psicólogos gastrointestinales y 5 especialistas esofágicos, emitió recomendaciones respecto a las terapias centradas en la modulación del eje cerebro-esófago. De acuerdo con este panel, es crucial la evaluación psicosocial, identificando factores como la hipervigilancia, la ansiedad específica por los síntomas y la calidad de vida relacionada con la salud. Se considera que la hipnoterapia y la terapia cognitivo-conductual son eficaces para el manejo de la pirosis funcional93.
Recomendación 21. La sobreposición de la ERGE con dispepsia o síndrome del intestinal irritable son frecuentes. Recomendamos la investigación detallada de criterios diagnósticos de estos y otros trastornos de la interacción cerebro intestino (TICI) en los pacientes con la ERGE.
La ERGE y la dispepsia son altamente prevalentes y coexisten frecuentemente en un mismo individuo, lo que incrementa la sintomatología y empeora la calidad de vida. La prevalencia de esta sobreposición varía según los criterios utilizados, oscilando entre el 12-35% con los criterios ROMA II y aumentando al 20-48% con ROMA III94. Esta coexistencia no es al azar, ya que mecanismos fisiopatológicos, como la alteración en la acomodación gástrica, vaciamiento retrasado e hipersensibilidad visceral, juegan un papel en la generación de síntomas95.
De manera similar, la sobreposición de la ERGE con el síndrome de intestino irritable (SII) es común, afectando entre el 5 y el 30% de la población96. Los pacientes con ERGE no erosiva son más propensos a esta combinación debido a la hipersensibilidad visceral, presente en el 74.3% de los casos. La prevalencia varía según el subtipo de SII, siendo mayor en aquellos con diarrea (40.9%) comparado con el estreñimiento (32.9%). Esta sobreposición está asociada con una menor calidad de vida y peor control de los síntomas de ERGE, debido a la alta prevalencia y los mecanismos fisiopatológicos compartidos entre ambas condiciones97.
Tratamiento de manifestaciones extraesofágicasRecomendación 22. Recomendamos el tratamiento con doble dosis de IBP por 12 semanas en los pacientes con manifestaciones extraesofágicas y evidencia objetiva de la ERGE. No se recomienda el tratamiento de prueba en los pacientes con estas manifestaciones sin la ERGE demostrado.
Tradicionalmente se ha considerado apropiado el uso de una prueba terapéutica con IBP cuando existen síntomas típicos, aunque la respuesta positiva también podría deberse al efecto placebo. Sin embargo, la evidencia demuestra que suponer la relación de la ERGE con tos, ronquera y otros síntomas extraesofágicos «aislados» (es decir, en ausencia de síntomas típicos de la ERGE) ha sobreestimado los diagnósticos de ERGE atípica, llevando al uso inapropiado de fármacos antisecretores, una alta carga económica y un desperdicio de recursos limitados para pruebas. Por lo tanto, en la actualidad y de acuerdo con el consenso de Lyon 2.0 se recomienda que ante la presencia de síntomas atípicos es necesaria la realización de pruebas diagnósticas para tener evidencia objetiva de la ERGE14.
Es claro que el IBP/2 veces al día es superior al IBP/una vez al día en la supresión del ácido gástrico y probablemente sea más efectivo para los síntomas extraesofágicos. En un estudio de cohorte prospectivo se observó una tasa de respuesta más alta (54% más) en los pacientes que no respondieron a IBP en dosis estándar después de 8 semanas98. Por otro lado, aunque se espera que los P-CAB se utilicen en el contexto de los síntomas extraesofágicos de la ERGE, por el momento no existe evidencia al respecto.
Tratamiento endoscópico y quirúrgico de la enfermedad por reflujo gastroesofágicoRecomendación 23. Recomendamos considerar el tratamiento endoscópico con fundoplicatura transoral sin incisiones (TIF) en los pacientes estrictamente seleccionados (hernia hiatal <2cm, Hill I o II, esofagitis A y B) realizada por endoscopistas debidamente entrenados.
La TIF con EsophyX 2.0 puede considerarse una opción de tratamiento para la ERGE en los pacientes estrictamente seleccionados con hernia hiatal <2cm, Hill I o II, esofagitis A y B, en manos de endoscopistas entrenados. El dispositivo está diseñado para crear una plicatura de espesor completo de serosa a serosa y reconstruir la válvula de aproximadamente 3cm de longitud, con una circunferencia de 270° a 300°, basándose en los principios de FPL laparoscópica99. Ensayos clínicos, como el RESPECT trial que comparó EsophyX® 2.0 vs. placebo con IBP mostró, en el análisis por intención de tratar, una mejoría subjetiva de los síntomas para el grupo tratado (67 vs. 45%; p=0.023), reducción de la exposición ácida esofágica del 9.3 al 6.3% (p<0.001) y del score de DeMeester de 33.6 a 23.9 (p<0.001)100. Resultados similares fueron obtenidos en el TEMPO trial donde compararon la eficacia de TIF frente a IBP, evidenciando a los 6 meses la superioridad de TIF vs. IBP en términos de mejorar la regurgitación (97 vs. 50%) y en mejorar las manifestaciones extraesofágicas (62 vs. 5%)101. Haseeb et al. evaluaron la eficacia TIF en síntomas atípicos de la ERGE mediante un meta análisis (10 estudios, 564 pacientes)102. En el seguimiento a los 6 y 12 meses, el índice de síntomas de reflujo después del TIF se redujo de 15.72 puntos (IC 95%: 12.15-19.29) y 14.73 puntos (IC 95%: 11.74-17.72), respectivamente. La tasa de éxito técnico fue del 99.5% y una tasa de eventos adversos del 1%. Testoni et al., en un estudio de cohortes, describieron resultados estables y permanentes con TIF en la regurgitación y el uso de IBP en 14 pacientes seguidos hasta 10 años103. Por lo anterior, el TIF se ha posicionado como el procedimiento endoscópico con mayor evidencia en comparación a la radiofrecuencia no ablativa (Stretta®), endoengrapadora ultrasónica (MUSE), mucosectomía endoscópica (ARMS) y ablación mucosa (ARMA). Se necesitan futuros trabajos correctamente diseñados que demuestren la eficacia y durabilidad de la TIF. En Latinoamérica, apenas se inicia la experiencia en algunos países.
Recomendación 24. Recomendamos la cirugía antirreflujo en los pacientes con diagnóstico de certeza de la ERGE, con hernia hiatal grande y regurgitación como síntoma predominante y en ausencia de un trastorno grave de la motilidad esofágica.
La FPL laparoscópica es el procedimiento de elección para el tratamiento quirúrgico de la ERGE. Múltiples estudios han demostrado que no solo mejora los síntomas a mediano y largo plazo con igual o mayor eficacia que la terapia médica, sino que también corrige las alteraciones fisiológicas relacionadas con la enfermedad. Antes de considerar la cirugía es necesario demostrar objetivamente la ERGE y evaluar la función peristáltica con MAR para descartar acalasia y otros trastornos motores. El esófago hipercontractil y el espasmo esofágico distal sin síntomas obstructivos pueden ser referidos para FPL. En contraste, la cirugía debe considerarse con precaución en los pacientes con trastornos motores asociados a síntomas obstructivos como disfagia o dolor torácico19. Un ensayo aleatorizado reciente comparó el tratamiento médico con el quirúrgico en 78 pacientes con ERGE y pirosis refractaria. El tratamiento quirúrgico fue significativamente superior al tratamiento médico activo y tratamiento médico de control en alivio sintomático (67, 28 y 12%, respectivamente; p=0.007)104. Una revisión sistemática y metaanálisis que evaluó la FPL frente al tratamiento médico con IBP encontró resultados en conjunto a favor de FPL en resolución de síntomas a corto y largo plazo (DME: 0.18; IC 95%: 0.01-0.35 vs. DME: 0.33; IC 95%: 0.13-0.54)105. En ese mismo sentido, una revisión Cochrane reportó que a largo plazo la calidad de vida y el control de los síntomas favoreció a la FPL comparada con terapia médica, pero los eventos adversos fueron mayores en el grupo quirúrgico (18.1 vs. 12.4%)106.
La duración del control sintomático de la FPL es variable. Un estudio de seguimiento a largo plazo reportó que después de 10 años, el 62% de los pacientes estaban tomando nuevamente medicación antirreflujo107. Estudios de FLP versus terapia médica realizados en centros de referencia han reportado tasas de recurrencia de la ERGE del 10-27% durante períodos de seguimiento de 3 a 5 años108,109. Algunos factores relacionados con buen pronóstico quirúrgico son presencia de hernia hiatal, respuesta favorable a IBP y una reserva peristáltica adecuada en la manometría esofágica110. Las FPL parciales (Toupet y Dor) parecen tener una eficacia similar a la FPL completa (Nissen). Dos metaanálisis de estudios comparativos han mostrado que los resultados entre los 2 tipos de FPL son equivalentes, pero las FPL parciales producen menos disfagia y menos incapacidad para eructar y vomitar111,112.
Una cohorte poblacional analizó los resultados a 5 años de la FPL realizada en 2,655 pacientes y encontró que el 17.7% tuvieron recurrencia de reflujo, el 4.1% presentaron complicaciones no graves y disfagia 0.8%. Se concluye con estos datos que la FPL tiene una baja tasa de morbilidad y que brinda un alivio duradero de los síntomas de la ERGE para la mayoría de los pacientes113.
En resumen, el tratamiento médico y la FLP laparoscópica tienen una eficacia terapéutica comparable en la resolución de los síntomas y de la esofagitis. La mayoría de los pacientes que han sido bien seleccionados y operados por cirujanos expertos obtienen beneficios a largo plazo y un nivel de satisfacción mayor al obtenido con el tratamiento médico crónico.
Enfermedad por reflujo gastroesofágico en condiciones especialesEsofagitis eosinofílicaRecomendación 25. En los pacientes con síntomas de la ERGE persistentes después de tratamiento óptimo con antisecretores, con disfagia, antecedente de atopia e impactación alimentaria esofágica, se debe realizar endoscopia con biopsias de esófago proximal y distal para descartar esofagitis eosinofílica.
La prevalencia de EEo en LATAM se desconoce, sin embargo, es menor que en países anglosajones. No obstante, debe sospecharse en los pacientes atópicos, con síntomas de la ERGE persistentes a pesar de un tratamiento óptico con IBP o P-CAB y antecedente de impacto alimentario. Estos pacientes deben ser sometidos a endoscopia y buscar detalladamente los signos endoscópicos de EEo como anillos o traquealización del esófago, abscesos eosinofílicos, surcos o rieles. Además, en estos casos deben tomarse biopsias del esófago distal y proximal. La presencia de >15 eosinófilos por campo de alto poder, establece el diagnóstico de EEo114,115.
EmbarazoRecomendación 26. Los síntomas típicos de la ERGE pueden presentarse o incrementarse durante el embarazo. Recomendamos las modificaciones al estilo de vida y el uso de antiácidos o sucralfato en los pacientes con síntomas leves y utilizar IBP en síntomas graves. Todos los IBP tienen categoría B durante todo el embarazo, excepto el omeprazol (categoría C). No hay categoría definida para los P-CAB.
Aproximadamente 2/3 de las embarazadas experimentan pirosis en cualquier trimestre del embarazo. La ERGE tiene la misma presentación que en la población adulta, sin embargo, los síntomas empeoran en etapas avanzadas del embarazo. La regurgitación y la pirosis se presentan con la misma frecuencia. En el primer trimestre del embarazo, la ERGE está relacionada con una respuesta fisiológica alterada116,117. La posibilidad de pirosis durante el embarazo se incrementa cuando la paciente presentaba síntomas previamente, además en casos de mayor paridad y duración del embarazo. La edad materna está inversamente correlacionada con pirosis118. El diagnóstico se da básicamente por síntomas referidos por la paciente. La endoscopía y pH metría raramente son necesarias. Usualmente se resuelve después del parto y la endoscopia suele diferirse al periodo posparto debido al mayor riesgo para el feto con la sedación. Por otro lado, el sobrepeso después del parto puede hacer que los síntomas persistan11. El tratamiento debe empezar con modificaciones en el estilo de vida. Los antiácidos o sucralfato pueden usarse en forma segura en los casos leves. Cuando la sintomatología no se controla con estos agentes, están indicados los ARH2 o los IBP a dosis estándar, ambos agentes tienen clasificación B, excepto el omeprazol, que es categoría C en la clasificación de la Administración de Alimentos y Fármacos (FDA, en inglés) en el embarazo.
Adulto mayor y enfermedad por reflujo gastroesofágicoRecomendación 26. Recomendamos realizar endoscopia en los adultos mayores con sospecha de la ERGE. En este grupo de pacientes la enfermedad es más frecuente, grave y con síntomas atípicos. Se debe tomar en cuenta comorbilidades y riesgos para realizar endoscopia.
La ERGE en los adultos mayores tiende a ser más grave, aunque presentan menor sintomatología en comparación con poblaciones más jóvenes. Se ha descrito que en los adultos mayores los factores protectores del esófago como el bicarbonato salival está disminuido por la xerostomía, además es frecuente encontrar trastornos de la motilidad y hernia hiatal en este grupo etario119. Los síntomas pueden ser leves o atípicos (dispepsia, dolor epigástrico, anorexia, disfagia, odinofagia, pérdida de peso, anemia y eructos), lo que puede resultar en un diagnóstico tardío119. Por ello, la esofagogastroduodenoscopia está indicada en este grupo de pacientes para la detección y tratamiento oportuno de esofagitis graves. El uso de IBP o P-CAB es el tratamiento médico más eficaz independiente de la edad y no requiere ajuste de dosis. El tratamiento en este grupo de pacientes debe seguir los mismos principios que los pacientes jóvenes120.
ObesidadRecomendación 27. En los pacientes obesos con indicación de cirugía bariátrica y con evidencia objetiva ERGE, recomendamos la derivación gastroyeyunal en Y de Roux como procedimiento de elección.
El sobrepeso y la obesidad son factores de riesgo para la ERGE. El incremento de la grasa intraabdominal y de la presión intraabdominal, predispone al desarrollo de hernia hiatal y ERGE121–123. La prevalencia de la ERGE en los pacientes obesos es mayor que en los no obesos (RM: 1.73; IC 95%: 1.46-2.06)124. En personas con IMC>35 hay una prevalencia de la ERGE al menos 6 veces mayor125.
La derivación gastroyeyunal en Y de Roux (DGYR) puede controlar la ERGE en los pacientes obesos porque el estómago residual produce menos ácido y la derivación quirúrgica previene el reflujo biliar. Debe considerarse esta técnica como la primera opción quirúrgica para pacientes obesos con ERGE que tienen indicación de cirugía bariátrica, y como alternativa para corregir una falla a la fundoplicación en los pacientes obesos4. Si bien la DGYR puede traer beneficios, es necesario recordar que es una técnica quirúrgica que produce mayor alteración anatómica y puede acarrear complicaciones tempranas y tardías. Por todo ello en los pacientes con obesidad mórbida y ERGE, o en obesos con ERGE refractario que tienen la opción quirúrgica para la ERGE, se debe considerar DGYR sopesando riesgo beneficio4. La DGYR también puede ser una opción en los pacientes no obesos operados de manga gástrica con empeoramiento de síntomas de la ERGE4.
Infección por Helicobacter pyloriRecomendación 28. Helicobacter pylori (H. pylori) no tiene efecto causal en la ERGE. Su erradicación no aumenta el riesgo de adenocarcinoma esofágico por lo que si durante el estudio de ERGE, se diagnostica infección por H. pylori, su tratamiento no está contraindicado.
La infección por H. pylori es muy prevalente a nivel mundial y su asociación causal con ulcera péptica y el cáncer gástrico causan más morbimortalidad que la ERGE126. Por lo tanto, la erradicación de H. pylori, es cada vez más frecuente, incluyendo la indicación de erradicación en el contexto de poblaciones de riesgo intermedio a alto de cáncer gástrico aun siendo asintomáticos127.
Hay dificultad para discriminar entre los síntomas atribuibles a la ERGE, úlcera péptica y síntomas funcionales, por lo que las indicaciones relativas para su erradicación han aumentado y se han expandido en las guías clínicas128. Aunque estudios epidemiológicos muestran negativa asociación entre la prevalencia de infección por H. pylori y la prevalencia y severidad de la ERGE, el H. pylori debe ser tratado de acuerdo con las recomendaciones de las guías al respecto129.
Estudios con monitorización del pH esofágico han determinado que no existe correlación entre exposición al acido anormal y la presencia o ausencia de H. pylori. En la mayoría de los pacientes la infección con H. pylori no tiene efectos en la severidad de los síntomas, la recurrencia o la eficacia del tratamiento de la ERGE. El erradicar H. pylori no exacerba ERGE. Sin embargo, la erradicación de H. pylori, puede recuperar la capacidad secretora de los pacientes posterradicación, generando una tendencia no significativa en el grupo posterradicación H. pylori con relación a la ERGE erosivo (OR: 1,11) y síntomas de la ERGE (1,22)130.
Además, dado que el uso de IBP asociado a la infección por H. pylori aumenta la prevalencia de atrofia gástrica y metaplasia intestinal, conocidos factores de riesgo para adenocarcinoma gástrico, en el contexto de la ERGE con tratamiento prolongado con IBP se recomienda buscar y tratar H. pylori, sobre todo en los pacientes jóvenes131,132. Recientemente, en un estudio nórdico, se demuestra que la erradicación de H. pylori no incrementa el riesgo de adenocarcinoma esofágico por lo que no existen razones de peso para no erradicar H. pylori en contexto de ERGE133.
Análogos de GLP-1 y enfermedad por reflujo gastroesofágicoRecomendación 29. Los pacientes con ERGE no tienen contraindicación de uso de análogos GLP-1. Sin embargo, estos fármacos pueden aumentar la frecuencia e intensidad de los síntomas de la enfermedad.
Los agonistas del glucagón-like peptide-1 (GLP-1) son medicamentos que se utilizan principalmente en el tratamiento de la diabetes tipo 2 y la obesidad. Algunos ejemplos incluyen liraglutida, semaglutida, exenatida y dulaglutida. Estos fármacos imitan la acción de la hormona natural GLP-1, que regula la liberación de insulina, la secreción de glucagón y el apetito. Sin embargo, su uso también tiene implicaciones para el sistema digestivo, lo que puede afectar la ERGE134.
Algunos posibles efectos negativos de los agonistas GLP-1 en los pacientes con ERGE son: 1) El retraso en el vaciamiento gástrico puede aumentar la presión intraabdominal, favoreciendo el reflujo ácido y empeorando los síntomas de la ERGE, y 2) Los efectos secundarios como náuseas y vómitos pueden lesionar el esófago y agravar los síntomas de la ERGE134.
Los efectos positivos de estos fármacos en la ERGE incluyen: 1) La pérdida de peso asociada con los agonistas de GLP-1 puede mejorar los síntomas de la ERGE en personas con sobrepeso u obesidad, y 2) La reducción del tamaño de las comidas gracias al aumento de la saciedad podría ayudar a controlar los episodios de reflujo134.
Es importante que los pacientes que tienen tanto diabetes tipo 2 u obesidad como la ERGE hablen con su médico antes de iniciar un tratamiento con agonistas de GLP-1, para evaluar los riesgos y beneficios en su caso específico.
Recomendación 30. Recomendamos individualizar al paciente con la ERGE tratado con agonistas de GLP-1 que será sometido a endoscopia evaluando el uso de dosis diaria o semanal e indicación (diabetes, sobrepeso, obesidad) del medicamento, así como la presencia de síntomas sugestivos de gastroparesia previos al procedimiento endoscópico, con el fin de disminuir el riesgo de broncoaspiración.
El uso de agonistas GLP-1 se ha incrementado de manera significativa para el manejo de la diabetes, el sobrepeso y la obesidad. Los efectos de estos fármacos sobre la función motora gástrica, que retrasa el vaciamiento e incrementa la retención de alimento en el estómago, son motivo de preocupación entre los gastroenterólogos por el posible mayor riesgo de broncoaspiración durante estudios endoscópicos134. Series de casos han mostrado que la retención de alimentos sólidos en el estómago es mayor en los pacientes diabéticos o en aquellos con síntomas sugestivos de gastroparesia como náusea, vómito, llenura o saciedad temprana. Estos síntomas son más comunes con el uso de agonistas GLP-1 de acción prolongada que con aquellos de vida media corta134,135.
Desafortunadamente, a la fecha, no existe suficiente evidencia para hacer recomendaciones respecto a la sedación y procedimientos endoscópicos en los pacientes tratados con agonistas GLP-1. No obstante, una revisión reciente de la Asociación Americana de Gastroenterología (AGA)4 sugiere lo siguiente:
En los pacientes tratados con agonistas GLP-1 sin síntomas de náusea, vómito, dispepsia o distensión abdominal, deben seguir el protocolo estándar para una endoscopia (ayuno de 8h). En los pacientes que presentan estos síntomas sugestivos de retención de contenido gástrico, se sugiere suspender el agonista GLP-1 una semana antes del procedimiento y dieta líquida el día previo a la endoscopia. El uso de ultrasonido transabdominal para identificar alimento retenido en el estómago previo a la endoscopia puede ser un recurso en este grupo de pacientes, sin embargo, no existe evidencia que determine la utilidad real de esta conducta136.
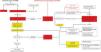
En la figura 1 se presenta un algoritmo diagnóstico y terapéutico de la ERGE en el cual se establece que un paciente con síntomas típicos de la ERGE sin datos de alarma puede recibir una prueba con IBP, si responde con mejoría de >50% se puede continuar con la dosis mínima de antisecretor suficiente para controlar los síntomas. Ante la presencia de signos de alarma, el paciente debe ser estudiado con endoscopia. La presencia de esofagitis grados B, C o D de Los Ángeles, esófago de Barrett o estenosis péptica establecen el diagnóstico de ERGE. El paciente con endoscopia normal o esofagitis A debe someterse a la medición del reflujo gastroesofágico con cápsula inalámbrica, pH con catéter o pH-impedancia sin IBP. Un TEA>6% establece el diagnóstico de ERGE. El TEA<4% descarta ERGE y apoya la presencia de trastornos funcionales esofágicos. El TEA entre el 4 y el 6% requiere parámetros adicionales como impedancia basal nocturna (IBN)>2500Ohms, más de 80 episodios de reflujo en 24h o una MAR con puntaje de Milán elevado, métricas que apoyan el diagnóstico de ERGE. Un paciente con evidencia demostrada de ERGE por endoscopia o medición del reflujo que no responde al tratamiento óptimo con IBP o P-CAB debe estudiarse con endoscopia y pH-impedancia con tratamiento antisecretor. La presencia de esofagitis o TEA>4% o >80 episodios de reflujo o IBN <1500 Ohms hacen el diagnóstico de ERGE refractaria y el paciente debe evaluarse para cirugía antirreflujo, sobre todo si tiene una hernia hiatal >3cm, o bien para LINX o tratamientos endoscópicos en ausencia de hernia hiatal o una hernia de tamaño pequeño. El obeso mórbido con ERGE demostrada debe tratarse con derivación gastroyeyunal. Los pacientes con trastornos funcionales esofágicos deben tratarse con neuromoduladores y terapias psicológicas.
Los pacientes con manifestaciones extraesofágicas de la ERGE deben someterse a la medición del reflujo con pH-metría con cápsula inalámbrica o pH-impedancia sin IBP. Los pacientes con TEA<4% deben ser evaluados por especialistas (otorrinolaringólogo, neumólogo, dentista, alergólogo) para investigar un origen de los síntomas diferentes a la ERGE. Aquéllos con TEA entre el 4 y el 6% o con TEA>6% deberán seguir el algoritmo tal y como se plantea para los pacientes con síntomas típicos.
Consideraciones éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo fue realizado sin recibir financiación alguna, y ningún participante recibió honorarios para la realización de estas guías.
Conflicto de interesesLuiz João Abrahão Junior, Claralí Almonte Nuñez, Josealberto Sebastiano Arenas Martínez, Herbert Burgos, Carla Dias, Ignacio Hanna, Carolina Olano, Amaya Ortiz, Arnoldo Riquelme y José Luis Tamayo de la Cuesta no presentan conflicto de intereses.
Claudia Defilippi: Conferencista laboratorio Saval/Carnot.
Octavio Gómez Escudero: Conferencista Carnot, Chinoin, Adium, Alfasigma y Faes Farma.
Albis Hani: Conferencista Farma de Colombia, Carnot y Medtronic.
Jorge Olmos: Conferencista Medtronic. grant de Abbott, Diversatek y Medtronic.
Guillermo Otoya: Conferencista laboratorios Carnot.
Luis Aguilar Paiz: Conferencista laboratorios Faes Farma.
Luis Fernando Pineda: Conferencista laboratorios Procaps, Farma, Carnott, MedTronic y Abbot.
José María Remes-Troche: Asesor y miembro de consejo consultivo para Asofarma, Carnot y Pisa. Conferencista para Asofarma, Abbot, Carnot, Chinoin, Johnson y Johnson, Medix y Medtronic.
Jorge Suazo Barahona: Conferencista Abbott y Menarini.
Miguel A. Valdovinos-Díaz: Comité asesor y conferencista para Carnot, M8, Conferencista Adium y Faes Farma.
Luis R. Valdovinos García: Conferencista laboratorios Carnot, Astra Zeneca, Adium y Chinoin.
Eduardo Vesco: Conferencista laboratorios Carnot, AstraZeneca y Tecnofarma.