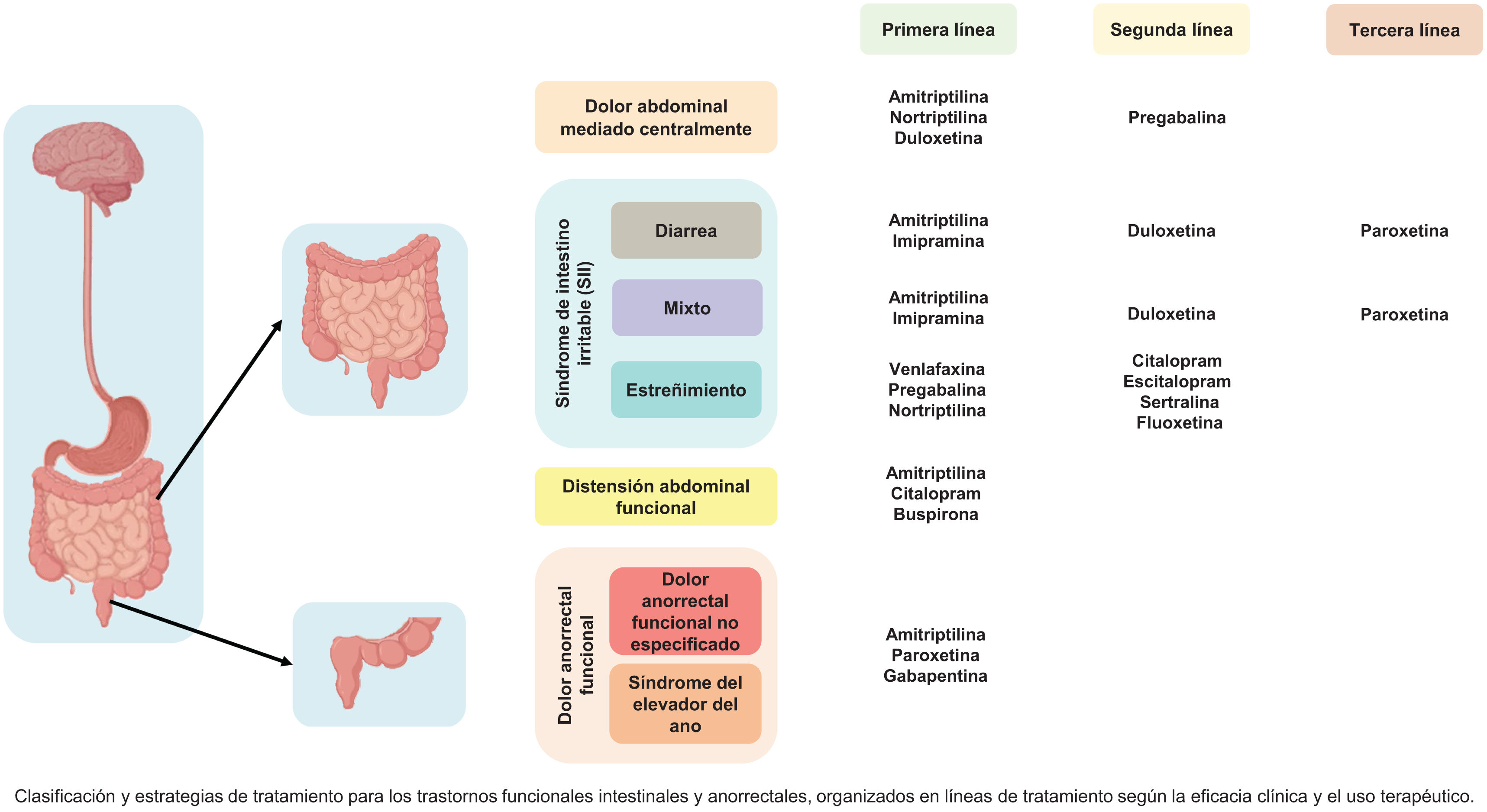
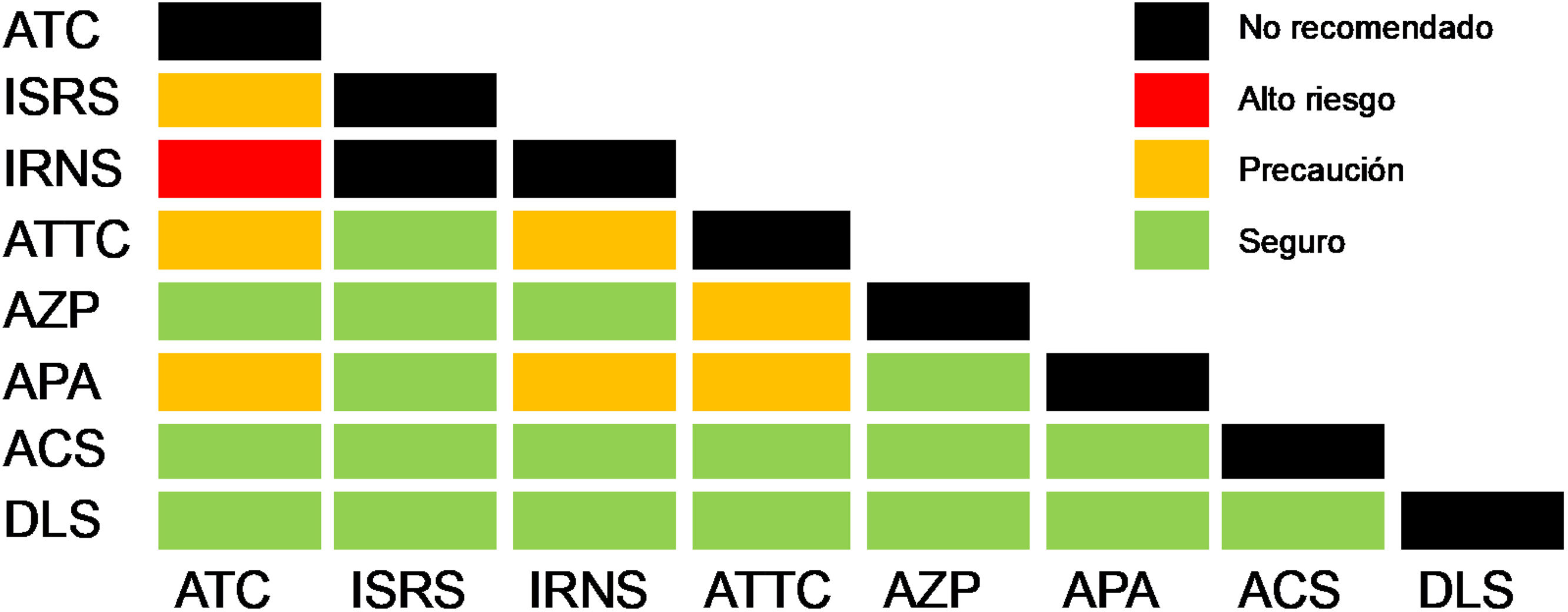
Los trastornos de la interacción cerebro-intestino (TICI) se caracterizan por alteraciones en el procesamiento central y periférico de estímulos en el eje cerebro-intestino (ECI), e incluyen padecimientos esofágicos, gastroduodenales, intestinales y anorrectales. Aunque los mecanismos fisiopatológicos son múltiples, la base del tratamiento son los neuromoduladores, un grupo heterogéneo de medicamentos que actúan sobre las vías y procesamiento central y periférico del dolor. Esta revisión de expertos de la Asociación Mexicana de Gastroenterología (AMG) y la Asociación Mexicana de Neurogastroenterología y Motilidad (AMNM) resume una serie de recomendaciones clínicas actualizadas basadas en una revisión exhaustiva de la literatura para el uso de neuromoduladores en TICI, organizada en seis secciones: principios farmacológicos, definición, clasificación, mecanismos de acción; pautas de uso en cada subtipo de TICI; estrategias para inicio, escalamiento, combinación, retiro; efectos adversos; manejo conjunto con psiquiatría en caso de comorbilidades, y neuromodulación no farmacológica. Además, se detalla el proceso de selección de fármacos y la personalización de dosis, adaptadas según la sensibilidad y las necesidades individuales de cada paciente, considerando factores como comorbilidades psiquiátricas y la posible sobreposición de síntomas y TICI.
Disorders of gut-brain interaction (DGBI) are characterized by alterations in both central and peripheral gut-brain axis (GBA)-related stimuli, and include esophageal, gastroduodenal, intestinal and anorectal disorders. Despite the fact that several pathophysiologic mechanisms are involved, the mainstay of treatment is neuromodulators, a heterogeneous group of drugs that act on pathways related to central and peripheral pain processing. This expert review by both the AMG (Asociación Mexicana de Gastroenterología) and AMNM (Asociación Mexicana de Neurogastroenterología y Motilidad) summarizes a series of updated clinical recommendations based on an exhaustive review of the literature, regarding the use of neuromodulators for DGBI, and is grouped into six sections: pharmacologic principles, definition, classification, mechanism of action; indications and use in each DGBI subtype; up/downscaling strategies, combination therapy; adverse events; joint use along with psychiatry in the case of comorbidities; and non-pharmacologic neuromodulation. Furthermore, drug selection process tips and dose personalization according to individual groups and sensitivities are provided, and special cases with DGBI-psychiatric comorbidity, as well as overlap with another DGBI, are considered.
En los últimos años el mejor entendimiento de la fisiopatología de los previamente llamados trastornos funcionales digestivos ha permitido reclasificarlos de acuerdo a los criterios de RomaIV como trastornos de la interacción cerebro-intestino (TICI)1. Los complejos mecanismos entre los componentes del eje cerebro-intestino (ECI) pueden manifestarse en el aparato digestivo con síntomas a diferentes niveles, con sobreposición tanto de trastornos como de mecanismos fisiopatológicos, pero teniendo como común denominador una alteración en el procesamiento central o periférico de sensaciones y estímulos. La base del tratamiento de los TICI son los neuromoduladores, un grupo heterogéneo de medicamentos que actúan sobre vías de transmisión de dolor o sobre el procesamiento del mismo a nivel del sistema nervioso central (SNC) y periférico (SNP). El grupo de trabajo de la Fundación Roma ha propuesto en forma reciente una guía con recomendaciones para su uso en gastroenterología2, pero hasta el momento no hay lineamientos, guías o recomendaciones de acuerdo a los fármacos disponibles en nuestro país, manejo conjunto con psiquiatría, ni de opciones de neuromodulación no farmacológica. Dada la asociación frecuente con trastornos psicológicos, se considera que el abordaje de estos pacientes debe ser multidisciplinario, y tanto el gastroenterólogo como el psiquiatra deben estar familiarizados con las asociaciones entre ambas entidades, así como las diferentes indicaciones de uso, dosis e interacciones de estos medicamentos.
MetodologíaEsta revisión por expertos ha sido comisionada por la Mesa Directiva 2024 y el Comité Científico de la Asociación Mexicana de Gastroenterología (AMG) con el objetivo de establecer recomendaciones actualizadas de buena práctica clínica para el uso de fármacos neuromoduladores en los TICI, y publicarlas en un documento para su difusión entre la comunidad médica. Este documento no es una guía de práctica clínica o un consenso, dada la metodología estricta que estos formatos requieren, por lo que no se puede emitir una calificación de la evidencia en base al sistema GRADE3, pero tendrá recomendaciones de expertos basadas en una revisión exhaustiva de la literatura reciente. Las recomendaciones están divididas de acuerdo al órgano de origen de cada grupo de TICI, y estructuradas en base a enunciados considerados clínicamente relevantes a la evidencia disponible para cada subgrupo de neuromoduladores, y han sido sometidas a discusión en una sesión presencial por el grupo de participantes, en forma similar a las recomendaciones de buena práctica de otras enfermedades digestivas publicadas en forma reciente4,5.
Las principales recomendaciones de práctica clínica a discutir se han dividido en seis secciones, que incluyen:
- 1)
Conceptos básicos farmacológicos de neuromodulación, definición, clasificación y mecanismos de acción de los neuromoduladores.
- 2)
Recomendaciones de uso de neuromoduladores de acuerdo a región e indicación por subtipo de TICI (esofágicos, gastroduodenales, intestinales y de anorrecto).
- 3)
Recomendaciones para iniciar, escalar, aumentar, combinar y retirar neuromoduladores.
- 4)
Efectos adversos.
- 5)
Uso conjunto con psiquiatría.
- 6)
Neuromodulación no farmacológica.
Se convocó e integró un panel de expertos en forma conjunta con miembros de la AMG y de la Asociación Mexicana de Neurogastroenterología y Motilidad (AMNM). Los participantes fueron divididos en grupos de trabajo por los coordinadores generales (OGE/JMRT/ECA/KRGZ). Se invitó a dos psiquiatras a participar en la sección de manejo conjunto con psiquiatría, así como en la discusión de inicio, combinación y retiro de neuromoduladores. Cada grupo se encargó de recabar en forma exhaustiva y completa la evidencia disponible, mediante una búsqueda cruzada a través de los portales de PubMed e IMBIOMED (hasta septiembre de 2024), revisión crítica de la misma, y emitió sus recomendaciones de buena práctica clínica sobre los problemas asignados en forma de enunciados acompañados de una discusión para justificar cada recomendación. Los coordinadores, después de una revisión inicial, enviaron los enunciados a todo el grupo de expertos para una segunda revisión y aportar correcciones, comentarios o sugerencias. Los enunciados que generaron duplicidad de la información fueron eliminados y redactados en conjunto en caso necesario. El primer draft (V.1.0) fue generado y discutido por el grupo de expertos de manera presencial el día 19 de septiembre, previo al inicio del Curso de Postgrado Regional Norte, en la ciudad de Ensenada, Baja California. Con las aportaciones y correcciones de esta sesión presencial se elaboró el documento final (V2.0), el cual fue firmado por todos los participantes, incluyendo una declaración de conflicto de intereses para asegurar la credibilidad del documento, y enviado finalmente para revisión por pares de acuerdo a los procedimientos estándar de la Revista de Gastroenterología de México.
Conceptos básicos farmacológicos de neuromodulacion, definición, clasificación y mecanismos de acción de los neuromoduladoresDefinición- •
Los neuromoduladores son moléculas endógenas o exógenas que actúan modulando la síntesis y/o liberaciónde uno o más neurotransmisores, la actividad de los canales iónicos y potenciales neurales, así como la activación o bloqueo de receptores pre y post-sinápticos en el SNC o SNP.
- •
Recomendamos adoptar el término propuesto por la Fundación Roma para describir los medicamentos que actúan sobre el eje cerebro-intestino como «neuromoduladores».
La actividad motora, sensorial y secretora gastrointestinal (GI) está conectada y regulada por la actividad cortical cerebral a través de un sistema de vías neuronales aferentes y eferentes, llamado eje cerebro intestino (ECI). Este eje consiste en una compleja red bidireccional, formada por asas reflejas que controlan la homeostasis de la función GI, y es impactado por la microbiota/microbioma entérica6,7. El ECI está dividido en un conectoma cerebral, que incluye al SNC, con diversas áreas interconectadas involucradas en diferentes procesos mentales, como discriminación y localización (corteza primaria sensoriomotora), procesamiento de emociones (tallo cerebral), comportamiento (tálamo medial, corteza cingulada y regiones insulares), la barrera hematoencefálica, ramas aferentes, eferentes, el cuerno dorsal espinal, el sistema nervioso autónomo (SNA) y entérico (SNE), y un conectoma intestinal, conformado por la microbiota, el microbioma, la barrera epitelial, neurorreceptores, células inflamatorias y mediadores inmunes6,7. La disfunción en uno o varios de estos mecanismos puede resultar en alteraciones motoras, secretoras, del tono autonómico, del eje hipotálamo-hipófisis adrenal, y sensitivas centrales y periféricas, que se traducen clínicamente en uno o más TICI, los cuales pueden afectar uno o más segmentos o aparatos del tracto GI1,8,9. Dentro de los múltiples mecanismos fisiopatológicos de los TICI, los más comunes son alteraciones en el procesamiento central de estímulos provenientes del órgano blanco, disfunción neuroinmune e hipersensibilidad visceral, y aunque existen fármacos dirigidos a otros mecanismos, como dismotilidad o alteraciones en la secreción intestinal, la base del tratamiento son los neuromoduladores1,8,10. Se considera neuromodulador cualquier molécula endógena o exógena que, sin ser acumulada y liberada por terminaciones nerviosas, actúa en forma presináptica modulando la síntesis y/o liberación de uno o más neurotransmisores, y en forma secundaria regula la actividad de los canales iónicos y potenciales de membrana en las células neurales, mediante la activación o bloqueo de diferentes receptores pre y post-sinápticos, en el SNC o en el SNP. Algunos dispositivos exógenos con propiedades similares pueden clasificarse también como neuromoduladores8,11,12. Debido a la heterogeneidad de grupos farmacológicos considerados como neuromoduladores, y a que los mismos son parte fundamental del tratamiento de los TICI, la Fundación Roma ha propuesto redefinir la terminología de los medicamentos que actúan dentro de este sistema, y acuñar el nombre de neuromoduladores, en lugar de referirse a ellos como antidepresivos, antipsicóticos, anticonvulsivantes o neurolíticos, debido a que las dosis utilizadas para inducir neuromodulación son diferentes a sus otras indicaciones13. Existe una marcada heterogeneidad en términos de conocimiento, actitud y nivel de práctica entre los médicos de atención primaria y algunos gastroenterólogos, como recién se describió en un hospital universitario en Corea, donde menos del 30% prescriben neuromoduladores debido a poca familiaridad con este grupo de medicamentos14.
Principales vías de neuromodulación farmacológica- •
Neuromodulación es el proceso fisiológico mediante el cual un estímulo regula la población, actividad y funciones neuronales a través de la acción de uno o más neurotransmisores que pueden activar o bloquear receptores para inducir un efecto modulador.
- •
Los neuromoduladores tienen la capacidad de modular la percepción de dolor e inducir neuroplasticidad debido al efecto sobre uno o más neurotransmisores y receptores post-sinápticos a nivel central o periférico.
Los neuromoduladores afectan vías de transmisión neural tanto ascendentes (interfieren con los circuitos cerebrales relacionados con el dolor, emocionales y cognitivos, e interfieren con la transmisión de dolor en el cuerno dorsal espinal) como descendentes (control de proyecciones provenientes de diversas estructuras cerebrales, mediadas por receptores serotoninérgicos, noradrenérgicos y opidérgicos). A nivel sináptico inducen un aumento rápido de la acción de una o más monoaminas, de acuerdo a cada subgrupo, causando acumulación de las mismas en el espacio sináptico. Un segundo mecanismo es infra-regulación retardada o desensibilización de los receptores post-sinápticos del receptor respectivo. Se ha descrito que los neuromoduladores pueden inducir neuroplasticidad que involucra componentes neurodegenerativos y propiedades regenerativas, particularmente en síndromes asociados a dolor crónico. Uno de los mecanismos parece ser reversión de la pérdida de neuronas corticales e inducción de neurogénesis, mediante el aumento en los niveles de factor neurotrópico derivado del cerebro (BDNF), ya que se ha descrito que, con el tiempo, el dolor crónico, la depresión, la ansiedad y otras formas de estrés emocional conducen a una pérdida de la densidad de neuronas corticales, proceso que los neuromoduladores pueden revertir1,8,15.
El mecanismo de acción en el tracto GI varía de acuerdo a cada subgrupo de neuromoduladores, y puede incluir estimulación y/o inhibición parcial o total de uno o más transportadores o receptores pre y post-sinápticos serotoninérgicos, muscarínicos, colinérgicos o noradrenérgicos, con efectos tanto terapéuticos (aumento o disminución en motilidad y tono gastrointestinal, acomodación gástrica, efecto antinociceptivo) como adversos (somnolencia, resequedad de boca, estreñimiento, diarrea, retención urinaria, ganancia ponderal) que varían dependiendo del receptor estimulado o inhibido1.
Concepto de agonismo/antagonismo/recaptura- •
Los efectos terapéuticos (y secundarios) de los neuromoduladores dependen de su agonismo o antagonismo sobre uno o más receptores, lo cual puede inducir aumento o disminución en la recaptura de diferentes neurotransmisores.
La farmacodinamia se refiere a los mecanismos y efectos de los medicamentos sobre las funciones biológicas en el organismo, es decir, lo que estos hacen al cuerpo y cómo lo hacen. Para poder tener efecto, los fármacos neuromoduladores tienen que llegar a sus células blanco y unirse a uno o más receptores, los cuales son proteínas especializadas que se encuentran en el interior de la célula o sobre su membrana. Al momento de unirse a una molécula de señalización llamada «ligando», pueden alterar su forma o actividad, según el efecto que tiene sobre el receptor, y existen dos grandes categorías: agonistas y antagonistas16.
Agonista. Es cualquier sustancia que imita la acción del ligando de la señal al unirse a un receptor y activarlo.
Antagonista. Es cualquier sustancia que se une a un receptor sin activarlo, impidiendo que se active por otras señales, es decir, disminuye la capacidad del receptor de ser activado por otro agonista. Los antagonistas de receptores pueden clasificarse en reversibles e irreversibles. Los antagonistas reversibles se separan con facilidad de su receptor; los antagonistas irreversibles forman un enlace químico estable, permanente o casi permanente con su receptor.
Recaptura. Consiste en la reabsorción de neurotransmisores u otras sustancias, después de que han sido liberados en la sinapsis. La recaptura es una forma de inactivación de los neurotransmisores, lo cual es crucial para la terminación de la señalización sináptica y para la regulación de la concentración de neurotransmisores disponibles en el espacio sináptico, lo que a su vez tiene implicaciones directas en la modulación de la función del sistema nervioso tanto central como periférico. En el SNC los procesos de recaptura son especialmente relevantes para neurotransmisores tales como la serotonina, la noradrenalina y la dopamina.
Clasificación- •
Los neuromoduladores se clasifican de acuerdo a su estructura química, grupo farmacológico y sitio de acción (central o periférica).
- •
Los neuromoduladores de acción central son los antidepresivos tricíclicos (ATC), los inhibidores selectivos de la recaptura de serotonina (ISRS); los inhibidores de recaptura de norepinefrina y serotonina (IRNS), las azapironas, los antipsicóticos atípicos y los anticonvulsivantes. Los neuromoduladores periféricos son los agentes delta-ligandos.
- •
Se debe explicar al paciente el concepto e indicación del neuromodulador, y evitar el uso de términos como antidepresivo, ansiolítico, antipsicótico o neurolítico, para evitar confusión con otras indicaciones del mismo fármaco.
Los neuromoduladores se clasifican de acuerdo con su estructura química, grupo farmacológico y sitio de acción (central o periférica, tabla 1)2,11,17. Debido a la heterogeneidad de grupos considerados como neuromoduladores, la mayoría poseen más de una indicación terapéutica, que puede incluir tratamiento de trastornos psiquiátricos como depresión, ansiedad o trastorno obsesivo-compulsivo (TOC), esquizofrenia, neuropatías o crisis convulsivas, entre otros. Debido a esto, se debe tomar el tiempo de explicarle al paciente no solo los mecanismos fisiopatológicos detrás del dolor, sino también los mecanismos de neuromodulación de cada uno de estos grupos de fármacos, el efecto clínico que queremos lograr, y que la indicación primaria de su uso en gastroenterología es modulación de la percepción del dolor, para evitar confusión y estigma entre los pacientes8,18.
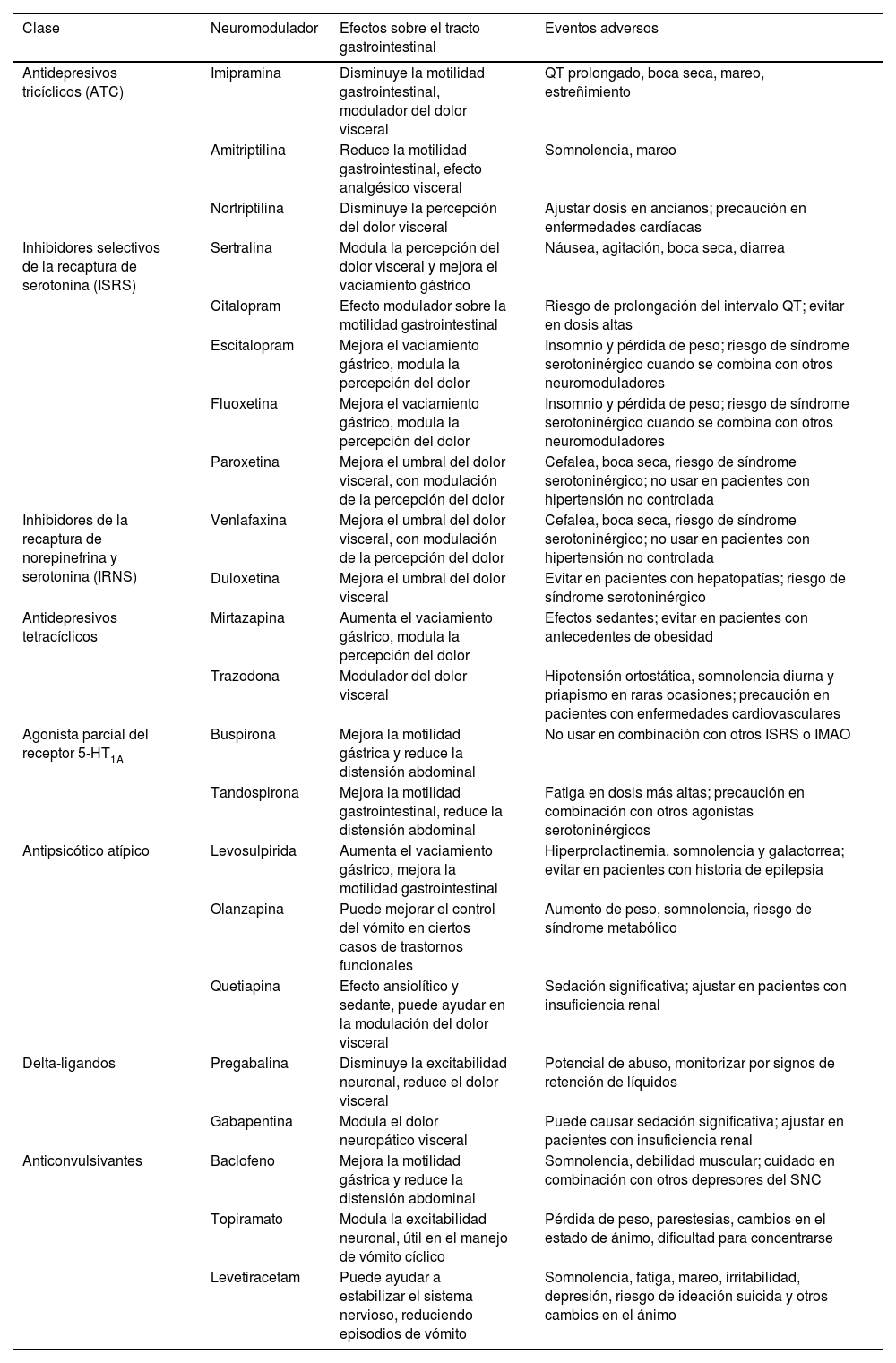
Neuromoduladores: efectos gastrointestinales y eventos adversos
| Clase | Neuromodulador | Efectos sobre el tracto gastrointestinal | Eventos adversos |
|---|---|---|---|
| Antidepresivos tricíclicos (ATC) | Imipramina | Disminuye la motilidad gastrointestinal, modulador del dolor visceral | QT prolongado, boca seca, mareo, estreñimiento |
| Amitriptilina | Reduce la motilidad gastrointestinal, efecto analgésico visceral | Somnolencia, mareo | |
| Nortriptilina | Disminuye la percepción del dolor visceral | Ajustar dosis en ancianos; precaución en enfermedades cardíacas | |
| Inhibidores selectivos de la recaptura de serotonina (ISRS) | Sertralina | Modula la percepción del dolor visceral y mejora el vaciamiento gástrico | Náusea, agitación, boca seca, diarrea |
| Citalopram | Efecto modulador sobre la motilidad gastrointestinal | Riesgo de prolongación del intervalo QT; evitar en dosis altas | |
| Escitalopram | Mejora el vaciamiento gástrico, modula la percepción del dolor | Insomnio y pérdida de peso; riesgo de síndrome serotoninérgico cuando se combina con otros neuromoduladores | |
| Fluoxetina | Mejora el vaciamiento gástrico, modula la percepción del dolor | Insomnio y pérdida de peso; riesgo de síndrome serotoninérgico cuando se combina con otros neuromoduladores | |
| Paroxetina | Mejora el umbral del dolor visceral, con modulación de la percepción del dolor | Cefalea, boca seca, riesgo de síndrome serotoninérgico; no usar en pacientes con hipertensión no controlada | |
| Inhibidores de la recaptura de norepinefrina y serotonina (IRNS) | Venlafaxina | Mejora el umbral del dolor visceral, con modulación de la percepción del dolor | Cefalea, boca seca, riesgo de síndrome serotoninérgico; no usar en pacientes con hipertensión no controlada |
| Duloxetina | Mejora el umbral del dolor visceral | Evitar en pacientes con hepatopatías; riesgo de síndrome serotoninérgico | |
| Antidepresivos tetracíclicos | Mirtazapina | Aumenta el vaciamiento gástrico, modula la percepción del dolor | Efectos sedantes; evitar en pacientes con antecedentes de obesidad |
| Trazodona | Modulador del dolor visceral | Hipotensión ortostática, somnolencia diurna y priapismo en raras ocasiones; precaución en pacientes con enfermedades cardiovasculares | |
| Agonista parcial del receptor 5-HT1A | Buspirona | Mejora la motilidad gástrica y reduce la distensión abdominal | No usar en combinación con otros ISRS o IMAO |
| Tandospirona | Mejora la motilidad gastrointestinal, reduce la distensión abdominal | Fatiga en dosis más altas; precaución en combinación con otros agonistas serotoninérgicos | |
| Antipsicótico atípico | Levosulpirida | Aumenta el vaciamiento gástrico, mejora la motilidad gastrointestinal | Hiperprolactinemia, somnolencia y galactorrea; evitar en pacientes con historia de epilepsia |
| Olanzapina | Puede mejorar el control del vómito en ciertos casos de trastornos funcionales | Aumento de peso, somnolencia, riesgo de síndrome metabólico | |
| Quetiapina | Efecto ansiolítico y sedante, puede ayudar en la modulación del dolor visceral | Sedación significativa; ajustar en pacientes con insuficiencia renal | |
| Delta-ligandos | Pregabalina | Disminuye la excitabilidad neuronal, reduce el dolor visceral | Potencial de abuso, monitorizar por signos de retención de líquidos |
| Gabapentina | Modula el dolor neuropático visceral | Puede causar sedación significativa; ajustar en pacientes con insuficiencia renal | |
| Anticonvulsivantes | Baclofeno | Mejora la motilidad gástrica y reduce la distensión abdominal | Somnolencia, debilidad muscular; cuidado en combinación con otros depresores del SNC |
| Topiramato | Modula la excitabilidad neuronal, útil en el manejo de vómito cíclico | Pérdida de peso, parestesias, cambios en el estado de ánimo, dificultad para concentrarse | |
| Levetiracetam | Puede ayudar a estabilizar el sistema nervioso, reduciendo episodios de vómito | Somnolencia, fatiga, mareo, irritabilidad, depresión, riesgo de ideación suicida y otros cambios en el ánimo |
- •
El efecto antinociceptivo de cada grupo de neuromoduladores puede diferir dependiendo de la activación o inhibición de diferentes receptores y neurotransmisores. Algunos pueden tener efecto sobre la motilidad gastrointestinal.
En general los neuromoduladores modifican la acción sináptica de una o más de las tres monoaminas principales: dopamina, serotonina y/o noradrenalina (tabla 1). El mecanismo de acción de cada grupo de neuromoduladores puede variar debido a su estructura farmacológica. Cada subgrupo puede estimular y/o inhibir de manera parcial o total a uno o más receptores pre y post-sinápticos de serotonina (5-HT), histaminérgicos, muscarínicos o noradrenérgicos, con efectos farmacológicos sobre la motilidad, la secreción y la analgesia visceral. Los efectos adversos sobre motilidad y secreción GI pueden en muchos casos ayudar a controlar algunos síntomas secundarios, como estreñimiento, diarrea o pérdida ponderal2,11.
Antidepresivos tricíclicos (ATC). Inducen antagonismo e inhibición de múltiples receptores pre (α2) y post-sinápticos (5-HT2, 5-HT3, H1, muscarínico-1, α1), que se traducen en disminución de la motilidad GI (efecto colinérgico, noradrenérgico) y efecto antinociceptivo central. A este grupo pertenecen imipramina, amitriptilina, nortriptilina, desipramina, doxepina y trimipramina11.
Inhibidores selectivos de recaptura de serotonina (ISRS). Bloquean en forma selectiva el transportador 5-HT presináptico, resultando en aumento de la motilidad GI, pero sin efecto significativo sobre la sensibilidad (tienen poco efecto analgésico). Los ISRS son citalopram, escitalopram, sertralina, fluoxetina, fluvoxamina y paroxetina19. Algunos poseen un segundo mecanismo de acción, como fluoxetina (antagonismo 5-HT2C) o paroxetina (efecto anticolinérgico)2.
Inhibidores de recaptura de norepinefrina y serotonina (IRNS). Bloquean el transportador 5-HT y de noradrenalina presinápticos. A este grupo pertenecen la venlafaxina, desvenlafaxina, duloxetina, milnaciprán y levomilnaciprán. La venlafaxina induce bloqueo 5-HT a dosis bajas, e inhibición de recaptura noradrenérgica a dosis altas (>225mg), la duloxetina tiene la misma afinidad por los transportadores de 5-HT y noradrenérgicos, mientras el milnaciprán tiene un efecto mayor inhibitorio de recaptura de noradrenalina. Los efectos antinociceptivos de los IRNS parecen ser superiores a los de los ISRS2,20.
Tetracíclicos. Incrementan la actividad noradrenérgica con un aumento específico de la actividad serotoninérgica a través del antagonismo neuronal presináptico de los auto y hetero-receptores de noradrenalina y 5-HT. Los efectos antidepresivos resultan del antagonismo 5-HT2A y 5-HT2C, mientras los efectos GI del antagonismo 5-HT3. A este grupo pertenecen mirtazapina, mianserina, amoxapina y trazodona2. La mirtazapina a dosis bajas exhibe antagonismo H1, lo cual puede causar sedación, mientras el antagonismo 5-HT2C estimula el apetito y el aumento de peso21.
Azapironas. Son agonistas pre y post-sinápticos parciales del receptor 5-HT1, y poseen cierta afinidad al receptor 5-HT2 y moderada afinidad a los receptores de dopamina D222. Se consideran ansiolíticos no benzodiazepínicos. A este grupo pertenecen la buspirona y la tandospirona, los cuales tienen un mecanismo de acción similar2.
Antipsicóticos atípicos. Son una clase de medicamentos heterogénea, conocidos también como antipsicóticos de segunda generación. A este grupo pertenecen sulpirida, amisulprida, levosulpirida, quetiapina, olanzapina, risperidona, aripiprazol, brexpiprazol y clozapina. Su mecanismo de acción es mediante antagonismo de los receptores de dopamina D2, además de agonismo parcial D2 (sulpirida, amisulprida, levosulpirida), agonismo parcial 5-HT1A (quetiapina) y antagonismo 5-HT2A (olanzapina, quetiapina)2. Todos estos mecanismos de acción adicionales reducen el riesgo de efectos adversos, particularmente extrapiramidales. Algunos antipsicóticos de primera generación, también llamados neurolépticos, como clorpromazina o trifluoperazina, han sido utilizados para el tratamiento de náusea, pero suelen asociarse más frecuentemente a efectos secundarios extrapiramidales23.
Anticonvulsivantes. Constituyen un grupo heterogéneo dividido en 8 subgrupos de fármacos de acuerdo con su mecanismo de acción, algunos de los cuales tienen más de uno, incluyendo a los bloqueadores de los canales de sodio de activación repetitiva (fenitoína, carbamazepina, oxcarbazepina), análogos y potenciadores del ácido gamma-aminobutírico o GABA (fenobarbital, benzodiazepinas, baclofeno), moduladores del glutamato (topiramato, lamotrigina, felbamato), bloqueadores de los canales de calcioT (etosuximida, ácido valproico), bloqueadores de los canales de calcioN yL (lamotrigina, topiramato, zonisamida, ácido valproico), moduladores de la corrienteH (gabapentina, lamotrigina), inhibidores de anhidrasa carbónica (topiramato, zonisamida) y bloqueadores de sitios de unión específicos (gabapentina, levetiracetam)8,24.
Delta-ligandos o ligandos α2-delta. Los delta-ligandos bloquean la subunidad α2-delta de los canales de calcio presinápticos dependientes de voltaje en el cuerno dorsal medular; por lo tanto, se consideran neuromoduladores periféricos. No poseen efecto sobre la motilidad GI. A este grupo pertenecen la pregabalina y la gabapentina. Como se ha mencionado, la gabapentina es además un modulador de corrienteH, por lo que también es clasificado como anticonvulsivante y puede tener efecto neuromodulador parcialmente central25,26.
Efecto terapéutico en la motilidad/sensibilidad grupo (tabla 1)- •
Los ATC (imipramina, amitriptilina, nortriptilina, desipramina, doxepina, trimipramina) tienen efecto analgésico visceral y disminuyen la motilidad y secreción GI. Su principal indicación es dolor como síntoma predominante, o en TICI asociados a diarrea.
Los ATC tienen varios mecanismos de acción: poseen antagonismo e inhibición de múltiples receptores pre (α2) y post-sinápticos (5-HT2, 5-HT3, H1, muscarínico-1, α1), que se traducen en disminución de la motilidad GI (efecto colinérgico, noradrenérgico, serotoninérgico), y un efecto antinociceptivo central22. Sus propiedades analgésicas se deben a la combinación de propiedades de inhibición de recaptura de 5-HT y noradrenalina. Por su acción dual, los ATC teóricamente tienen un efecto analgésico más potente en comparación con otros neuromoduladores como los ISRS27. Además, actúan como antagonistas de los receptores muscarínicos-1, lo cual se asocia a un tránsito orocecal lento (amitriptilina, imipramina, desipramina)2,28.
- •
Los ISRS (citalopram, escitalopram, sertralina, fluoxetina, paroxetina, fluvoxamina) aumentan la motilidad GI pero no tienen efecto sobre sensibilidad/analgesia visceral. Son útiles para el tratamiento de ansiedad, fobias y trastorno obsesivo-compulsivo (TOC) asociado a los TICI.
El mecanismo de acción común de los ISRS es a través del bloqueo selectivo del transportador 5-HT presináptico, resultando en aumento de la motilidad GI, pero sin efecto significativo sobre la sensibilidad19. La inhibición aguda del transporte de serotonina en humanos aumenta la fase de contractilidad colónica y la frecuencia de contracciones propagadas de gran amplitud, aumento de la distensibilidad colónica y supresión de la respuesta tónica colónica a los alimentos, por lo cual los ISRS aumentan la motilidad propulsiva gástrica e intestinal29. Pueden utilizarse para la reducción de ansiedad o la hipervigilancia asociada a diferentes TICI.
- •
Los IRNS (duloxetina, venlafaxina, desvenlafaxina, milnaciprán, levomilnaciprán) inhiben el tono gastro-colónico en menor grado que los ATC, y poseen efecto analgésico visceral. Son útiles para trastornos con predominio de dolor, incluyendo condiciones asociadas (fibromialgia, cefalea), o cuando hay intolerancia a los ATC.
Los IRNS actúan como antagonistas de los receptores 5-HT3, por lo que retrasan el vaciamiento gástrico y disminuyen la velocidad del tránsito colónico2. Su perfil de seguridad es más favorable que los ATC, razón por la cual son la alternativa para el tratamiento de trastornos asociados a dolor crónico cuando existe intolerancia a ATC. Los efectos antinociceptivos de los IRNS parecen ser superiores a los de los ISRS30.
- •
Los agentes tetracíclicos (mirtazapina, mianserina, amoxapina, trazodona) tienen un efecto relajante sobre el fondo gástrico, y su uso potencial es en trastornos asociados a saciedad, náusea y pérdida ponderal.
Los efectos GI de los agentes tetracíclicos se deben a su acción específica sobre receptores noradrenérgicos y serotoninérgicos, particularmente actividad noradrenérgica aumentada, y antagonismo 5-HT1 y 5-HT3, lo que puede explicar sus efectos en reducción de náusea, dolor y diarrea, pero como la histamina juega un papel importante en saciedad y regulación del apetito, su inhibición se asocia a ganancia ponderal. Existe evidencia de los efectos inhibitorios sobre el tono gástrico y colónico; sin embargo, se requieren más estudios para evaluar su efecto sobre la motilidad GI31.
- •
Las azapironas (buspirona, tandospirona) aumentan la contractilidad esofágica y tienen un efecto predominante sobre la acomodación gástrica, con evidencia menor de efecto antinociceptivo. Su uso potencial es en saciedad temprana, plenitud postprandial, náusea y ansiedad asociada.
Las azapironas son agonistas no selectivos de receptores post-sinápticos 5-HT1A, antagonistas de receptores presinápticos D2, D3 y D4, y agonistas parciales α1-adrenérgicos. Tienen efectos sobre la acomodación y relajación gástricas, sin efectos sobre motilidad a nivel esofágico o colónico, y con evidencia menor de efecto antinociceptivo. Los trabajos en dispepsia han mostrado su utilidad para mejoría sintomática en pacientes con saciedad temprana, plenitud postprandial y náusea. Al ser ansiolíticos no benzodiazepínicos, son de utilidad cuando existe ansiedad asociada32,33.
- •
Los antipsicóticos atípicos (sulpirida, levosulpirida, olanzapina, quetiapina, aripiprazol, brexpiprazol, risperidona, clozapina, flupentixol) y algunos típicos (clorpromazina, trifluoperazina) tienen efectos terapéuticos y adversos diferentes de acuerdo al subtipo, y su uso principal en TICI es control de náusea y vómito. Levosulpirida mejora la relajación gástrica y tiene efecto mixto procinético y ansiolítico.
No existe evidencia sobre el efecto en la motilidad GI de los antipsicóticos atípicos en sujetos sanos. Sin embargo, debido a su efecto antagonista de dopamina y serotoninérgico, y en algunos casos antimuscarínico, han sido utilizados como tratamiento de náusea y vómito asociados a diferentes padecimientos23. La sulpirida y la levosulpirida se utilizan ocasionalmente para el tratamiento de la dispepsia funcional (DF) y la gastroparesia (GP) por sus efectos en el vaciamiento gástrico34,35. Existe evidencia de mejoría de náusea y vómito con olanzapina en diferentes trastornos, incluyendo estados postquirúrgicos y tras administración de quimioterapia36.
- •
Existe escasa evidencia sobre los efectos en la motilidad y sensibilidad GI de los anticonvulsivantes (carbamazepina, oxcarbazepina, baclofeno, lamotrigina, ácido valproico, topiramato). Topiramato es útil para prevención de diferentes formas de cefalea y síndrome de vómito cíclico.
Los anticonvulsivantes tienen un efecto analgésico potencial; sin embargo, la evidencia sobre su efectividad en dolor agudo o crónico es limitada37. Tampoco se cuenta con evidencia suficiente sobre sus efectos en la motilidad GI. Topiramato ha sido utilizado como agente profiláctico en diversas formas de cefalea, y en forma más reciente, en vómito cíclico38,39. Gabapentina es un fármaco de acción dual, ya que se considera anticonvulsivante bloqueador de sitio de unión específico, pero su principal mecanismo de acción es como neurolítico de acción periférica. Su papel principal es el control del dolor en neuropatías, aunque se conoce poco de su efecto antinociceptivo central37.
- •
Los delta-ligandos (pregabalina, gabapentina) son útiles en dolor neuropático asociado a TICI, y trastornos asociados como fibromialgia.
Pregabalina y gabapentina tienen un mecanismo de acción similar, al unirse a canales de calcio y modular el flujo de calcio además de influir en la neurotransmisión asociada a receptores GABAérgicos. En el caso de pregabalina el efecto es analgésico y ansiolítico, y en el de gabapentina, analgésico, ansiolítico y anticonvulsivante40. El efecto sobre la motilidad y la sensibilidad GI de los delta-ligandos aún no se ha estudiado; sin embargo, debido a su mecanismo de acción a nivel de SNC, parecen tener efecto sobre la neuromodulación25.
- •
Algunos neuromoduladores pueden ser útiles para control de comorbilidades psiquiátricas en los TICI, incluyendo ansiedad, hipervigilancia, TOC y depresión, entre otros.
Además de su efecto antinociceptivo, los neuromoduladores pueden utilizarse en los TICI para tratamiento de comorbilidades asociadas, incluyendo manifestaciones extragastrointestinales como fibromialgia, migraña y cistitis intersticial, o en pacientes que presentan comorbilidades psiquiátricas. Estos fármacos pueden reducir ansiedad, hipervigilancia, atención selectiva y el catastrofismo asociado con los síntomas GI, y servir para el tratamiento de otras condiciones, como TOC y depresión. Además, pueden revertir la pérdida de neuronas corticales e inducir neurogénesis, ya que, con el tiempo, el dolor crónico, la depresión, la ansiedad y otras formas de distrés emocional conducen a una pérdida de densidad de neuronas corticales, y como se ha mencionado previamente, los neuromoduladores de acción central pueden revertir este proceso al aumentar los niveles de BDNF, lo que conlleva un aumento de la neurogénesis11,12.
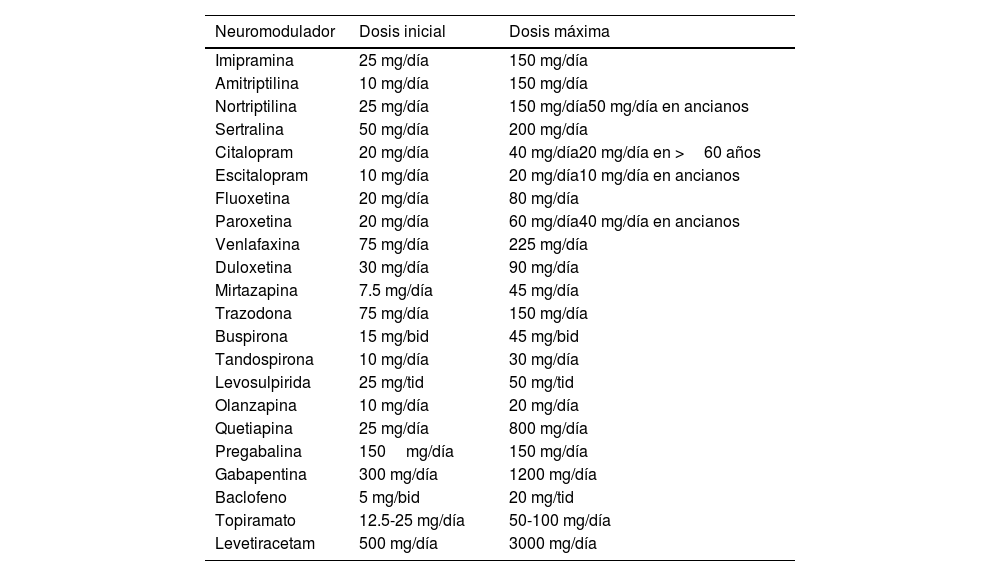
En la tabla 2 se muestran las dosis recomendadas de cada uno de los diferentes tipos de neuromoduladores utilizados en los TICI.
Dosis de neuromoduladores
| Neuromodulador | Dosis inicial | Dosis máxima |
|---|---|---|
| Imipramina | 25 mg/día | 150 mg/día |
| Amitriptilina | 10 mg/día | 150 mg/día |
| Nortriptilina | 25 mg/día | 150 mg/día50 mg/día en ancianos |
| Sertralina | 50 mg/día | 200 mg/día |
| Citalopram | 20 mg/día | 40 mg/día20 mg/día en >60 años |
| Escitalopram | 10 mg/día | 20 mg/día10 mg/día en ancianos |
| Fluoxetina | 20 mg/día | 80 mg/día |
| Paroxetina | 20 mg/día | 60 mg/día40 mg/día en ancianos |
| Venlafaxina | 75 mg/día | 225 mg/día |
| Duloxetina | 30 mg/día | 90 mg/día |
| Mirtazapina | 7.5 mg/día | 45 mg/día |
| Trazodona | 75 mg/día | 150 mg/día |
| Buspirona | 15 mg/bid | 45 mg/bid |
| Tandospirona | 10 mg/día | 30 mg/día |
| Levosulpirida | 25 mg/tid | 50 mg/tid |
| Olanzapina | 10 mg/día | 20 mg/día |
| Quetiapina | 25 mg/día | 800 mg/día |
| Pregabalina | 150mg/día | 150 mg/día |
| Gabapentina | 300 mg/día | 1200 mg/día |
| Baclofeno | 5 mg/bid | 20 mg/tid |
| Topiramato | 12.5-25 mg/día | 50-100 mg/día |
| Levetiracetam | 500 mg/día | 3000 mg/día |
- •
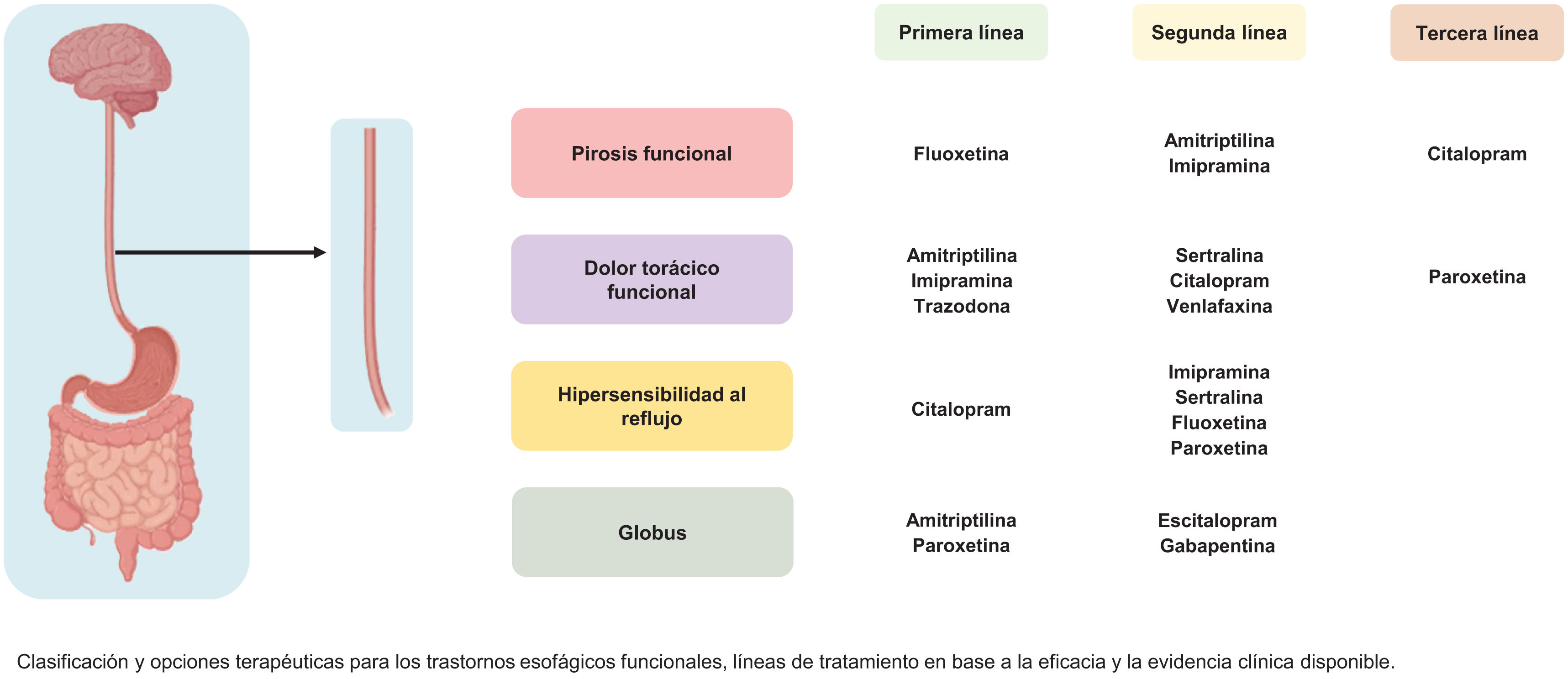
Recomendamos el uso de ISRS y ATC para el tratamiento de la PF.
La PF se define como ardor o malestar ardoroso retroesternal refractario a terapia antisecretora óptima, en ausencia de enfermedad por reflujo gastroesofágico (ERGE), anormalidades histológicas, trastornos motores mayores o anormalidades estructurales41. Los consensos de Porto y Lyon 1.0 y 2.0 han definido mejor a este grupo de pacientes, los cuales tienen una exposición normal al ácido y una asociación de síntomas negativa, lo que los diferencia del grupo con hipersensibilidad al reflujo42,43, aunque puede haber sobreposiciones entre grupos44,45. Por muchos años el tratamiento fue empírico; sin embargo, en años recientes y con el mejor entendimiento de la fisiopatología, ha surgido evidencia a favor del uso de neuromoduladores para tratar esta condición46,47. La evidencia actual sugiere que algunos ISRS, como fluoxetina, o ATC, como imipramina o amitriptilina, pueden ser efectivos en PF47. Al presente momento solo hay dos ensayos que evalúan directamente el uso de neuromoduladores en PF. Un estudio que evaluó pacientes con pirosis, endoscopia y pH-metría normales comparó el uso de fluoxetina, omeprazol o placebo durante 6semanas, y el tratamiento con fluoxetina se asoció a mayor número de días libres de pirosis, sin observar mejoría en el grupo con pH-metría anormal48. En un estudio que evaluó pacientes con PF que no respondieron adecuadamente al tratamiento con inhibidores de la bomba de protones (IBP), la imipramina no mostró diferencia significativa en comparación con el placebo en alivio de los síntomas; sin embargo, se asoció con mejoría en la calidad de vida según el puntaje SF-3649. En pacientes con ERGE y persistencia de síntomas se ha documentado que puede existir sobreposición con PF. En este subgrupo de pacientes la amitriptilina en combinación con el antisecretor es útil para controlar los síntomas, al igual que en pacientes en los cuales coexiste ansiedad50. Un metaanálisis que evaluó el uso de neuromoduladores en TICI esofágicos reportó resultados inconsistentes en PF, aunque la mayoría de los estudios evaluaron en conjunto a los grupos con PF e hipersensibilidad al reflujo51. Finalmente, un metaanálisis de red que evaluó el efecto de diferentes grupos de antidepresivos en ERGE sugiere que los ISRS pueden ayudar al control de síntomas, aunque el estudio no especifica si se trata de sobreposición ERGE con PF52.
Dolor torácico funcional (DT-F)- •
Recomendamos el uso de ATC, ISRS, venlafaxina y trazodona para el tratamiento de DT-F. Puede considerarse el uso de gabapentina y pregabalina.
El DT-F se define como dolor retroesternal inexplicable, recurrente, no asociado a otros síntomas esofágicos como pirosis o disfagia, no ocasionado por ERGE, trastornos motores o alteraciones mucosas como infección o esofagitis eosinofílica, y forma parte del espectro clínico del dolor torácico no cardíaco (DTNC)41,53. Se considera actualmente un TICI, dado que se ha demostrado que además de hipersensibilidad esofágica y comorbilidad esofágica, existe un procesamiento anormal de los estímulos esofágicos a nivel central54, con hipersensibilidad tanto central como periférica53, por lo que la base del tratamiento del DT-F son los neuromoduladores55. La evidencia actual sugiere que los ATC, los ISRS, la venlafaxina, la trazodona y los neuromoduladores periféricos (gabapentina y pregabalina) se asocian a tasas variables de mejoría. La imipramina aumenta el umbral al dolor a la distensión con balón en voluntarios sanos56, y a dosis de 50mg/día se asocia a reducción significativa del dolor torácico en el 52% de pacientes al compararse contra clonidina o placebo en pacientes con coronariografías normales independientemente de las pruebas esofágicas y psiquiátricas, lo cual sugiere un efecto analgésico visceral57. La combinación de amitriptilina en dosis bajas (10mg por día) con IBP a dosis estándar (rabeprazol) demostró ser más eficaz que el IBP a dosis doble en pacientes con DT-F58. Un trabajo comparó amitriptilina con citalopram tras 3meses de tratamiento, y reportaron mejoría en el 56.3% de los pacientes con el ATC, y en el 47% con citalopram, versus el 11% del placebo59. En otro trabajo, Prakash et al. reportaron efecto terapéutico hasta por 3años en pacientes con DTNC persistente con respuesta incompleta a cirugía antirreflujo que continuaron usando diferentes ATC60.
Al menos tres ISRS han sido evaluados en DTNC (sertralina, paroxetina, citalopram). Sertralina fue evaluada en dos estudios, en el primero, un ensayo clínico controlado (ECC) doble ciego, se reportó que a dosis de 50-200mg redujo en forma significativa los puntajes de percepción del dolor con mejoría en hasta el 57% de los pacientes a 8semanas61, y en el segundo se comparó contra placebo y a un entrenamiento de habilidades de afrontamiento (coping skills training), con seguimiento semanal por escala visual análoga a 34semanas, y tanto el fármaco como la combinación con terapia fueron superiores a placebo62. Paroxetina fue evaluada en dos trabajos: en el primero fue superior a placebo en una escala sintomática medida por el médico y no en puntajes autopercibidos63, pero en el segundo no fue superior a placebo ni a terapia cognitiva a 12semanas de tratamiento64. Citalopram administrado a dosis única de 20mg por vía intravenosa redujo hipersensibilidad mecánica y química esofágica sin alterar la motilidad65. Sin embargo, una revisión sistemática que incluyó todos estos estudios reportó que su efecto como grupo parece no ser superior al placebo en mejoría de los síntomas de DTNC, y la calidad de la evidencia se considera como moderada66.
Venlafaxina ha sido el único IRNS evaluado en DT-F. Fue evaluada en un ECC, y administrada a dosis de 75mg/d durante 4semanas demostró ser superior a placebo, con mejoría sintomática en el 52% de los pacientes comparado con el 4% del grupo placebo en un análisis de intención a tratar que definió eficacia primaria y número de pacientes con mejoría sintomática mayor al 50%67. En una revisión sistemática se reportó que fue el antidepresivo más eficaz para reducción de dolor esofágico y mejoría global68, y es considerada una buena opción para manejo de DT-F en pacientes que no toleran ATC69.
Trazodona ha sido evaluada en dos estudios. En el primero, administrada a dosis de 100-150mg, 4 veces al día por 6semanas, mejoró en forma significativa los puntajes de dolor en DTNC y trastornos motores sin inducir cambio en la motilidad con tasas de respuesta de 41%70. En el segundo trabajo se reportó un beneficio modesto al ser comparada contra clomipramina en pacientes con DTNC y espasmo esofágico difuso71.
Recientemente se ha publicado evidencia con neuromoduladores periféricos. Se ha demostrado que pregabalina disminuye la sensibilidad a la distensión esofágica en personas sanas; sin embargo, no hay ensayos clínicos en DTNC72. Gabapentina a dosis de 300mg/día administrada junto con IBP mejora la sensación de globus en pacientes con dolor torácico, y existe evidencia preliminar de efecto neuromodulador central73.
En la revisión sistemática de Nguyen y Eslick68 publicada en 2012, que incluyó 6 estudios controlados, se reportó mejoría global significativa con imipramina, sertralina, paroxetina, venlafaxina y trazodona. En el estudio los fármacos venlafaxina, sertralina, e imipramina demostraron la mayor eficacia, con porcentajes de reducción en comparación con el placebo del 50% vs el 10% para venlafaxina, el 63% vs el 15% para sertralina, y el 52% vs el 1% para imipramina. Finalmente, en el metaanálisis más reciente los neuromoduladores en conjunto se asociaron a reducción de dolor retroesternal entre el 52 y el 71%51.
Hipersensibilidad al reflujo (HR)- •
Recomendamos el uso de ISRS para el tratamiento de la HR con o sin terapia adyuvante supresora de ácido, o de ATC como primera alternativa, y en casos de comorbilidad psiquiátrica pueden considerarse otros neuromoduladores.
La HR fue introducida por el grupo de RomaIV como un nuevo TICI esofágico, y se define como la presencia de síntomas típicos de pirosis en un paciente con endoscopia y biopsias normales, con exposición esofágica normal al ácido, pero con correlación positiva entre síntomas y cambios de pH medidos por pH-metría, reemplazando el término previo de esófago hipersensible41,74. La base del tratamiento de HR son neuromoduladores, y se ha publicado evidencia con ISRS (citalopram) y ATC (imipramina). En un trabajo que evaluó sujetos sanos con hipersensibilidad esofágica establecida mediante prueba de distensión con balón, la administración de citalopram intravenoso incrementó el umbral a la primera sensación de pirosis y disconfort durante la prueba65. Un ECC incluyó 75 pacientes con síntomas refractarios a IBP, exposición esofágica normal al ácido y un índice de síntomas positivo, y la administración de citalopram 20mg/día eliminó en forma significativa los síntomas comparado contra placebo (61.5% vs 33.3%)75.
Los ATC se consideran eficaces para tratar algunos síntomas esofágicos. Se ha descrito que la imipramina puede disminuir la percepción de dolor en voluntarios sanos tras la distensión con balón56. Sin embargo, su uso en la HR es menor. Como se mencionó previamente, el tratamiento con imipramina en pacientes con síntomas de reflujo persistentes tras uso de IBP se asoció con una mejora en la calidad de vida, según lo medido por el puntaje SF-36, sin que se observara disminución de los síntomas, en comparación con el placebo en el trabajo de Limsrivilai et al.49, que incluyó pacientes con PF y con HR. Sin embargo, un trabajo que evaluó el efecto de nortriptilina en la respuesta cerebral a la infusión con ácido demostró que el medicamento redujo en forma significativa la respuesta cerebral a dolor en la corteza prefrontal, aunque se desconoce el significado clínico de este hallazgo76.
Hasta el momento no existen estudios que evalúen el papel de otros neuromoduladores (IRNS, trazodona, análogos de GABA) en el tratamiento de la HR. En pacientes seleccionados, los neuromoduladores de acción central pueden ser beneficiosos a nivel sintomático dependiendo de las comorbilidades, la coexistencia con DT-F, la respuesta al tratamiento, los efectos adversos, las exposiciones previas y la disponibilidad2.
Globus- •
Los ATC pueden considerarse para el tratamiento del globus no asociado con reflujo o trastornos motores, y en casos de comorbilidad psiquiátrica pueden considerarse otros neuromoduladores.
Globus se define como una sensación persistente o intermitente no dolorosa de cuerpo extraño u opresión en la garganta, más comúnmente entre el cartílago tiroideo y la horquilla esternal, en ocasiones asociado a disfagia u odinofagia, y que mejora al deglutir41. Puede asociarse a ERGE, HR, presencia de parches de mucosa ectópica en esófago superior, trastornos motores esofágicos, alteraciones en la percepción o en el procesamiento central o periférico de sensaciones, y a anormalidades psicológicas/psiquiátricas, incluyendo ansiedad y somatización77. Si el paciente tiene un trastorno psiquiátrico asociado, este debe ser tratado con el neuromodulador indicado. Un estudio que comparó la efectividad de IRNS contra bloqueadores selectivos de potasio concluyó que la respuesta al neuromodulador aumenta si el paciente padece de somatización78. En el paciente con pruebas negativas, la base del tratamiento son neuromoduladores, aunque la evidencia es escasa. Un estudio comparó el uso de amitriptilina a dosis baja (25mg/día) versus pantoprazol a 4semanas, y el grupo con amitriptilina mostró mejoría significativa en el puntaje de síntomas de la Glasgow Edinburgh Throat Scale (GETS), así como en el cuestionario SF-36 y en calidad de sueño79. Una revisión descriptiva que evaluó el uso de escitalopram en diferentes TICI observó mejoría en el 64% en una serie de 14 casos de pacientes con globus80. En el metaanálisis de Yeh et al.51 que evaluó neuromoduladores en TICI esofágicos, la tasa de respuesta en globus con neuromoduladores varió entre el 46% y el 75%, con una razón de momios (OR) de 6.30 (IC95%: 4.17-9.50), aunque solo incluyó 3 estudios.
En la figura 1 se muestran los neuromoduladores recomendados de acuerdo a los diferentes grupos de TICI del esófago.
Trastornos gastroduodenalesDispepsia funcional (DF)- •
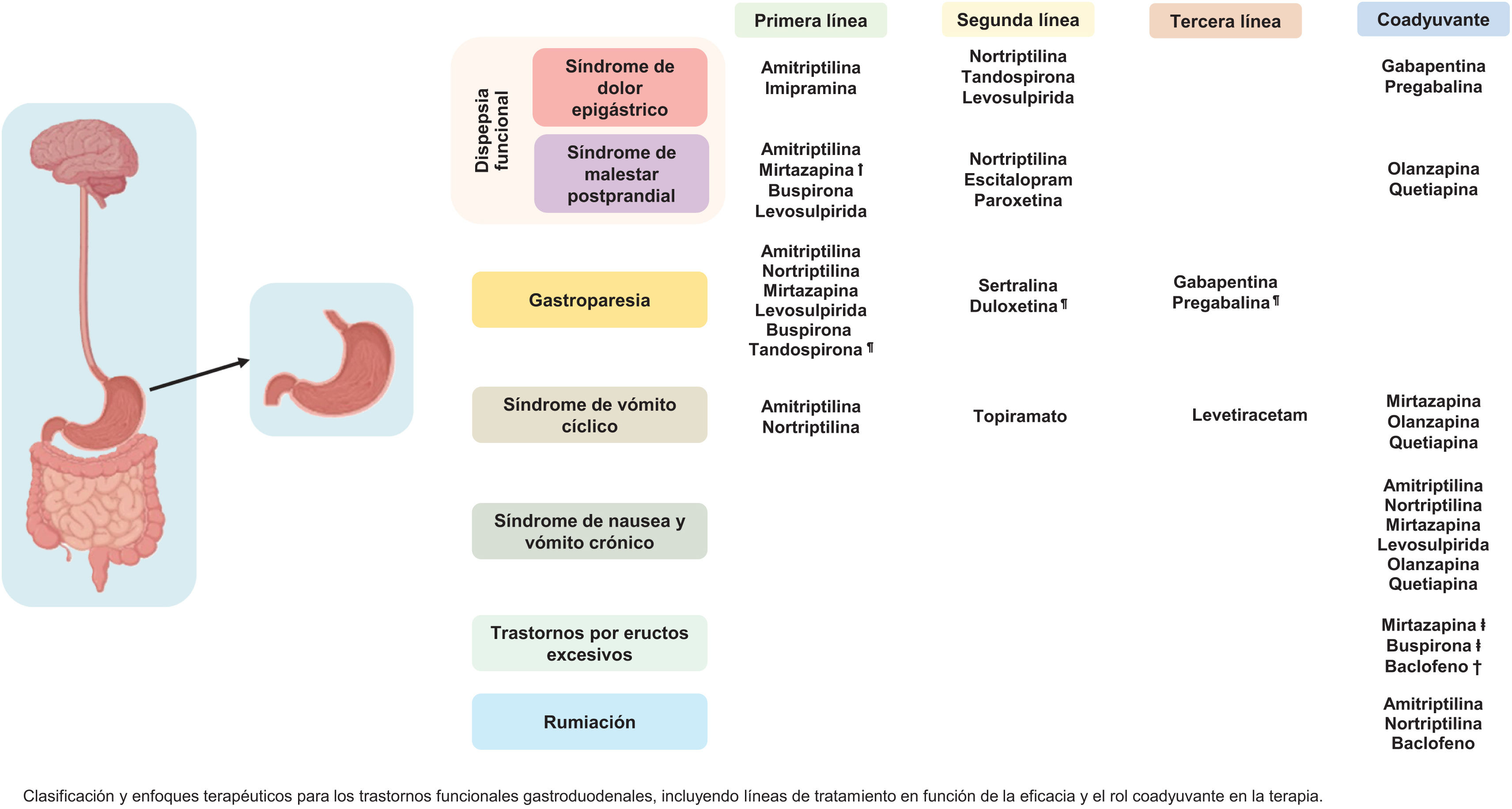
Recomendamos el uso de ATC para el control sintomático del síndrome de dolor epigástrico (SDE). Los ATC también pueden considerarse para el síndrome de malestar postprandial (SMP).
En forma general, como grupo, los neuromoduladores han mostrado ser útiles para el tratamiento de la DF, con un número necesario a tratar (NNT) de 681. Los estudios y revisiones sistemáticas iniciales los catalogaban como antidepresivos o ansiolíticos o los agrupaban en una sola categoría82, pero el mejor entendimiento de los TICI ha podido demostrar que existen diferencias importantes entre grupos. Varios estudios han demostrado la utilidad de los ATC en DF, siendo el subgrupo con mejor grado de evidencia. Entre los ATC, amitriptilina ha sido el más estudiado, y la evidencia de su utilidad proviene de cinco estudios. El primero de ellos fue una serie de casos en la cual 7 de 7 pacientes con DF reportaron mejoría sintomática tras 4semanas de tratamiento con amitriptilina 50mg/día83. El segundo reportó disminución en intensidad de náusea y síntomas postprandiales a 2semanas a dosis de 25-50mg/día al compararse con placebo84. En el tercero, una dosis de 12.5-50mg/día disminuyó la intensidad de náusea y puntajes totales de síntomas en 38 pacientes con DF, aunque sin diferencias en distensión, saciedad, dolor abdominal alto o tolerancia a líquidos en una prueba de ingestión. En este trabajo la tasa de eventos adversos fue significativamente mayor para amitriptilina (72% vs 35%, p=0.03), particularmente somnolencia85. Un estudio reciente comparó el efecto en DF entre ATC e ISRS, y la amitriptilina fue superior a escitalopram y placebo para alivio sintomático (53% vs 38% y 40% vs 28%, respectivamente) en el subgrupo de pacientes con DF tipo SMP, con una OR de 3 (IC95%: 1.1-9.0)86. El trabajo más reciente comparó el efecto de pantoprazol contra dosis baja de amitriptilina (25mg por la noche) en SDE. A 4semanas, la severidad de síntomas fue menor en el grupo de amitriptilina; sin embargo, no redujo los puntajes de estrés psicológico o ansiedad87. La evidencia con imipramina proviene de un estudio reciente que evaluó 107 pacientes con DF refractaria a esomeprazol y domperidona, en el cual se analizó el efecto a dosis ascendente bisemanal contra placebo, y se reportó mejoría significativa en los puntajes de síntomas globales de dispepsia en un análisis de intención a tratar en grupo de tratamiento (63.6% vs. 36.5%) con un NNT=4. En este estudio, el 18% de los pacientes en el grupo de imipramina suspendieron el tratamiento debido a efectos adversos versus el 8% del grupo placebo, siendo los más comunes resequedad de boca, estreñimiento y somnolencia88. Cinco estudios han evaluado la utilidad de nortriptilina en DF. En el primero de ellos no fue superior a placebo en mejoría sintomática ni en calidad de vida89. El segundo estudio, publicado recientemente, reportó efectividad similar a mosaprida a 4semanas90. En el tercero, nortriptilina fue inferior a mirtazapina en SMP91. En el cuarto estudio no fue superior a terapia metacognitiva92. Pero en el último estudio fue superior a duloxetina en mejoría sintomática, aunque duloxetina fue más efectivo para reducir ansiedad93. En una revisión sistemática con metaanálisis de red de tratamientos para DF, los ATC resultaron segundos para efectividad (razón de riesgos [RR] 0.71; IC95%: 0.58-0.87), solo por detrás de antipsicóticos, y primeros cuando se incluyeron únicamente estudios con bajo riesgo de sesgo94. Otra revisión sistemática concluyó que los neuromoduladores más efectivos en DF eran aquellos que demostraban, además del efecto antinociceptivo, un efecto sobre reducción de ansiedad; en este estudio el ATC amitriptilina y el antipsicótico levosulpirida fueron significativamente superiores a placebo para control sintomático95. Un metaanálisis de eficacia (medida por mejoría en puntaje de síntomas globales de DF) y aceptabilidad reportó una OR superior a placebo tanto para imipramina (2.21; IC95%: 1.02-4.79) como para amitriptilina (1.71; IC95%: 1.06-3.09). El único neuromodulador de otro grupo superior a placebo en este estudio fue tandospirona96. Finalmente, en el metaanálisis de Ford et al.81 de 2017, el riesgo de persistencia de síntomas en DF con ATC fue menor a la unidad (RR: 0.74; IC95%: 0.61-0.91), con un NNT de 6 (4-18) y un número necesario para dañar (NNH) de 7 (3-40). Al agruparlos junto con el grupo de psicotrópicos, el NNT es de 2 (1.5-10).
- •
Puede considerarse el uso de ISRS e IRNS en pacientes con DF que tienen comorbilidad psiquiátrica, particularmente TOC, ansiedad o depresión, o cuando haya intolerancia a ATC.
En los estudios comparativos de eficacia entre diferentes grupos de antidepresivos, los ISRS no han mostrado ser superiores a ATC o tetracíclicos para control sintomático. Un estudio pequeño realizado en Hong Kong reportó mejoría del índice de síntomas al administrar sertralina 50mg/día tras 8semanas contra placebo97. Otro estudio que comparó amitriptilina, escitalopram y placebo reportó tasas similares de control sintomático entre el ISRS y placebo, pero inferior al ATC86. La paroxetina resultó inferior a mirtazapina en pacientes con DF y pérdida de peso98. Un análisis comparativo entre antidepresivos reportó que escitalopram y sertralina fueron los menos tolerados debido a eventos adversos99. En el metaanálisis de psicotrópicos de Ford et al.81 los ISRS no fueron superiores al placebo (RR: 1.01; IC95%: 0.89-1.15), y el NNH fue de 16. Las guías de uso de neuromoduladores de la Fundación Roma sugiere que pueden ser de utilidad cuando existe comorbilidad psiquiátrica, particularmente TOC, catastrofización, ansiedad o depresión1,2.
Hay poca evidencia del uso y efectividad de IRNS en DF. El trabajo más relevante no mostró mejoría global ni en síntomas individuales al comparar venlafaxina contra placebo a 4 y 8semanas de tratamiento, con un seguimiento de hasta 20semanas100. En el estudio comparativo de nortriptilina con duloxetina, el IRNS no fue superior al ATC en mejoría sintomática, pero fue más efectiva para el control de ansiedad93. Al igual que los ISRS, los IRNS no alcanzaron superioridad sobre placebo en el metaanálisis de psicotrópicos (RR: 1.02; IC95%: 0.80-1.30), y el NNH reportado fue de 681. Algunas guías y revisiones consideran a este grupo como el de segunda elección para control de dolor cuando hay intolerancia a ATC2.
- •
Recomendamos el uso de mirtazapina para el tratamiento del SMP, especialmente cuando está asociado con pérdida de peso. La mirtazapina también puede considerarse en pacientes con sobreposición de SMP y SDE.
Varios estudios con mirtazapina han mostrado mejoría sintomática en SMP. En dos de ellos mirtazapina a dosis de 15-30mg/día mejoró en forma significativa la severidad de síntomas, particularmente saciedad temprana, además de incrementar calidad de vida, mejoría en escala de ansiedad y recuperación de peso desde la semana2, y hasta a 8semanas de iniciar tratamiento al ser comparada contra placebo en dos estudios controlados98,101. En uno de los dos trabajos disminuyó síntomas depresivos al asociarse con paroxetina. En este estudio, la tasa de eventos adversos varió entre el 10 y el 15%, siendo los más comunes mareo, letargia y fatiga98. El efecto terapéutico parece estar relacionado con efecto sobrerregulatorio sobre los receptores de ghrelina, neuropéptidoY, motilina y gastrina, y disminución de leptina, 5-hidroxitriptamina y colecistocinina98. Otro ensayo comparó el efecto de mirtazapina con nortriptilina en DF, y en este estudio la mirtazapina disminuyó en forma significativa el dolor epigástrico, los eructos y la distensión, sin diferencias significativas en escala de ansiedad91. A pesar de estos tres estudios, el metaanálisis de psicotrópicos reportó un riesgo de persistencia sintomático que atravesó la unidad (RR: 0.73; IC95%: 0.50-1.08)81.
- •
Recomendamos el uso de azapironas como tratamiento de SMP (buspirona) y SDE (tandospirona).
Las azapironas buspirona y tandospirona han sido evaluadas cada una en dos estudios en DF. En un ECC publicado por el grupo de Tack la buspirona a dosis de 10mg tres veces al día por 4semanas redujo en forma significativa la severidad de síntomas globales de dispepsia al ser comparada contra placebo, así como síntomas individuales de saciedad temprana, plenitud postprandial y distensión32. El segundo estudio comparó una dosis menor de buspirona (20mg/día) contra cleboprida o amitriptilina a dosis baja (15mg/día) a 3meses, y redujo la saciedad temprana, la cual correlacionó con un aumento en el tiempo medio de vaciamiento gástrico102. La tandospirona, por su parte, fue evaluada en 144 pacientes con DF a dosis de 10mg tres veces al día por 4semanas, y redujo de forma significativa los puntajes de dolor y malestar abdominal superior, con una proporción significativamente mayor de respondedores a las semanas tres y cuatro103. En este y otro estudio la tandospirona redujo además los puntajes de ansiedad asociada a dolor epigástrico104. Actualmente ninguna de las dos azapironas se encuentra disponible en nuestro país.
- •
Recomendamos el uso de levosulpirida en pacientes con SMP. Olanzapina y quetiapina pueden considerarse para el control de náusea y vómito en la DF.
Los antipsicóticos atípicos, o de segunda generación, son un grupo heterogéneo de medicamentos no relacionados entre sí. De estos, el más estudiado es la levosulpirida. Este es un fármaco de acción dual que tiene efecto procinético debido a su antagonismo de dopamina, pero con acción ansiolítica y neuromoduladora. Varios trabajos realizados durante la década de los noventa reportaron mejoría en síntomas globales de DF cuando esta se asociaba a un vaciamiento gástrico retardado105. Un trabajo posterior comparó levosulpirida a una dosis de 25mg tres veces al día contra cisaprida en la entonces llamada dispepsia tipo dismotilidad (ahora renombrada SMP), y reportó eficacia similar entre grupos para control de síntomas y calidad de vida, con una tasa de eventos adversos mayor en el grupo de levosulpirida106. En el metaanálisis de red de tratamientos para DF, la sulpirida o levosulpirida reportaron la mayor eficacia (RR: 0.49; IC95%: 0.36-0.69); sin embargo, la calidad de los estudios fue baja y en suma únicamente incluyeron 86 pacientes94. Un solo estudio ha evaluado quetiapina en DF, fue una serie de 21 casos de los cuales 10 suspendieron tratamiento por efectos secundarios, particularmente somnolencia, y de los 11 restantes, 6 reportaron mejoría global sintomática107. Olanzapina ha sido evaluada para control de náusea y vómito en otros padecimientos, incluyendo síndrome de vómito cíclico y uso de quimioterapia, pero tampoco ha sido evaluada en DF108,109. En la revisión sistemática de Hojo et al.95, levosulpirida junto con amitriptilina fueron superiores a placebo debido a su efecto dual neuromodulador y ansiolítico. En el metaanálisis de Ford et al.81 de 2017, el grupo de antipsicóticos se asoció a un riesgo de persistencia sintomática menor a la unidad (RR: 0.50; IC95%: 0.37-0.67), con un NNT de 3 (4-12), y un NNH de 21 (10-74).
- •
Recomendamos el uso de neuromoduladores de acción periférica (pregabalina y gabapentina) como terapia coadyuvante en SDE.
Los delta-ligandos son neuromoduladores de acción periférica que poseen además actividad ansiolítica. La evidencia en DF proviene de tres trabajos: uno con pregabalina y dos con gabapentina. Pregabalina fue evaluada en un ECC con 72 pacientes sin respuesta a IBP, y los autores reportaron tasas de mejoría global autopercibida significativamente mayores con pregabalina a 4 (70.6% vs. 42.1%) y 8 (70.6% vs 44.7%) semanas, además de reducción en síntomas globales y mejoría en calidad de vida110. Gabapentina fue evaluada como terapia coadyuvante en un trabajo con 126 pacientes con DF resistente a terapia convencional, en el cual la combinación gabapentina-omeprazol fue significativamente superior para el control de síntomas globales al compararse contra omeprazol solo111. Un estudio abierto retrospectivo, también con gabapentina, reportó hallazgos similares, así como una tasa de abandono superior a placebo debido a efectos adversos112.
Gastroparesia (GP)- •
Puede considerarse el uso de ATC como terapia coadyuvante sintomática en GP.
GP se define por la presencia de síntomas de retención gástrica, con evidencia objetiva de vaciamiento gástrico (VG) retardado, sin obstrucción mecánica113. Los síntomas más comunes son náusea y/o vómito (N/V), saciedad temprana, distensión y dolor abdominal. Este último es un síntoma común en GP, reportado hasta en 90% en algunas series, y en 72% de los casos como síntoma principal, el cual afecta con mucha frecuencia la calidad de vida de los pacientes114. Se han descrito diferentes mecanismos involucrados en la génesis de dolor en GP, incluyendo sobredistensión gástrica, disfunción autonómica, daño neuronal, disfunción neuroinmune y alteración en el procesamiento central del mismo, e incluso se ha llegado a especular que GP es una forma severa de DF115, ya que entre el 37% y el 42% de los pacientes que son diagnosticados inicialmente como GP o DF eventualmente reciben el diagnóstico opuesto116. Los neuromoduladores pueden reducir la percepción de dolor a diferentes niveles del ECI mediante diversos mecanismos, y su eficacia está demostrada en DF; algunos de ellos, debido a su efecto terapéutico, pueden inducir cambios en la distensibilidad y el VG mejorando los principales síntomas en GP117,118. Los ATC han mostrado ser eficaces en DF, pero la evidencia en GP es menor. La administración de amitriptilina 50mg/día o nortriptilina 25-50mg/día redujo la frecuencia de N/V en un grupo de pacientes con DF y vómito intermitente, así como en diabéticos con N/V, pero sin criterios diagnósticos objetivos de GP119,120. Un estudio en el cual se agregó nortriptilina al uso a demanda de procinéticos o antieméticos en GP refractaria (ensayo NORIG) no mejoró los desenlaces primarios (síntomas medidos por la escala Gastrointestinal Cardinal Symptom Index [GCSI]) ni los subpuntajes de saciedad, llenura o distensión a 15semanas121. Debido a su efecto antinociceptivo central, se ha propuesto que los ATC pueden ser utilizados para el control del dolor asociado a GP, pero la evidencia aún es insuficiente122.
- •
Puede considerarse el uso de ISRS y de IRNS en GP y síntomas de ansiedad asociados.
Los ISRS pueden mejorar la ansiedad y la depresión asociada en los pacientes con GP refractaria, pero la evidencia de control sintomático de dolor visceral es menor. En un estudio la duloxetina, un IRNS, mejoró el dolor asociado a neuropatía periférica en diabéticos en comparación con placebo a dosis de 60-120mg durante 12semanas; sin embargo, se reportó una tasa mayor de náusea y estreñimiento123.
- •
Puede considerarse el uso de mirtazapina para el control de náusea, vómito y pérdida de peso en GP.
Los agentes tetracíclicos tienen efectos indirectos sobre la actividad de serotonina y noradrenalina mediante antagonismo neuronal, muscarínico y efecto sobre receptores 5-HT2 y 5-HT32,124. En DF y SMP, la mirtazapina ha mostrado ser superior a placebo para la reducción sintomática y la recuperación ponderal101. Desde hace algunos años se han publicado reportes de caso de mejoría con mirtazapina en GP refractaria a procinéticos125,126, así como resolución sintomática en GP postinfecciosa comprobada127. Un estudio abierto reportó que la administración de mirtazapina mejoró el puntaje de N/V de los cuestionarios GCSI y de Clinical Patient Grading Assessment Scale (CPGAS) a 2 y 4semanas en pacientes con GP refractaria a tratamiento convencional. De los predictores de respuesta, el grupo con GP idiopática reportó una tendencia a mejoría en vómito, y los pacientes con edad avanzada, mejoría en pérdida de apetito. En este estudio, el 46% de los pacientes reportaron eventos adversos, y el 57%, más de un efecto128. También se ha descrito que mirtazapina puede ser una opción para revertir efectos de uso prolongado de opioides por síndromes dolorosos, incluyendo N/V129.
- •
Puede considerarse el uso de levosulpirida para tratamiento de náusea y vómito en GP.
Levosulpirida es un antipsicótico atípico que acelera el VG debido a su efecto antidopaminérgico y agonista 5-HT4. Dos estudios han reportado mejoría sintomática en GP diabética e idiopática, con un efecto procinético similar a cisaprida, pero sin un aumento significativa del VG34,130. Sin embargo, otro trabajo reportó que levosulpirida acelera el VG en pacientes con DF131.
- •
Puede considerarse el uso de azapironas para el control de saciedad temprana y distensión asociada a GP.
Buspirona y tandospirona han mostrado ser de beneficio en DF. Buspirona ha demostrado mejorar síntomas postprandiales como saciedad temprana y mejoría de la relajación fúndica en DF, pero no hay estudios similares en GP. Un ECC recién publicado (estudio BESST), en el cual se comparó buspirona versus placebo en GP, no mostró diferencias entre grupos tras 4semanas de tratamiento; sin embargo, buspirona mostró una tendencia estadística a mejoría en distensión asociada132,133.
- •
Los agentes delta-ligandos pueden considerarse en pacientes con GP y dolor abdominal asociado, o con neuropatía periférica.
Los neuromoduladores de acción periférica, tanto pregabalina como gabapentina, han mostrado su eficacia en el tratamiento del dolor de origen neuropático asociado a diversas condiciones, incluyendo neuropatía periférica diabética, neuritis postherpética, postraumática, oncológica, mixta y de origen central, con dosis muy variables (pregabalina 75-600mg/día, gabapentina 300-1.200mg/día)134,135. Una revisión reciente de Cochrane ha confirmado estos hallazgos136. Su utilidad, sin embargo, para el control de dolor asociado a GP no ha sido evaluada en estudios clínicos. Debido a que se ha reportado un paralelismo crónico entre el desarrollo de neuropatía periférica y autonómica en diabetes mellitus, y que algunas formas de GP comparten entre sus mecanismos fisiopatológicos, además del procesamiento central de dolor, disfunción neuroinmune y señalización anormal periférica, desde el punto de vista teórico los neuromoduladores periféricos podrían ser de utilidad en algunos subtipos de GP con evidencia de neuropatía periférica, aunque no hay evidencia en estudios clínicos al momento137.
Síndrome de vómito cíclico (SVC)- •
Recomendamos el uso de ATC como primera línea de tratamiento en la profilaxis del SVC.
El SVC es un trastorno caracterizado por episodios recurrentes de náusea, vómito y dolor abdominal incapacitante, que pueden durar varios días y con períodos libres de síntomas entre episodios108,138,139, y que ha sido integrado entre los TICI gastroduodenales en los criterios de RomaIV140. La fisiopatología incluye alteraciones en polimorfismos mitocondriales, en el sistema de señalización endocannabinoide, disregulación del sistema nervioso y alostasis141. Al tratarse de un padecimiento recientemente reconocido en adultos, la mayor evidencia que justificó la recomendación de ATC en la guía de la American Neurogastroenterology and Motility Society (ANMS) de 2019 provino de estudios en población infantil con esta condición, y posteriormente en estudios con población mixta, adulta e infantil142-145. Dos guías clínicas han sido publicadas en los últimos años: una conjunta ANMS-Cyclic Vomiting Syndrome Association, y otra por parte de la American Gastroenterological Association (AGA), además de cuatro revisiones recientes108,138-141,146,147. En forma general, tanto las guías como las revisiones recomiendan que durante la fase aguda el tratamiento puede incluir triptanos, ondansetrón, antihistamínicos, fenotiazinas y benzodiazepinas como terapia abortiva del ataque. Entre episodios los neuromoduladores pueden utilizarse para prevenir recurrencias, particularmente en formas severas (>4 episodios al año, duración del episodio >2días, recuperación larga entre episodios y requerimiento de visitas a urgencias u hospitalización durante el ataque). Las guías recomiendan el uso de ATC, particularmente amitriptilina, como terapia profiláctica. La evidencia de efectividad de ATC en adultos con SVC se basa en estudios abiertos y retrospectivos y dos ECC en niños. De un total de 14 estudios que incluyeron 600 pacientes adultos y pediátricos, 413 (70%) tuvieron una mejoría completa o parcial con una disminución en la frecuencia, la duración o la gravedad de los síntomas del SVC al ser tratados con un ATC, más comúnmente amitriptilina, aunque también existe menor evidencia con nortriptilina y doxepina, con reducciones tanto en la frecuencia como en la duración de los episodios141,143,145,148-150. En el estudio abierto de Hejazi et al.143, los ATC redujeron la frecuencia de 17 a 3 episodios, la duración de 6 a 2días, y el número de visitas a urgencias de 15 a 3. Otro estudio reportó eficacia similar entre amitriptilina y ciproheptadina en niños145. De acuerdo a las guías, la dosis promedio efectiva de ATC es 75 a 100mg/día y puede titularse a incrementos de entre 10-25mg para mejorar la tolerabilidad y prevenir la suspensión debido a eventos adversos, la cual se ha reportado entre el 9 y el 25%138. Se han reportado diferentes comorbilidades asociadas a ataques agudos de SVC, como episodios de estrés extremo, ansiedad, depresión, trastornos de pánico, migraña, cefalea crónica, disfunción autonómica, trastornos del sueño y uso de sustancias, factores que son importantes de identificar, ya que pueden ser prevenidos. De estos, migraña e historia familiar de migraña se asocian con más frecuencia a SVC, con una prevalencia de entre el 13 y el 70%. Un beneficio adicional de los ATC es su utilidad en el tratamiento (ansiedad/depresión) o profilaxis (migraña, cefalea crónica) de algunos de los factores asociados a exacerbaciones de SVC151.
- •
Recomendamos el uso de topiramato como profilaxis en SVC cuando hay intolerancia a ATC. Levetiracetam y zonisamida son alternativas. Puede considerarse el uso de mirtazapina, olanzapina o quetiapina como terapia sintomática coadyuvante en SVC.
Otros medicamentos de segunda línea recomendados como profilaxis en SVC, particularmente cuando no hay respuesta o hay eventos adversos no tolerados tras la administración de ATC, son: antagonistas de neurocinina (aprepitant), ciertos anticonvulsivantes (topiramato, levetiracetam, zonisamida, ácido valproico, fenobarbital), y suplementos nutricionales de riboflavina y coenzima Q10, con desenlaces terapéuticos similares a los observados con los ATC, pero una tasa mayor de efectos adversos24,152,153. La evidencia con levetiracetam y zonisamida proviene de una serie de casos retrospectiva24, mientras que con otros grupos de neuromoduladores es escasa. No hay estudios con ISRS, IRNS o delta-ligandos. De entre los tetracíclicos, se ha reportado mejoría anecdótica con mirtazapina. Una serie pequeña de casos en niños y jóvenes con trastornos de ansiedad asociados reportó una reducción en la frecuencia de episodios de vómito tras la administración de mirtazapina154. En pacientes con respuesta subóptima se han propuesto diferentes tipos de agentes antieméticos, incluyendo ondansetrón, olanzapina, quetiapina en base a respuesta observada en estudios de padecimientos asociados a eventos emetogénicos severos, como uso de quimioterapia. Por ejemplo, un metaanálisis de Cochrane demostró que la olanzapina disminuye en forma significativa la probabilidad de tener náusea o vómito durante el tratamiento comparado con placebo en un 25-50%, con un RR de 5.48 (IC95%: 1.35-22.20)155; sin embargo, no hay estudios en SVC.
Síndrome de náusea y vómito crónico (SNVC)- •
Puede considerarse el uso de ATC y de neuromoduladores con acción antagonista 5-HT3(ATC, mirtazapina, levosulpirida, olanzapina, quetiapina), así como gabapentina como terapia coadyuvante sintomática en SNVC.
El SNVC está clasificado de acuerdo a los criterios de RomaIV dentro del apartado de desórdenes asociados a náusea y vómito (N/V) de los trastornos gastroduodenales140. El criterio principal es la presencia de náusea y/o vómito que ocurre al menos una vez por semana en ausencia de trastornos de la alimentación, rumiación, o trastornos estructurales o metabólicos que expliquen los síntomas140. Dada la fisiopatología tan compleja de la náusea, que implica la activación de múltiples receptores centrales como periféricos (histamina, muscarínicos, dopamina, serotonina, neurocinina), así como diferentes vías de transmisión neural (sistema vestibular, área postrema, vagales abdominales aferentes)23, se han utilizado diversos grupos de fármacos con mecanismos muy diferentes en forma empírica para el tratamiento sintomático de N/V23,156. Al ser considerado ahora un grupo particular de los TICI gastroduodenales, la fisiopatología implica una compleja relación entre alteraciones psicológicas, acomodación gástrica, disfunción neuromuscular, disautonomía, respuestas parasimpáticas anormales y activación de diversos receptores157,158, lo cual se asocia a deterioro en calidad de vida y productividad laboral159. Algunos pacientes pueden beneficiarse por el efecto de estos fármacos sobre la relajación fúndica, efecto antiemético, de neuromodulación central, o asociado a reducción en ansiedad, aunque la evidencia proviene mayormente en forma indirecta de los estudios de SMP, GP y SVC. Existe evidencia que apoya el uso de neuromoduladores de acción central (ATC, mirtazapina, levosulpirida, olanzapina, quetiapina) y periférica (gabapentina) para el manejo de N/V crónicos, principalmente proveniente de series de pacientes oncológicos, quirúrgicos y neurológicos, además de la evidencia en otros TICI gastroduodenales36,154,160-164. El mecanismo de acción primordialmente es central e incluye efectos sobre el sueño, la ansiedad y la depresión154. Hay poca evidencia directa de beneficio del uso de neuromoduladores en SNVC. Dos trabajos han evaluado a los ATC en síndrome de náusea y vómito funcional, el primero retrospectivo y antes de la creación de los criterios de Roma, y el segundo usando criterios de RomaIII. El primero analizó expedientes de 37 pacientes, 57% con síntomas persistentes. La tasa de respuesta fue del 84%, con remisión completa en el 51%, e incluyó el uso de amitriptilina, desipramina, nortriptilina, doxepina e imipramina, con una dosis promedio de 50mg119. El mayor estudio que evaluó respuesta a neuromoduladores en N/V funcional (de acuerdo a RomaIII) reportó tasas de mejoría sintomática en el 72% y de resolución en el 22% en 94 pacientes seguidos por 8.5meses. El estudio incluyó todos los grupos de neuromoduladores; de estos, la mayoría usó ATC (n=65), con una respuesta sintomática del 72%, seguido de IRNS (n=10), con una respuesta del 70%, e ISRS (n=5), con respuesta del 100%. Otros neuromoduladores con números menores de uso y respuestas similares fueron mirtazapina, buspirona y el anticonvulsivante zonisamida. Los autores concluyen que se puede obtener respuesta sintomática en al menos dos terceras partes de los pacientes, independientemente del agente utilizado165. Dos series de casos de enfermos con N/V crónicos evaluaron la utilidad de mirtazapina; la primera reportó que el 51% alcanzaron remisión sintomática y el 84% tuvieron mejoría significativa, y la segunda reportó una reducción en la duración de los episodios de vómito en pacientes con SVC y N/V crónicos, particularmente cuando este se asociaba a ansiedad y a otros trastornos psiquiátricos154,160. Una revisión sistemática y metaanálisis evaluó el efecto de mirtazapina sobre N/V postoperatorios en 7 estudios, siendo superior a placebo, además de reducir la ansiedad, pero aumentando el riesgo de sedación161. Durante algún tiempo se han usado los antipsicóticos como tratamiento para N/V refractario asociado a diversas condiciones, incluyendo fármacos de primera generación como clorpromazina o trifluoperazina, o de segunda generación como olanzapina o quetiapina23. Olanzapina es uno de los antipsicóticos atípicos ensayado para diversas condiciones asociadas a N/V crónicos. Una revisión sistemática reportó su utilidad antiemética en pacientes hospitalizados con diferentes padecimientos, particularmente oncológicos, y al menos dos de los estudios reportaron su utilidad en N/V refractaria no asociada a quimioterapia o radioterapia36. Quetiapina ha sido reportada como útil para el control de N/V en enfermedad de Parkinson163. Finalmente, el delta-ligando de acción periférica gabapentina ha sido utilizado para manejo de N/V asociado a diferentes problemas médicos, incluyendo causas postquirúrgicas, quimioterapia, hiperémesis gravídica, SVC, así como cefalea crónica, y algunas revisiones sugieren que puede ser útil en otras causas de N/V crónicas, incluyendo náusea y vómito de origen funcional2,166.
Síndromes asociados a eructos- •
Puede considerarse el uso de neuromoduladores en combinación con terapia de lenguaje y respiración diafragmática para el tratamiento de eructos de origen gástrico (EG) y supragástricos (ESG) asociados a ERGE (baclofeno) y comorbilidad psiquiátrica asociada a TICI (mirtazapina y buspirona).
El tratamiento de los trastornos asociados a eructos, tanto de origen gástrico (EG) como supragástrico (ESG), se basa en su asociación con otros trastornos (ERGE, dispepsia), o el mecanismo fisiopatológico involucrado (conducta aprendida, factores psicológicos o relajación transitoria del esfínter esofágico inferior [EEI]). En ESG la base del tratamiento es la explicación y el entendimiento por parte del paciente de los mecanismos por las cuales se presentan los eructos, crear conciencia de las maniobras de paso de aire hacia el esófago (psicoeducación), ejercicios de respiración diafragmática, terapias cognitivas y terapias del lenguaje. Estas medidas son suficientes en la mayoría de los casos para el control o la mejoría sintomática de los ESG167-170. La utilidad de los neuromoduladores no ha sido demostrada en EG o ESG aislados, aunque los de acción central podrían ser de utilidad cuando estas condiciones se asocian a trastornos psiquiátricos como ansiedad o TOC ligados al inicio o a la persistencia de síntomas, o bien a ansiedad asociada a distensión asociada. Baclofeno puede ser útil cuando los ESG se asocian a ERGE debido a su efecto inhibitorio sobre las relajaciones transitorias del EEI167,171,172. En EG asociados a DF subtipo SMP el uso de agentes relajantes del fondo gástrico, como mirtazapina o buspirona, podría ser de utilidad32.
Rumiación- •
Puede considerarse el uso de neuromoduladores en combinación con terapia de comportamiento enfocada en respiración diafragmática en pacientes con rumiación (ATC), rumiación asociada a ERGE (baclofeno) o comorbilidades psiquiátricas (ISRS).
Rumiación es un trastorno caracterizado por regurgitación recurrente sin esfuerzo de comida recientemente ingerida, con remasticación y re-deglución subsecuentes, no precedida por arqueo, y que cede cuando el material regurgitado se vuelve ácido140,173. El mecanismo de inicio es un aumento súbito de la presión intragástrica que desencadena una relajación del EEI, lo cual condiciona el movimiento retrógrado del contenido gástrico hacia el esófago174. Se ha descrito una ruta primaria y varios mecanismos fisiopatológicos secundarios, que pueden incluir asociaciones aprendidas, respuesta a estímulos específicos, baja tolerancia al deseo, o un padecimiento adicional como ESG (rumiación supragástrica) o ERGE (rumiación secundaria)175. La base del tratamiento en rumiación es terapia de comportamiento basada en respiración diafragmática, ya que al usar el diafragma para respirar durante el período postprandial se compite con el deseo de regurgitar, y puede combinarse con biorretroalimentación controlada por electromiografía, para reducir la actividad intercostal y abdominal anterior173,176. Un solo estudio ha evaluado la utilidad de los ATC en rumiación. En este trabajo, 44 pacientes con rumiación por criterios de RomaIV recibieron un ATC además de instrucciones y apoyo para realizar técnicas de respiración diafragmática, y fueron seguidos por 3meses. Tras un período promedio de 8.8meses de seguimiento, el 90.9% reportaron mejoría sintomática, y el 45% de ellos reportaron una mejoría mayor al 80%, además de estabilización ponderal en el 80.6%. Debido a que las tasas de respuesta publicadas previamente con respiración diafragmática sola son altas, se desconoce cuál es el efecto neto de agregar el neuromodulador a la terapia de comportamiento177. Fuera de este único trabajo, la evidencia actual no apoya la efectividad de los neuromoduladores para reducción de los episodios de rumiación, por lo cual no se recomiendan como tratamiento único. Algunas guías sugieren que deben utilizarse solo para tratar comorbilidades psiquiátricas siguiendo los lineamientos del TICI asociado175.
La figura 2 resume los principales neuromoduladores recomendados para el manejo de los TICI gastroduodenales.
Trastornos intestinalesDolor abdominal mediado centralmente (DAMC)- •
Se recomienda el uso de ATC, IRNS y delta-ligandos para el manejo de pacientes con DAMC. Puede considerarse la terapia aditiva o combinada en pacientes con respuesta subóptima.
Debido al efecto analgésico proporcionado por los neuromoduladores (ver secciones anteriores), se recomienda este grupo de medicamentos para el manejo del DAMC. No obstante, es importante destacar que la evidencia específica sobre el uso de estos fármacos en DAMC es limitada, y en la mayoría de los estudios se extrapolan los resultados obtenidos sobre el dolor abdominal en otros trastornos intestinales funcionales, especialmente en el síndrome de intestino irritable (SII). Por ejemplo, amitriptilina, nortriptilina y duloxetina han mostrado mejoría del dolor abdominal en el manejo del SII178-180. Existe un solo estudio específicamente en DAMC, el cual investigó la eficacia de la pregabalina. En este ECC, los pacientes fueron asignados a recibir pregabalina (75mg), bromuro de pinaverio, o una combinación de ambos, tres veces al día durante 4semanas181. Los resultados primarios midieron la severidad y la frecuencia del dolor abdominal en las semanas2 y4, mientras que los resultados secundarios evaluaron la reducción en los puntajes de dolor abdominal y los cambios en las escalas de autoevaluación somática (SSS), el Cuestionario de Salud del Paciente-15 (PHQ-15) y la Escala de Ansiedad Generalizada7 (GAD-7). Un total de 102 pacientes participaron en el estudio, y los resultados mostraron que aquellos que recibieron pregabalina, ya sea sola o en combinación con bromuro de pinaverio, experimentaron una mayor reducción en la severidad y frecuencia del dolor abdominal en comparación con los que solo recibieron bromuro de pinaverio. Al comparar los cambios en los puntajes de las escalas SSS, PHQ-15 y GAD-7, los pacientes que recibieron pregabalina o el régimen combinado reportaron una mayor disminución que los que recibieron bromuro de pinaverio (p=0.0002, p=0.0002 y p=0.0033). Además, los pacientes en los grupos de pregabalina también reportaron mejoras significativas en los síntomas somáticos y de ansiedad en comparación con el grupo de bromuro de pinaverio. En conclusión, este estudio sugiere que la pregabalina podría ser benéfica para el manejo del dolor en DAMC, así como para los síntomas somáticos y de ansiedad asociados.
El uso de terapia «aditiva», es decir, la combinación de dos o más neuromoduladores con diferentes vías de acción, no ha sido explorado en DAMC ni en otros TICI. Su uso se basa en recomendación de expertos y extrapolando evidencia de uso individual de cada fármaco. Se requiere que se lleve a cabo un seguimiento estrecho, con monitoreo cercano para aquellos que están bajo esta modalidad de tratamiento por la potencial aparición de interacciones farmacológicas y efectos adversos secundarios.
- •
No se recomienda el uso de antiinflamatorios no esteroideos (AINE), esteroides y analgésicos opiáceos para el manejo del DAMC.
Dado que dentro de la fisiopatología tan compleja del DAMC no se ha descrito inflamación tisular como causa de los síntomas, el uso de AINE, esteroides u opioides no ocupa un papel en el tratamiento. Más aún, extrapolando datos de toxicidad de los mismos (gastrointestinal y renal preponderantemente), administrarlos para una condición crónica como es el DAMC puede generar más efectos deletéreos que beneficio. Se ha descrito una entidad denominada síndrome de intestino narcótico/hiperalgesia GI inducida por opiáceos, la cual está asociada al uso continuo y a dosis crecientes de este tipo de analgésicos para controlar el dolor. Muchos pacientes tienen TICI e inician el consumo de estos medicamentos, por lo cual la detección rápida para evitar su continuidad en el tratamiento, o la intervención de especialistas en cuidados de dolor para disminuir el uso establecido de estos medicamentos, son cruciales en el manejo de este problema182.
Síndrome de intestino irritable (SII)- •
Recomendamos el uso de ATC para el manejo del dolor abdominal en SII sin estreñimiento.
Los ATC son el grupo de neuromoduladores con mayor respaldo en el manejo del SII10,178-181,183,184. Entre ellos, la amitriptilina ha demostrado ser el más eficaz para el alivio del dolor abdominal y la mejoría global de síntomas. Debido a su efecto anticolinérgico, frecuentemente induce estreñimiento y puede mejorar la consistencia y disminuir la frecuencia de las evacuaciones, por lo que es particularmente útil en el SII con predominio de diarrea (SII-D) y mixto (SII-M). La evidencia que respalda el uso de estos fármacos se fundamenta en diversos metaanálisis. En el metaanálisis de Ford et al.185, que incluyó 12ECC con un total de 787 pacientes, se observó que, de los 436 pacientes que recibieron terapia activa, 186 (42.7%) no mostraron mejoría en los síntomas después del tratamiento, en comparación con 224 (63.8%) de los 351 que recibieron placebo. El NNT con ATC fue de 4.5 (IC95%: 3.5-7). Recientemente se ha publicado el estudio ATLANTIS, que puede considerarse la evidencia que faltaba en la literatura para apoyar el uso de amitriptilina en el SII186. Este estudio, un ECC, evaluó la amitriptilina como terapia de segunda línea para pacientes con SII en cualquiera de sus subtipos clínicos, comenzando con una dosis inicial de 10mg, la cual se incrementó semanalmente hasta 30mg según la tolerancia del paciente. El tratamiento se mantuvo durante 6meses, y al final de este periodo se observó una disminución media en la escala IBS-SSS de 27 puntos (IC95%: 7-46.9) (p=0.0079) en el grupo tratado con amitriptilina, en comparación con el grupo control. Además, la mejoría adecuada de los síntomas fue significativamente superior en el grupo con amitriptilina, con una RR de 1.56 (IC95%: 1.20-2.30) (p=0.008). El mayor efecto se observó en la reducción del dolor abdominal, sin impacto significativo sobre la distensión. Las dosis habitualmente utilizadas de amitriptilina comienzan en 6.25mg (1/4 de la tableta de 25mg, la presentación más baja disponible en México) cada 24horas, con la posibilidad de aumentar hasta 50mg si es necesario. Posteriormente, se recomienda un tratamiento de mantenimiento de 6 a 12meses para prevenir recaídas. Es importante señalar que, si durante el tratamiento se presentan recaídas con la dosis alcanzada, esta puede ajustarse según sea necesario.
- •
Puede considerarse el uso de ISRS para el manejo de la ansiedad e hipervigilancia, y los IRNS para dolor en los pacientes con SII.
Existen algunos estudios que han demostrado la eficacia de los ISRS en SII. Por ejemplo, citalopram en un ECC comparado contra placebo disminuyó las calificaciones de dolor abdominal, distensión abdominal, que fueron independientes de la ansiedad o la depresión29. En otro estudio, paroxetina produjo una mejoría del bienestar general en individuos con SII187, y fluoxetina redujo el malestar abdominal en SII-E188. Sin embargo, metaanálisis más recientes demuestran que estos medicamentos no son eficaces para el manejo del dolor en este trastorno. En un ensayo realizado por Ladabaum et al.189, en el que se comparó citalopram con placebo, se encontró que los pacientes que recibían citalopram no presentaban una mayor tasa de respuesta que el grupo de placebo, con una OR para respuesta clínica semanal de 0.80 (IC95%: 0.61-1.04). En un metaanálisis llevado a cabo por Xie et al.190, el uso de ISRS no mostró una diferencia estadísticamente significativa en la mejoría de los síntomas globales de los pacientes con SII en comparación con el control (RR: 1.38; IC95%: 0.83-2.28). De manera similar, en el subanálisis también se demostró que estos medicamentos no mejoraban el dolor ni la calidad de vida de los pacientes afectados. Con base en un metaanálisis de 7ECC con 356 participantes, se puede considerar el uso de ISRS en el SII cuando la ansiedad predomina en el cuadro clínico y el dolor o la diarrea no constituyen un problema importante. El RR a favor de los ISRS fue de 0.74 (IC95%: 0.58-0.95), y el NNT, de 6.8191.
Los IRNS se han utilizado en el manejo del dolor crónico, con mayor evidencia en fibromialgia; sin embargo, existe evidencia creciente que respalda su uso en el SII. En un estudio piloto realizado por Brennan et al.192, se demostró que el uso de duloxetina a una dosis de 60mg durante 12semanas tiene un impacto positivo en la calidad de vida, el dolor abdominal y otros síntomas relacionados con la hipersensibilidad visceral, como la urgencia evacuatoria y la distensión abdominal subjetiva. Sin embargo, al igual que con los ATC, en este estudio se observó que el efecto adverso GI más frecuente en la población estudiada fue la exacerbación del estreñimiento. En otro ensayo realizado por Kaplan et al.193, que estudió a pacientes con SII y ansiedad, se demostró que el uso de duloxetina fue efectivo para tratar la ansiedad, los síntomas y la calidad de vida en pacientes con SII, según los índices IBS-SSS e IBS-QOL.
- •
Puede considerarse el uso de delta-ligandos (pregabalina y gabapentina) para el manejo de dolor y distensión abdominal en SII, particularmente en pacientes con comorbilidades como fibromialgia, o dolor originado en pared abdominal.
Existe evidencia que ha evaluado el efecto de la pregabalina sobre la sensibilidad visceral en pacientes con SII. En un primer estudio, que incluyó a 26 pacientes diagnosticados según los criterios de RomaII, se observó que aquellos con hipersensibilidad rectal (umbral de dolor ≤28mmHg) que recibieron pregabalina durante 3semanas (dosis gradual: 50mg tid los días 1 a 3, 100mg tid los días 4 a 7, 150mg tid los días 8 a 11, y 200mg tid los días 12 a 21 ±4) mostraron una mejora significativa en la sensibilidad visceral en comparación con el placebo (p=0.045)194. Además, la pregabalina incrementó los umbrales del deseo defecatorio (p=0.008) y del dolor, mostrando un efecto sobre la alodinia (p=0.048), así como una mayor distensibilidad rectal (p<0.0001), lo que sugiere una posible respuesta tanto sensorial como motora favorable en estos pacientes. Sin embargo, un segundo estudio realizado en 18 pacientes con SII-E, que recibieron una única dosis de 200mg de pregabalina frente a placebo, no encontró una reducción significativa en el dolor durante la distensión ni en otros parámetros motilidad del colon195. Recientemente, en el ECC realizado por Saito et al.196, se evaluó la eficacia de la pregabalina en la reducción de síntomas gastrointestinales en 85 pacientes (86% mujeres) con SII, diagnosticados con criterios de RomaIII. Se administró una dosis de 225mg de pregabalina dos veces al día durante 12semanas. Los resultados mostraron una disminución significativa en las puntuaciones de dolor durante las semanas9 a12, en comparación con el grupo placebo (p=0.008), así como mejoras en la severidad de los síntomas intestinales, la diarrea y la distensión abdominal (p=0.049 y p=0.016, respectivamente), sin diferencias notables en el estreñimiento entre los grupos.
Distensión abdominal funcional (DAF)- •
Puede considerarse el uso de neuromoduladores en casos seleccionados de DAF, especialmente cuando coexiste con otros TICI o con comorbilidades psiquiátricas.
La DAF (objetiva/subjetiva) afecta significativamente la calidad de vida de los pacientes197. Esta condición suelen ser el resultado de la disfunción de múltiples mecanismos a lo largo del ECI, incluyendo la hipersensibilidad visceral debida a una disregulación central de las señales viscerales entrantes. Estos síntomas pueden verse amplificados, especialmente cuando coexisten trastornos como la ansiedad, la depresión o la somatización. Su tratamiento es multifactorial e incluye cambios dietéticos, probióticos, antibióticos, agentes procinéticos y neuromoduladores. Estos han demostrado ser efectivos en el manejo de la DAF. Aquellos de acción central, como los ATC e ISRS, han mostrado ser particularmente efectivos en la reducción de las sensaciones viscerales198. La DAF frecuentemente coexiste con otros TICI, como el SII y la DF, y los ATC como amitriptilina son útiles debido a su capacidad para reducir la motilidad intestinal y mejorar el umbral del dolor visceral, resultando en una reducción significativa de la distensión en pacientes con SII-D. Por otra parte, un estudio en pacientes con DAF demostró que tanto la amitriptilina (50mg diarios) como el escitalopram (10mg diarios) mejoraron significativamente la distensión abdominal postprandial en comparación con el placebo (p=0.03 y p=0.02, respectivamente)199. En otro estudio, la buspirona mejoró significativamente la distensión abdominal en pacientes con DF32, efecto relacionado aparentemente con mejoría en distensibilidad y relajación fúndicas. La dosis ensayada en el tratamiento de distensión asociado a DF es de 15 a 45mg dos veces al día.
Dolor anorrectal funcional- •
Puede considerarse el uso de neuromoduladores en pacientes que no responden adecuadamente a tratamientos conservadores para el manejo del dolor anorrectal funcional.
Los síndromes dolorosos anorrectales incluyen, de acuerdo a RomaIV, el síndrome del elevador del ano (SEA), el dolor anorrectal funcional no específico (DAFNE) y la proctalgia fugax o fugaz. El SEA y el DAFNE se caracterizan por la presencia de dolor rectal crónico o recurrente, o sensación de molestia que dura al menos 30minutos sin evidencia de una explicación estructural o sistémica para estos síntomas, y se distinguen por la presencia (SEA) o ausencia (DAFNE) de dolor a la palpación del músculo elevador del ano200. La proctalgia fugaz se caracteriza por un dolor anorrectal agudo y recurrente en ausencia de enfermedad proctológica o pélvica orgánica que es independiente de la defecación y dura menos de 30minutos, con remisión completa entre los episodios. Para el manejo de los trastornos anorrectales funcionales es posible considerar el uso de neuromoduladores como una opción terapéutica en pacientes que no responden adecuadamente a tratamientos conservadores, como la terapia física del suelo pélvico o el manejo del estrés. Los neuromoduladores, como los ATC o los ISRS, además de gabapentina, pueden utilizarse por sus propiedades analgésicas y combinarse con relajantes musculares como ciclobenzaprina. No se ha realizado ningún ECC que haya probado la efectividad de las terapias médicas en este grupo de pacientes, y los efectos secundarios podrían limitar su utilidad. Sin embargo, diversos grupos de expertos (como por ejemplo C. Knowles en Cleveland Clinic de Londres) usan por ejemplo clomipramina en dosis bajas a pacientes con trastornos de ansiedad coexistentes201.
En la figura 3 se resumen los principales neuromoduladores recomendados para el manejo de los TICI intestinales y anorrectales.
Recomendaciones para iniciar, escalar, adición y retiro de neuromoduladores- •
Recomendamos seleccionar el neuromodulador con base en las propiedades farmacológicas, los efectos adversos y el síntoma predominante.
El mecanismo de acción de cada grupo de neuromoduladores sobre la estimulación o inhibición de los receptores y transportadores centrales o periféricos resulta en incremento o disminución de los niveles y/o disponibilidad de las monoaminas en el espacio presináptico (serotonina, noradrenalina y dopamina), con subsecuente efecto sobre la sensibilidad, secreción y motilidad GI2. La selección del neuromodulador debe guiarse en las propiedades farmacológicas, los potenciales efectos adversos y el síntoma predominante, así como la coexistencia con más de un TICI, o comorbilidades psiquiátricas10. Al momento de prescribir un neuromodulador se debe explicar al paciente las razones de su uso, aclarar los beneficios esperados, describir los efectos adversos y resolver todas las dudas y preocupaciones, ya que utilizar los términos «antidepresivos» o «antipsicóticos» contribuye al estigma sobre los psicofármacos y puede desarrollar falsas percepciones con respecto a la salud mental y los efectos sobre su comportamiento18. Cuando el paciente cursa con dolor abdominal, los neuromoduladores de primera línea son los ATC y los IRNS, ya que los ISRS han mostrado poco efecto global sobre el dolor visceral, debido a falta de interacción con los receptores de norepinefrina, a excepción de en pacientes con DT-F2,18,202. Los IRNS pueden ser de utilidad en los pacientes que no toleran ATC. El hábito intestinal de base puede guiar también la selección de un grupo de neuromoduladores en particular: los pacientes con estreñimiento se benefician más de los IRNS y ATC cuaternarios (desipramina y nortriptilina), evitando los ATC terciarios (amitriptilina e imipramina) por su efecto anticolinérgico; sin embargo, estos últimos, junto con la duloxetina, son útiles en el paciente que cursa con diarrea o patrón mixto. Por último, cuando el paciente cursa con ansiedad, hipervigilancia, comportamientos obsesivos, fobia social o agorafobia, los ISRS son los fármacos de elección, aunque cabe resaltar que la paroxetina es el único ISRS con efecto anticolinérgico y, por tanto, puede resultar en estreñimiento2,10.
- •
Recomendamos iniciar el tratamiento con neuromoduladores a dosis bajas, e incrementar en forma progresiva cada 2-4 semanas hasta alcanzar la respuesta clínica o la dosis máxima.
El efecto clínico de los neuromoduladores suele alcanzarse entre las 4 a 6semanas, en comparación con los efectos adversos, que suelen experimentarse en las primeras 2semanas y son el principal motivo de la suspensión del fármaco; sin embargo, ceden gradualmente y se debe reforzar al paciente a continuar con el fármaco hasta superar este umbral. La mejor estrategia para iniciar un neuromodulador es con un cuarto o la mitad de la dosis por 1 a 2semanas para evaluar la tolerancia y los efectos adversos, y posteriormente incrementar la dosis en intervalos bisemanales hasta alcanzar la respuesta clínica o la dosis máxima2. El estudio ATLANTIS, realizado en 463 pacientes con SII en 55 centros de primer contacto en Inglaterra, ejemplifica de forma perfecta la secuencia de eventos adversos seguida del efecto terapéutico al comparar amitriptilina a dosis bajas (10mg con incrementos de 10mg cada 3semanas hasta 30mg al día) contra placebo por 6meses y reportar una diferencia significativa a favor del grupo de amitriptilina. En este trabajo, el 20% de los pacientes suspendieron la amitriptilina (13% por efectos adversos), mientras el 26% suspendieron el placebo (9% por efectos adversos)186. Al completar el seguimiento, el 61% de los pacientes en el grupo de amitriptilina reportaron alivio considerable o resolución completa de los síntomas, contra el 45% en el grupo placebo (OR: 1.78; IC95%: 1.19-2.66; p=0.005), lo que destaca la importancia del efecto placebo en los TICI203.
- •
Recomendamos mantener los neuromoduladores a una dosis estable por 6 a 12meses después de alcanzar la respuesta clínica antes de considerar su retiro.
El uso de neuromoduladores a largo plazo se ha asociado con un aumento de la neurogénesis asociada a incremento en niveles de BDNF (ver vías de neuromodulación) con un eventual efecto sobre neuroplasticidad15. El tratamiento con neuromoduladores requiere de un tiempo prolongado, y aunque algunos pacientes responden en 4 a 8semanas, se ha estimado una mayor tasa de remisión y menor tasa de recaídas luego de continuar el tratamiento por al menos durante 6 a 12meses posteriores al control sintomático10. En un metaanálisis de 31 estudios aleatorizados en pacientes con depresión, la tasa de recaída se redujo en un 70% en aquellos pacientes que continuaron los antidepresivos por un período mayor a 6meses204.
- •
Se recomienda el cambio o la combinación de neuromoduladores (terapia de adición) en respuesta subóptima o parcial, poca tolerancia a efectos adversos tras el incremento de dosis, o en pacientes con múltiples quejas somáticas y síntomas o tratamiento psiquiátricos en curso.
La combinación de neuromoduladores, también llamada terapia de adición, es efectiva, ya que permite potenciar diferentes mecanismos de acción farmacológica y, por tanto, lograr un mejor control sintomático. No obstante, se recomienda precaución y conocimiento adecuado de las interacciones farmacológicas tanto entre neuromoduladores como con otros fármacos, ya que podrían resultar en efectos adversos graves o la suspensión de ambos medicamentos. En la figura 4 se ilustran de forma gráfica las combinaciones potenciales de neuromoduladores de acuerdo a su seguridad y riesgo. Si se considera al paciente candidato para la combinación de neuromoduladores y no se cuenta con la experiencia suficiente, se recomienda la asesoría con otras áreas de la salud mental (p.ej., neurogastroenterología y/o psiquiatría) para brindar una indicación y seguimiento óptimos del paciente y no retrasar la intervención terapéutica. Adicionalmente, es muy importante explicar al paciente la necesidad de combinar los neuromoduladores y los objetivos terapéuticos esperados, ya que en ocasiones pueden manifestar preocupaciones y perder la confianza en el médico202.
Combinaciones potenciales de los neuromoduladores. No se recomienda combinar dos o más neuromoduladores de la misma clase. Existe alto riesgo de síndrome serotoninérgico, riesgo de caídas y/o disminución del umbral convulsivo con la combinación de ISRS con IRNS.
APA: antipsicóticos atípicos; ATC: antidepresivos tricíclicos; ATTC: antidepresivos tetracíclicos; AZP: azapironas; IRNS: inhibidores de recaptura de norepinefrina y serotonina; ISRS: inhibidores selectivos de recaptura de serotonina; DLS: delta-ligandos.
Existen dos estrategias básicas para la combinación de neuromoduladores:
- 1)
Agregar un neuromodulador periférico a uno de acción central (p.ej., gabapentina y sertralina).
- 2)
Agregar un neuromodulador central a otro central (p. ej., amitriptilina y escitalopram).
La combinación de neuromoduladores debe ser personalizada con respecto a los síntomas no resueltos (p.ej., síntomas de ansiedad en un paciente con DF controlado con amitriptilina) o a las comorbilidades (p.ej., fibromialgia y SII con estreñimiento controlado con sertralina). Se utilizan las mismas recomendaciones generales para el inicio y el escalamiento de dosis (iniciar bajo e incrementar lento) con mayor vigilancia de la tolerancia del paciente, ya que de la misma manera que se potencia el efecto terapéutico, también se pueden potenciar los efectos adversos (p.ej., somnolencia, o cambio en el hábito intestinal). No se recomienda combinar fármacos de la misma clase (p. ej., dos ATC) o con mecanismos de acción similares (p.ej., un ISRS con un IRNS) ya que pueden condicionar efectos adversos potencialmente fatales (p.ej., síndrome serotoninérgico).
Se recomienda realizar un electrocardiograma de 12 derivaciones para medir el intervalo QT antes de iniciar ATC o ISRS.
La prolongación del intervalo QT se observa principalmente con los ATC debido a su afinidad débil por los canales de sodio, y los ISRS deben evitarse en pacientes con bloqueo de rama o intervalo QT prologando, así como en aquellos pacientes con uso concomitante de antiarrítmicos (p.ej., amiodarona, sotalol, quinidina, procainamida, verapamil, diltiazem) y otros fármacos no cardiovasculares (ondansetrón, macrólidos, fluoroquinolonas, antibióticos, antipsicóticos como haloperidol, tioridazina y sertindol). La mortalidad por arritmia inducida por antidepresivos se incrementa con un OR de 2.11 (IC95%: 1.10-4.22) con dosis altas de ATC, y con un OR de 2.78 (IC95%: 1.24-6.24) con dosis altas de ISRS205. El riesgo de QT prolongado se debe valorar en todos los pacientes a través de un electrocardiograma de 12 derivaciones con medición del intervalo QTc (QT corregido) antes del inicio de esta clase de neuromoduladores, y si durante el tratamiento se documenta la prolongación del intervalo QT se debe suspender inmediatamente el fármaco y referir para valoración por cardiología10.
- •
Se recomienda descontinuar gradualmente la dosis de neuromoduladores, reduciendo en un 25% cada 2-4semanas, según la tolerancia del paciente.
Durante la administración continua de fármacos neuromoduladores se establece una nueva adaptación neurobiológica que conduce a un equilibrio homeostático. En este nuevo estado, el sistema se acomoda a las alteraciones producidas por el fármaco. Cuando la medicación se reduce o se suspende, se altera este nuevo punto de equilibrio homeostático, lo que resulta en la aparición de síntomas de descontinuación y supresión. Esto es muy común tras el uso de dosis altas de neuromoduladores como amitriptilina, imipramina, venlafaxina, desvenlafaxina, duloxetina, paroxetina y fluvoxamina, que generan síntomas de descontinuación frecuentes y severos. La duración y la gravedad de los síntomas dependerán del tiempo que le tome al cerebro readaptarse a niveles más bajos del fármaco o a su ausencia, y los más comunes son ansiedad, agitación, irritabilidad, insomnio, náusea, vértigo, disestesias o alucinaciones206,207. La incidencia de los síntomas de descontinuación es del 53.9%, y cuando se presentan cuatro o más síntomas, se habla de síndrome de descontinuación. Los factores de riesgo para el síndrome de descontinuación o abstinencia son: sexo femenino, uso de neuromoduladores de vida media corta, dosis altas y uso prolongado (más de un año)208.
Efectos adversos- •
Recomendamos conocer los principales eventos adversos y reacciones graves de los neuromoduladores previo a su prescripción.
Los neuromoduladores son por lo general seguros y se indican en dosis más bajas a las utilizadas en psiquiatría; sin embargo, deben conocerse e identificarse los eventos adversos que ameritan ajuste de dosis o suspensión. Los principales efectos secundarios de los neuromoduladores están asociados al agonismo o a la inhibición de los receptores sobre los cuales actúan, y algunos son dependientes de clase. Usualmente ocurren antes de observar el efecto terapéutico, y pueden reducirse iniciando a dosis baja y con incrementos periódicos. El efecto nocebo se define como las percepciones negativas de la administración de un tratamiento (real o simulado) en el contexto terapéutico y suele ser desencadenado por los simbolismos, rituales o experiencias que acompañarán a los pacientes durante la actividad clínica209. El efecto nocebo se observa principalmente en pacientes con ansiedad anticipatoria por tratamientos previos y no por los efectos propios del medicamento, manifestando efectos adversos poco frecuentes o incluso tras la primera dosis (antes de alcanzar las concentraciones sanguíneas terapéuticas) y, por tanto, se debe reforzar al paciente sobre la importancia de continuar con el tratamiento y el incremento gradual antes de considerar el cambio o suspensión de este8.
ATC. Los principales efectos adversos como clase son resequedad de boca, estreñimiento, disfunción sexual, retención urinaria, arritmias y ganancia de peso, entre otros. Amitriptilina, doxepina, imipramina y trimipramina se asocian más comúnmente a sueño, pero pueden ocasionar además aumento de peso. Los ATC son más propensos a causar sedación e hipotensión ortostática, por lo que se recomienda la administración por la noche. Los efectos adversos muy tempranos no anticolinérgicos suelen correlacionarse más con los niveles de ansiedad del paciente que con las concentraciones séricas o el número de dosis recibidas (efecto nocebo)2,11,12,210.
ISRS. Los efectos secundarios más comunes de los ISRS son náusea, diarrea, agitación, insomnio, diaforesis nocturna, cefalea, mareo, pérdida de peso y disfunción sexual. Los ISRS pueden acompañarse de agitación y exacerbar la ansiedad, que puede complicar el tratamiento y limitar la funcionalidad; en estos casos se ha propuesto utilizar benzodiazepinas (clonazepam 0.25-0.5mg dos veces al día) para el alivio sintomático y como terapia «puente» por 2 a 4semanas con reducción en 4semanas una vez se haya tolerado mejor el ISRS11. Asimismo, se ha reportado incremento en el riesgo de hemorragia del tubo digestivo al combinar ISRS con el uso concomitante de AINE con OR de 1.75 (IC95%: 1.32-2.33)211; por lo tanto, se recomienda evitar dicha combinación suspendiendo el AINE, vigilar por datos de sangrado de manera intencionada, suspender el ISRS pero con vigilancia por el síndrome de descontinuación y cambiarlo a mirtazapina o bupropión de ser necesario2,11,12,210.
IRNS. Entre los posibles efectos secundarios de los IRNS se incluyen náusea, agitación, mareo, resequedad de boca, diaforesis, cefalea, prurito, hipertensión, trastornos de sueño, fatiga y disfunción hepática. El uso de IRNS puede acompañarse de náusea, y ese efecto adverso disminuye si se toma con los alimentos. Algunos pacientes con depresión pueden cursar con trastorno bipolar oculto, y al iniciar los IRNS o dosis altas de IRNS o ISRS pueden virar a hipomanía o manía (exceso de energía, habla y pensamiento acelerado, euforia, impulsividad, insomnio e hipersexualidad) en las primeras 2semanas del tratamiento y debe ser referido para evaluación psiquiátrica11. En un estudio de cohorte en Inglaterra que incluyó 21,012 registros electrónicos de adultos con depresión, el riesgo de manía/hipomanía posterior al inicio de antidepresivos se incrementó con ISRS con HR: 1.34 (IC95%: 1.18-1.52) y con venlafaxina con HR: 1.35 (IC95%: 1.07-1.70)2,12,212,213.
Tetracíclicos. Su consumo puede asociarse a sedación, cefalea, resequedad de boca y ganancia ponderal2,12,21.
Azapironas. Pueden ocasionar agitación, mareo, sedación, cefalea, confusión, vértigo, palpitaciones y manifestaciones extrapiramidales2,12.
Antipsicóticos atípicos. Dependiendo del subgrupo, pueden inducir sedación, mareo, hiperprolactinemia, ganancia ponderal, diabetes mellitus, hiperlipidemia y disbiosis intestinal. Al compararlos con antipsicóticos típicos o de primera generación, tienen menor riesgo de ocasionar efectos extrapiramidales, como rigidez muscular o temblores2,12.
Anticonvulsivantes. Al ser un grupo heterogéneo, pueden ocasionar diferentes efectos, como somnolencia, mareo, aumento de peso, inducción enzimática e interacción con otros fármacos, alteraciones visuales, toxicodermas, hepatotoxicidad, nefrotoxicidad, inducción de lupus eritematoso sistémico, trastornos del movimiento y prurito12,214.
Delta-ligandos. Los efectos más comunes son sedación, mareo, cefalea, vértigo, ganancia ponderal y edema periférico2,12,26.
Una de las complicaciones más graves del uso de neuromoduladores es el síndrome serotoninérgico, un toxíndrome descrito por primera vez en 1955 en un paciente con tuberculosis que recibió tratamiento con iproniazida (inhibidor irreversible de la monoaminooxidasa) y meperidina215, caracterizado por la triada de anomalías neuromusculares, hiperactividad autonómica y alteración del estado mental. Ocurre por el exceso central y periférico de activación central y periférica de los receptores post-sinápticos de serotonina, se manifiesta por la triada de anomalías neuromusculares (clonus, mioclonus, tremor, hiperreflexia, hipertonicidad), hiperactividad autonómica (hipertermia, taquicardia, hipertensión, diarrea) y alteración del estado mental (agitación, confusión, ansiedad, coma)216. El síndrome serotoninérgico no es exclusivo de los antidepresivos y puede ocurrir con un solo fármaco a dosis terapéutica o en sobredosis, pero es más frecuente con la combinación de varios serotoninérgicos. Los cinco fármacos más comúnmente asociados son citalopram, fluoxetina, sertralina, bupropión y tramadol. El síndrome serotoninérgico debe sospecharse en pacientes con historia reciente de exposición a un fármaco serotoninérgico y al menos uno de los siguientes criterios, llamados de Hunter: clonus espontáneo, clonus inducible con agitación o diaforesis, clonus ocular con agitación y diaforesis, tremor e hiperreflexia o hipertonía o temperatura >38°C con clonus ocular o inducible217. Los pacientes con historia de una dosis estable o tolerancia adecuada es improbable que desarrollen el síndrome y, por tanto, con el uso de neuromoduladores a dosis bajas el riesgo se incrementa con la combinación de neuromoduladores o con las interacciones farmacológicas que disminuyen el metabolismo del agente serotoninérgico. En las visitas de seguimiento se recomienda interrogar por síntomas somáticos o psiquiátricos relacionados con el uso de los neuromoduladores, ya que en muchas ocasiones el paciente los normalizará u omitirá durante la consulta y puede resultar en el retraso en la identificación y tratamiento de una enfermedad grave.
Uso conjunto con psiquiatría- •
Se recomienda el manejo conjunto con psiquiatría en pacientes con TICI y comorbilidad psiquiátrica, o cuando se requiera combinación de neuromoduladores o psicoterapia.
Se ha establecido que tanto el estrés como los factores psicológicos son contribuyentes y en muchas ocasiones desencadenantes de síntomas en los pacientes con TICI, particularmente hipervigilancia, ansiedad, somatización y catastrofización. En muchas ocasiones estos mismos factores pueden perpetuar la sintomatología. Algunos gastroenterólogos no se sienten familiarizados con la búsqueda y la discusión de estos factores, por lo que se recomienda un abordaje multidisciplinario, en que el personal de salud mental (psicólogo y psiquiatra) debe estar involucrado218.
Habilidades de comunicación y estrategias de apego (tabla 3)- •
Recomendamos la enseñanza de habilidades de comunicación, como escucha activa y validación de emociones, para garantizar una atención integral y empática, mejorar la satisfacción del paciente, la percepción de la amabilidad del médico y la adherencia al tratamiento.
Tabla 3.Estrategia de comunicación
Recomendado (qué hacer) No recomendado (qué no hacer) Reconocer los síntomas y su gravedadEntender al paciente y el efecto que los síntomas tienen en élDemostrar al paciente que usted cree que tiene los síntomas. Son reales y se experimentan en el cuerpoSer honesto cuando un paciente tiene síntomas inusuales o inconsistentesPensar en cómo puede empoderar al pacienteExplicar los vínculos entre el estrés físico y psicológico con un lenguaje claro y positivoNegociar una explicación que tenga en cuenta la culturaNormalizar: todos los síntomas son biopsicosociales Decir al paciente que no hay nada maloDecirle al paciente que los síntomas son normalesTranquilizarlo repetidamente (ciclo sin fin)Decirle al paciente que no hay nada para ayudarloDar resultados normales de las pruebas, tranquilizarlo y pensar que esto lo ayudaráSugerir al paciente que la causa «real» de los síntomas es psicológicaOfrecer explicaciones simplificadas y dicotómicas puramente psicológicas o somáticas - •
Recomendamos establecer comunicación bidireccional médico y paciente para mejorar la comprensión e involucrar al paciente en su propio tratamiento y adherencia. Recomendamos explicar los mecanismos fisiopatológicos en los TICI, el concepto de neuromodulación y la justificación del tratamiento.
Se ha recomendado un abordaje que incluya la evaluación de ansiedad específica relacionada a cada TICI, efecto sobre calidad de vida y comportamiento hacia la enfermedad. Ejemplos de ansiedad específica incluyen miedo de tener una comorbilidad cardíaca en DT-F, miedo al alimento en DF, miedo a evacuar en SII o temor a tener un accidente al salir de la casa en incontinencia fecal (IF). Esto requiere habilidades de comunicación, así como una buena relación entre el médico y el paciente, que permita validar, empatizar y proveer confianza, realizar una conceptualización del comportamiento, educar y discutir opciones de manejo218. En Alemania se realizó un estudio que examinó transversalmente la comunicación médico-paciente, evaluada a través de conversaciones y cuestionarios validados de relación difícil médico-paciente, en la que participaron 520 médicos y 5,354 pacientes, encontrándose que dentro de las hipótesis sobre el desarrollo del TICI los médicos sospecharon principalmente cargas relacionadas con el estrés como la causa en la mayoría de los casos (65.4%), y los pacientes con mayor frecuencia tenían mayor probabilidad de sospechar que la comida (55.4%) u otras causas somáticas (43.6%) eran las razones principales de sus síntomas. Los síntomas funcionales y/o somatomorfos conducen más a menudo a interacciones difíciles que los síntomas «somáticos», y a la percepción del paciente como una persona que consume mucho tiempo. Aunque los médicos informaron tomarse suficiente tiempo para hablar con sus pacientes con TICI, solo un tercio estaba totalmente de acuerdo en tener suficiente tiempo, y solo el 5% se sentía suficientemente compensado por estas conversaciones219. La buena comunicación en la atención médica correlaciona con mejor adherencia del paciente (OR: 1.62) en comparación a una mala comunicación220. Las intervenciones interpersonales mejoran la comunicación en la relación médico-paciente, como lo demostró una revisión sistemática de ECC y estudios observacionales controlados que examinaron intervenciones interpersonales médico-paciente en 73 estudios, y reportaron que el 67% de las intervenciones estuvieron dirigidas al médico, y la medición del impacto en la experiencia del paciente y las mejoras en las experiencias fueron satisfacción, experiencia centrada en el paciente y reducción de las necesidades insatisfechas, las cuales a menudo correspondieron con un impacto positivo en otros resultados de salud del paciente, como calidad de vida, depresión y adherencia. Las interacciones interpersonales mejoradas incidieron positivamente sobre el bienestar, el agotamiento, el estrés y la confianza de los médicos en comunicarse con pacientes difíciles221.
En su análisis de comunicación, el grupo de Roma concluyó que la evidencia de que las intervenciones en la interacción médico-paciente mejoran la salud de la población, la experiencia del paciente y la del médico, y la capacitación en habilidades de comunicación, fueron las intervenciones más comunes y condujeron a una mejor comunicación, satisfacción y percepción de amabilidad del médico, y recomiendan una serie de 5 puntos prácticos: 1)preparación con intención antes de ver al paciente; 2)escuchar con atención; 3)formular una agenda con el paciente sobre los puntos más importantes; 4)conectar con la historia del paciente, y 5)explorar señales emocionales nombrando y validando los sentimientos del paciente13. Se recomienda tomarse el tiempo para explicar los mecanismos fisiopatológicos detrás de los TICI, el concepto de neuromodulación, los mecanismos de acción del medicamento, la justificación de su uso y la respuesta esperada, lo cual mejorará la comprensión de su valor farmacológico, reduciendo el estigma y aumentando probablemente la adherencia2.
Trastorno afectivo primario- •
Se recomienda tamizar para depresión y ansiedad en todo paciente con TICI, utilizando escalas autoaplicables (HADS, PHQ-9 o GAD-7).
Se ha descrito una asociación importante entre los TICI y los trastornos afectivos primarios218. Dado que los síntomas pueden superponerse entre entidades, los síntomas cognitivos y afectivos son clave para el diagnóstico diferencial. Este grupo de expertos no encontró estudios de validación de la escala de ansiedad y depresión hospitalaria (HADS) en población con SII u otros TICI; sin embargo, ha sido validada en México en otras entidades GI con alta prevalencia de síntomas depresivos y ansiosos, como enfermedad inflamatoria intestinal (EII)222. En esta escala, un puntaje total de 20 a 23 nos habla de síntomas moderados, y si es mayor a 24, de síntomas graves. El cuestionario de salud de pacientes PHQ-9 cuenta con validez en población mexicana para tamizaje de trastorno depresivo mayor, indicando un puntaje de 10 o más un episodio depresivo moderado a severo que requiere inicio de tratamiento antidepresivo223. La GAD-7, igualmente desarrollada por la Organización Mundial de la Salud (OMS), establece un punto de corte mayor a 10 para ansiedad moderada a grave que requiere igualmente medidas neuromoduladoras ansiolíticas. Todos estos puntos de corte han sido igualmente validados en población internacional con SII224.
- •
Se recomienda interconsulta con salud mental (psiquiatría/psicología) en pacientes con TICI que presenten depresión o ansiedad moderada a grave, uso de neuromoduladores a dosis con acción central o trastorno de la conducta alimentaria.
- •
Ante un episodio depresivo moderado a grave sin tratamiento para TICI, se recomienda continuar la titulación gradual del neuromodulador antidepresivo hasta la dosis mínima efectiva. Si se usan antipsicóticos atípicos, delta-ligandos, azapironas o existe intolerancia a ATC o mirtazapina, se sugiere combinar con ISRS a dosis antidepresiva.
Los síntomas depresivos, así como el trastorno depresivo mayor y los trastornos de ansiedad, son comorbilidades frecuentes en las patologías del ECI. La media global en los estudios de prevalencia de la comorbilidad del trastorno depresivo mayor y el trastorno de ansiedad asociado a SII es del 15.2% y del 20.7%, respectivamente; sin embargo, hasta un tercio de los pacientes con TICI en general puede presentar algún grado de sintomatología ansiosa y/o depresiva. Los datos apoyan un riesgo mayor de presentar ansiedad y depresión antes y después del diagnóstico de un TICI, en especial dentro del primer año del diagnóstico, así como mayor gravedad de los síntomas GI en la comorbilidad. La relación entre los TICI con depresión y ansiedad parece ser bidireccional. Los mecanismos detrás de esta relación incluyen inflamación de bajo grado, señalización vagal alterada, disbiosis intestinal y alteraciones en la señalización neuronal a nivel central y periférico225,226. Es importante conocer la dosis mínima antidepresiva de neuromoduladores antidepresivos utilizados en gastroenterología227.
Consideraciones especiales (trastornos de síntomas somáticos)- •
Recomendamos el manejo multidisciplinario de los TICI asociados a trastornos afectivos y somáticos. Se sugiere fomentar la formación de médicos con conocimiento de estas asociaciones mediante el apoyo con profesionales de la salud mental.
- •
Se recomienda que los profesionales de la salud adopten un enfoque más integral, centrado en el paciente, considerando tanto los síntomas físicos como los aspectos psicológicos y del comportamiento, y se detecten predictores de gravedad como alexitimia, somatización persistente y desmoralización.
- •
Se recomienda usar herramientas de evaluación validadas y accesibles (PHQ-15 y SCL-90).
La somatización es la tendencia a experimentar y comunicar malestar somático en respuesta al estrés psicosocial y a buscar ayuda médica228. En el Manual diagnóstico y estadístico de trastornos mentales DSM-V, la categoría de trastornos somatoformes del DSM-IV-TR fue reemplazada por trastornos de síntomas somáticos y trastornos relacionados229. El cambio es la identificación de un síntoma físico asociado con malestar y deterioro significativos. El trastorno de síntomas somáticos subraya la importancia de basar el diagnóstico en la presencia de síntomas y signos positivos, tales como síntomas somáticos angustiantes con pensamientos, sentimientos y comportamientos anormales en respuesta a dichos síntomas, eliminando el criterio de ausencia de explicación médica para los síntomas somáticos230. Existen estudios que identificaron la salud mental como un fuerte predictor de la dificultad percibida en la interacción médico-paciente, particularmente pacientes con trastornos multisomatoformes con un OR de 12.3 de ser percibidos como difíciles219. La aplicación de una entrevista estructurada con criterios diagnósticos para la investigación psicosomática revisados (DCPR-R) encontró que los síntomas de SII eran más intensos cuando se asociaban a comorbilidades psicológicas como alexitimia (46.8%), somatización persistente (34%) y desmoralización (19.7%), con una prevalencia tres veces mayor de trastorno de síntomas somáticos (cuestionario de salud de paciente PHQ12) e hipocondriasis (índice de Whiteley). Además, reportaron que tanto la alexitimia como la somatización persistente son predictores de gravedad de síntomas somáticos231. Una revisión sistemática identificó 40 escalas para evaluar síntomas somáticos, concluyendo que el cuestionario de salud del paciente (PHQ-15) y la Lista de Verificación de síntomas (SCL-90) son las mejores opciones para utilizar en estudios poblacionales a gran escala, por sus características psicométricas y la carga baja para el paciente232. Se recomienda evaluación para diagnóstico y recomendaciones de conducta profesional en los pacientes con TICI y estas comorbilidades233.
Opciones no farmacológicas de neuromodulacionTerapias psicológicas- •
Recomendamos como parte de la atención integral de los TICI la incorporación de intervenciones no farmacológicas.
- •
Recomendamos promover Programas de Autogestión para identificar desencadenantes específicos, y la implementación de estrategias de autocontrol para manejo del estrés.
- •
Recomendamos en conjunto con psiquiatría la incorporación de los diferentes procesos psicoterapéuticos (terapia cognitiva conductual, hipnoterapia dirigida al intestino, atención plena y terapia psicodinámica-interpersonal) de acuerdo con las características y los objetivos del paciente.
- •
Se recomienda trabajar en habilidades de comunicación efectivas por parte del médico, las cuales son esenciales para una relación sólida y de confianza para que el paciente acepte las recomendaciones y se sienta cómodo siendo derivado a un especialista en salud mental.
Las terapias basadas en la conducta son intervenciones no farmacológicas, breves, enfocadas en síntomas GI, personalizables y basadas en habilidades que alivian síntomas GI y mejoran la comorbilidad psicológica2,234. Pueden combinarse con otras terapias conductuales y neuromoduladores, ofreciendo una atención integral para los TICI18,235.
La Fundación Roma recomienda diversas intervenciones no farmacológicas para el tratamiento de los TICI236:
- 1.
Programas de autogestión. Fomentan el autocuidado y la confianza en la capacidad de controlar la salud, mejorando síntomas GI, psicológicos y de calidad de vida. Enfatizan la identificación de desencadenantes como la dieta, el ejercicio y el estrés, y el manejo del estrés a través de capacitación en autocontrol, disponible en folletos o manuales.
- 2.
Terapia cognitivo-conductual (TCC). Es una técnica que se enfoca en modificar comportamientos y alterar patrones de pensamiento disfuncional, que ayuda a desaprender comportamientos desadaptativos desarrollados en respuesta a síntomas GI o estrés. Varios ECC han demostrado la eficacia de la TCC en TICI, y aunque el criterio de inclusión en la mayoría de ellos fue al menos 4 sesiones, se recomiendan al menos 10 sesiones (rango 12-16), las cuales son tradicionalmente presenciales, pero en la actualidad pueden hacerse por mínimo contacto o mediante aplicaciones en línea234,237-239. En un metaanálisis de terapias psicológicas para SII, la TCC demostró eficacia al ser administrada ya sea presencial, con mínimo contacto o cara a cara, vía telefónica, o mediante aplicación (app) por internet, con RR de persistencia de síntomas de 0.61 (IC95%: 0.45-0.83)240.
- 3.
Hipnoterapia dirigida al intestino. Es una técnica desarrollada por Whorwell et al.241 en 1984 que cultiva un estado de recepción aumentada a sugerencias específicas durante una serie de 7-12 sesiones semanales, durante al menos 3meses, con una frecuencia que depende de la gravedad de cada caso. Se ha descrito tanto en forma individual como en grupo, así como en el consultorio o el hogar, y la mayor evidencia de su utilidad en TICI proviene de varios estudios en SII242,243. El protocolo actual de hipnosis en el hogar fue desarrollado por Palsson y Whitehead en 1994244, en el cual durante cada sesión un médico capacitado induce un estado elevado de concentración y apertura a sugerencias post-hipnóticas personalizadas, enfocadas en la disregulación intestino-cerebro, encaminada a reducir la atención y la percepción de dolor abdominal, el impacto del estrés en los síntomas, y aumentar la sensación de control sobre los síntomas. Hay evidencia sólida de su eficacia en SII, con más de 15ECC y un metaanálisis que reportó superioridad sobre educación o terapia de rutina o soporte (RR persistencia de síntomas: 0.67; IC95%: 0.49-0.91)234,240, y recientemente ha empezado a surgir evidencia en otros TICI245.
- 4.
Atención plena (mindfulness). Puede describirse como el deseo de estar anclado en el momento presente y aceptar el dolor o las sensaciones dolorosas o emociones como inevitables234, lo cual puede ayudar a reducir el sufrimiento, el estrés y mejorar la regulación de emociones. Al participante se le enseña a observar e identificar detalles acerca de sus síntomas sin dejar pasar juicio o reacción a desencadenantes, y el objetivo primario no es la reducción de síntomas sino identificar y aceptar el malestar. Debido a su naturaleza sensible al estrés, aprender a mantenerse firme y tranquilo cuando se enfrentan a situaciones estresantes puede disminuir los síntomas. Ha demostrado eficacia en una amplia gama de afecciones al reducir el estrés, mejorar la regulación emocional y disminuir la hipersensibilidad visceral. Estudios clínicos muestran que puede aliviar síntomas específicos, como estreñimiento, diarrea, distensión y ansiedad GI. Un metaanálisis reveló que las terapias de atención plena son útiles en diversos TICI246. Para ejemplos de ejercicios de terapia de atención plena, ver el link a material suplementario en audio.
- 5.
Terapia psicodinámica-interpersonal. Ofrecida por un psicoterapeuta capacitado, esta terapia se basa en una relación sólida y de confianza para reparar emociones negativas asociadas con TICI. Tiene evidencia de beneficios en síndromes somáticos funcionales, SII y dispepsia247.
Varios metaanálisis han evaluado el beneficio de las diferentes opciones de psicoterapia o terapia psicológica, incluyendo psicoeducación, autoayuda, terapia cognitiva, psicoterapia psicodinámica, hipnoterapia, atención plena y terapia de relajación en SII, y reportaron NNT de 2248 y de 4185. En los dos más recientes, que incluyeron 41 ensayos clínicos aleatorizados y más de 4,072 pacientes, las intervenciones psicológicas más efectivas, que incluyeron el mayor número de ensayos y pacientes, fueron la TCC autoadministrada o de contacto mínimo, la TCC presencial y la hipnoterapia dirigida al intestino, aunque ninguna demostró ser superior a otra. Las intervenciones basadas en TCC y la hipnoterapia dirigida al intestino fueron las más efectivas a largo plazo240,249.
Dispositivos externos y digitales- •
Puede considerarse el uso de dispositivos de neuromodulación no farmacológica, como estimulación vagal auricular transcutánea (EVAT) en DF, GP y SII.
- •
Puede considerarse la estimulación continua del nervio sacro (ECNS), tibial posterior percutánea/transcutánea (ETP) y neuroestimulación magnética translumbosacra (EMTLS) en incontinencia fecal (IF).
- •
Puede considerarse TCC administrada mediante aplicaciones digitales o realidad virtual (RV) /realidad médica extendida (RME) para DF y SII.
- •
Puede considerarse musicoterapia (MT) para trastornos de ansiedad asociados.
En forma reciente se han desarrollado varios dispositivos externos emergentes que funcionan como neuromoduladores no farmacológicos. Se ha reportado que la estimulación de corriente alterna transcraneal (ECAT) es capaz de modular la actividad neuronal fásica y la transmisión en vías centrales descendentes, lo cual puede inducir neuromodulación y neuroplasticidad, restaurando la homeostasis de señalización neurointestinal250-252. Varios dispositivos externos de aplicación de ECAT han sido evaluados para diferentes TICI, incluyendo estimulación vagal transcraneal (EVTC), estimulación vagal cervical transcutánea (EVCT), estimulación vagal auricular transcutánea (EVAT), acuestimulación eléctrica transcutánea (AET), estimulación eléctrica transabdominal (EET), estimulación continua del nervio sacro (ECNS), estimulación de nervios tibiales posteriores (ETP) y neuroestimulación magnética translumbosacra (EMTLS). En años recientes ha surgido evidencia de mejoría preliminar con EVAT tanto en DF, en SVC como en DT-F253-255. La mayor evidencia del beneficio de la EVAT en TICI proviene de dos trabajos en DF. El primero de ellos demostró que dos sesiones de EVAT fueron superiores a terapia sham a 2semanas para disminuir puntaje de síntomas, escalas de ansiedad y depresión, así como acomodación gástrica, aumento de la actividad vagal eferente y aumento en el porcentaje de ondas gástricas lentas256. Un estudio más reciente incluyó 300 pacientes con DF (RomaIV) y fueron asignados a dos grupos de EVAT (10Hertz, 25Hertz o placebo) por 4semanas, y tanto las tasas de respuesta, definidas como reducción de más de 5 puntos en el puntaje diario de síntomas (81.2% vs 75.9% vs 47%, respectivamente, <0.001), como de mejoría adecuada (85.1% vs 80.8% vs 67%, p<0.05) fueron significativamente superiores en ambos grupos de tratamiento sobre placebo257. La AET redujo en un 55% la intensidad de síntomas de DF a 2semanas258, mientras que en otro estudio mejoró los puntajes de calidad de vida, acomodación y VG259. Tanto la EVAT como la EVCT han sido evaluadas en GP, reportándose disminución de la severidad de náusea con EVAT, y mejoría sintomática de N/V, saciedad, llenura, distensión y dolor abdominal259,260. La AET ha sido evaluada también en SII-E, en el cual aumentó el número de evacuaciones espontáneas completas, siendo el primer estudio que reporta este hallazgo, además de reducir los puntajes de dolor abdominal261. Otro estudio reportó hallazgos similares con EVAT, la cual mejoró puntajes de calidad de vida además del efecto beneficioso sobre evacuaciones y dolor262. Al menos tres formas de neuroestimulación han sido evaluadas recientemente con éxito en IF: ECNS, ETP y EMTLS, las cuales en general reducen el número semanal de episodios de IF, disminuyen los episodios de escape fecal y mejoran la calidad de vida263-268.
La tecnología digital ha transformado la forma como nos comunicamos y accedemos a información sobre casi cualquier tema. Las intervenciones terapéuticas basadas en tecnología han emergido y evolucionado durante los años más recientes, ayudando en la prevención, el manejo o el tratamiento de diferentes problemas médicos. Diferentes aplicaciones digitales (app) permiten ahora acceder a cuestionarios de síntomas y escalas autoaplicables, así como programas de entrenamiento y relajación, que incluyen diferentes formas de psicoterapia269. De entre estas, la TCC y la hipnoterapia administrada a través de internet o por app digital con apoyos visuales, videos y ejercicios en casa ha demostrado tener resultados muy parecidos a la TCC presencial, con reducción de severidad sintomática, así como en puntajes de náusea, dolor abdominal y distensión en sujetos con DF o SII, aunque carecen de grupo control o bien no son cegadas269,270. El desarrollo de estas apps con el apoyo de la inteligencia artificial parece optimizar el tiempo de respuesta y disminuir el número de sesiones271.
Recientemente ha surgido una tecnología llamada realidad virtual (RV), que consiste en la creación de un ambiente en tres dimensiones (3D) que hace sentir a los usuarios como si formaran parte de un ambiente virtual, con sensores de movimiento integrados al dispositivo que ajustan la imagen cuando la persona se mueve, y que limitan la capacidad de procesar y ser consciente de los estímulos nocivos y sensaciones más allá del mundo virtual. En medicina, la RV ha sido evaluada con éxito para el tratamiento de dolor experimental y dolor somático, y en Estados Unidos la US Federal Drug Administration la ha renombrado como «realidad médica extendida» (RME). Recientemente la RV/RME ha incorporado técnicas de relajación y modalidades de psicoterapia como TCC para el tratamiento de TICI, particularmente DF y SII272-274. En el primer estudio que evaluó RV en DF (RomaIV), los pacientes fueron asignados a RV y a un grupo control con videos de naturaleza en 2D, diario por 2semanas, y observaron que, además de segura, la RV se asoció a mejoría en puntajes de síntomas y calidad de vida273. En SII, un estudio de validación inicial reportó que un programa estandarizado de 8semanas de TCC administrada mediante RV puede ayudar a los pacientes a manejar sus síntomas274. Al ser una tecnología emergente, pero en crecimiento, seguramente en los próximos años surgirá mayor evidencia de su utilidad en otros TICI.
Se ha reportado que la terapia musical o musicoterapia (MT) se asocia a placer que puede alterar la bioquímica cerebral induciendo liberación de diversos neurotransmisores y hormonas, como dopamina, serotonina y oxitocina275, con un efecto benéfico sobre la motivación, la reducción de estrés y la afiliación social, además de efectos sobre reducción de la ansiedad y mejoría en la calidad del sueño276,277. Estudios funcionales de neuroimagen han demostrado que la música induce analgesia asociada a modulación de las vías descendentes, así como efecto sobre los circuitos asociados a emoción, como la amígdala y la corteza cingulada278. Un trabajo reciente reportó que dos estrategias de MT, una activa improvisada y otra receptiva, por 50minutos, dos veces a la semana, por 3meses, se asociaba a reducción en puntajes de depresión279. Otro trabajo comparó el efecto de MT versus no terapia en el efecto del uso de sedantes durante estudios endoscópicos, y los autores reportaron que el grupo en MT tuvo menores puntajes de ansiedad, mayor tolerancia y menor consumo de propofol durante sus procedimientos280. Finalmente, un metaanálisis de 14 estudios controlados publicado en 2017 reportó que la MT se asoció a reducción de dolor en condiciones asociadas a dolor crónico, y en la mayoría de los estudios sin una estrategia fija de exposición o duración281.
FinanciamientoLa AMG y la AMNM proporcionaron el apoyo financiero en cuanto a logística, gastos de viaje y reunión presencial para todos los expertos de este documento. Ningún participante recibió honorarios para la realización de estas guías. Estas recomendaciones están avaladas por la AMG y la AMNM.
Conflicto de interesesO. Gómez-Escudero ha sido conferencista para Carnot, Chinoin, Adium Pharma, Alfa-Sigma y Faes Farma
J.M. Remes-Troche es asesor y miembro de consejo consultivo para Adium Pharma, Carnot, Pro.Med.CS. Praha a.s. y Pisa. Conferencista para Adium Pharma, Abbott, Carnot, Chinoin, Ferrer, Johnson y Johnson, Medix y Medtronic.
E. Coss-Adame ha sido conferencista para Adium Pharma, Alfa-Sigma, Megalabs, AstraZeneca, Carnot, Medtronic, Abbott, Chinoin y Grunenthal.
K. García-Zermeño ha sido conferencista para Carnot, Ferrer, Megalabs y M8.
M.A. Valdovinos ha sido conferencista para Carnot, Megalabs, M8, Bayer y Faes Farma.
M. Amieva Balmori ha sido conferencista para Carnot, AstraZeneca, Adium Pharma, Alfa-sigma.
A.S. Villar Chávez ha sido conferencista para Carnot, Adium Pharma, Alfasigma, Schwabe.
L.R. Valdovinos García ha sido conferencista para Carnot, AstraZeneca, Adium Pharma y Chinoin.
C. Prakash Gyawali es consultante para Medtronik, Diversatek, Phathom, Braintree, y conferencista para Carnot
AgradecimientosLos autores agradecen a la Dra. María José Romero González, del Servicio de Psiquiatría de Enlace del Instituto Nacional de la Nutrición «Salvador Zubirán», por el material suplementario en audio para terapia de atención plena.