El objetivo de este posicionamiento es proporcionar a los profesionales de la salud una guía actualizada y basada en evidencia para el manejo farmacológico del síndrome del intestino irritable (SII) en México.
Material y métodosSe realizó en una revisión de la literatura, incluyendo guías y estudios relevantes hasta la fecha de su publicación. En cada clase terapéutica se evaluó su mecanismo de acción, indicaciones específicas en el SII, perfil de seguridad y disponibilidad. Las recomendaciones fueron desarrolladas por 14 expertos, considerando la realidad clínica de los pacientes con SII en México.
ResultadosSobre cada clase se emitieron recomendaciones específicas. Los antiespasmódicos (solos o en combinación) se usan como primera línea para el manejo del dolor, mientras que los antidiarreicos como la loperamida, para reducir la diarrea en el SII con diarrea (SII-D) y los laxantes para el estreñimiento en el SII con esta variedad (SII-E). Los agonistas 5-HT4 (prucaloprida y mosaprida) se recomiendan en el SII-E y los antagonistas 5-HT3 (ondansetrón) en el SII-D. El único secretatogogo disponible en México es linaclotida y se usa en el SII-E. La rifaximina alfa destaca por su eficacia en un subgrupo de pacientes con SII-D o mixto. Los probióticos son recomendados como adyuvantes y de manera condicional debido a la evidencia heterogénea. Los neuromoduladores (tricíclicos, inhibidores de recaptura de serotonina, etc.) son recomendados como segunda línea para el manejo del dolor. Aunque se puede utilizar mesalazina en el SII-D, la evidencia es débil.
ConclusiónEn conjunto, estas recomendaciones proporcionan un marco sólido para la personalización del tratamiento en función de las características clínicas del paciente mexicano con SII.
The aim of this position statement is to provide health professionals with an updated and evidence-based guideline for the pharmacologic management of irritable bowel syndrome (IBS) in Mexico.
Material and methodsA literature review was conducted that included relevant guidelines and studies, up to the date of its publication. The mechanism of action, specific indications in IBS, safety profile, and availability of each therapeutic class were evaluated. The recommendations were developed by 14 experts, considering the clinical reality of IBS patients in Mexico.
ResultsSpecific recommendations were issued for each class. Antispasmodics (alone or combined) are used as first-line therapy for pain management, whereas antidiarrheals, such as loperamide, are used for reducing diarrhea in diarrhea-predominant IBS (IBS-D) and laxatives are used for constipation in constipation-predominant IBS (IBS-C). 5-HT4 agonists (prucalopride and mosapride) are recommended in IBS-C and 5-HT3 antagonists (ondansetron) are recommended in IBS-D. Linaclotide is the only secretagogue available in Mexico and is used in IBS-C. Rifaximin-alpha stands out for its efficacy in a subgroup of patients with IBS-D or mixed IBS. Probiotics are conditionally recommended as adjuvant therapy due to heterogeneous evidence. Neuromodulators (tricyclic antidepressants, selective serotonin reuptake inhibitors, etc.) are recommended as second-line treatment for pain management. Mesalazine can be used in IBS-D, but the corresponding evidence is weak.
ConclusionOverall, these recommendations provide a solid framework for personalizing treatment, based on the clinical characteristics of the Mexican patient with IBS.
El síndrome de intestino irritable (SII) es un trastorno de la interacción intestino-cerebro (TIIC) de curso benigno con episodios de exacerbación y remisión que afecta la calidad de vida, y se caracteriza por la presencia de dolor abdominal relacionado con alteraciones en la frecuencia y en la consistencia de las evacuaciones1. Tradicionalmente se había considerado como un «trastorno funcional sintomático» por no estar asociado a alteraciones estructurales o bioquímicas, sin embargo, actualmente se reconocen distintos mecanismos fisiopatológicos involucrados que pueden explicar la sintomatología, y esto en gran parte ha servido para ser más precisos en el tratamiento2.
En México, su prevalencia se estima entre el 4 y el 35%, siendo una de las enfermedades gastrointestinales más comunes en la población3–5. El tratamiento farmacológico del SII ha sido objeto de continua investigación y debate. En México existe una amplia gama de opciones farmacológicas cuyo acceso y disponibilidad ha sido variable en los últimos años. El objetivo de este posicionamiento es proporcionar a los profesionales de la salud una guía práctica y actualizada, basada en evidencias, para el manejo farmacológico del SII. Se abordan aspectos relevantes como la eficacia de los diferentes fármacos, su perfil de seguridad, recomendaciones de uso, y las limitaciones en cuanto a su acceso para los pacientes.
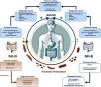
Material y métodosEste posicionamiento fue solicitado conjuntamente por el Comité Científico y la Mesa Directiva de la Asociación Mexicana de Gastroenterología (AMG) 2023 para proporcionar orientación oportuna sobre un tema de alta importancia clínica para los miembros de la AMG. Se propuso hacer una revisión didáctica, exhaustiva y completa de los tratamientos farmacológicos disponibles para el SII en México mediante la designación de 2 coordinares (ECA y JMRT) quienes a su vez convocaron a 12 expertos en el área del tratamiento del SII. Se dividió el trabajo en 14 secciones de acuerdo con las clases terapéuticas disponibles para el manejo del SII, y se solicitó a cada autor de la sección correspondiente, realizar una búsqueda cruzada a través de los portales de PubMed e IMBIOMED (hasta junio de 2024) de los términos correspondientes relacionados con los fármacos para el manejo del SII. En cada sección se pidió que se proporcionaran los mecanismos de acción correspondientes, las indicaciones, la evidencia clínica, los eventos adversos y su disponibilidad en México.
La invitación se realizó a todos los participantes el primero de julio de 2023, y el 10 de julio se realizó una reunión virtual para explicar el proceso de trabajo. Se dispuso de 3 meses, tiempo en el cual los autores enviaron el material a los coordinadores quienes lo integraron para ser presentados forma presencial el día 16 de noviembre de 2023. En la reunión presencial se discutió la información recabada en cada sección, y se decidió la información a presentarse en este documento. A continuación, se detalla en cada sección la información más relevante.
AntiespasmódicosLos antiespasmódicos, también llamados espasmolíticos, son un grupo de medicamentos que tradicionalmente se han usado para el manejo del dolor en el SII6,7.
Mecanismos de acciónLos antiespasmódicos se dividen en varios subgrupos de acuerdo con su estructura química y mecanismo de acción:
- a)
Agentes relajantes directos de músculo liso (v.gr: mebeverina, trimebutina, derivados de la papaverina)
- b)
Derivados anticolinérgicos de escopolamina (v.gr: butilhioscina, hioscina, levsina, hiosciamina, dicicloverina, bromuro de cimetropio, bromuro de propantelina, butilescopolamina)
- c)
Derivados de amonio (v.gr: bromuro de otilonio, bromuro de prifinio)
- d)
Calcioantagonistas (bromuro de pinaverio, citrato de alverina, fenoverina, rociverina, pirenzepina, aceite de menta o menta piperita)7–13
Algunos agentes pueden tener varios mecanismos de acción al actuar sobre uno o más receptores, y presentar efecto calcio antagonista, anticolinérgico, antimuscarínico, o sobre receptores de 5-hidroxitriptamina (5-HT). Para la mayoría de estas moléculas el mecanismo exacto de acción no está completamente establecido, aunque se cree tienen mecanismos de acción mixtos. El ejemplo típico es el bromuro de otilonio, una amina cuaternaria con efecto calcio antagonista que previene las contracciones intestinales excesivas, pero interfiere con respuestas muscarínicas y receptores de taquicininas, lo cual resulta en un efecto de modulación motora, pero al que también se le han descrito propiedades anti nociceptivas. Otro ejemplo es el aceite de menta piperita, que además de su efecto antiespasmódico tiene otros mecanismos, por lo cual en esta revisión hemos decidido mencionarlo en la sección de «terapias herbales»14–16.
IndicacionesSe recomienda su uso en cualquier subtipo del SII (diarrea: SII-D, estreñimiento: SII-E, mixto: SII-M) cuando el dolor sea el síntoma predominante. Debido a los efectos anticolinérgicos algunos antiespasmódicos (por ejemplo, antagonistas de calcio), pueden inducir cambios en el hábito intestinal hacia estreñimiento, por lo que podrían ser de mayor utilidad tanto en el SII-D como en el SII-M16–18.
Evidencia clínicaLa efectividad de los antiespasmódicos ha sido evaluada tanto en estudios abiertos como en ensayos clínicos controlados (ECC). Se han publicado al menos 7 revisiones sistémicas y metaanálisis que evalúan la utilidad de los antiespasmódicos en conjunto en el SII17,19–24. En el metaanálisis de Cochrane21 se reporta superioridad de los antiespasmódicos como grupo en mejoría de dolor abdominal (p<0.001), mejoría global de síntomas (p<0.001), con una ganancia terapéutica de 12% (58 vs. 46%), y números necesarios a tratar (NNT) de 7 para dolor abdominal, 5 para mejoría global, y 3 para mejoría en el puntaje de síntomas. Otros meta-análisis han descrito los NNT para cada antiespasmódico, bromuro de otilonio: 5, bromuro de pinaverio: 4, bromuro de hioscina: 3, bromuro de cimetropio: 3, diciclomina: 4, alverina: 4, y mebeverina: 517,20. Por otra parte el número necesario para dañar (NND) fue de 175,20. En un metaanálisis mexicano que incluyó 23 estudios y 2585 pacientes, los antiespasmódicos fueron superiores a placebo en la mejoría global (razón de momios [RM] 1.55; intervalo de confianza [IC] del 95%: 1.33-1.83), y dolor (RM: 1.52; IC 95%: 1.28-1.80)22. En este estudio, el bromuro de otilonio y la combinación de alverina con simeticona se asociaron en forma significativa a mejoría global, mientras que el bromuro de pinaverio con simeticona, se asoció a mejoría en distensión. Finalmente, un metaanálisis de red publicado hace 3 años ranqueó en segundo lugar a los antiespasmódicos como grupo -por detrás de los neuromoduladores tricíclicos- en términos de mejoría de dolor a 4-12 semanas24.
La AMG en su último consenso sobre SII les ha asignado a los antiespasmódicos un nivel de evidencia y fuerza de la recomendación A1 fuerte a favor de la intervención25.
Eventos adversosAunque se prescriben como fármacos seguros, los efectos más comunes son los relacionados con su efecto anticolinérgico (resequedad de boca, mareo, visión borrosa). La fenoverina es un fármaco que se ha reportado causa rabdomiólisis, por lo que ante la amplia disponibilidad de antiespasmódicos la recomendación es optar por aquellos que exhiben un mejor perfil de seguridad26.
Disponibilidad, dosis recomendada y duración del tratamientoEn la tabla 1 se muestran los antiespasmódicos disponibles en México y sus dosis recomendadas. La duración del tratamiento con antiespasmódicos es de forma inicial al menos 4 semanas, y pueden prescribirse hasta por de 8 a 12 semanas, aunque la evidencia sugiere que algunos (v.gr: otilonio, pinaverio) pueden ser efectivos hasta durante 15 semanas.
Antiespasmódicos disponibles en México para el manejo del SII
| Fármaco | Dosis recomendada | Duración |
|---|---|---|
| Bromuro de pinaverio | 100mg/2 a 3 veces al día | 4 a 12 semanas |
| Bromuro de otilonio | 40mg/3 veces al día | 4 a 12 semanas |
| Citrato de alverina | 60mg/3 veces al día | 4 a 12 semanas |
| Trimebutina | 100mg/3 veces al día200mg/3 veces al día | 4 a 12 semanas |
| Diciclomina/dicicloverina | 10-20mg/3 veces al día | 4 a 12 semanas |
| Mebeverina | 200mg/3 veces al día | 4 a 12 semanas |
| Fenoverina | 200mg/2 veces al día | 4 a 12 semanas |
| Pargeverina | 10mg/3 veces al día | Una semana (sin evidencias para uso prolongado) |
| Hioscina | 10mg/3 veces al día | Una semana (sin evidencias para uso prolongado) |
SII: síndrome de intestino irritable.
Los antiespasmódicos en combinación son aquellos que con el objetivo de mejorar síntomas asociados (por ejemplo, distensión, flatulencias, etc.) o favorecer la digestión de carbohidratos, se combinan con antiespumantes como la simeticona o enzimas con el caso de la alfa-galactosidasa. A continuación, nos referimos a los antiespasmódicos en combinación con simeticona o enzimas, no sin antes aclarar que, aunque en nuestro país existen combinaciones de antiespasmódicos con antiinflamatorios (por ejemplo, con clonixinato de lisina) no recomendamos estos para su uso en el SII.
Mecanismos de acciónLa simeticona o dimeticona activada resulta de la combinación de dimeticona (dimetilpolisiloxano) y dióxido de silicio. Este compuesto tiene propiedades antiespumantes, por lo que disminuye la tensión superficial de las burbujas mucogaseosas, causando su coalescencia. En modelos animales también se ha demostrado que disminuye la permeabilidad paracelular colónica inducida por estrés27,28. Por su efecto exclusivo en la luz intestinal, se considera un fármaco muy seguro.
Por otra parte, la alfa D-galactosidasa (una enzima que descompone diferentes oligosacáridos no absorbibles), también llamada o agalsidasa alfa o melibiasa, es una enzima derivada de la fermentación selectiva del hongo Aspergillus niger que hidroliza los grupos alfa-galactosil terminales de glicolípidos y glicoproteínas29. Esta enzima hidroliza 3 carbohidratos complejos: rafinosa, estaquiosa, y verbascosa, y los convierte en monosacáridos: glucosa, galactosa y fructuosa, así como en el disacárido sucrosa, los cuales se absorben fácilmente30. Esto evita que estos azúcares complejos lleguen al colon, donde son fermentados por bacterias generadoras de gas, lo que teóricamente evita síntomas como distensión y flatulencia31.
IndicacionesLas combinaciones con simeticona se recomienda en cualquier subtipo del SII cuando, además de dolor, el paciente refiere distensión abdominal asociada. Por otro lado, la combinación con alfa D-galactosidasa se recomienda cuando además de dolor el paciente refiere distensión abdominal u otros síntomas relacionados con gases (p. ej., flatulencias), en especial si han consumido abundantes carbohidratos altamente fermentables.
Evidencia clínicaActualmente los antiespasmódicos que se han combinado con simeticona son bromuro de pinaverio, citrato de alverina, trimebutina, y más recientemente mebeverina. El bromuro de pinaverio con simeticona ha sido estudiada en México. Un ECC de 12 semanas de duración, que incluyó 285 pacientes, mostró que el bromuro de pinaverio con simeticona fue superior a placebo para mejorar el dolor y la distensión abdominal subjetiva en los pacientes que reunieron criterios de Roma III para el SII32. También se reportó mejoría de la consistencia de las heces, particularmente en el SII-E y en el SII-M. Por otra parte, otro ECC de 4 semanas de duración, que incluyó 412 pacientes con criterios de Roma III para el SII, mostró que la combinación de citrato de alverina con simeticona fue superior a placebo para la mejoría global de los síntomas, así como el control del dolor y la distensión abdominal33. En otro estudio se compararon 2 estrategias: el uso de alverina con simeticona a demanda vs. el tratamiento convencional de médicos de primero contacto, y se demostró que la calidad de vida a los 6 meses fue superior en los pacientes que recibieron alverina con simeticona34. El NNT para alverina simeticona para la mejoría global de síntomas es de 822.
En México se comercializa también la combinación de maleato de trimebutina con simeticona sola y con alfa D-galactosidasa. De forma aislada se ha demostrado que la alfa D-galactosidasa mejora los síntomas del SII. Por ejemplo, en un estudio con 125 pacientes con SII que recibieron alfa D-galactosidasa (400 unidades de galactosidasa [Ga] IU TID) o placebo en las comidas durante 12 semanas, se demostró que la administración de la enzima resultó en una tendencia a disminuir los síntomas de forma más prominente35. En otro estudio, Tuck et al.36 administraron alfa D-galactosidasa en dosis de 300GaIU TID, o 150GaIU TID o placebo a 31 sujetos con SII que eran productores de hidrógeno en las pruebas de aliento mientras consumían una dieta alta en oligosacáridos durante 3 días. La adición de alimentos con alto contenido de oligosacáridos dio como resultado un aumento significativo de los síntomas generales con 21 pacientes que mostraron sensibilidad a estos alimentos (aumento >10mm para los síntomas generales). De ellos, la enzima en dosis completa redujo los síntomas generales (p=0.006) y la distensión abdominal (p=0.017).
Recientemente, en México se realizó un ensayo cruzado en los pacientes con distensión abdominal funcional (algunos con síntomas de SII) y controles que se sometieron a una dieta alta en fermentables y posteriormente recibieron de forma aleatorizada una tableta de trimebutina+simeticona+alfa D-galactosidasa (154mg/75mg/450GaIU) o placebo37. En el estudio se demostró que la triple combinación evitó de forma significativa la distensión abdominal objetiva y disminuyó la intensidad de las flatulencias y eructos en los sujetos controles. En los pacientes con distensión la combinación disminuyó la intensidad del dolor.
Finalmente, la combinación de mebeverina con simeticona es la más reciente disponible en nuestro país, sin embargo, aún no existe evidencia clínica al respecto.
Eventos adversosEn algunos casos las dosis altas de simeticona se asocian con diarrea. No se han descrito efectos adversos serios, ni con simeticona ni con alfa D-galactosidasa.
Disponibilidad, dosis recomendada y duración del tratamientoEn la tabla 2 se muestra la disponibilidad en México y la forma de prescribir las combinaciones.
Antiespasmódicos en combinación disponibles en México para el manejo del SII
| Fármaco | Dosis recomendada | Duración |
|---|---|---|
| Pinaverio/simeticona | 100mg/300mg/2 a 3 veces al día | 12 semanas |
| Alverina/simeticona | 60mg/300mg/3 veces al día | 4 semanas6 meses dosis demanda |
| Trimebutina/simeticona | 100mg/75mg/3 veces al día200mg/75mg/3 veces al día | 4 a 12 semanas |
| Trimebutina/simeticona/alfa D-galactosidasa | 200mg/75 mg/450 GaUI/3 veces al día | 4 a 12 semanas |
| Mebeverina/simeticona | 200mg/300mg/3 veces al día | 4 a 12 semanas |
SII: síndrome de intestino irritable.
Los laxantes son alimentos o fármacos que, al ser ingeridos, actúan directamente en el intestino para aumentar la frecuencia de las deposiciones y facilitar la evacuación al mejorar la consistencia de las heces. En el manejo del SII, no todos los laxantes tienen las indicaciones ni las evidencias suficientes para recomendar su uso. Por ejemplo, los estimulantes se recomiendan para estreñimiento agudo u ocasional, pero no para el SII. Aunque las fibras dietarias tienen un efecto laxante como formadores de bolo, en este documento nos enfocaremos en particular a el uso de los laxantes osmóticos (polietilenglicol y lactulosa).
Mecanismos de acciónPolietilenglicol (macrogol 3350) es un polímero sintético no absorbible y altamente soluble que no genera absorción de sal (en contraparte del polímero 4000 de este compuesto), no presenta toxicidad en cantidades altas, y que es capaz de generar un efecto osmótico reteniendo agua en la luz intestinal, incrementando el volumen de las heces y aumentando el tránsito intestinal38.
La lactulosa es un disacárido sintético, no digerible en el tracto gastrointestinal. Al no ser digerido, llega al colon y mediante un proceso de fermentación, se produce acidificación del colon, generando un efecto irritativo con potencial de promover contractilidad del colon. El efecto más conocido de su acción es el de retención osmótica, hidratación de las heces y aceleramiento del tránsito colónico39. El inicio de acción se espera en 24-48h.
IndicacionesEl polietilenglicol está indicado para el manejo del estreñimiento asociado con el SII-E, pero no tiene efectos sobre el dolor abdominal. Aunque la lactulosa está indicada en el manejo del estreñimiento crónico, se puede utilizar también en el manejo del estreñimiento asociado con el SII-E, aunque al ser un disacárido no absorbible puede producir distensión abdominal empeorando los síntomas de los pacientes. Por otra parte, es importante mencionar que no existe evidencia para recomendar laxantes estimulantes o emolientes en el tratamiento de los pacientes con el SII-E, aunque se pueda usar como terapia de rescate.
Evidencia clínicaEl grado de evidencia que respalda a macrogol 3350 en el tratamiento de estreñimiento crónico es alta, grado I A40. Sin embargo, la evidencia clínica del uso de macrogol 3350 en el SII-E es escasa y proviene de un solo ensayo clínico con duración de 4 semanas. Este ensayo comparó macrogol 3350 con placebo teniendo como desenlace primario al incremento en el número de evacuaciones por semana, encontrando que macrogol aumentó el número de evacuaciones por semana en comparación con placebo (4.40±2.5; placebo, 3.11±1.9; p<0.0001). Se observaron valores ligeramente más bajos de dolor/distensión abdominal en los pacientes que usaron macrogol, pero esto no alcanzó significancia estadística. El dolor abdominal y la diarrea fueron los eventos adversos más frecuentes41. Con esto los autores concluyen que macrogol 3350 puede ser utilizado en el tratamiento del SII-E.
Por otra parte, no hay estudios de adecuada calidad para el uso de lactulosa en los pacientes con SII-E.
Eventos adversosEl macrogol 3350 es bien tolerado y se asocia a efectos adversos leves a moderados comparado con placebo (38.8 vs. 32.9% respectivamente) y que en ocasiones llevan a discontinuar el tratamiento. Los efectos adversos más frecuentes son la diarrea, distensión y dolor abdominal41. No se han reportado efectos adversos graves con el uso de macrogol 3350.
Disponibilidad, dosis recomendada y duración del tratamientoEn México el macrogol 3350 se encuentra en 2 presentaciones para el tratamiento de estreñimiento crónico. En forma de sobres de 17 gramos, que se disuelven en un vaso con agua y se titula la dosis a requerimiento del paciente. Se recomienda iniciar con una dosis al día y aumentarlo hasta 3 veces al día. También está la forma de frasco/polvo, en la que es posible utilizar cantidades variables para titular la dosis de manera más adecuada en situaciones donde el paciente requiere mayor o menor dosificación para obtener la respuesta. La evidencia en el SII-E es de 4 semanas. También se ha demostrado seguridad a largo plazo en estreñimiento crónico (52 semanas). Lactulosa está disponible en suspensión y existe una forma comercial de lactulosa más parafina. La dosis recomendada es una cucharada 1-3 veces al día.
AntidiarréicosEl uso de estos medicamentos puede beneficiar a algunos pacientes, sobre todo en la mejoría de la frecuencia y consistencia de las evacuaciones.
Mecanismos de acciónLa loperamida es un agonista sintético de los receptores periféricos μopioides, que inhibe la peristalsis y la actividad antisecretora y aumenta el tiempo de tránsito intestinal con penetración limitada de la barrera hematoencefálica42. La lidamidina es un agente antidiarreico que actúa como agonista en los receptores alfa 2 adrenérgicos, inhibiendo así la secreción intestinal y modificando el tiempo de tránsito intestinal43. La colestiramina es insoluble y no se absorbe por el tracto gastrointestinal. Su mecanismo de acción consiste en intercambiar iones cloruro con grupos carboxilo de los ácidos biliares en el intestino delgado, uniéndose a ellos e interfiriendo en su reabsorción por la circulación enterohepática, por lo que se usa como un secuestrador de ácidos biliares formando así complejos iónicos que son excretados por las heces44.
IndicacionesLa loperamida y la lidamidina están indicadas en los pacientes con SII-D para disminuir la frecuencia y mejorar la consistencia de las evacuaciones. La colestiramina se puede utilizar en los pacientes con SII-D con sospecha de malabsorción ileal de ácidos biliares45.
Evidencia clínicaLoperamida: Se han publicado algunos ECC con pocos pacientes y con criterios antiguos, en los que se ha evaluado la eficacia de loperamida en los pacientes con SII-D46,47. Comparada con placebo, la loperamida se asoció con un adecuado alivio del dolor abdominal (razón de riesgos [RR]: 0.41; IC 95%: 0.2-0.84), mejoría en la consistencia de las heces (RR: 0.06; IC 95%: 0.01-0.43), y mejoría global de síntomas (RR: 0.73; IC 95%: 0.29-1.86). No se ha informado mejoría en los síntomas de urgencia y no hay información acerca del impacto en la calidad de vida. Por lo tanto, la evidencia clínica con loperamida es muy baja.
Lidamidina: Existen publicaciones de algunos ECC en los que se evaluó la eficacia de la lidamidina en el SII-D; uno de ellos es un ensayo en el que participaron 72 sujetos con SII. Se sometieron a una fase de lavado de 2 semanas y posteriormente se aleatorizaron para recibir 8mg/día de lidamidina durante 2 semanas y a continuación se aumentó la dosis a 16mg/día; el otro grupo recibió placebo y posteriormente se cruzaron los grupos48. De acuerdo con este ensayo, no hubo beneficio del uso de lidamidina en el SII-D en cuanto a mejoría de la consistencia y frecuencia de las heces, así como de los síntomas globales. En un ensayo clínico, doble ciego y controlado con placebo realizado en México hace muchos años; se incluyeron 40 pacientes con criterios de Manning, coproparasitoscópico, rectosigmoidoscopia y colon por enema normales. Aleatoriamente se integraron 4 grupos de tratamiento: lidamidina con y sin psicoterapia de grupo, y placebo con y sin psicoterapia de grupo, durante 6 semanas, y posteriormente se realizó un cruce de grupos49. Fueron evaluados 38 pacientes que mostraron respuesta favorable 94.7 y 68.4% de los que recibieron solo lidamidina y placebo, respectivamente, y en quienes se adicionó psicoterapia, 84.3 y 63.2%. La diferencia con y sin psicoterapia no fue significativa. En forma global, hubo mejor respuesta con lidamidina que con placebo (89.5 vs. 65.8%; p=0.02). Con esto concluimos que la evidencia clínica de lidamidina es muy baja y su efectividad es discreta en el control de síntomas en el SII.
Colestiramina: Algunos pacientes con SII-D pueden tener sobreposición con malabsorción de ácidos biliares (aproximadamente 30%)50. Específicamente, este grupo de pacientes podría tener cierto beneficio de este medicamento. Sin embargo, no se cuenta con evidencia científica directa, ya que no hay estudios que evalúen específicamente la utilidad de colestiramina en el SII-D, y por otra parte las pruebas diagnósticas no están disponibles en todo el país y son costosas. Sin embargo, asumiendo que pueda existir malabsorción de ácidos biliares, se recomienda su uso iniciando con una prueba terapéutica.
Eventos adversosLoperamida: Los efectos adversos más frecuentes son estreñimiento, náusea, vómito, sequedad de boca, distensión abdominal, astenia, somnolencia, mareos y erupciones exantemáticas. En <1% de los niños y a dosis altas, puede ocasionar depresión del sistema nervioso central (SNC) (somnolencia, miosis, depresión respiratoria y ataxia). En caso de sobredosis puede causar depresión respiratoria. Las dosis de loperamida superiores a las recomendadas pueden causar accidentes cardiacos graves, incluyendo una prolongación del intervalo QT, torsades de pointes, otras arritmias ventriculares, paros cardiacos, síncopes y la muerte.
Lidamidina: A dosis terapéuticas, ocasionalmente se ha reportado sequedad de boca, náuseas, cefalea, mareo y estreñimiento leve y transitorio.
Colestiramina: Se han descrito efectos adversos como estreñimiento, dolor abdominal, flatulencia, vómito, diarrea, erupciones cutáneas y esteatorrea; por lo general estos efectos son poco frecuentes. Con mayor frecuencia los pacientes reportan intolerancia a la suspensión de colestiramina.
Disponibilidad, dosis recomendada y duración del tratamientoEn la tabla 3 se muestran los antidiarreicos y las dosis recomendadas que están disponibles en México.
Antidiarreicos disponibles en México para el manejo del SII
| Fármaco | Dosis recomendada | Duración |
|---|---|---|
| Loperamida | 2mg para ajustar de acuerdo con respuesta (dosis máxima 16mg/día) | 4 a 12 semanas |
| Lidamidina | 4-8mg/3 veces al día | 4 a 6 semanas |
| Colestiramina | 4g/una a 4 veces al día (polvo para suspensión) | De acuerdo con respuesta |
SII: síndrome de intestino irritable.
Se denominan agentes serotoninérgicos a los fármacos que actúan a través del agonismo o antagonismo de los receptores de la serotonina (5-HT) y que pueden ser útiles en el manejo del SII-D y el SII-E dependiendo de que receptores estimulen.
Mecanismos de acciónLa serotonina (5-HT) es un señalizador de la transmisión celular y neurotransmisor sintetizado a partir del triptófano mediante la enzima triptófano hidroxilasa (TPH). El 95% de la producción de 5-HT se lleva a cabo en las células enterocromafines del intestino y un menor porcentaje en las neuronas serotoninérgicas de los plexos mientéricos51. El paso limitante de la actividad de la 5-HT es el transportador selectivo de la recaptura de serotonina (SERT), ya que remueve a la 5-HT del espacio intersticial en la lámina propria hacia los enterocitos de la mucosa y las neuronas presinápticas, responsables de su catabolismo52. Por otra parte, existen 7 subtipos de receptores de 5-HT, entre ellos, son de importancia terapéutica para el SII, los receptores 5-HT3 y 5-HT4. Los primeros se localizan en los plexos intestinales, nervios sensoriales, nervios simpáticos y parasimpáticos; la serotonina al ligarse a los receptores 5-HT3 en los ganglios parasimpáticos, estimula la contracción del músculo liso, la secreción intestinal mediada por la liberación de acetilcolina y la sensibilidad visceral53. Los receptores 5-HT4 se localizan en las neuronas de plexos mientéricos, en aferencias primarias, células de músculo liso y enterocromafines. Estos receptores son mediadores de neurotransmisores liberados localmente que estimulan el reflejo peristáltico. Estos receptores son mediadores de la relajación y contracción del músculo liso circular y tienen efectos variables en el músculo longitudinal, así como en la secreción de fluidos en intestino delgado, y con menor extensión en el colon54. En el SII hay varios elementos de la señalización serotoninérgica que se encuentran alterados, incluyendo el número de células enterocromafines, el contenido de serotonina, los niveles de la TPH, niveles de ácido 5-hidroxiindolacético, y la expresión del SERT, cuyas variantes están determinadas genéticamente y pueden contribuir a su menor expresión en el SII-D, especialmente, lo cual disminuye la recaptura de serotonina y por consiguiente su mayor disponibilidad55.
En el SII-D se han utilizado diversos antagonistas de 5-HT3 ya que producen inactivación de las neuronas con estos receptores, disminuyendo la actividad refleja motora y la secreción, y disminuyen la despolarización de las neuronas sensoriales extrínsecas que transmiten señales hacia el cerebro.
IndicacionesEn el SII-D está indicado el uso de antagonistas de 5-HT3 ya que reducen la frecuencia de las evacuaciones, mejoran la consistencia, y disminuyen síntomas como el dolor abdominal. Por otra parte, en el SII-E se recomienda el uso de agonistas 5-HT4.
Evidencia clínicaAntagonistas 5-HT3: En cuanto a los antagonistas de 5-HT3, actualmente existen el alosetrón, ramosetrón y ondansetrón56, sin embargo, solo el último está disponible en México. En el más reciente ECC (estudio TRITON), se evaluó ondansetrón en dosis de 4.0mg/al día, el cual se ajustó en un período de 2 semanas subiendo la dosis cada 3 días hasta 8.0mg/3 veces al día, o disminuyéndola hasta un mínimo de 4.0mg/cada 3 días, en comparación con placebo57. La variable primaria fue la combinación de dolor abdominal y diarrea (de acuerdo con la Food and Drug Administration [FDA]) considerando un análisis de intención de tratar (ITT). Se calcularon 400 pacientes, sin embargo, debido a la pandemia y a la dificultad de reclutarlos, se terminó el estudio antes de tiempo, aleatorizando solo 80 pacientes (37 a ondansetrón y 43 a placebo). Posteriormente, se revisó la literatura y los datos de este ensayo se conjuntaron con los datos de los demás ensayos de ondansetrón controlados con placebo, y se llevó a cabo un metaanálisis para estimar RR, IC 95% y NNT58,59. En la ITT, 40.5% (IC 95%: 24.7-56.4%) alcanzó la variable primaria con ondansetrón vs. 27.9%; (14.5-41.3%) con placebo, (p=0.19). El ondansetrón mejoró la consistencia de las evacuaciones en comparación con placebo (p<0.001). Así mismo, ondansetrón incrementó el tiempo de tránsito total entre el valor basal y la semana 12 (promedio [DE]: 3.8 [9.1] horas, vs. placebo −2.2 [10.3] horas, [p=0.01]). En cuanto al metaanálisis, se identificaron 2 estudios adicionales, uno de ellos cruzado de 10 semanas, pero para este metaanálisis, los autores solo obtuvieron los datos de las 5 primeras semanas del ensayo59. Con los pacientes del TRITON y los de estos 2 ensayos adicionales, se analizó un total de 327 pacientes en el metaanálisis. Se demostró que el ondansetrón fue superior al placebo en la variable de desenlace compuesta de la FDA (RR para no respuesta de los síntomas: 0.86; IC 95%: 0.75-0.98; NNT=9), y la respuesta en las evacuaciones fue (RR: 0.65; 0.52-0.82, NNT: 5). Sin embargo, no hubo diferencias en dolor abdominal (RR: 0.95; 0.74-1.20).
Agonistas 5-HT4: El citrato de mosaprida, es un agonista selectivo de receptores 5-HT4 cuyo metabolito principal es un antagonista ligero 5-HT3. En un estudio piloto de 10 pacientes con SII-E con base en criterios de Roma III, se analizó la relación de tiempo de tránsito intestinal con síntomas, antes y después del tratamiento con 15mg de mosaprida, una vez al día después del desayuno, por 4 semanas60. La variable primaria fue la correlación de los cambios sintomáticos de SII-E con los cambios del tiempo de tránsito. Los cambios sintomáticos fueron la gravedad del dolor abdominal, la escala de Bristol y el tiempo para evacuar. Luego de 4 semanas, la frecuencia de síntomas abdominales (3.7 a 2.6), la gravedad de dolor abdominal (3.8 a 2.0), disminuyeron de acuerdo con las escalas utilizadas. Así mismo, la consistencia de las evacuaciones aumentó de 2.5 a 3.5 de acuerdo con la escala de Bristol, y se aumentó la frecuencia de las evacuaciones predominando los pacientes que reportaron al menos una evacuación al día. Así mismo, estos cambios correlacionaron significativamente con el tránsito gástrico, pero no con el tránsito intestinal60. Otro estudio evaluó la función sensorimotora en 37 pacientes con SII Roma II y 17 controles y todos fueron sometidos a una prueba con baróstato para determinar la percepción al dolor61. Posteriormente, los pacientes con SII fueron aleatorizados a tomar mosaprida 15mg (n=19) o placebo (n=18) por vía oral con 200ml de agua y la percepción y la motilidad se evaluaron nuevamente a los 60min postratamiento. El tono y la contractilidad del rectosigmoides se determinaron cada 10 minutos. El umbral al dolor fue significativamente menor en el SII que en controles, pero no hubo diferencias en los parámetros sensoriomotoras entre los pacientes asignados a mosaprida o controles. Sin embargo, el volumen de la bolsa disminuyó y el número de contracciones aumentó en comparación con placebo, pero no modificó la percepción. Específicamente en los pacientes con SII-E asignados a mosaprida (9/19), mostraron un aumento significativo en el tono del rectosigmoides y en las contracciones, en comparación con el placebo61. Estos datos sugirieron que la mosaprida tiene un potencial de manejo del estreñimiento en los pacientes con SII-E.
Otro estudio aleatorizó 285 pacientes con SII sin diarrea según criterios de Roma III, a una combinación de probióticos (Bacillus subtilis y Streptococcus faecium) en una de 4 dosis, y mosaprida (10mg/día en los 2 grupos con dosis bajas de probióticos y 15mg/día en los 2 grupos con dosis más altas de probióticos) o placebo, por 4 semanas62. Comparado con placebo, la mejoría adecuada fue significativamente superior en todos los grupos de tratamiento (53.6 a 55.2%) en comparación con el placebo (35.1%). Así mismo, la mejoría global completa o la mejoría considerable fueron superiores en los grupos de tratamiento que con el placebo. El dolor/malestar abdominal mejoró significativamente en el grupo con dosis más alta de tratamiento vs. placebo, y en los pacientes con SII-E, la mejoría de la frecuencia y consistencia de las evacuaciones fueron superiores en los grupos con las dosis más alta y baja, pero no en los intermedios.
En cuanto a la prucaloprida, este es otro agonista selectivo de receptores 5-HT4 con efectos coloquinéticos que ha sido aprobado para el estreñimiento crónico.63 Sin embargo, una revisión retrospectiva llevada a cabo en Sheffield en Gran Bretaña, analizó todos los pacientes que recibieron tratamiento con prucaloprida por al menos 4 semanas para determinar si había alguna asociación de la respuesta con el tipo de estreñimiento (estreñimiento de tránsito lento: 44%, estreñimiento obstructivo: 29%, combinación: 12% o SII-E: 15%)63. Identificaron 69 pacientes tratados, 59 eran mujeres, y el 65% de las recetas fueron de cirujanos colorrectales. Se consideró una respuesta positiva en caso de la satisfacción del paciente y la continuación del tratamiento. A las 4 semanas el 31, 59, 43 y 44% de los grupos anteriores respectivamente, reportaron mejoría de los síntomas, lo que indica que el grupo de estreñimiento no predice la respuesta positiva. En 2017 se publicó un análisis del diagnóstico y manejo de 878 pacientes consecutivos con estreñimiento en Italia, la información fue colectada por 52 gastroenterólogos del país64. Los pacientes fueron clasificados en estreñimiento crónico, SII-E y estreñimiento no relacionado con criterios de Roma. Prucaloprida fue recetada al 14.4% de los pacientes, sin diferencias en los grupos. Esta baja frecuencia se puede atribuir a que, en el año del estudio, apenas se hizo disponible la prucaloprida en ese país, además de su alto costo, por lo cual se utilizó como un tratamiento de segunda línea. Sin embargo, esta revisión retrospectiva no determinó predictores de respuesta al tratamiento por lo cual no se puede sacar conclusiones sobre su efectividad en el SII-E.
En 2014 se publicaron los datos acumulados de los ensayos de fase III de prucaloprida en estreñimiento crónico, en mujeres tratadas con 2mg al día de este procinético65. Datos de 936 mujeres mostraron que prucaloprida tuvo un alto tamaño del efecto (>0.8) en todas las escalas de la evaluación del paciente de los síntomas del estreñimiento (PAC-SYM, por sus siglas en inglés) incluyendo dolor abdominal, malestar abdominal, distensión subjetiva, pujo, y evacuaciones dolorosas. Para los síntomas abdominales y de las evacuaciones, el tamaño del efecto con prucaloprida 2mg fue mayor en 1.3 a 2.3 veces que con el placebo. Mucho más recientemente, un análisis post hoc de los pacientes con EC con distensión subjetiva moderada a grave incluidos en 6 estudios de fase 3 y 4, demostró que la proporción de respondedores (≥1 punto de mejoría en la escala de distensión subjetiva a la semana 12) fue prucaloprida que con placebo (62.1 vs. 49.6%)66.
Los datos anteriores muestran que prucaloprida es frecuentemente utilizada en la práctica clínica de los pacientes con SII-E. Si bien no hay ensayos clínicos específicos en el SII-E, la mejoría de dolor, malestar abdominal y distensión subjetiva en pacientes con estreñimiento crónico, sugieren que también tiene el potencial de mejorar estos síntomas claves del SII-E. Mas aún, Roma IV considera al estreñimiento crónico y el SII-E como los extremos de un espectro y la diferenciación es artificial, así que no se puede determinar si muchos de los pacientes incluidos en estos ensayos clínicos, en realidad tengan SII-E. Finalmente, debido a que no son ensayos en el SII-E, tampoco se puede proveer un NNT.
Eventos adversosEn el TRITON, no se reportaron efectos adversos serios con ondansetrón, sin embargo, una mayor proporción de los pacientes tratados con este agente presentó estreñimiento en comparación con el placebo (45.9 vs. 25.6%), aunque en general fue leve; y solo 3% con ondansetrón y uno con placebo reportaron estreñimiento grave. Así mismo, un paciente en cada grupo descontinuó el tratamiento por el estreñimiento. Adicionalmente, mediante interrogatorio directo, se reportó sangrado rectal en 3 pacientes con ondansetrón y en 7 con placebo, considerándolo como un efecto menor, excepto en uno de los casos con placebo, pero en ninguno de ellos se juzgó necesario realizar una rectosigmoidoscopia.
En cuanto a los agonistas 5-HT4, en los estudios analizados anteriormente con mosaprida, los 2 estudios mecanísticos no mostraron efectos adversos, pero fueron ensayos con dosis única. En cuanto a prucaloprida en los ensayos pivotes en estreñimiento crónico, los efectos secundarios fueron muy frecuentes (71.4 a 80.2 vs. 67.1 a 78.4%); y los más frecuentemente reportados fueron cefalea hasta en un 29% de los pacientes y dolor abdominal en uno de cada 5 pacientes.
Disponibilidad, dosis recomendada y duración del tratamientoEn la tabla 4 se muestran los agentes serotoninérgicos y las dosis recomendadas que están disponibles en México.
Agentes con acción en receptores de serotonina disponibles en México para el manejo del SII
| Fármaco | Dosis recomendada | Duración |
|---|---|---|
| Ondansetrón | 4mg (media tableta) al día, hasta 8mg (una tableta) 3 veces al día; o disminuir hasta 4mg intercalados con días sin tratamiento de acuerdo con la respuesta | 12 semanas, pero luego se puede utilizar por períodos según necesidad |
| Mosaprida | 15mg repartidos en 3 tomas al día, antes o después de los alimentos. Se puede disminuir a 7.5mg en 3 tomas | 4 -12 semanas |
| Prucaloprida | 1 a 2mg con el desayuno | 12 semanas o más |
SII: síndrome de intestino irritable.
Los secretagogos son un grupo de fármacos utilizados específicamente en el SII-E y el estreñimiento crónico. Estos medicamentos actúan aumentando la secreción de fluidos en el intestino, lo que ayuda a suavizar las heces y promueve un tránsito intestinal más regular y fácil. Entre los secretagogos se encuentran lubiprostona, linaclotida, plecanatida. Solo los 2 primeros se han comercializado en México, pero en la actualidad linaclotida es el único disponible.
Mecanismos de acciónLinaclotida: Es un péptido de 14 aminoácidos, estructuralmente similar a las hormonas endógenas humanas guanilina y uroguanilina, y funcionalmente análogo a la enterotoxina termoestable de cepas patógenas de Escherichia coli (E. coli). La linaclotida actúa como un agonista potente y altamente selectivo de la guanilato ciclasa-2C (GC-2C) y sus metabolitos activos se unen a los receptores transmembrana GC-C y funcionan localmente en la superficie luminal de la mucosa, en el revestimiento epitelial del intestino67,68. La activación de GC-C condiciona niveles elevados de monofosfato de guanosina cíclico (cGMP) intracelular y extracelular. Las concentraciones elevadas de cGMP intracelular estimulan la secreción de electrolitos, cloruro y bicarbonato, hacia la luz del intestino, principalmente mediante la activación del canal de iones llamado regulador de la conductancia transmembrana de la fibrosis quística (CFTR); además, e inhiben la absorción de sodio, produciendo aumento del contenido de líquido intestinal y acelerando el tránsito. Por otra parte, las concentraciones elevadas de cGMP a nivel extracelular en la submucosa, inhiben los nociceptores colónicos mejorando el dolor abdominal69.
Lubiprostona: Es un ácido graso bicíclico derivado de un metabolito de la prostaglandina E1 (PGE1) que activa un canal de cloruro específico de tipo 2 (ClC-2) en la membrana apical del enterocito70,71. Una vez que los canales se abren, el cloruro ingresa al enterocito en la membrana basal mediante la acción de los co-transportadores Na+ K+ 2Cl activos, que crean la fuerza impulsora que favorece la secreción de cloruro. Específicamente, un ion sodio y un ion potasio ingresan a la célula junto con cada 2 iones de cloruro. Los equilibrios isoeléctrico e isotónico continúan manteniéndose cuando los iones de sodio y el agua, respectivamente, siguen a los iones de cloruro hacia la luz intestinal a través de la vía paracelular, lo que lleva a un aumento general de la secreción de líquido intestinal dependiente de la concentración, sin alterar los niveles séricos de sodio y potasio72. Este flujo de iones de cloruro a su vez conduce a la secreción neta de líquido en la luz del intestino, aumentando el contenido líquido de las heces y mejorando el tránsito. Aunque hay evidencia suficiente sobre el mecanismo primario de acción de la lubiprostona como agente prosecretor en el estreñimiento, su(s) mecanismo(s) exacto(s) de acción para mejorar los síntomas (incluido el dolor abdominal) en el SII-E, solo están parcialmente caracterizados73.
IndicacionesLinaclotida y lubiprostona están aprobados para el manejo del SII-E en México.
Evidencia clínicaLinaclotida: La evidencia para el uso de este fármaco es adecuada y la mayoría de las guías lo consideran como una intervención con grado de evidencia A1. Uno de los ECC que incluyó a 420 pacientes con SII-E durante 12 semanas, evaluó la eficacia y seguridad de la linaclotida oral en dosis de 75, 150, 300 o 600μg. Se reportó que todas las dosis de linaclotida mejoraron significativamente el hábito defecatorio, incluyendo la frecuencia de las evacuaciones espontáneas, la severidad del esfuerzo defecatorio y la consistencia de las heces74. El dolor abdominal disminuyó significativamente desde el inicio, en comparación con el placebo; los cambios promedio en el dolor abdominal (evaluado en una escala de 5 puntos) desde el inicio fueron −0.71, −0.71, −0.90 y −0.86 para las dosis de linaclotida de 75, 150, 300 y 600μg, respectivamente, en comparación con −0.49 para el placebo. En otro ensayo de fase 3, se evaluó la eficacia y seguridad de la linaclotida en 804 pacientes con SII-E durante 26 semanas75. Se asignaron al azar para recibir placebo o 290μg de linaclotida una vez al día. Durante las primeras 12 semanas, se reportó 33.7% de mejoría significativa de los síntomas (definida por la FDA como el incremento de ≥1 evacuación espontánea completa por semana desde el inicio del tratamiento y una reducción de ≥30% en el puntaje promedio del dolor abdominal por semana durante el 50% de las semanas de tratamiento) en el grupo de linaclotida vs. 13.9% en el grupo placebo (p<0.0001), con un NNT de 5.1 (IC 95%: 3.9-7.1)75. En ensayos subsecuentes se ha demostrado que linaclotida en dosis de 290μg durante 12 semanas reduce significativamente el dolor abdominal (≥30%) y aumenta consistentemente el número de evacuaciones espontáneas76.
Lubiprostona: La eficacia terapéutica de la lubiprostona ha sido evaluada en múltiples ensayos, incluyendo un estudio realizado en población mexicana77. En el estudio pivote de Johanson et al.78, 195 pacientes recibieron dosis diarias de 16μg [8μg/2 veces al día (BID)], 32 (16μg BID) o 48μg (24μg BID) de lubiprostona o placebo BID durante 3 meses. Después de 2 meses, todos los grupos de lubiprostona mostraron mejoras significativamente mayores en las puntuaciones medias de malestar/dolor abdominal (p≤0.039), pero las dosis mayores a 16μg se asociaron a mayores náuseas. En todos los estudios posteriores y de acuerdo con un metaanálisis de 9 ensayos con un total de 1,468 sujetos que recibieron lubiprostona y 841 que recibieron placebo, se ha demostrado que lubiprostona mejora significativamente la intensidad de los síntomas de estreñimiento, la consistencia de las evacuaciones y la calidad de vida79. Se estima que el NNT con lubiprostona es de 4 (IC 95%: 3-6)80. En el estudio mexicano que incluyó a 211 pacientes, se reportó una mejor respuesta dentro de las 24h después de la primera dosis con lubiprostona en comparación con placebo (60.0 vs. 41.5%; OR: 2.08: IC 95%: 1.19-3.62; p=0.009), además de que lubiprostona también mostró una mejora significativa con respecto al esfuerzo, la consistencia de las heces y la distensión abdominal77.
Eventos adversosLinaclotida: El efecto adverso más común es la diarrea81,82. Durante la vigilancia poscomercialización, se han informado casos de diarrea grave asociada con deshidratación. La deshidratación se manifestó con taquicardia, hipotensión, mareos, síncope y alteraciones electrolíticas (hipocalemia, hiponatremia), lo que requirió hospitalización y terapia de fluidos intravenosos. La diarrea generalmente comienza durante las primeras 2 semanas de iniciar la terapia con linaclotida. La frecuencia de diarrea grave es mayor entre los pacientes que reciben dosis más altas y requieren suspensión de la dosis, reducción de la dosis o interrupción del tratamiento con linaclotida. Otros efectos secundarios comunes son dolor abdominal, flatulencia, distensión abdominal, urgencia para defecar, incontinencia fecal, gastroenteritis viral y cefalea.
En general, el efecto adverso más común es la náusea. En un estudio la incidencia de náuseas en los pacientes tratados con lubiprostona varió entre el 11.4 y el 31.1%. Los pacientes informaron que la severidad de náuseas fue de leve a moderada, y se reportó con mayor frecuencia en los primeros 5 días de tratamiento83. La náusea parece estar relacionada con la dosis y puede deberse al retraso en el vaciamiento gástrico84. Cuando la lubiprostona se administra con alimentos, la náusea parece disminuir. También se demostró que, entre los hombres y los pacientes de edad avanzada, la incidencia de náuseas fue menor (8.2 y 18.8%, respectivamente)85.
Disponibilidad, dosis recomendada y duración del tratamientoEn México la linaclotida se comercializa en forma de cápsulas con una cubierta de gelatina dura con presentación de 290μg administración oral. Si bien esta es la dosis para el SII, mientras que la dosis para EC es la de 145μg, pero esta presentación ya no se encuentra disponible en nuestro país, lo que dificulta ajustar la dosis, especialmente en los pacientes que presentan diarrea excesiva con 290μg.
La dosis recomendada de lubiprostona para el SII-E es de 8μg/2 veces al día/por 4 a 12 semanas, pero este fármaco ya no está disponible en México.
Antibióticos no absorbibles (rifaximina)La rifaximina alfa es un antibiótico no absorbible que ha demostrado eficacia y seguridad en el manejo del SII86.
Mecanismo de acciónDerivada de la rifamicina, la rifaximina-alfa es un antibiótico sintético, bactericida, de amplio espectro, no absorbible que inhibe la síntesis del RNA bacteriano por su unión con la subunidad beta de la RNA polimerasa bacteriana DNA dependiente87. La rifaximina tiene distintos cristales polimorfos denominados con letras griegas: α, β, γ, δ, ɛ, los cuales son hidratos de rifaximina con diferente contenido de agua. Los distintos polimorfos de rifaximina muestran diferentes perfiles de solubilidad y biodisponibilidad que se traducen en variaciones en la absorción predecibles. Debido a que las secreciones gástricas no inactivan a rifaximina alfa, por su escasa absorción oral, no requiere ajustes en los pacientes con falla hepática o con insuficiencia renal. Su biodisponibilidad es <0.4% después de su administración oral, aproximadamente 97% de la dosis se excreta sin cambios en las heces, encontrándose 0.32% de la dosis en orina, (quitar la coma) y sin niveles detectables en bilis ni leche materna88. Una de las bases racionales para usar rifaximina alfa en el SII es el hecho de que algunos pacientes pueden tener asociado sobrepoblación bacteriana del intestino delgado. Además del efecto antibiótico tradicional de la rifaximina se ha descrito que esta molécula tiene efectos moduladores positivos (eubióticos) sobre la microbiota intestinal. Por ejemplo, Soldi et al.89 evaluaron, con técnicas de metagenómica, el efecto de 1,650mg diarios de rifaximina por 14 días sobre la microbiota fecal en 15 pacientes con SII, encontrando un incremento en la abundancia de Faecalibacterium prausnitzii, Bacteroidaceae y Prevotellaceae, y reducción de Clostridiaceae y Streptococcaceae, sin un impacto significativo en la composición global de la microbiota intestinal. De la misma manera, Ponziani et al.90 investigaron con técnicas de metagenómica la composición de la microbiota en los pacientes con diversos trastornos gastrointestinales demostrando un cambio significativo en la composición total de la microbiota, y un incremento en la abundancia de Lactobacilli.
IndicacionesLa rifaximina alfa está indicada en los pacientes con SII-D y/o SII-M. Se ha descrito que mejora además la distensión abdominal, las flatulencias e incluso la urgencia para evacuar.
Evidencia clínicaLa rifaximina alfa ha sido ampliamente estudiada en los ensayos clínicos de fase 3 TARGET 1 y TARGET 2, demostrando que, en los pacientes con SII sin estreñimiento, el tratamiento con rifaximina durante 2 semanas se asoció con un alivio significativo de los síntomas del SII, la distensión abdominal, el dolor abdominal y las heces sueltas o acuosas91. Un metaanálisis de 5 ECC con placebo (N=1,803 sujetos con SII/SII-D) que incluyó datos de TARGET 1 y TARGET 2, informó que el 42.2% de los pacientes tratados con rifaximina frente al 32.4% de los que recibieron placebo lograron una mejoría global de los síntomas del SII (RM=1.57)92. Con base a estos estudios se estima un NNT de 1 en 10. El estudio TARGET 3 demostró que el retratamiento con rifaximina fue efectivo y bien tolerado en los pacientes con síntomas recurrentes de SII93. Un subanálisis del TARGET 3 también mostró que, de 2,438 pacientes, el 56.8% tuvo una respuesta al dolor abdominal con rifaximina (≥30% de mejora desde el inicio en la puntuación media semanal del dolor abdominal durante ≥2 de las primeras 4 semanas después del tratamiento)94. Además, después del primer tratamiento, significativamente más pacientes tratados con rifaximina fueron respondedores al dolor abdominal (53.9%) en comparación con el placebo (44.4%), con resultados similares después del segundo tratamiento (52.9 vs. 44.7%, respectivamente). Después de TARGET 3, otro ensayo en 2,579 pacientes con SII amplió esos hallazgos al mostrar que el tratamiento repetido con rifaximina (550mg/2 veces al día/durante 2 semanas) mejoró la calidad de vida relacionada con el SII95.
Eventos adversosLa evaluación farmacológica y los experimentos realizados han sido suficientemente precisos para permitir una evaluación adecuada de la toxicidad de la polimorfa alfa de la rifaximina (no así de otros polimorfos) particularmente en vista de su muy limitada absorción oral. Se han informado muy pocos efectos adversos (<1%) durante el tratamiento breve con el fármaco, siendo el más frecuentemente de naturaleza gastrointestinal (por ejemplo, flatulencias, náuseas, dolor abdominal y vómitos).
Una evaluación de la seguridad de la rifaximina en los ensayos clínicos informó que, según datos de estudios retrospectivos y prospectivos, no hubo diferencias significativas en la incidencia de efectos adversos entre rifaximina y el comparador91–95. En general, solo alrededor del 6% de los efectos adversos informados fueron graves, y entre estos, solo el 0.1% estuvo relacionado con rifaximina.
Disponibilidad, dosis recomendada y duración del tratamientoEn México, la rifaximina alfa está disponible en tabletas de 200, 400 y 550mg. En el SII sin estreñimiento la dosis recomendada es de 550mg TID por 14 días. En caso de mejoría sintomática con el primer tratamiento y que existan recurrencia de síntomas dentro de las 18 semanas, se puede repetir el tratamiento, cuantas veces sea necesario.
ProbióticosRecientemente, múltiples estudios han demostrado la importancia de la microbiota intestinal en la fisiopatología del SII y han promovido el uso de tratamientos como los prebióticos, probióticos, simbióticos, antibióticos (revisados previamente), y el trasplante de microbiota fecal, cuyos objetivos son modular la composición y/o funciones de la microbiota intestinal96. Los probióticos son microorganismos vivos que, administrados en cantidades adecuadas, confieren beneficios para la salud del huésped97. Por otro lado, se denomina prebióticos a componentes dietéticos no digeribles, generalmente fibras, que promueven el crecimiento y/o la actividad de microorganismos beneficiosos en el intestino97. Los simbióticos son combinaciones de probióticos y prebióticos que actúan sinérgicamente97. El trasplante de material fecal consiste en la transferencia de materia fecal de un donante sano a un receptor con el objetivo de restablecer la disbiosis. Debido a que los prebióticos y simbióticos no se consideran terapias farmacológicas y la evidencia de su uso en el SII es nula no se abordaran en este documento. Por otro lado, aunque existen estudios del trasplante de material fecal en el SII, esta terapia no farmacológica no está aprobada aún para su uso. Así pues, en este documento solo abordaremos la evidencia con probióticos.
Mecanismos de acciónLos mecanismos por los cuales los probióticos pueden influir en la fisiopatología del SII incluyen la regulación de la motilidad intestinal, reducción de la hipersensibilidad visceral, disminución de la activación inmune de la mucosa, mejoría de la permeabilidad intestinal, e incremento en la comunicación intestino-cerebro98. La mayoría de estos efectos se han demostrado en estudios in vitro o en animales de experimentación y son muy escasos los estudios mecanísticos de probióticos en humanos. Se ha demostrado que Bifidobacterium lactis DN-173 mejoró los síntomas y el tránsito orocecal en los pacientes con SII-E99. Lactobacillus paracasei NCC2461, Lactobacillus acidophilus NCFM, E. coli Nissle 1917, mejoraron el dolor abdominal y redujeron la hipersensibilidad visceral en humanos y en animales, modulando la expresión de neurotransmisores como la sustancia P o de receptores implicados en la nocicepción como el receptor opioide μ1 o el cannabinoide 2100,101. Bifidobacterium infantis 35624 mejoró los síntomas del SII y aumentó la relación de interleucina antiinflamatoria IL-10/proinflamatoria IL-12 en los pacientes con SII102,103. La combinación de probióticos como el VSL#3 (L. casei subsp. paracasei, L. plantarum, L. acidophilus, L. delbrueckii subsp. bulgaricus, B. longum, B. infantis, B. breve y Streptococcus thermophilus) redujo la secreción de citocinas intestinales y mejoró la función de barrera intestinal en modelos animales de inflamación intestinal104, mientras que E. coli Nissle 1917 restauró la permeabilidad intestinal in vitro inducida por sobrenadantes fecales de los pacientes con SII105. El Bifidobacterium longum NCC3001 mejoró los puntajes de depresión en los pacientes con SII-D o SII-M asociados con reducción en la actividad de la amígdala cerebral demostrada en estudios de neuroimagen106.
La restauración de la microbiota en los pacientes con SII es un mecanismo potencial de los probióticos22–28. Sin embargo, el número de estudios que han evaluado el papel de los probióticos en la restauración de la disbiosis en el SII es muy limitado29–31. Por lo tanto, el posible mecanismo de acción de los probióticos de modular la microbiota intestinal en los pacientes con SII permanece aún poco definido y requiere de mayor investigación32.
IndicacionesDebido a la heterogeneidad de los estudios y a la rigidez metodológica con la que se han conducido muchos de estos, el uso de probióticos en la práctica clínica en el tratamiento del SII se considerado aún controvertido y los estudios de baja calidad. En la tabla 5 se enlistan las Guías de Práctica Clínica (GPC) de las principales asociaciones de gastroenterología sobre el uso de probióticos en SII publicadas en los últimos 5 años en el mundo occidental107. En resumen, las GPC americanas del Colegio Americano de Gastroenterología (ACG)108 y de la Asociación Americana de Gastroenterología (AGA)109, no recomiendan el uso de probióticos en el SII, mientras que la GPC británica110, canadiense111, y los consensos mexicanos25,112, recomiendan el uso de probióticos para el manejo de síntomas globales y el dolor abdominal por un tiempo limitado a 4 o 12 semanas y suspenderse en caso de falta de respuesta clínica.
Recomendaciones para el uso de probióticos de acuerdo con las diferentes guías de práctica clínica
| Guía de práctica clínica | Recomendaciones | Nivel de evidencia |
|---|---|---|
| CAG guía en SII 2019 | Sugiere ofrecer probióticos a los pacientes con SII para mejorar los síntomas del SII (por un mes) | Enfoque GRADERecomendación condicionalNivel muy bajo de evidencia |
| AGA guía en probióticos 2020 | Solo se recomiendan en el contexto de un ensayo clínico | Enfoque GRADESin recomendaciones |
| BSG guía en SII 2021 | Para los síntomas globales y el dolor abdominal | Enfoque GRADERecomendación débilNivel muy bajo de evidencia |
| ACG guía en SII 2021 | En contra del uso de probióticos para los síntomas globales | Enfoque GRADERecomendación condicionalNivel muy bajo de evidencia |
| WGO guía en probióticos 2023 | Para el alivio de distensión y flatulencia. Algunas cepas específicas en dolor abdominal | Oxford: 2 y 3 |
ACG: Colegio Americano de Gastroenterología; AGA: Asociación Americana de Gastroenterología; BSG: Sociedad Británica de Gastroenterología; CAG: Asociación Canadiense de Gastroenterología; SII: síndrome de intestino irritable; WGO: Organización Mundial de Gastroenterología.
Varias revisiones sistemáticas y metaanálisis han mostrado que los probióticos tienen un efecto limitado, pero significativamente superior al placebo en el manejo de los síntomas del SII113. Ford et al.114 evaluaron 53 ECC en 5545 pacientes con SII. Treinta y siete de estos ensayos fueron elegidos para el análisis (21 evaluaron la combinación de probióticos) en un total de 4403 pacientes, con un rango: 16 a 391 sujetos por estudio. Las combinaciones de probióticos tuvieron un efecto benéfico en la persistencia de síntomas, estadísticamente superior al placebo (RR: 0.79; IC 95%: 0.68-0.91), pero con una heterogeneidad significativa (I2: 72%) y un NNT de 7. En comparación con las especies combinadas, las especies únicas de probióticos tuvieron un menor impacto en el tratamiento del SII. En 33 ensayos se valoró el impacto sobre el dolor abdominal. Un efecto modesto se observó con la combinación de probióticos, y no hubo diferencias con el placebo en los ensayos. Veinticuatro estudios reportaron el efecto sobre la distensión abdominal. Hubo una tendencia a la reducción del puntaje de distensión con la combinación de probióticos. En 11 ensayos se observó que la combinación de probióticos redujo significativamente el puntaje de flatulencia, pero no con ninguno de los otros probióticos estudiados. La urgencia fue evaluada en 8 ensayos y no se observaron efectos benéficos aparentes con algún probiótico. Existen pocos estudios con una muestra grande de los pacientes, con desenlaces bien definidos, en los cuales se usaron cepas de probióticos específicos. En uno de ellos Whorwell et al.115 evaluaron en un ECC, 3 dosis diferentes de Bifidobacterium infantis 35624 versus placebo en 362 pacientes con SII en atención primaria por 4 semanas. Los resultados mostraron una mejoría global de los síntomas, del dolor y la distensión abdominal a la dosis de 1×108 unidades formadoras de colonias (ufc) en comparación con el placebo. En otro estudio, Spiller et al.116 investigaron el efecto de Saccharomyces cerevisiae I-3856 (1000mg/diarios) en 379 pacientes con SII vs. placebo, por 12 semanas. Los autores no mostraron un efecto benéfico del probiótico contra el placebo en la población estudiada, sin embargo, en el subanálisis de pacientes con SII-E, esta cepa de S. cerevisiae fue superior al placebo en la mejoría del dolor y distensión abdominal. Es importante resaltar que no todos los probióticos son similares ni producen los mismos resultados, su efectividad es cepa específica y síntoma-específico.
Con estas evidencias resulta difícil establecer recomendaciones puntuales para el uso de probióticos en el SII debido a la heterogeneidad en los ensayos clínicos, las múltiples combinaciones y cepas utilizadas y la inconsistencia en los beneficios de estos agentes en los síntomas individuales y la falta de estudios con desenlaces rigurosos basados en los criterios de FDA o la Agencia Europea de Medicamentos (EMA) para el SII.
No obstante, en la práctica clínica del mundo real, los médicos recomiendan los probióticos para el tratamiento del SII, sin considerar los niveles bajos de evidencia para su uso. Por ejemplo, Rangan et al.117 encuestaron a 302 médicos americanos, gastroenterólogos y médicos generales que atienden pacientes con SII, y a 3254 sujetos con criterios de Roma III para el SII. Los resultados mostraron que el 77% de los pacientes con SII usan tratamientos sin prescripción médica y solamente el 15% están «muy satisfechos» con el tratamiento. Interesantemente, el 70% de los médicos encuestados recomiendan probióticos para el manejo del SII probablemente por su bajo costo, buen perfil de seguridad y eficacia percibida, a pesar de que la evidencia es de baja calidad. Valdovinos et al.118 encuestaron a 997 gastroenterólogos y nutricionistas mexicanos sobre el uso de probióticos en la práctica clínica. El 64. 9% de los encuestados usa frecuentemente los probióticos, 31.7% rara vez los utiliza y solo el 3.6% nunca los recomienda. El 81.2% de los gastroenterólogos y nutricionistas consideran que los probióticos son eficaces en el manejo del SII. El 7% reportaron desconocer la evidencia científica sobre la utilidad de los probióticos en trastornos gastrointestinales.
Eventos adversosAunque los probióticos se perciben como inocuos y seguros, además de que en los ensayos clínicos no se ha reportado mayor incidencia de efectos adversos cuando se comparan contra placebo, es importante mencionar que sí existen algunas precauciones en el uso de estos. Por ejemplo, se ha reportado sepsis y endocarditis asociadas a algunas cepas de probióticos como (Saccharomyces y Lactobacilos) cuando se usa en los pacientes inmunocomprometidos o existe contaminación de accesos vasculares119,120. Recientemente se han reportado síntomas como mente obnubilada y fatiga crónica como consecuencia quizás de un aumento de la producción de ácido láctico121.
Disponibilidad, dosis recomendada y duración del tratamientoAunque en México existen muchas formulaciones de probióticos, en la tabla 6 se mencionan las cepas específicas que han demostrado eficacia con estudios de buena calidad. Las dosis recomendadas varían de acuerdo con cada cepa y la duración recomendada es entre 4 y 12 semanas. En caso de optar por el uso de probióticos es importante destacar que se recomienda como terapia adyuvante y no como monoterapia.
Probióticos recomendados en México para el manejo del SII
| Cepa probiótica | Dosis recomendada | Duración |
|---|---|---|
| Bifidobacterium longum subsp. longum 35624 | 108 UFC Una vez al día | 4-12 semanas |
| Saccharomyces cerevisiae I-3856 | 500mg (8×109 UFC)Una vez al día | 4-12 semanas |
SII: síndrome de intestino irritable; UFC: unidad formadora de colonias.
Dentro de las opciones que se han explorado para el manejo del SII, existen un grupo de intervenciones que se consideran terapias alternativas a base de extractos de plantas (solas o en combinación), dentro de las cuales destacan el STW 5 y el aceite de menta piperita.
Mecanismo de acciónSTW 5: Es un fitofármaco que contiene extractos hidro-etanólicos de 9 hierbas combinadas en una proporción fija (Iberis amara totalis recens, Angelicae radix, Cardui mariae fructus, Chelidonii herba, Liquiritiae radix, Matricariae flos, Melissae folium, Carvi fructus y Menthae piperitae folium), que ha sido comercializado en Europa como medicamento de libre venta para el alivio de la dispepsia y el SII desde la década de los años sesenta122,123. El STW 5 se considera un agente terapéutico multipropósito, ya que ha mostrado actuar sobre diversos blancos terapéuticos en forma simultánea124,125. En modelos farmacológicos in vitro se ha demostrado que tiene efecto dual (relajante y tonificante) sobre el músculo liso del intestino delgado126, produce relajación del músculo liso del colon, ejerce efectos prosecretores127, antiinflamatorio y antioxidante en el intestino128, y mejora la hipersensibilidad visceral129. Estudios más recientes han demostrado que el STW 5 ejerce efectos benéficos en modelos inducidos de disbiosis intestinal a través de 3 rutas diferentes: una mayor producción microbiana de ácidos grasos de cadena corta, una producción microbiana de metabolitos potencialmente bioactivos de los componentes del fitofármaco y mediante la proliferación de bacterias benéficas130,131.
Menta piperita: La menta piperita es una planta híbrida de la menta acuática (Mentha aquatica) y la hierbabuena (Mentha spicata) perteneciente a la familia taxonómica Lamiaceae, que está ampliamente distribuida en las regiones templadas del mundo. Tiene una amplia variedad de aplicaciones en la medicina tradicional y también se utiliza como agente aromatizante y té funcional.132 El aceite de menta piperita es volátil y su principio activo es el mentol que tiene propiedades antiespasmódicas debido a su capacidad para bloquear los canales de calcio del músculo liso intestinal133. Aunque sus beneficios clínicos se han atribuido al efecto antiespasmódico, existe evidencia de otros posibles mecanismos de acción, entre los que destacan modulación de la sensibilidad visceral y central, efectos antioxidantes, antiparasitarios, antifúngicos, moduladores de la microbiota y antiinflamatorios directos134–136. Incluso existen estudios en humanos que han demostrado que la inhalación del aroma de menta mejora la atención y estudios en roedores que sugieren que el mentol tiene efectos ansiolíticos dependientes de la dosis a través de las vías de la dopamina137. El aceite de menta ejerce efectos sobre la función esofágica, gástrica, del intestino delgado, de la vesícula biliar y del colon, por lo que su aplicación clínica en la gastroenterología es potencialmente amplia y ha mostrado una rápida expansión138,139.
IndicacionesSTW 5: Está indicado en el control sintomático del SII y de la dispepsia funcional (DF)122–124. Por lo tanto, el perfil del paciente que mayor beneficio puede obtener del fitofármaco es aquel con síndrome de sobreposición entre el SII y DF. Los estudios clínicos han demostrado que el STW 5 es significativamente mejor que el placebo para reducir el dolor abdominal y los índices compuestos de síntomas globales en el SII. Los estudios clínicos realizados con STW 5 no establecen diferencia entre los diferentes subtipos del SII.
Aceite de menta piperita: Esta indicado para el control de los síntomas generales y el dolor abdominal. Consensos y guías recientes recomiendan su empleo como agente terapéutico en forma independiente de los antiespasmódicos y no ha sido indicado en forma específica para algún subtipo de SII108,111,140, Ya que ha demostrado buen efecto clínico en la DF es válido pensar que el perfil del paciente que mayor beneficio terapéutico puede obtener es aquel con sobreposición entre la DF y el SII.
Evidencia clínicaSTW 5: Una docena de estudios no controlados u observacionales publicados entre 1980 y 1990 informaron sobre la eficacia del STW 5 para el alivio de síntomas gastrointestinales en diversos escenarios clínicos141. El estudio más grande publicado hasta ahora en el SII es un ECC que investigó la eficacia y seguridad del STW 5 en 208 pacientes con diversos subtipos del SII en los EE. UU.142. El fitofármaco fue significativamente mejor que el placebo para reducir el dolor abdominal y la puntuación en la escala global de síntomas (flatulencia, meteorismo, distensión, sensación de evacuación incompleta). Otro estudio de experiencia en el mundo real en más de 2500 pacientes con SII que recibieron STW 5 durante un máximo de 4 semanas, demostró disminución en la puntuación de síntomas individuales abdominales entre un 65 y un 80%143. En este trabajo, el 80% de los médicos y pacientes evaluaron la eficacia de STW 5 como muy buena o buena. Diversos metaanálisis y revisiones sistemáticas que involucran este fitofármaco señalan que existe evidencia de los efectos beneficiosos en la fitoterapia moderna en el SII, pero también la necesidad de más y mejores estudios con ensayos de alta calidad144,145.
Menta piperita: Cinco revisiones sistemáticas y metaanálisis que han incluido solo estudios clínicos aleatorizados, controlados y comparativos con placebo, de moderada a buena calidad, han sido publicados20,21,146–148. Todos han demostrado que el aceite de menta es superior al placebo en el alivio global de síntomas con un NNT de 2.5 a 4 y superior al placebo en el alivio del dolor abdominal con un NNT de 4 a 7. La principal crítica para estos metaanálisis es la gran heterogeneidad de los ensayos clínicos incluidos, principalmente en los criterios definitorios del SII, los subgrupos estudiados, dosis utilizada, la presentación del fármaco, y la duración del tratamiento. Estudios más recientes, no incluidos en los metaanálisis mencionados, han mostrado hallazgos menos prometedores y confirman la necesidad de más investigación. Un ECC que comparó la administración de 182mg de aceite de menta de liberación intestinal, 182mg de aceite de menta de liberación íleo-colónica y placebo por 4 semanas, no encontró reducción estadísticamente significativa en la respuesta al dolor abdominal o el alivio general de los síntomas149. Sin embargo, en comparación con el placebo, el aceite de menta liberado en el intestino delgado produjo mejoras significativas en los resultados secundarios, incluyendo la puntuación del dolor abdominal, el malestar, y la gravedad del SII. Otro ensayo clínico, controlado y aleatorizado, que comparó la administración de 180mg/3 veces por día y placebo por 6 semanas, no encontró diferencia estadísticamente significativa entre ambos grupos en al alivio global de los síntomas150. El costo/efectividad del tratamiento con aceite de menta de liberación en el intestino delgado fue evaluado mediante un ensayo multicéntrico, aleatorizado y controlado con placebo, por 8 semanas, en los pacientes con SII151. El estudio demostró que, cuando se utiliza al dolor abdominal como parámetro de respuesta, el aceite de menta tiene una alta probabilidad de ser rentable y su uso podría justificarse por los modestos incrementos en las escalas de calidad de vida.
Eventos adversosSTW 5: La seguridad ha sido evaluada en estudios clínicos, preclínicos y controlados, de no intervención y retrospectivos que incluyeron toxicidad aguda, subcrónica y crónica, con enfoque específico en hepatotoxicidad, toxicidad reproductiva, fertilidad, embriotoxicidad y fetotoxicidad, mutagenicidad y citotoxicidad y no mostraron efectos relevantes de seguridad para el uso humano. No se produjeron efectos adversos graves y los estudios tampoco encontraron desviaciones clínicamente significativas de los valores de laboratorio. El STW 5 fue bien tolerado en las poblaciones examinadas, independientemente de enfermedades concomitantes y sin interacciones medicamentosas152. Las reacciones de hipersensibilidad pueden ocurrir muy raramente y pueden tomar la forma de prurito, disnea o reacciones cutáneas en los pacientes predispuestos153. Hay un solo informe publicado sobre hepatotoxicidad grave asociada a STW 5 que condujo a trasplante hepático154.
Menta piperita: El aceite de menta ha mostrado tener un buen perfil de seguridad y tolerancia en los estudios clínicos. Los efectos adversos han sido significativamente más frecuentes en comparación con placebo, aunque generalmente leves y transitorios20,21,146–148. De acuerdo con los resultados obtenidos en diversos metaanálisis, el RR de presentar algún efecto adverso es de 1.4-1.57 veces más en comparación con placebo y el NND es de 125146–148. Se ha informado que los efectos del aceite de menta sobre la función del esófago y del esfínter esofágico inferior pueden provocar el desarrollo de síntomas de reflujo. Es aquí donde la diferentes presentaciones y formas de liberación del fármaco (liberación en intestino delgado o liberación íleo-colónica) pudieran ser relevantes.
Disponibilidad, dosis recomendada y duración del tratamientoSTW 5: Se encuentra disponible en México en presentación de frasco gotero con 20, 50 o 100ml. La dosis para adultos recomendada por el fabricante es de 20 gotas en una pequeña cantidad de líquido antes o con los alimentos, 3 veces al día. El mecanismo de acción es rápido y se considera máximo a las 4semanas. Según el fabricante, el fitofármaco puede utilizarse por periodos prolongados.
Menta piperita: Existen al menos 2 presentaciones de aceite de menta piperita en México. Una presentación para libre venta son cápsulas de 181.6mg de liberación intestinal. La dosis para adultos recomendada por el fabricante es de una cápsula vía oral antes de los alimentos, 3 veces al día. No existe consenso en la duración adecuada del tratamiento, pero la información disponible varía de 2 a 12 semanas. Recientemente se ha vuelto a comercializar una presentación por prescripción a base de cápsulas que contienen una combinación de aceite esencial de menta piperita (menta) 90mg y aceite esencial de Carum carvi (alcaravea) 50mg, las cuales se prescriben 3 veces al día al menos por 12 semanas.
NeuromoduladoresEl término de neuromodulador se ha propuesto por la Fundación Roma para sustituir el uso de «antidepresivo» ya que esto mejora la aceptación del paciente y disminuye el estigma de los clínicos a este grupo de fármacos155. Este grupo de medicamentos se han recomendado desde hace más de 40 años en las guías internacionales para el manejo de los pacientes con SII con o sin comorbilidades psiquiátricas156. La base para su uso radica en el efecto que ejercen sobre la sensibilidad visceral periférica y el procesamiento central de dolor, además de tener un efecto sobre la comorbilidad psiquiátrica.
Este grupo de medicamentos se comienzan a utilizar con mayor frecuencia en los TIIC, cuando predomina el dolor y se consideran terapia de segunda línea para el manejo del SII. Es importante recalcar que como la mayoría de estos medicamentos pueden tardar algunas semanas en lograr su efecto terapéutico, se pueden combinar con las terapias de primera línea (p. ej., antiespasmódicos). A continuación, se presenta la información con respecto a las diferentes categorías de neuromoduladores que se pueden usar para tratar el SII en México.
Inhibidores selectivos de la recaptura de serotonina (ISRS)La serotonina, norepinefrina (NE), la dopamina, y la epinefrina, afectan la función del tubo digestivo por su acción sobre receptores en la pared intestinal, por lo que tienen un efecto sobre la motilidad intestinal y la sensibilidad visceral157. En el intestino se encuentran también los SERT. Desde el punto de vista de la inhibición de la recaptura de serotonina, esto explica el hecho por ejemplo que los pacientes con SII-D y SII-posinfección (SII-P) tienen niveles elevados de serotonina plasmática y los pacientes con SII-E tienen niveles disminuidos158. Los ISRS son un grupo de medicamentos que tienen como primera indicación el tratamiento de la depresión en adultos y niños, así como otras condiciones psiquiátricas (ansiedad, trastorno obsesivo compulsivo, síndrome de estrés postraumático, trastorno de pánico y fobia social). En esta clase de medicamentos se incluyen: fluoxetina, sertralina, paroxetina, fluvoxamina, citalopram y escitalopram.
A los pacientes a veces les sorprende mucho que los médicos les indiquen ISRS para el tratamiento del SII. Las razones para el uso de ISRS en el contexto del SII son múltiples y no se limitan a la coexistencia de trastornos de ansiedad y depresión (se pueden prescribir en ausencia de estos), sino, además, por ejemplo, por el efecto que tienen sobre el dolor crónico y la corrección de los trastornos de la motilidad intestinal159.
Mecanismos de acciónLos ISRS corrigen la deficiencia de serotonina, que se ha postulado como causa de la depresión en la hipótesis de las monoaminas160. Su mecanismo de acción se basa en la inhibición de la recaptura de serotonina en la terminal nerviosa, lo que finalmente incrementa la actividad de serotonina sobre los receptores postsinápticos. Estos fármacos inhiben al transportador SERT en la terminal axonal presináptica lo que incrementa las concentraciones de serotonina en la sinapsis, lo que a su vez puede tener un efecto sobre la contractilidad. Se ha demostrado por ejemplo que citalopram incrementa la contractilidad colónica y reduce el tono colónico en ayuno y después de los alimentos161. Esta clase terapéutica tiene poca actividad sobre otros neurotransmisores, como la dopamina o la NE. Al tener pocos efectos sobre receptores de histamina, acetilcolina y adrenalina, sus efectos secundarios son limitados162. Los ISRS, no actúan sobre los receptores de norepinefrina, a diferencia de otros neuromoduladores, y por eso no tienen acciones sobre el dolor. Se les indica en cuadros donde predomine la ansiedad, los trastornos obsesivo-compulsivos y los síntomas fóbicos.
IndicacionesLos ISRS están indicados en el SII cuando los pacientes tienen ansiedad, en cuadros con hipervigilancia, trastornos con síntomas somáticos, ansiedad visceral y cognición malaptativa, siempre que el dolor y la diarrea no sean síntomas predominantes. Los ISRS no tienen efecto sobre el dolor y son más útiles en individuos con estreñimiento, pues como efecto secundario tienen propensión a producir diarrea.
De manera empírica, pues no hay estudios específicos de combinación de medicamentos, se puede agregar otro neuromodulador en casos de mejoría parcial de las molestias del paciente. Por ejemplo, si un paciente es tratado con antidepresivos tricíclicos (ATC) y se ha logrado una mejoría del dolor, pero no de la ansiedad, ya que las dosis utilizadas de estos fármacos no son suficientes para la ansiedad o la depresión, se puede añadir un ISRS155.
Evidencia clínicaExisten múltiples estudios que han demostrado la eficacia de los ISRS. Por ejemplo, citalopram en un ECC comparado contra placebo disminuyó las calificaciones de dolor abdominal, distensión abdominal, que fueron independientes de la ansiedad o la depresión161. En otro estudio, paroxetina produjo una mejoría del bienestar general en individuos con SII163 y fluoxetina redujo el malestar abdominal en SII-E164. Con base en un metaanálisis de 7 ECC con 356 participantes, se puede considerar el uso de ISRS en el SII cuando la ansiedad predomina en el cuadro clínico y el dolor o la diarrea no constituyen un problema importante. El RR a favor de los ISRS fue de 0.74; (IC 95%: 0.58, 0.95), y el NNT de 6.8.
Eventos adversosLos efectos adversos comunes de los ISRS incluyen disfunción sexual, alteraciones del sueño, aumento o disminución del peso corporal, ansiedad, mareo, xerostomía, cefalea y malestar gastrointestinal165. En el 2004 la FDA publicó la advertencia de incremento del riesgo de suicidio en adolescentes y adultos hasta los 25 años. Los ISRS pueden alargar el intervalo QT del electrocardiograma, lo cual se puede asociar con arritmias fatales como torsada de pointes, particularmente el citalopram166. Otros 2 efectos que considerar son la coagulopatía y el síndrome serotoninérgico, este último cuando se utilizan otros medicamentos con efectos sobre la serotonina. Varios de los efectos adversos de este grupo de medicamentos mejoran con la adaptación después de varias dosis (tolerancia), sin embargo, esto no siempre sucede con la disfunción sexual que pueden provocar, efecto que permanece a largo plazo. El efecto sobre la función sexual puede estar mediado por la estimulación de receptores de 5-HT2A y 5-HT2C. Los ISRS se contraindican junto con inhibidores de la monoamino oxidasa, el linezolid, y otros medicamentos que incrementen los niveles de serotonina. Paroxetina es teratogénico y se contraindica en el embarazo159. La sobredosis de ISRS es poco frecuente, debido a su estructura química; sería más probable que esto ocurriera con citalopram o escitalopram que con el resto de los miembros de este grupo terapéutico. El síndrome serotoninérgico puede ocurrir cuando el paciente toma varios medicamentos que elevan los niveles de serotonina. Se caracteriza por cambios del estado mental, disfunción autonómica y distonía.
Disponibilidad, dosis recomendada y duración del tratamientoLos siguientes ISRS disponibles en México, su presentación, dosis diaria y duración del tratamiento, se muestran en la tabla 7. Una recomendación muy importante es iniciar a dosis bajas (p. ej., la mitad de la dosis) e ir escalando la dosis de acuerdo con la tolerancia del paciente. En términos generales el tratamiento debe administrarse por 6 a 12 meses para evitar las recaídas, y es importante reconocer que el beneficio sobre los síntomas empieza a ser evidente entre las 2 y 4 semanas después del inicio del tratamiento. Un concepto muy interesante es la neurogénesis central. La formación de circuitos de conducción alterados por cambios de la estructura cerebral puede formar parte de la fisiopatología de la persistencia de los síntomas en el SII. Por esta razón los ISRS deben administrarse suficiente tiempo para lograr un efecto de remisión de los síntomas a largo plazo.
Inhibidores de la recaptura de serotonina disponibles en México
| Fármaco | Presentación | Dosis recomendada | Duración |
|---|---|---|---|
| Fluoxetina | Cápsulas y tabletas | 20mg | 6- 12 meses |
| Sertralina | Cápsulas y tabletas | 50 y 100mg | 6- 12 meses |
| Paroxetina | Tabletas | 20mg | 6- 12 meses |
| Fluvoxamina | Tabletas | 50 y 100mg | 6- 12 meses |
| Citalopram | Tabletas | 20mg | 6- 12 meses |
| Escitalopram | Tabletas | 5, 10 o 20mg | 6- 12 meses |
Nota: Se puede iniciar con la mitad de la dosis recomendada e ir aumentado la dosis 1-2 semanas después, de acuerdo con la tolerancia del paciente.
Los ATC además de sus indicaciones primarias psiquiátricas (ansiedad, depresión) son medicamentos que se usan como analgésicos viscerales a dosis bajas en enfermedades relacionadas con dolor crónico como la fibromialgia, lumbalgia, y dolor neuropático. En ese contexto, su uso en el SII es para el manejo del dolor, pero también para disminuir la diarrea y la frecuencia de las evacuaciones por sus efectos anticolinérgicos155. Dentro de estos fármacos se incluyen a la amitriptilina, nortriptilina e imipramina.
Mecanismos de acciónLos ATC actúan mediante varios mecanismos que contribuyen a sus efectos terapéuticos. Principalmente, inhiben la recaptura de neurotransmisores como la serotonina y la NE en las neuronas presinápticas, aumentando sus niveles en la sinapsis y mejorando la transmisión neuronal, lo cual es esencial para su efecto antidepresivo. Además, bloquean los receptores α1-adrenérgicos, lo que puede causar hipotensión ortostática, y antagonizan los receptores H1 de histamina, contribuyendo a efectos sedantes y al aumento de peso en algunos pacientes. También bloquean los receptores muscarínicos, lo que provoca efectos anticolinérgicos como sequedad de boca, visión borrosa, estreñimiento y retención urinaria. Aunque menos prominentes, los ATC también pueden interactuar con otros receptores de neurotransmisores como los de dopamina y glutamato. Estos diversos mecanismos de acción, los hacen ser «agentes sucios» lo cual no solo explica los beneficios terapéuticos de los ATC en el tratamiento de la depresión y otros trastornos, sino también su perfil de efectos secundarios155. El efecto antimuscarínico que producen los ATC los hace ideales para el manejo del paciente con SII-D esto debido a que con un solo fármaco se controla dolor y habito intestinal.
Los ATC se subclasifican en aminas secundarias, como desipramina y nortriptilina, y aminas terciarias, como amitriptilina e imipramina, siendo estas últimas las que presentan mayores acciones antimuscarínicas y antihistamínicas. Aunque ambos tipos pueden ser efectivos para el dolor asociado al SII, se prefieren las aminas secundarias si el estreñimiento es un síntoma predominante167.
IndicacionesSe recomienda como terapia de segunda línea para el manejo del dolor abdominal en el paciente con SII-D y SII-M (aminas terciarias), o en SII-E (aminas secundarias). Las recomendaciones generales para el uso de estos fármacos son las siguientes 4: 1) utilizarlos a dosis bajas; 2) antes de agregar un segundo fármaco se recomienda aumentar la dosis del primero, si se presentan efectos adversos se pueden combinar con otros (quetiapina, ligandos α2δ), siempre teniendo precaución con las interacciones y efectos adversos; 3) si existe respuesta el tratamiento se debe mantener por 6 a 12 meses; 4) se requiere destreza por parte del médico para una efectiva comunicación con el paciente, esto mejorará la adherencia y aceptación del fármaco por parte del paciente.
Evidencia clínicaLa evidencia que respalda el uso de estos fármacos se basa en un metaanálisis que lo sustentan20,21. Por ejemplo, en el 2012 Chao et al.168 públicaron un metaanálisis donde se encontró un RR de 4.18 (IC 95%: 2.00-8.77; p=0.0001). Otros metaanálisis han replicado estos resultados demostrando que con dosis bajas de ATC se ha demostrado una disminución en la escala sintomática de 44.15 (IC 95% 53.27-35.04; p=0.0001) sobre todo para dolor abdominal169. En el metaanálisis de Ford A et al.170 que incluyeron 12 ECC (787 pacientes) de 436 pacientes que recibieron la terapia activa, 186 (42.7%) no presentaron mejoría en los síntomas después del tratamiento, en comparación con 224 (63.8%) de 351 que recibieron placebo. El RR de que los síntomas del SII no mejoraran con los ATC en comparación con el placebo fue de 0.65 (IC 95%: 0.55-0.77). El NNT con ATC fue de 4.5 (IC 95%: 3.5-7).
Recientemente se ha publicado el estudio ATLANTIS, quizá la evidencia que hacía falta en la literatura para apoyar el uso de amitriptilina en SII. Este fue un ECC en donde la intervención fue amitriptilina como terapia de segunda línea para pacientes con SII en cualquiera de los subtipos clínicos, a dosis inicial de 10mg, y se aumentó semanalmente hasta 30mg de acuerdo con la tolerancia del paciente. El tratamiento se mantuvo durante 6 meses. El desenlace primario fue la mejora sintomática investigada por el cuestionario de gravedad de síntomas Irritable Bowel Syndrome-Symptom Severity Scale (IBS-SSS)171. Se incluyeron 463 pacientes de 55 prácticas de medicina general de Gran Bretaña, de los cuales 232 recibieron la intervención de manera ciega y aleatorizada. A los 6 meses se observó una disminución media en el IBS-SSS de 27 puntos (IC 95%: −46.9 −7.10) (p=0.0079) en el grupo con amitriptilina vs. control; y también fue superior en la mejoría adecuada de síntomas, RM=1.56 (IC 95%: 1.20, 2.30); p=0.008. El síntoma en el cual se encontró mayor respuesta fue el dolor abdominal, sin efecto sobre la distensión. Los autores de este ensayo concluyen que la amitriptilina es superior a placebo para el manejo de pacientes con SII independientemente del subtipo clínica. Se ha calculado un NNT de 4 para la mejoría del dolor abdominal172.
Eventos adversosLa inducción de la función de serotonina provoca agitación, ansiedad, insomnio, disfunción sexual, nausea y vómito; la inducción de la NE puede provocar alteraciones en la presión arterial, frecuencia cardiaca también activación motora y agitación. Debido a que los ATC no son selectivos, actúan sobre otros neurotransmisores como se mencionó anteriormente por lo cual tiene múltiples efectos adversos: efecto antimuscarínico lo cual explica el estreñimiento, boca seca, visión borrosa y somnolencia; antagonismo α1adrenérgico que provoca mareo, somnolencia e hipotensión ortostática; antagonismo H1 que puede producir aumento de peso y somnolencia; bloqueo de canales de sodio que explica una de las complicaciones más temidas de estos fármacos que son la arritmias, convulsiones y coma, sobre todo cuando se ingieren en dosis superiores a las terapéuticas, es por eso que nos debemos asegurar que el paciente al que administremos este fármaco no tenga un intervalo QT corregido (QTc) elevado en un electrocardiograma. Es importante explicar al paciente que los efectos adversos aparecen primero que los benéficos y aclarar que los efectos adversos desaparecen entre 2 a 4 semanas y los benéficos persisten, esto con la finalidad de mejorar el apego. Por lo anterior, también es recomendable iniciar con la dosis mínima posible e ir escalando progresivamente hasta lograr el efecto terapéutico con los menores efectos secundarios.
Disponibilidad, dosis recomendada y duración del tratamientoEn México tenemos disponible amitriptilina e imipramina. La nortriptilina solo se encuentra en combinación con flufenazina y no hay disponibilidad de desipramina. Las dosis comúnmente utilizadas de amitriptilina son de 6.25mg (1/4 de la tableta de 25mg que es la presentación más baja en México) cada 24h, y aumentar la dosis hasta 50mg si es necesario. Posteriormente se recomienda tratamiento de mantenimiento de 6 a 12 meses para evitar recaídas. Es de anotar que, si durante el tratamiento con la dosis alcanzada se presentan recaídas, se puede ajustar la dosis si es posible. De imipramina la dosis inicial es de 6.25mg (1/4 de la tableta de 25mg) cada 24h, y aumentar la dosis hasta 25mg si es requerido, también manteniendo el tratamiento de 6 a 12 meses.
Antidepresivos tetracíclicosLos antidepresivos tetracíclicos son una clase de medicamentos utilizados principalmente para tratar la depresión. Algunos ejemplos de antidepresivos tetracíclicos son la maprotilina y la mianserina. La mirtazapina es un medicamento que se clasifica como un antidepresivo tetracíclico, pero con características adicionales que la distinguen de otros antidepresivos de esta clase. Específicamente, la mirtazapina pertenece a la clase de los antidepresivos noradrenérgicos y serotoninérgicos específicos (NaSSA, por sus siglas en inglés). Para el manejo del SII, el antidepresivo tetracíclico que cuenta con evidencia es la mirtazapina.
Mecanismo de acciónLa mirtazapina es un derivado 6-aza de la mianserina con un mecanismo de acción dual sobre el SNC; por un lado, es un NaSSA que actúa antagonizando los autoreceptores α-2 y heteroreceptores α-2 adrenérgicos, y además es un bloqueador postsináptico de receptores 5-HT2 y 5-HT3, por lo cual estimula la transmisión serotoninérgica mediada por 5-HT1A. Mirtazapina tiene una baja afinidad por los receptores dopaminérgicos y muscarínicos-colinérgicos. Este mecanismo dual es el responsable de su rápido inicio de acción, tras una dosis se absorbe rápidamente alcanzando concentraciones plasmáticas pico (Cmáx) tras 1 a 2.1h. Se une a proteínas plasmáticas (85%) de forma no específica y reversible. Tiene una biodisponibilidad del 50%, debido al metabolismo hepático de primer paso. Es metabolizada principalmente en el hígado (isoenzimas CYP P450: CYP1A2, CYP2D6 y CYP3A4), con una vida media de eliminación que oscila entre 20-40h, alcanzando un estado de equilibrio después de 4 días en adultos y 6 días en personas mayores173,174.
IndicacionesHasta el momento no existe indicación precisa para el uso de antidepresivos tetracíclicos en el contexto de SII como monoterapia. Sin embargo, por sus efectos sobre la ansiedad, la saciedad temprana, las náuseas y otros síntomas asociados con trastornos esofágicos y gastroduodenales, puede usarse en los pacientes con sobreposición de SII con DF y síndrome de náuseas y vómito crónico. Se pudiera recomendar su uso para el manejo del SII-D de acuerdo con la evidencia clínica175.
Evidencia clínicaUna búsqueda realizada de mirtazapina en SII, se encontraron algunos reportes de caso y un estudio aleatorizado controlado con placebo para el manejo del SII-D por su efecto anti-HT3174,176. Khalilian A et al.175 en un estudio controlado con placebo en los pacientes con SII-D Roma IV, evaluó a 67 pacientes que fueron asignados aleatoriamente a recibir mirtazapina (n=34) o placebo (n=33). Los pacientes comenzaron con mirtazapina 15mg/día antes de acostarse durante una semana; después, la dosis se aumentó a 30mg/día durante 7 semanas adicionales. Los resultados mostraron que, en comparación con el placebo, la mirtazapina es más eficaz en la disminución de la gravedad de los síntomas del SII (p=0.002). Además, al final del período de tratamiento, todos los síntomas excepto la distensión, mostraron una mejora significativamente mayor en los sujetos tratados con mirtazapina en comparación con los tratados con placebo. Mientras que la mirtazapina fue bien tolerada, también mejoró significativamente la calidad de vida de los pacientes (p=0.04) y los síntomas de ansiedad (p=0.005). De forma similar, pero en un estudio abierto, Sanagapalli et al.177, investigaron la eficacia de mirtazapina en el tratamiento del SII-D en 16 pacientes: 11 recibieron 15mg y 5 recibieron 30mg durante 12 semanas. El 69% fueron considerados como respondedores, debido a una reducción >50 puntos en la escala IBS-SSS; además, hubo una reducción significativa en depresión y ansiedad mediante la escala de ansiedad y depresión hospitalaria (HADS, por sus siglas en inglés). Asimismo, se reportó una disminución significativa en los puntajes para dolor abdominal, urgencia, diarrea y distensión abdominal (p≤0.01).
Efectos adversosLa mayoría de los efectos adversos son leves y transitorios. Los efectos asociados al bloqueo de los receptores de histamina H1 como sedación y aumento de peso, son más marcados cuando se utiliza a dosis baja. A diferencia de los ISRS, la mirtazapina no tiene efectos secundarios sobre la sexualidad. En un 2% de los pacientes puede producir elevación de alanino aminotransferasa (ALT), y en un 3-4% elevación de colesterol y triglicéridos. Es bien tolerada en adultos mayores, siendo mareos y resequedad bucal los efectos adversos más frecuentes.
Disponibilidad, dosis recomendada y duración del tratamientoEn la tabla 8 se muestra la presentación y dosis recomendada de mirtazapina en México.
Antidepresivos tetracíclicos y atípicos, y otros neuromoduladores que potencialmente se puede usar en el manejo del SII en México
| Fármaco | Presentación | Dosis recomendada | Duración |
|---|---|---|---|
| Mirtazapina | Tabletas 15 y 30mg | 7.5-45mg al día en las noches | 4-12 semanas |
| Trazodona | Comprimidos/cápsulas de 25, 50 y 100mg | 75-150mg al día en las noches | 4-12 semanas |
| Pregabalina | Cápsulas con presentación de 25, 50, 75, 150 y 300mg, y solución en frasco de 105ml (2g pregabalina/100ml) | 225mg vía oral BID titulada (iniciar con 75mg BID durante 3 días, luego 150mg BID durante 3 días, 225mg BID durante 10 semanas y dosis gradual descendente durante la semana 12 (150mg BID durante 3 días, luego 75mg BID durante 3 días) | 12 semanas |
| Quetiapina | Tabletas de liberación prolongada de 25mg | 25-100mg/d (iniciar con 25mg antes de acostarse y titularse de manera gradual según respuesta y tolerancia) | 12 semanas |
| Trifluoperazina/isopropamida | Tabletas de 1mg/5mg | Una tableta/cada 12h (iniciar una tableta por la noche y de acuerdo con tolerancia agregar la dosis matutina) | 2-4 semanas |
BID: 2 veces al día; SII: síndrome de intestino irritable.
Estos fármacos se unen a los transportadores SERT y de NE con diferentes niveles de potencia y afinidad de unión, sin influencia significativa sobre otros neurotransmisores (acetilcolina, adrenalina, dopamina, histamina)178. A diferencia de los ISRS, estos antidepresivos tienen una curva dosis/respuesta ascendente en lugar de plana. Los inhibidores de la recaptura de serotonina y NE son: duloxetina, venlafaxina, desvenlafaxina y milnacipran. Están aprobadas para trastornos depresivos, ansiedad, dolor neuropático periférico diabético, fibromialgia y dolor musculoesquelético. Sin embargo, la evidencia para su uso en el SII es limitada, por lo que al momento solo se cuenta con poca información del uso de duloxetina y venlafaxina.
Mecanismo de acciónLa duloxetina, es un inhibidor más potente, que el resto de este grupo de fármacos, con un perfil de unión más equilibrado de aproximadamente 10:1 para la unión al transportador de 5HT y NE178. También es un inhibidor moderado de CYP2D6, por lo que se necesitarán reducciones moderadas de la dosis y un control cuidadoso cuando se utilice en combinación con medicamentos que son metabolizados por esta vía. Se absorbe por el tracto digestivo y alcanza su Cmáx a las 6h sin ser afectada por alimentos. Posee además una vida media plasmática larga (12h, rango: 8-17h) y elevada unión a proteínas plasmáticas (>90%). Su principal vía de eliminación es a través de la orina (>70%) como metabolitos.
La venlafaxina, una feniletilamina, es un inhibidor relativamente débil de la captación de 5-HT y NE más débil con una diferencia de 30 veces en la unión de los 2 transportadores. Por lo tanto, el fármaco tiene una clara progresión de la dosis, con dosis bajas que se unen predominantemente al transportador 5-HT y se unen más al transportador NE a medida que aumenta la dosis178. La venlafaxina se metaboliza también por CYP2D6. Tiene una vida media corta, de 5 horas y el metabolito de 12h, y tiene una baja unión a proteínas. Por lo tanto, es una opción potencial si las interacciones farmacológicas son una preocupación.
IndicacionesAl igual que los ISRS se recomiendan como terapia de segunda línea, cuando el dolor es el síntoma predominante o cuando los ATC limitan su uso, y cuando coexiste la comorbilidad psicológica.
Evidencia clínicaLa duloxetina, ha demostrado eficacia a través de varios estudios piloto y ensayos clínicos. Tres estudios piloto han mostrado mejoras significativas en varios aspectos del SII179–181. En un estudio abierto con 15 pacientes, aunque solo 8 completaron el seguimiento de 12 semanas con una dosis de 60mg/24h de duloxetina, se observaron mejoras significativas en el dolor, la severidad de la enfermedad, la calidad de vida, la consistencia de las heces y la ansiedad179. Otro estudio abierto con 17 pacientes (solo 11 lo completaron) también de 12 semanas, comenzó con una dosis de 30mg de duloxetina incrementándose hasta un máximo de 120mg, con una dosis promedio de 60mg, y mostró mejoras en la escala clínica global, la severidad, la ansiedad y la calidad de vida.180 Un tercer estudio piloto con 17 pacientes (solo 10 lo completaron) de 12 semanas con una dosis inicial de 20mg seguida de 30mg y finalizando con 60mg, también reportó resultados positivos181.
Además, 2 ECC han confirmado estos hallazgos182,183. Un estudio comparó los efectos terapéuticos de la duloxetina y la fluoxetina en 182 pacientes con SII-E según los criterios de Roma III, durante 8 semanas. El grupo que recibió duloxetina mostró mejoras significativas en la flatulencia, la intensidad del dolor abdominal, la calidad de vida y la frecuencia de evacuaciones. Otro estudio con 60 pacientes con SII-D según los criterios de Roma IV de 12 semanas de duración, comparó 135mg de mebeverina más placebo con 135mg de mebeverina más 30mg de duloxetina183. Los pacientes que recibieron duloxetina presentaron mejoras significativas en los síntomas del SII, la severidad y la calidad de vida, con efectos adversos iniciales que disminuyeron después de la cuarta semana.
Respecto a venlafaxina, existe un estudio aleatorizado y doble ciego realizado en 33 pacientes con SII mediante criterios de Roma III, quienes recibieron venlafaxina en una dosis inicial de 37.5mg/24h/por 2 semanas, incrementándose a 75mg/por 2 semanas adicionales y alcanzando una dosis final de 150mg/24h, comparados con un grupo placebo, durante un seguimiento de 12 semanas184. Los resultados mostraron una mejoría significativa en la severidad de los síntomas del SII, así como en los niveles de depresión, ansiedad, estrés, síntomas intestinales (como dolor abdominal, distensión y evacuaciones satisfactorias) y calidad de vida. Sin embargo, al seguimiento a 3 meses después de terminado el estudio, se observó una recaída en los síntomas de los pacientes tratados.
Eventos adversosEn el caso de la duloxetina, se reportan en menos del 2% de los pacientes, siendo el más común la náusea, sin embargo, fueron la causa principal de salida de los pacientes, en los estudios piloto. Los efectos secundarios más comunes identificados en los ensayos clínicos son náuseas, sequedad de boca, mareos, estreñimiento, insomnio, astenia e hipertensión, fatiga.
En el caso de la venlaflaxina, en dosis bajas, el perfil de efectos adversos es similar al de un IRS con náuseas, diarrea, fatiga o somnolencia, vómito y efectos secundarios sexuales, mientras que la venlafaxina en dosis más altas puede producir aumentos leves de la presión arterial, diaforesis, taquicardia, temblores y ansiedad.
Disponibilidad, dosis recomendada y duración del tratamientoEn México, tanto la duloxetina como la venlafaxina están disponibles. La duloxetina está disponible en presentaciones de 30 y 60mg de liberación prolongada. La dosis inicial recomendada es de 30mg diarios, incrementando a 60mg diarios después de 2 semanas, siendo esta la dosis máxima recomendada. Por otro lado, la venlafaxina se encuentra disponible en presentaciones de 37.5 y 75mg. La dosis inicial es de 37.5mg/día, incrementando a 75mg/día después de 2 semanas, que es la dosis máxima recomendada para el manejo del SII. Estas dosificaciones están diseñadas para mejorar la tolerabilidad inicial del tratamiento, reducir los síntomas del SII, incluyendo el dolor abdominal y la ansiedad, y mejorar la calidad de vida del paciente. La duración es de al menos 12 semanas hasta 12 meses.
Antidepresivos atípicos, antipsicóticos y otros neuromoduladoresTrazodonaMecanismo de acciónLa trazodona es un fármaco catalogado como antidepresivo atípico, y es un derivado de la triazolopiridina, con un mecanismo de acción dual: antagonista de los receptores 5-HT2 e inhibidor de la recaptura de serotonina (SARI, por sus siglas en inglés serotonin antagonist and reuptake inhibitors). Esta actividad simultánea de antagonizar 5-HT2A/2C e inhibir el SERT, incrementa el efecto antidepresivo y mejora la tolerancia al tratamiento. Además, tiene propiedades antagonistas sobre receptores α1 y α-2 adrenérgicos y de histamina H1, con mínimos efectos anticolinérgicos. Tras la administración oral de 100mg de trazodona la Cmáx se alcanza en 1h y la vida media de eliminación es relativamente corta, de 6.6h. Es metabolizada extensamente en el hígado, principalmente por vía de oxidación microsomal185.
IndicacionesLa trazodona no está específicamente indicada para el manejo del SII. Aunque la trazodona es un antidepresivo atípico utilizado principalmente para tratar la depresión y el insomnio, no se ha establecido ampliamente su eficacia para tratar los síntomas del SII, pero ante la coexistencia de estas condiciones podría usarse de forma concomitante.
Evidencia clínicaLa evidencia más sólida para usar trazodona en el contexto de los TIIC es en el dolor esofágico de presumible origen esofágico, pero podría utilizarse en ausencia de disponibilidad de otros neuromoduladores.
Eventos adversosLos eventos adversos más frecuentes son la somnolencia, vértigo, cefalea y boca seca. En adultos mayores puede incrementar el riesgo de hipotensión ortostática y en concentraciones plasmáticas tóxicas puede generar prolongación del QTc. Además, puede estar asociado con casos raros de priapismo.
Disponibilidad, dosis recomendada y duración del tratamientoEn la tabla 8 se muestra la presentación y dosis recomendada de trazodona en México.
PregabalinaMecanismo de acciónPregabalina es un neuromodulador periférico del grupo de los ligandos alfa2-delta (α2δ) de segunda generación que bloquea la subunidad proteica α2δ de los canales de calcio dependientes de voltaje a nivel presináptico, disminuyendo la despolarización en las terminaciones nerviosas por el influjo de calcio y, en consecuencia, inhibe la liberación de diversos neurotransmisores excitadores, como glutamato, NE, acetilcolina, sustancia P y el péptido relacionado con el gen de la calcitonina, los cuales están involucrados en las vías del dolor, con efectos analgésicos y ansiolíticos, así como en la disminución de la hipersensibilidad visceral en los pacientes con SII186–188.
La pregabalina es 2 a 10 veces más potente y con efectos farmacológicos más predecibles que su prototipo ligando α2δ, la gabapentina. Algunos investigadores consideran a la pregabalina como agonistas GABA (ácido gamma-aminobutírico), debido a su similitud química con dicho ácido; sin embargo, es de destacar que funcionalmente no se une a los receptores GABAA186.
IndicacionesSe puede usar en el tratamiento del dolor y distensión abdominal en los pacientes con SII-D y SII-M, como terapia de segunda línea. También puede usarse en los pacientes con SII con comorbilidades como fibromialgia y dolor de la pared abdominal.
Evidencia clínicaExisten 2 ECC de pregabalina sobre la sensibilidad visceral en los pacientes con SII186,189, En el primer estudio, 26 pacientes con SII mediante criterios de Roma II sin especificar subtipo y con hipersensibilidad rectal a la distensión con balón (umbral del dolor ≤28mmHg), recibieron pregabalina oral durante 3 semanas (titulada: 50mg TID los días 1 a 3, 100mg TID los días 4 a 7, 150mg/3 veces al día los días 8-11; 200mg fijos/3 veces al día los días 12 a 21±4) o placebo186. La pregabalina en comparación con el placebo aumentó significativamente los umbrales para la primera sensación, traduciéndose en mejoría de la sensibilidad visceral (p=0.045) e incrementó los umbrales del deseo defecatorio (p=0.008) y del dolor, con efecto sobre la alodinia (p=0.048); además aumentó significativamente la distensibilidad rectal (p<0.0001), por lo que la pregabalina pudiera tener una respuesta satisfactoria tanto sensorial como motora en los pacientes con SII. Sin embargo, en el segundo estudio en 18 pacientes con SII-E en los que se les dio una sola dosis de pregabalina de 200mg contra placebo y se evaluaron los umbrales de sensación y de distensibilidad del colon izquierdo por medio de distensiones ascendentes (16, 24, 30 y 36mmHg) controladas con baróstato, no disminuyó el dolor a la distensión. Tampoco modificó el tono colónico en ayunas o posprandial, ni el índice de motilidad pre y posprandial189.
Saito et al.190 realizaron el primer ECC, para evaluar la eficacia de pregabalina sobre la mejoría de los síntomas gastrointestinales en los pacientes con SII, utilizando una dosis escalonada de 225mg de pregabalina 2 veces al día por 12 semanas en 85 pacientes (86% mujeres) con SII por criterios Roma III, con al menos 3 ataques de dolor por mes, incluyendo SII-D (n=37, 44%), SII-M (29, 35%) y SII-E (18, 21%). El criterio de evaluación fue un cuestionario semanal empleando la escala de dolor de síntomas intestinales en las semanas 9 a 12. Se observó que el grupo de pregabalina mostró menores puntuaciones de dolor en las semanas 9 a 12 (durante las últimas 4 semanas del estudio) en comparación con el placebo (25 vs. 42; p=0.008), así como una menor puntuación en la severidad de síntomas intestinales en el grupo de pregabalina (26 vs. 42; p=0.009). Además, se observó diferencias en las puntuaciones de diarrea y distensión abdominal (p=0.049 y 0.016, respectivamente), sin diferencias en estreñimiento entre los grupos.
En una revisión sistemática y metaanálisis sobre el papel de los neuromoduladores en el tratamiento del dolor en los pacientes con SII se incluyeron 13 estudios con un total de 629 participantes en el que 6 ensayos investigaron amitriptilina, 4 a los α2δ ligandos (pregabalina n=3 y gabapentina n=1) y 3 duloxetina191. En los estudios que evaluaron a los α2δ ligandos (pregabalina n=129 pacientes; gabapentina n=43 sujetos), donde el 47% de los participantes tenían SII-D y el 21% SII-E, no se demostró mejoría consistente en dolor abdominal. Solo uno de los 4 estudios informó mejoría del dolor en el grupo activo, mientras que 2 estudios informaron mejoría en algunas escalas del dolor, y otro ensayo no informó diferencias en mejoría del dolor entre el tratamiento activo y placebo. Los resultados relacionados con la severidad del SII y la calidad de vida solo se informaron en uno de los 4 estudios; con mejoría en la severidad, pero no en calidad de vida.
Eventos adversosEn general es bien tolerada y se asocia con eventos dependientes de la dosis que son leves a moderados y generalmente transitorios. El mareo y la somnolencia son los más frecuentes, seguidos de xerostomía, ataxia, cefalea, edema periférico, visión borrosa, aumento de peso, dificultad para concentrarse, euforia o perdida de la atención. También se han reportado casos de estreñimiento, náusea y vómito, mioclonías, asterixis y ginecomastia. La pregabalina debe retirarse gradualmente para minimizar la posibilidad de un aumento de la frecuencia de las convulsiones en los pacientes con epilepsia. Si se suspende la pregabalina, la dosis debe reducirse gradualmente durante un mínimo de una semana.
Disponibilidad, dosis recomendada y duración del tratamientoEn México la pregabalina (tabla 8) se encuentra disponible en cápsulas con presentación de 25, 50, 75, 150 y 300mg, así como en solución con frasco con 105ml (2g pregabalina/100ml). La dosis de pregabalina se debe titular para evitar efectos adversos e iniciar con 75mg BID/durante 3 días, luego 150mg BID/durante 3 días, 225mg BID/durante 10 semanas y dosis graduales descendentes/durante la semana 12 (150mg BID/durante 3 días, luego 75mg BID/durante 3 días). La respuesta terapéutica ocurre a las 8 semanas.
QuetiapinaMecanismo de acciónLa quetiapina es un antipsicótico atípico con propiedades antagonistas de los receptores D2, 5HT2A, H1, α1, a2 y M y agonista parcial de los receptores serotoninérgicos 5HT1A. También es un inhibidor de la recaptura de NA lo que explica su efecto analgésico; además a través del antagonismo M e H1 y del agonismo 5HT1A, la quetiapina puede reducir la contracción intestinal y por lo tanto el dolor abdominal, así como la diarrea por su efecto antagonista M. Los mecanismos indirectos de la quetiapina incluyen su efecto antidepresivo, analgésico, ansiolítico y sedante192–194.
IndicacionesTratamiento complementario cuando la monoterapia es insuficiente en dolor abdominal severo refractario a otros neuromoduladores en SII-D. Pacientes con dolor crónico con fibromialgia, insomnio y trastornos severos de ansiedad y depresión.
Evidencia clínicaActualmente, no se han realizado ECC con el poder estadístico adecuado para determinar la eficacia de la quetiapina en el SII. Existe un solo estudio retrospectivo de 21 pacientes con síntomas gastrointestinales severos que persistían con trastorno de ansiedad, insomnio o dolor abdominal refractario, o que desarrollaron eventos adversos intolerables a diversos neuromoduladores; en ellos se agregó quetiapina a dosis de 25 a 100mg/día195. La dosis se ajustó según la respuesta clínica o los efectos adversos. La duración media del tratamiento fue de 90 días (rango: 1-330 días). Solo 11 pacientes continuaron el tratamiento, ya que 10 lo interrumpieron por falta de respuesta o efectos adversos. Seis de los 11 pacientes informaron mejoría global de síntomas y 9 estaban satisfechos con los resultados de su tratamiento. Existen algunos reportes de casos, en donde una dosis de quetiapina de liberación prolongada de 100mg/día combinado con venlafaxina de 300mg/día produjo una mejoría rápida y notable del dolor abdominal y disminución en la frecuencia de las evacuaciones, observándose una remisión completa y rápida de los síntomas de SII-D a las 2 semanas y del trastorno depresivo mayor a los 2 meses190. Se ha demostrado el beneficio de agregar quetiapina a dosis de 50-300mg/día en EC controlados con placebo en los pacientes con fibromialgia, así como en los pacientes con trastornos del sueño196,197.
Eventos adversosLos más comunes son sedación, fatiga, somnolencia (que disminuye en 1 a 2 semanas de su uso), xerostomía, dispepsia, síntomas extrapiramidales, estreñimiento, síndrome metabólico (aumento de peso, hiperglucemia, hiperlipidemia), cefalea, y en menos del 1% de los casos alteración de las pruebas de función hepática, pancreatitis, prolongación del intervalo QT (dosis/dependiente).
Disponibilidad, dosis recomendada y duración del tratamientoEn México la quetiapina de liberación inmediata se encuentra disponible en tabletas con 25, 100 y 300mg y la quetiapina de liberación prolongada a dosis de 50, 150, 200, 300 y 400mg (tabla 8). Se indicará una dosis inicial de 25-100mg/cada 24h antes de acostarse por 3 meses y se titulará de acuerdo con respuesta y tolerancia del paciente.
SulpiridaMecanismos de acciónLa sulpirida es un antipsicótico atípico con propiedades antagonistas D2 centrales y periféricas, con efecto procinético a nivel gástrico y en colon sigmoides disminuye la motilidad posprandial (reflejo gastro-cólico). La levosulpirida es el enantiómero (−) de la sulpirida R (+) que ha mostrado una mayor actividad antidopaminérgica central, con efectos antieméticos y con buena evidencia en DF y con menores efectos adversos que la sulpirida198.
IndicacionesNo existe evidencia suficiente para recomendar la sulpirida para el tratamiento del SII. Tratamiento de trastornos psicóticos, incluyendo esquizofrenia y trastornos de ansiedad. Uso potencial como terapia concomitante para la reducción del dolor; sin embargo, actualmente faltan evidencias formales en el tratamiento del SII. La levosulpirida tiene evidencia para el manejo de síntomas de dispepsia/gastroparesia y podría usarse en caso de sobreposición con estas entidades199.
Evidencia clínicaEn un estudio de 12 pacientes con SII se estudió la respuesta motora posprandial del colon. En 6 casos se administró sulpirida 100mg IM, lo cual redujo significativamente el reflejo gastrocólico, que se encuentra aumentado en algunos pacientes con SII198. Actualmente, oólo se ha reportado la eficacia de sulpirida en un ECC ruso en 40 pacientes con SII que se aleatorizaron en 2 grupos para recibir sulpirida dosis de 200-450mg/día/por 6 semanas y el segundo grupo tratamiento médico estándar. El 85% de los pacientes refirieron mejoría del dolor abdominal y de la consistencia de las evacuaciones, así como en escalas de ansiedad y depresión200.
Eventos adversosAunque son poco frecuentes se reporta mareo, somnolencia, cefalea, efectos extrapiramidales, discinesia tardía, hiperprolactinemia, estreñimiento, ginecomastia y xerostomía201.
Disponibilidad, dosis recomendada y duración del tratamientoSulpirida está disponible en México en forma de tabletas de 50 y 200mg, y levosulpirida como comprimidos de 25mg.
Trifluoperazina/isopropamidaEn México existe una combinación de un antipsicótico (trifluoperazina) y un anticolinérgico (isopropamida) que se ha utilizado en algunos casos para el tratamiento de trastornos psicosomáticos asociados a manifestaciones digestivas.
Mecanismos de acciónLa trifluoperazina es un medicamento antipsicótico que pertenece a la clase de las fenotiazinas. Se utiliza principalmente en el tratamiento de trastornos psiquiátricos como la esquizofrenia, así como para tratar síntomas de ansiedad severa. Funciona bloqueando ciertos receptores de dopamina en el cerebro, lo que ayuda a disminuir síntomas como delirios, alucinaciones y agitación202. La isopropamida es un compuesto anticolinérgico que se utiliza principalmente para tratar trastornos gastrointestinales, como úlceras y dolor abdominal. Actúa reduciendo la producción de ácido gástrico y disminuyendo el tono muscular del tracto gastrointestinal, lo que ayuda a aliviar los síntomas asociados con estas condiciones203.
IndicacionesAunque no se recomienda de manera inicial el uso de esta combinación para el tratamiento del SII, sus efectos sedantes leves y antiespasmódicos, junto con su acción contra las náuseas, la hacen una opción viable como tratamiento de segunda línea en casos de SII donde persiste el dolor asociado con la ansiedad. Además, debido a su efecto antisecretor del ácido gástrico, podría considerarse su uso en casos que también presenten DF con predominio tipo dolor epigástrico. Según su registro sanitario en México, también podría ser efectiva en el manejo de la aerofagia.
Evidencia clínicaLa evidencia es escasa y data de estudios de la década de los 60s, donde las indicaciones en ese momento eran el manejo de síntomas relacionados con enfermedad ácido-péptica o que se consideraba antes como «neurosis gástrica»; «colon irritable» o «irritabilidad gastrointestinal». No existen estudios actuales considerando los criterios diagnósticos vigentes del SII. Sin embargo, es una opción viable como segunda o tercera línea de tratamiento de acuerdo con las indicaciones previamente mencionadas.
Evntos adversosSe ha reportado estreñimiento, xerostomía, visión borrosa, inquietud o insomnio y en contados casos, retención urinaria. Aunque extremadamente rara con dosis bajas, puede aparecer discinesia tardía persistente en algunos pacientes bajo tratamiento prolongado o después de haber suspendido la terapia. El riesgo parece ser mayor en los pacientes ancianos, especialmente mujeres, o con altas dosis y en algunos pacientes parece ser irreversible.
Disponibilidad en México, dosis recomendada y duración del tratamientoSe encuentra disponible en una sola presentación de tabletas de 1mg de diclorhidrato de trifluoperazina y 5mg de yoduro de isopropamida. La dosis recomendada es de una tableta cada 12h, de acuerdo con la tolerancia. Si no existe un efecto sedante importante con la dosis nocturna se puede administrar la dosis matutina. No existe una duración específica, pero se puede intentar esta combinación al menos 2-4 semanas.
MesalazinaLa mesalazina, también conocida como mesalamina, es un derivado del 5-ácido aminosalicílico (5-ASA) y es un medicamento antiinflamatorio utilizado principalmente para tratar enfermedades inflamatorias del intestino, como la colitis ulcerosa y la enfermedad de Crohn. Algunos estudios sugieren que, en un subconjunto de pacientes con SII, especialmente aquellos con SII-D y SII-PI, puede existir una inflamación de bajo grado que contribuye a los síntomas204.
Mecanismos de acciónAunque no se comprende completamente, el mecanismo de acción de la mesalazina, se basa en la activación de los receptores nucleares (específicamente la forma gamma de los receptores activados por proliferadores de peroxisomas), lo que a su vez regula a la baja la inflamación y reduce la liberación de citoquinas inflamatorias205. Además, la mesalazina y la sulfasalazina (una combinación del antibiótico sulfapiridina con 5-ASA) también pueden actuar regulando a la baja la función de los mastocitos en humanos y roedores, una característica importante de la activación inmunitaria en el SII206,207.
IndicacionesSi bien tradicionalmente se había considerado que no existe evidencia suficiente para recomendar el uso de 5-ASA en el SII, o se considera una medida controversial, la evidencia más reciente considera que la mesalazina podría ser moderadamente eficaz para mejorar los síntomas globales de SII-D208. De igual manera, en el SII-PI la mesalazina (en particular las formulaciones de acciones prolongadas) pudieran ser eficaces.
Evidencia clínicaUna revisión sistemática recién publicada que incluyó 8 ECC con un total de 820 pacientes, de los cuales 432 fueron tratados con mesalamina, mostró que la mesalamina es más eficaz que el placebo para los síntomas globales del SII, con un RR de 0.86 (IC 95%: 0.79-0.95) y un NNT de 10208. Sin embargo, no se observaron beneficios significativos en la reducción del dolor abdominal, el hábito intestinal, o la frecuencia de las evacuaciones. En el análisis de subgrupos, la mesalamina mostró eficacia solo en los pacientes con SII-D. No hubo un aumento significativo en la incidencia de eventos adversos con la mesalamina en comparación con el placebo (RR: 1.20; IC 95%: 0.89-1.63). En conclusión, aunque la mesalamina puede ser modestamente eficaz para los síntomas globales del SII, la calidad de la evidencia es baja y se requiere realizar ensayos clínicos mejor diseñados.
En el caso del SII-PI, se ha publicado recientemente un estudio sobre la eficacia de la mesalamina en 61 pacientes con esta variedad209. Los pacientes fueron aleatorizados a recibir 2.4g de mesalamina de acción prolongada, o un placebo diariamente durante 8 semanas. La mesalamina demostró ser más eficaz que el placebo en la reducción del puntaje general de síntomas intestinales y en la calidad de vida.
Eventos adversosEntre los más comunes, se encuentran las molestias gastrointestinales como dolor abdominal, diarrea, náuseas, y flatulencias, que son frecuentemente reportadas en la práctica clínica. Además, la cefalea es un evento adverso notablemente común. En cuanto a efectos más serios, aunque infrecuentes, la mesalazina puede inducir nefritis intersticial aguda o crónica, lo que puede evolucionar a insuficiencia renal. Asimismo, se han reportado reacciones de hipersensibilidad que pueden incluir el síndrome de Stevens-Johnson y necrólisis epidérmica tóxica, aunque estos casos son raros. La toxicidad hepática también es una preocupación, particularmente en los pacientes con disfunción hepática subyacente, ya que la mesalazina puede elevar las enzimas hepáticas y, en casos raros, provocar hepatitis colestásica.
Disponibilidad en México, dosis recomendada y duración del tratamientoEn México, la mesalazina está disponible en diversas presentaciones. Existen tabletas, grageas, tabletas de liberación prolongada, y gránulos de liberación prolongada. Se recomienda usar las presentaciones de liberación prolongada o capa entérica de preferencia. Las dosis disponibles incluyen 500mg, 1 y 1.2g. La duración del tratamiento de acuerdo con la evidencia es de 8 semanas. De acuerdo con la evidencia la dosis recomendad es de 2.4g al día, de preferencia usando las tabletas de liberación prolongada.
Resumen de recomendacionesLas recomendaciones generales y a la disponibilidad de todas las clases terapéuticas evaluadas, se resumen en la tabla 9 y en la figura 1.
Resumen de recomendaciones, indicaciones y disponibilidad de los fármacos empleados en México para el manejo del SII
| Clase terapéutica | Recomendación/indicación | Disponibilidad |
|---|---|---|
| Antiespasmódicos | ||
| Solos | Se recomienda su uso en cualquier subtipo de SII cuando el dolor sea el síntoma predominante y como tratamiento de primera línea | Adecuada. Comercializados por múltiples empresas farmacéuticas |
| En combinación con dimeticona | Se recomienda su uso en cualquier subtipo de SII para el manejo del dolor y de la distensión abdominal, como tratamiento de primera línea | Adecuada. Comercializados por múltiples empresas farmacéuticas |
| En combinación con dimeticona+alfa-galactosidasa | Se recomienda su uso en cualquier subtipo de SII para el manejo del dolor y de la distensión abdominal asociado a la ingesta de alimentos altamente fermentables, como tratamiento de primera línea | Exclusiva. Una sola presentación comercializada por una sola empresa farmacéutica |
| Laxantes osmóticos | ||
| Polietilenglicol | Se recomienda su uso en el manejo del SII-E, ya que mejora el número de evacuaciones y la consistencia de las heces. No tiene efecto sobre el dolor | Adecuada. Comercializado por múltiples empresas farmacéuticas |
| Lactulosa | No recomendamos su uso ya que puede empeorar los síntomas como la distensión abdominal | Adecuada. Comercializada por múltiples empresas farmacéuticas |
| Antidiarreicos | ||
| Loperamida, lidamidina | Se recomienda su uso en los pacientes SII-D, ya que disminuye la frecuencia y mejora la consistencia de las evacuaciones, como tratamiento de primera línea | Adecuada para loperamida. Comercializada por múltiples empresas farmacéuticasExclusiva para lidamidina. Comercializada por una sola empresa farmacéutica |
| Colestiramina | Se puede utilizar en los pacientes con SII-D cuando existe la sospecha de malabsorción ileal de ácidos biliares | Limitada. Aunque se comercializa por varias empresas farmacéuticas, debido a su indicación como hipolipemiante regularmente escasea |
| Agentes serotoninérgicos | ||
| Antagonistas 5-HT3 | ||
| Ondansetrón | Se recomienda su uso en los pacientes con SII-D. Mejora la frecuencia y la consistencia de las heces, así como el dolor abdominal | Adecuada. Comercializada por múltiples. empresas farmacéuticas |
| Agonistas 5-HT4 | ||
| Prucaloprida | Aunque su uso está aprobado para EC, se puede utilizar en los pacientes con SII-E ya que hay evidencia de mejoría en el dolor, malestar abdominal y distensión subjetiva | Exclusiva. Comercializada por una sola empresa farmacéutica |
| Mosaprida | Se puede utilizar en SII-E. Evidencia escasa | Exclusiva. Comercializada por una sola empresa farmacéutica |
| Secretagogos | ||
| Linaclotida | Se recomienda su uso para el manejo del SII-E. Mejora la consistencia y la frecuencia de evacuaciones, dolor y distensión abdominal. Se puede utilizar como tratamiento de primera línea | Exclusiva. Comercializada por una sola empresa farmacéutica |
| Lubiprostona | Se recomienda su uso para el manejo del SII-E. Mejora la consistencia y la frecuencia de evacuaciones y dolor abdominal | Actualmente no disponible |
| Antibióticos no absorbibles | ||
| Rifaximina alfa | Se recomienda su uso para el manejo del SII-D y/o SII-M. Mejora otros síntomas como la distensión abdominal, las flatulencias, y urgencia para evacuar. Se puede utilizar como tratamiento de primera línea y repetir según sea necesario si hubo mejoría. En el caso de no responder al primer tratamiento no se recomienda repetir | Exclusiva. Comercializada por una sola empresa farmacéutica. Aunque existen otras formas de rifaximina comercializadas por múltiples empresas farmacéuticas, no corresponden al polimorfo alfa |
| Probióticos | Se recomienda como terapia adyuvante para el manejo «global» de los síntomas y el dolor abdominal. Puede mejorar otros síntomas como la distensión y las flatulencias | Exclusiva. Para las 2 cepas que tienen evidencia suficiente, ya que cada una es comercializada por una sola empresa farmacéutica, respectivamente |
| Terapias herbales | ||
| STW 5 | Se recomienda para reducir el dolor abdominal y los síntomas globales del SII | Exclusiva. Comercializado por una sola empresa farmacéutica |
| Menta piperita | Se recomienda para reducir el dolor abdominal y los síntomas globales del SII | Adecuada. Comercializada por múltiples empresas farmacéuticas |
| Neuromoduladores | ||
| Inhibidores selectivos de la recaptura de serotonina | Se recomienda como terapia de segunda línea en los pacientes con ansiedad, hipervigilancia, depresión concomitante y cognición malaptativa, siempre que el dolor y la diarrea no sean síntomas predominantes (SII-E) | Adecuada. Comercializada por múltiples empresas farmacéuticas |
| Antidepresivos tricíclicos | Se recomienda como terapia de segunda línea para el manejo del dolor abdominal y de la diarrea en el paciente con SII-D | Exclusiva. Comercializado por una sola empresa farmacéutica |
| Antidepresivos tetracíclicos | Se puede considerar su uso como terapia concomitante cuando el paciente tiene ansiedad y síntomas de sobreposición con dispepsia funcional. Evidencia limitada de su potencial uso en SII-D | Adecuada. Comercializada por múltiples empresas farmacéuticas |
| Inhibidores de la recaptura de serotonina y norepinefrina | Se recomienda como terapia de segunda línea para el manejo del dolor abdominal, en particular en los pacientes con SII-E. En los pacientes con ansiedad y depresión concomitante pueden iniciarse de primera línea | Adecuada. Comercializada por múltiples empresas farmacéuticas |
| Antidepresivos atípicos y otros | ||
| Trazodona | Se puede considerar su uso cuando coexista depresión y/o trastornos del sueño | Exclusiva. Comercializado por una sola empresa farmacéutica |
| Pregabalina | Se recomienda como terapia de segunda línea para tratar el dolor abdominal y la distensión en los pacientes con SII-D y SII-M. También puede usarse en los pacientes con SII con comorbilidades como fibromialgia y dolor de la pared abdominal | Adecuada. Comercializada por múltiples empresas farmacéuticas |
| Quetiapina | Se puede usar de forma complementaria cuando la monoterapia es insuficiente en dolor abdominal severo refractario a otros neuromoduladores en SII-D. Pacientes con dolor crónico con fibromialgia, insomnio y trastornos severos de ansiedad y depresión | Adecuada. Comercializada por múltiples empresas farmacéuticas |
| Sulpirida, levosulpirida | Sulpirida puede usarse como terapia concomitante para la reducción del dolor; sin embargo, actualmente faltan evidencias formales en el tratamiento del SII.Levosulpirida puede usarse en caso de sobreposición con dispepsia/gastroparesia | Sulpirida. Adecuada. Comercializada por múltiples empresas farmacéuticasLevosulpirida. Exclusiva, comercializado por una sola empresa farmacéutica |
| Trifluoperazina/isopropamida | Pudiera usarse como tratamiento de segunda línea en los casos de SII donde persiste el dolor asociado con la ansiedad. Podría considerarse su uso en los casos que también presenten DF con predominio de dolor epigástrico. Según su registro sanitario en México, también podría ser efectiva en el manejo de la aerofagia | Exclusiva. Comercializado por una sola empresa farmacéutica |
| Mesalazina | Podría ser útil para mejorar los síntomas globales del SII-D. En el SII-PI la mesalazina (en particular las formulaciones de acciones prolongadas) pudieran ser eficaces | Adecuada. Comercializada por múltiples empresas farmacéuticas |
EC: enfermedad de Crohn; DF: dispepsia funcional; SII: síndrome de intestino irritable. SII-D: SII predominio diarrea. SII-E: SII predominio estreñimiento; SII-M: SII predominio mixto. SII-PI: SII predominio postinfección.
Aunque existe diversos tipos de rifaximina, se insisten en el hecho de que el polimorfo alfa es el que tiene la evidencia adecuada.
Manejo farmacológico del síndrome de intestino irritable en México.
* Los probióticos se consideran como una terapia adyuvante.
** Se puede utilizar como tratamiento de primera línea y repetir según sea necesario si hubo mejoría. En caso de no responder al primer tratamiento no se recomienda repetir.
*** En los casos con síntomas moderados a intensos, la linaclotida pudiera considerarse como una terapia de primera línea debido a su efecto antinociceptivo.
El posicionamiento de la Asociación Mexicana de Gastroenterología (AMG) sobre el manejo del SII en México es un documento de gran relevancia para guiar a los profesionales de la salud en la toma de decisiones en la práctica clínica basadas en evidencia científica pero también de acuerdo con la disponibilidad local de los tratamientos. Este posicionamiento aborda de manera integral las recomendaciones terapéuticas según las diferentes clases de medicamentos, con base en su eficacia, seguridad y disponibilidad en el contexto clínico mexicano.
FinanciaciónLos laboratorios Alfasigma y Carnot proporcionaron el apoyo financiero en cuanto a logística, gastos de viaje y reunión presencial para todos los expertos de este documento. Ningún participante recibió honorarios para la realización de estas guías. Estas recomendaciones están avaladas por la AMG.
Conflicto de interesesJ.M. Remes-Troche es asesor y miembro de consejo consultivo para Asofarma, Carnot, PRO.MED.CS Praha a.s. y Pisa. Conferencista para Asofarma, Abbot, Carnot, Chinoin, Ferrer, Johnson y Johnson, Medix y Medtronic.
E. Coss-Adame ha sido conferencista para Asofarma, Alfa-Sigma, Megalabs, Astra-Zeneca, Carnot, Medtronic, Abbott, Chinoin y Grunenthal.
M. Schmulson es miembro del Consejo Consultivo de Daewoong Corea del Sur, Gemelli Biotech Inc. EE. UU., Moksha 8 México, y PRO.MED.CS Praha a.s. Ha sido ponente para Alfa SigmaMéxico, Armstrong México, Carnot, Daewoong Corea del Sur, Ferrer México/América Central, Medix México, Megalabs Ecuador, Tecnofarma Colombia/Bolivia y Medicamenta-Tecnofarma Ecuador. Materiales educativos para Carnot y Moksha 8.
K. García-Zermeño ha sido conferencista para Carnot, Ferrer, Megalabs y M8.
M.A. Valdovinos ha sido conferencista para Carnot, Megalabs, M8 y Bayer.
M. Amieva Balmori ha sido conferencista para Carnot, AstraZeneca, Asofarma y Alfasigma.
E.C. Morel Cerda ha sido conferencista para AstraZeneca y Megalabs.
A.S. Villar Chávez ha sido conferencista para Carnot, Asofarma, Alfasigma y Schwabe.
L.R. Valdovinos García ha sido conferencista para Carnot, AstraZeneca, Asofarma y Chinoin.
O. Gómez-Escudero ha sido conferencista para Carnot, Chinoin y Asofarma.
M. Icaza-Chávez y R. Carmona declaran no tener conflicto de intereses.
A. López-Colombo ha sido conferencista para Chinoin, M8, Europharma y PRO.MED.CS Praha a.s.