La esofagitis eosinofílica (EEo) es una enfermedad crónica, inmunomediada, caracterizada por la infiltración de eosinófilos en la mucosa esofágica. Es la causa más frecuente de disfagia e impactación alimentaria en los adultos. Por su fisiopatología, similar a la rinitis alérgica, asma y dermatitis atópica, se le ha considerado como la manifestación esofágica de la alergia. Se observa con mayor frecuencia en EE. UU., Europa y Australia. En estos países la incidencia y la prevalencia se han incrementado significativamente en las últimas 3 décadas al grado que algunos la consideran una epidemia. En México y Latinoamérica es una enfermedad poco diagnosticada, por lo que existe escasa información generada en nuestro país relacionada con esta enfermedad. Se desconoce con precisión cuales son los factores que pudieran explicar esta baja incidencia.
Por otra parte, globalmente ha habido una intensa investigación sobre la EEo en los últimos años, su fisiopatología ha sido mejor comprendida y se han afinado los procedimientos clínicos y endoscópicos para el diagnóstico. Además, se han introducido nuevos fármacos y formulaciones especiales de los ya existentes para el tratamiento, también se han evaluado estrategias más efectivas y simplificadas en el tratamiento dietético de estos pacientes.
El objetivo del presente trabajo es revisar el estado actual de la EEo en el mundo y en México, poniendo énfasis en los probables factores que intervienen en la baja incidencia registrada (medioambientales y técnicos) en nuestro país y, por otra parte, revisar los avances realizados en los últimos años de investigación sobre los diversos aspectos de la EEo.
Eosinophilic esophagitis (EoE) is a chronic, immune-mediated disease characterized by the infiltration of eosinophils into the esophageal mucosa. It is the most frequent cause of dysphagia and food impaction in adults. Due to its similar pathophysiology to allergic rhinitis, asthma, and atopic dermatitis, it has been considered the esophageal manifestation of allergy. It is more frequently seen in the United States, Europe, and Australia. Incidence and prevalence have increased significantly in those countries over the past three decades, to such a degree that some consider it an epidemic. The disease is infrequently diagnosed in Mexico and Latin America, and so little information on this disease is produced in our region of the world. The precise factors explaining this low incidence are unknown.
On the other hand, there has been intense research on EoE in other parts of the world in recent years. Its pathophysiology has been better understood and endoscopic and clinical procedures have been refined for making the diagnosis. In addition, new drugs and special formulations of existing ones have been introduced for treating the disease. Simpler and more effective dietary treatment strategies have also been evaluated.
The aim of the present work was to review the current status of EoE globally and in Mexico, emphasizing the probable factors (environmental and technical) that intervene in the low incidence recorded in our country. In addition, we conducted a review of the advances in research on the different aspects of EoE carried out in recent years.
La esofagitis eosinofílica (EEo) es una enfermedad crónica, inmunomediada, caracterizada por la infiltración de eosinófilos en la mucosa esofágica1. Desde su primera descripción en 1970 se ha observado un incremento exponencial en la incidencia y en la prevalencia en países de Europa occidental, Australia, Canadá y EE. UU.2,3. En México y Latinoamérica es una enfermedad poco común, y la mayoría de la información disponible proviene de estudios pequeños y series de casos.
En los últimos años la investigación mundial en torno a esta enfermedad se ha incrementado, permitiendo una mayor comprensión de los procesos fisiopatológicos, del diagnóstico no invasivo, del tratamiento y el seguimiento de los pacientes. El objetivo de esta revisión es el exponer los avances que se han hecho en años recientes en los diferentes aspectos de la EEo de manera global y de analizar los factores probablemente involucrados en la baja prevalencia de la enfermedad en nuestro país en función de la experiencia que, sobre esta enfermedad, existe en México y Latinoamérica.
DefiniciónLa definición de la EEo ha tenido algunas modificaciones a medida que ha aumentado el conocimiento sobre la enfermedad. La primera definición formal surgió en el primer consenso internacional para el diagnóstico y el tratamiento de la EEo en el año 2007. Allí se definió la EEo como un trastorno caracterizado por síntomas esofágicos en asociación con infiltración ≥15 eosinófilos/campo de alto poder (CAP) en la mucosa esofágica. En esta definición, la EEo y la enfermedad por reflujo gastroesofágico (ERGE) se consideraron entidades excluyentes entre sí, por lo que se requería la presencia de una prueba de medición de pH esofágico de 24h normal o la ausencia de respuesta al tratamiento con inhibidores de la bomba de protones (IBP), como criterios de diagnóstico4.
En el consenso internacional del año 2011 se reconoció un fenotipo diferente de la EEo con respuesta favorable al tratamiento con IBP. A esta entidad se le dio el nombre de eosinofilia esofágica sensible a IBP (EESIBP) para diferenciarla de la EEo5. Sin embargo, años después se descubrió que la EESIBP y la EEo tenían características clínicas y fisiopatológicas similares, y que los IBP tenían efecto antiinflamatorio sobre la vía inflamatoria Th2, similar al conferido por los esteroides6,7. Debido a esto, se aceptó que la EESIBP es parte del espectro de la EEo. En función de esto, en el consenso internacional del año 2018 se suprimió la falta de respuesta a los IBP como un criterio de diagnóstico1,8.
EpidemiologíaEn el contexto global, la EEo es más frecuente en los países de Europa, EE. UU., Canadá y Australia3. Afecta tanto a niños como adultos. En un metaanálisis reciente que incluyó 40 estudios poblacionales entre los años 1976 y 2022 se reportó una incidencia global de 5.3 casos/100,000 habitantes y una prevalencia de 40 casos/100,000 habitantes. En un subanálisis se observó que la prevalencia se ha incrementado de manera considerable en años recientes, entre los años 1976-2001 fue de 8.1 casos/100,000 habitantes y del 2017-2022 fue de 74.4 casos/100,000 habitantes2. Este incremento en la incidencia y en la prevalencia se ha considerado como una epidemia9; aunque no se ha determinado si se debe a una mayor búsqueda de la enfermedad o a un cambio en el comportamiento biológico del padecimiento o ambos.
La prevalencia varía con relación a las características clínicas de la población estudiada. En los pacientes con síntomas esofágicos en quienes se realiza una esofagogastroduodenoscopia (EGD) es del 6.5%, en pacientes con disfagia del 12-15% y en los que tienen impactación esofágica puede llegar hasta el 50%10–12.
La prevalencia en los países de América Latina y México es inferior a la descrita en las regiones antes mencionadas. Además, en estudios realizados en EE. UU., se observó significativamente menor prevalencia de la EEo en la población latina que en la caucásica13–15. En México y en Brasil, la prevalencia informada en pacientes con endoscopía superior por síntomas esofágicos fue del 1 y del 1.7%, respectivamente16,17. En otros estudios realizados en México, se encontró prevalencia del 4% en pacientes con síntomas de ERGE refractario y del 11% con impactación alimentaria. Estas cifras son significativamente inferiores a las descritas en otras latitudes18,19.
Se desconocen los factores involucrados en la baja prevalencia de EEo en nuestro subcontinente. Se han propuesto factores genéticos, ambientales, socioculturales y económicos los cuales se describirán más adelante20.
Factores probablemente involucrados con la baja detección de esofagitis eosinofílica en MéxicoLa Eeo es una entidad causada por la interacción de diversos factores de riesgo: genéticos, ambientales y no biológicos.
Factores genéticos y ambientalesGenéticosAlgunos de los genes relacionados con incremento en el riesgo de desarrollar Eeo son TSLP, CCL26 y CAPN14; los cuales tienen un importante papel en la regulación de la respuesta inmune y la migración de eosinófilos al epitelio esofágico21. El riesgo de desarrollar Eeo es mayor en los familiares de primer grado que en la población general, sin embargo, en estudios familiares y cohortes de gemelos, el peso de la herencia ha mostrado ser menor en comparación con los factores ambientales22.23.
Ambientales y socioculturalesDebido a que la EEo es una enfermedad alérgica cuya incidencia en los países desarrollados se ha incrementado a la par que otras enfermedades atópicas (rinitis alérgica, asma y dermatitis atópica), las causas medioambientales parecen tener mayor relevancia. Esta es la base de la «hipótesis de la higiene», propuesta por Okada et al. que sugieren que las modificaciones significativas del estilo de vida y del nivel socioeconómico que han sufrido algunas poblaciones en las últimas décadas han generado en los individuos, cambios en la tolerancia inmunoalérgica.
Los mecanismos a través de los cuales la «hipótesis de la higiene» intenta explicar estos fenómenos no están bien definidos, pero propone que el principal podría estar relacionado con una redirección inducida por la exposición a ciertos factores, de las reacciones inflamatorias Th1 y Th2. Los linfocitos T auxiliares en la vía inflamatoria Th1 producen citocinas inflamatorias, como la interleucina IL-2, el interferón-γ y el factor de necrosis tumoral alfa (TNF-α), que actúa sobre la inmunidad mediada por células. Por el contrario, los linfocitos T auxiliares de la reacción Th2 que producen las interleucinas IL-4, IL-5 e IL-13 contribuyen a la producción de inmunoglobulinas tipo E (IgE) y respuestas alérgicas mediadas por eosinófilos24.
En los países de Latinoamérica por razones socioculturales y económicas es más frecuente el nacimiento por vía transvaginal, y la alimentación al seno materno lo que podría contribuir a la menor incidencia de EEo25. Por otro lado, las infecciones por bacterias no letales en la infancia (entre ellas Helicobacter pylori) también se han propuesto como un factor protector de la EEo26. En un metaanálisis de 11 estudios se reportó un OR 0.63 con una reducción del 37% en el riesgo de EEo en los pacientes con exposición a H. pylori27. En población mexicana también se ha descrito esta asociación inversa, sin embargo, aún no se ha dilucidado si existe una relación causa/efecto o se trata de un epifenómeno28 (tabla 1).
Probables causas de la baja prevalencia de esofagitis eosinofílica en México
| Factores medioambientales | Factores técnicos |
|---|---|
| • Parto transvaginal | • Baja sospecha diagnóstica |
| • Alimentación al seno materno | • Manifestaciones clínicas atípicas (predominio de pirosis y regurgitación) |
| • Exposición a antibióticos en la infancia temprana | • Uso incorrecto de IBP |
| • Infección con bacterias no letales en la infancia | • EGD normal |
| • Alta prevalencia de H. pylori | • No suspensión de IBP previo a EGD |
| • Modificaciones de la microbiota digestiva | • Técnica inadecuada de toma de biopsias |
EGD: esofagogastroduodenoscopia; IBP: inhibidores de la bomba de protones.
En México, es razonable afirmar que en la baja prevalencia de EEo pueden también estar involucrados además de los factores medio ambientales ya discutidos, otros derivados de la practica medica tales como la baja sospecha diagnóstica por parte de los médicos (por insuficiente conocimiento de la enfermedad), las manifestaciones atípicas del padecimiento, la menor frecuencia de las alteraciones endoscópicas, deficiencias en la toma de biopsias esofágicas y al enmascaramiento de la EEo por el uso inadecuado de IBP, especialmente mediante la prueba diagnóstica con IBP29,30 (tabla 1). En apoyo a esto, en un estudio realizado en México se observó que de 186 pacientes con disfagia referidos para EGD, el 45.7% había recibido IBP antes del estudio y únicamente el 23.7% de los casos se tomaron biopsias de esófago (la American Gastroenterological Association [AGA] Abstracts, Gastroenterology S-358 DDW Chicago 2023). La baja proporción de pacientes en quienes se obtuvieron biopsias podría deberse a la baja frecuencia de anormalidades endoscópicas típicas de la enfermedad. Se ha observado en población mexicana que hasta el 32% de los pacientes con EEo tienen endoscopia normal en comparación con el 10% de los pacientes caucásicos31. Además, debido a la inflamación mucosa en parches de la EEo, la obtención de al menos 6 biopsias del esófago proximal y distal es necesaria para incrementar la posibilidad de diagnóstico8.
FisiopatologíaLa disfunción de la barrera epitelial, inflamación mediada por linfocitos Th2 y por diversas citocinas y la remodelación tisular son las características fisiopatológicas distintivas de la EEo32,33.
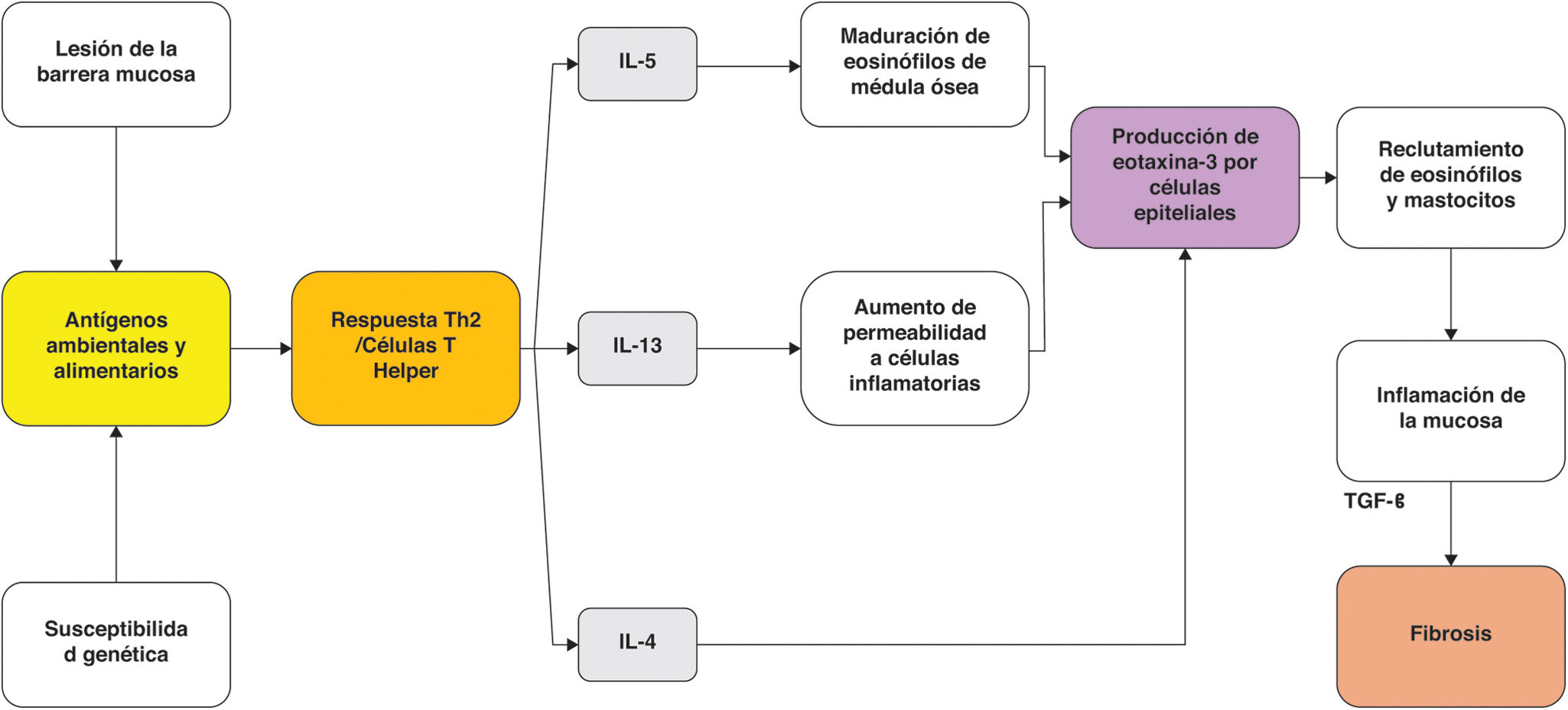
En condiciones normales no hay eosinófilos en la mucosa del esófago. En la EEo la exposición a alérgenos ambientales incrementa la actividad endógena de proteasas en el esófago lo cual resulta en disrupción de las uniones intercelulares epiteliales facilitando el acceso de alergenos principalmente alimentarios a las capas profundas de la mucosa33. Lo anterior desencadena respuesta inmunitaria inflamatoria mediada por linfocitos Th2. Estos linfocitos se sensibilizan liberando citocinas proinflamatorias como IL-4, IL-5 e IL-13 que inducen la infiltración de la mucosa esofágica por eosinófilos34,35. La IL-5 promueve la diferenciación, maduración y liberación de eosinófilos desde la médula ósea y facilita el transporte de eosinófilos al esófago. La IL-4 promueve la proliferación y la diferenciación de los linfocitos Th2, además tiene efecto inhibidor de la apoptosis36. Por otra parte, la IL-13 induce la secreción de eotaxina 1 y 337. Este agente es un potente reclutador de eosinófilos y mastocitos, cuya presencia provoca inflamación de la mucosa. La persistencia de la inflamación estimula la producción de fibrosis por actividad del TGF β en un proceso conocido como remodelación esofágica37 (fig. 1).
Características clínicasLa EEo afecta tanto a niños como a adultos. Las manifestaciones clínicas en los lactantes e infantes consisten en dificultad para alimentarse y retraso en el crecimiento; en los escolares predomina el vómito y el dolor retroesternal y en los adolescentes la disfagia. En los adultos predominan la disfagia y la impactación alimentaria que se han descrito como los síntomas capitales8,21,38. En los países desarrollados, la EEo se comporta como una enfermedad crónica con elevada tasa de recurrencia la cual con frecuencia progresa desde el fenotipo inflamatorio (en el cual predomina la inflamación de la mucosa esofágica, y es más frecuente en niños y en las fases iniciales en el adulto) al fenotipo fibroestenótico (en el cual predomina la estenosis esofágica el cual es más frecuente en los adultos), lo cual da como resultado impactación alimentaria12. La estenosis esofágica con impactación alimentaria es más frecuente a medida que aumenta la duración de la enfermedad, observándose en el 70% de los casos que han tenido actividad sintomática durante más de 2 décadas.
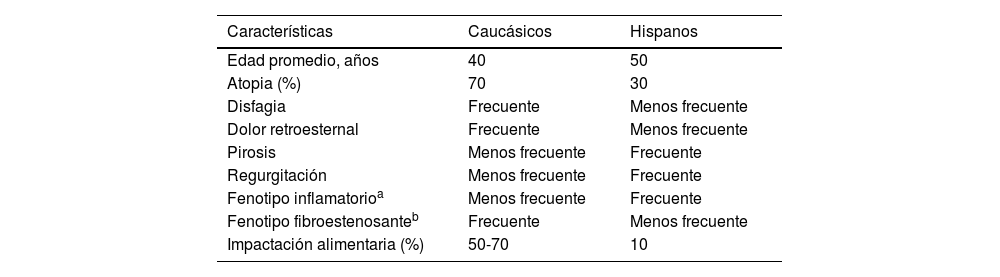
Por otro lado, en pacientes adultos de origen latino se ha observado un perfil clínico similar al reportado en otros países (varones, jóvenes, con disfagia y atopia), aunque con una mayor proporción de pirosis y regurgitación lo que evoca ERGE. En una serie de pacientes adultos mexicanos con EEo se encontró que hasta el 71% presentaba pirosis y/o regurgitación, el 61% disfagia y solamente el 18% había tenido algún episodio de impactación alimentaria31. En otro estudio realizado en los EE. UU. con 64 pacientes caucásicos, afroamericanos y latinos con EEo y con un seguimiento de 10 años se observó que los afroamericanos y los latinos presentaban una forma clínicamente atípica de la enfermedad caracterizada por: edad más avanzada, mayor frecuencia de síntomas de ERGE, menos disfagia para los alimentos sólidos, y menos anillos esofágicos en la endoscopia, en comparación con los caucásicos39. Estos resultados fueron confirmados posteriormente en un estudio multicéntrico de EE. UU. en 793 pacientes con EEo. Al igual que en el estudio previamente descrito los pacientes afroamericanos y latinos tenían una forma atípica de la enfermedad, dado que presentaban una menor frecuencia de disfagia (56 y 53% vs 74%) e impactación alimentaria esofágica (13 y 13% vs. 35%, respectivamente) que la población caucásica15 (tabla 2). La prevalencia de EEo observada en pacientes mexicanos con impactación alimentaria descrita por nuestro grupo fue también muy baja del 11% en comparación con el 48% en los países desarrollados19.
Diferencias clínicas y endoscópicas de la esofagitis eosinofílica entre los pacientes caucásicos e hispanos
| Características | Caucásicos | Hispanos |
|---|---|---|
| Edad promedio, años | 40 | 50 |
| Atopia (%) | 70 | 30 |
| Disfagia | Frecuente | Menos frecuente |
| Dolor retroesternal | Frecuente | Menos frecuente |
| Pirosis | Menos frecuente | Frecuente |
| Regurgitación | Menos frecuente | Frecuente |
| Fenotipo inflamatorioa | Menos frecuente | Frecuente |
| Fenotipo fibroestenosanteb | Frecuente | Menos frecuente |
| Impactación alimentaria (%) | 50-70 | 10 |
Las evidencias aportadas por los estudios discutidos sugieren que personas de origen latino tienen diferencias tanto en el tipo como en la severidad de las manifestaciones clínicas en comparación con los individuos caucásicos. Queda por determinar si existen diferencias en la historia natural de la enfermedad. Estos datos deben de tomarse en cuenta para sospechar la enfermedad, planear el abordaje de diagnóstico y establecer estrategias de seguimiento en pacientes de nuestra población.
DiagnósticoEl diagnóstico de la EEo se debe sospechar con la presencia de síntomas esofágicos (principalmente disfagia) en los pacientes jóvenes, de sexo masculino y con historial de padecimientos alérgicos. Sin embargo, se requiere obligadamente la demostración de infiltración intraepitelial eosinofílica (≥15 eosinófilos/CAP) en la mucosa del esófago excluyendo causas secundarias de eosinofilia esofágica1. El diagnostico diferencial más importante para la EEo es la ERGE que también puede provocar infiltración eosinofílica del esófago. Sin embargo, la infiltración observada en la ERGE en la mayoría de los casos no rebasa los 10 eosinófilos/CAP. Pero si existe duda en el diagnóstico se recomienda realizar monitorización de pH esofágico de 24h. No obstante, debido a la alta prevalencia de ERGE, ambas entidades pueden coexistir y actuar en forma sinérgica. La EEo puede favorecer el reflujo debido a trastornos de la motilidad esofágica y la ERGE puede facilitar la EEo dañando la barrera epitelial permitiendo la exposición de antígenos exógenos en la mucosa40,41.
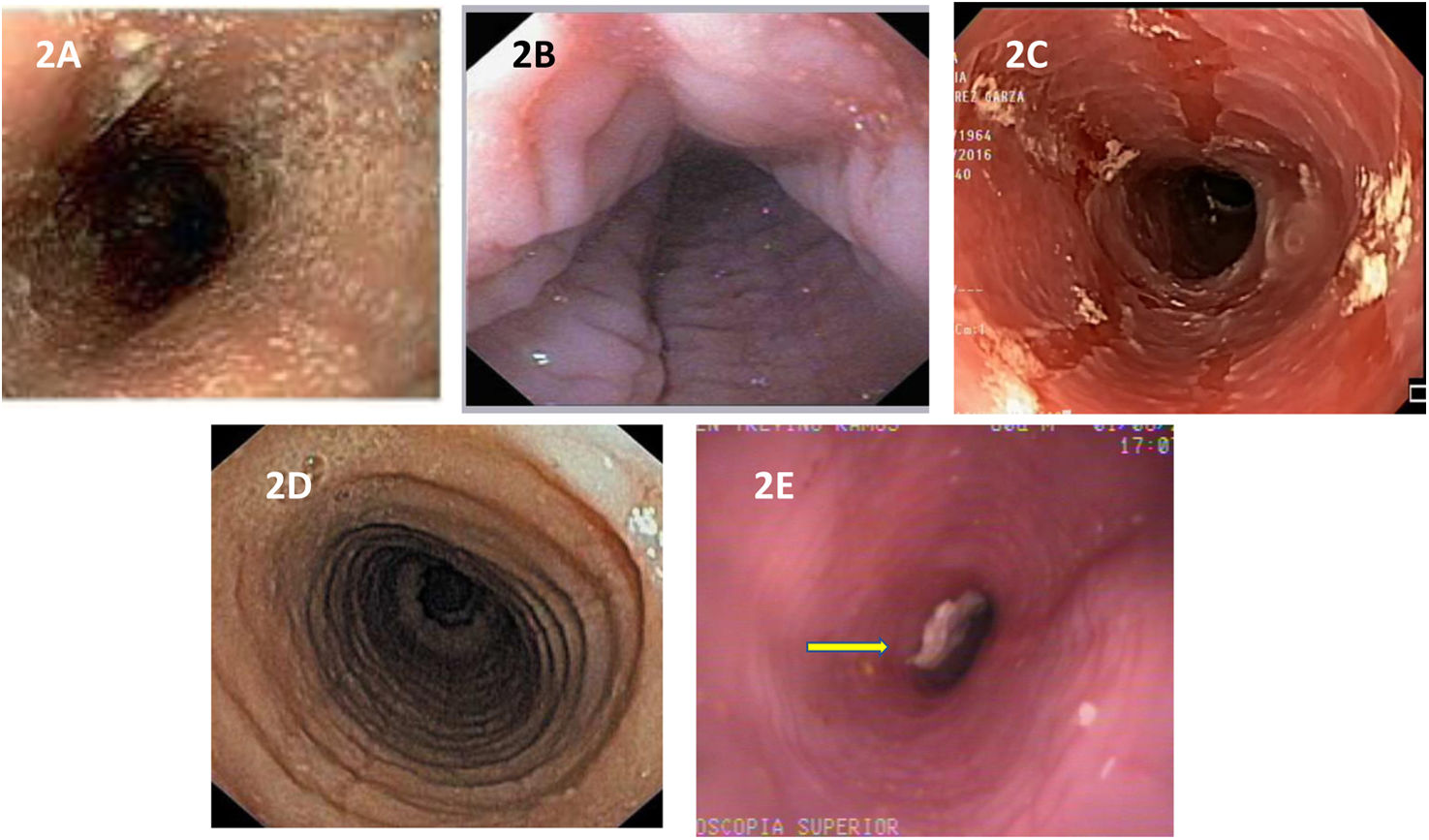
Características endoscópicasLas anormalidades endoscópicas típicas de la EEo se presentan entre el 70 y el 90% de los casos. Incluyen: edema, surcos lineales, anillos esofágicos, exudados blanquecinos y estenosis (figura 2A-E)42. Para la descripción y clasificación de estas alteraciones se utiliza el puntaje de referencia endoscópica EREFS (acrónimo en ingles de: edema, rings, exudates, furrows, strictures) que ha cobrado un papel importante en la práctica clínica desde su descripción en el año 2013 por Hirano et al.43. Actualmente es el sistema más aceptado para evaluar la actividad endoscópica en EEo y ha demostrado buena concordancia inter observador y correlación con la respuesta al tratamiento y la actividad histológica44–46. No obstante, la ausencia de anormalidades endoscópicas no descarta la enfermedad por lo que se necesita de un alto índice de sospecha por parte del endoscopista para decidir la toma de biopsias esofágicas.
Imágenes endoscópicas del esófago en los pacientes con EEo. 1: Fenotipo inflamatorio: A) Edema de la mucosa y exudados blanquecinos en la circunferencia del esófago; B) Surcos longitudinales y transversales en la mucosa, dándole un aspecto «esófago en piel de felino»; C) Esfacelación de la mucosa «mucosa en papel crepé». 2: Fenotipo fibroestenótico: D) Anillos circunferenciales de grado severo; E) Estenosis de la luz esofágica con impactación de alimento (flecha).
Por otro lado, debido a la distribución en parches de la enfermedad, las biopsias deben obtenerse del esófago proximal/medio y distal, idealmente sobre las zonas de inflamación, tomado como mínimo 6 biopsias47. Es imprescindible suspender la ingesta de IBP al menos 3 semanas antes de la endoscopia ya que estos fármacos pudieran enmascarar los hallazgos inflamatorios en la endoscopia y las biopsias29. Se recomienda, además, tomar biopsias del estómago y duodeno para descartar enfermedad celíaca o síndromes eosinofílicos gastrointestinales48–50.
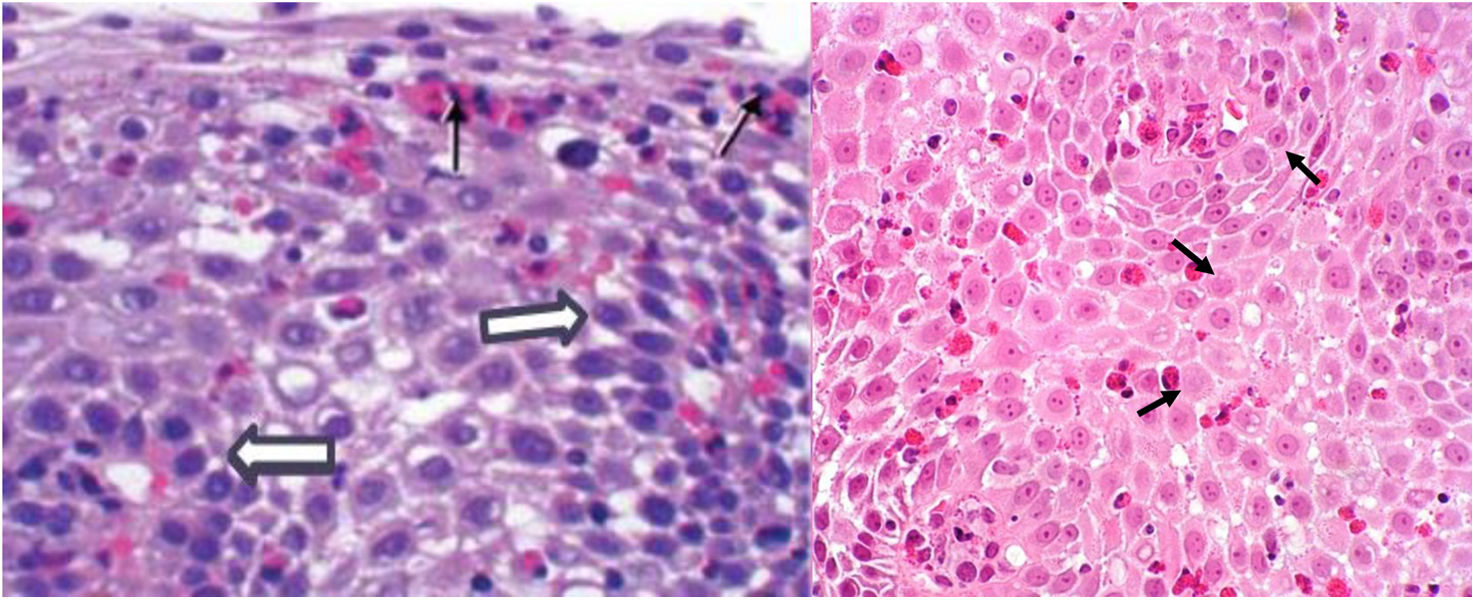
Características histopatológicasAdemás del infiltrado con una cuenta total pico de ≥15 eosinófilos/CAP en la mucosa del esófago, otras anormalidades histológicas descritas en esta enfermedad incluyen: la agrupación superficial de eosinófilos, la formación de microabscesos eosinofílicos, la desgranulación eosinofílica, espongiosis, hiperplasia basal epitelial y fibrosis subepitelial (fig. 3)51. Para afinar la precisión diagnostica por histopatología se ha desarrollado un puntaje de severidad histológica EoEHSS (eosinophilic esophagitis histological scoring system, por sus siglas en inglés) que toma en cuenta las otras características, además del conteo total pico de eosinófilos, para valorar la actividad de la enfermedad52. Esta ha demostrado ser una buena herramienta para el diagnóstico y la valoración de respuesta al tratamiento, teniendo buena concordancia con las anormalidades endoscópicas y una mejor correlación sintomática que el conteo total pico de eosinófilos53–55.
Aunque la actividad histológica se considera como el elemento fundamental en la progresión de la enfermedad y el desarrollo de estenosis e impactación alimentaria, en estudios terapéuticos se ha observado que existe una disociación entre el grado de actividad histológica con los síntomas, especialmente la disfagia56,57. La disfagia refleja con mayor claridad el grado de fibroestenosis esofágica que el grado de inflamación. Este dato es importante para evaluar en forma más racional el efecto terapéutico a corto y largo plazo de los tratamientos médicos.
Métodos emergentes/adyuvantes del diagnósticoLa sonda de imagen endoluminal funcional o endoFLIP (Functional Lumen Imaging Probe, por sus siglas en inglés) se ha introducido como un adyuvante novedoso en la valoración de pacientes con EEo. Este método permite medir la distensibilidad esofágica, la cual puede estar reducida en pacientes con EEo58,59. El endoFLIP es capaz de identificar estenosis parciales aun en los pacientes sin estrechamientos visibles en la endoscopia, por lo que el índice de distensibilidad aportado por este procedimiento tiene mayor capacidad predictiva independiente de impactación alimentaria que la actividad inflamatoria. Este procedimiento puede ser útil en la planeación de dilataciones endoscópicas en los pacientes con disfagia persistente60–62.
Por otro lado, debido a que el diagnóstico y la evaluación de la actividad de la enfermedad requieren obligatoriamente de EGD, se han implementado técnicas no invasivas para la obtención de muestras esofágicas. La citoesponja consiste en una cápsula unida a un hilo la cual deglute el paciente, la cápsula se disuelve y libera una esponja la cual al retirar con la tracción del hilo toma muestras de la mucosa esofágica. Con este método se logró obtener, en pacientes con EEo, muestras adecuadas de tejido en el 95% con una concordancia del 80% con la biopsia63. Otro método evaluado es el hilo esofágico (enterotest o string-test) el cual al ser deglutido permite la obtención de proteínas derivadas de eosinófilos, incluidas las proteínas secundarias de gránulos de eosinófilos. Esta prueba ha demostrado buena correlación con la infiltración eosinofílica por biopsia64.
También se ha evaluado el uso de biomarcadores para el diagnóstico y seguimiento de la EEo. Los candidatos más fuertes son las proteínas contenidas en los gránulos secundarios de los eosinófilos que incluyen a la peroxidasa de eosinófilos, la proteína básica mayor, la neurotoxina derivada de eosinófilos y la proteína catiónica de eosinófilos65-67. Sin embargo, aún no se ha definido el papel que juegan los biomarcadores en esta enfermedad.
Los métodos previamente mencionados continúan en desarrollo y se requiere de más investigación para validar su uso clínico definitivo. Probablemente en el futuro, jugarán un papel complementario en el diagnóstico y en el seguimiento junto con la endoscopia y la biopsia.
TratamientoEl tratamiento de la EEo en términos generales es médico y endoscópico, este último en función de las dilataciones esofágicas.
Existen 3 modalidades de tratamiento médico con efectividad probada: Los IBP, los esteroides tópicos y la terapia de eliminación dietética68. Los esteroides tópicos tienen mayor efectividad que los IBP y las dietas restrictivas. Sin embargo, cada uno tiene ventajas y desventajas, por lo que en la elección de tratamiento inicial se debe de tomar en cuenta además de la eficacia, la facilidad de administración, el apego esperado, el costo del tratamiento y la preferencia del paciente69. Por lo general se busca inducir la remisión histológica mediante tratamiento de 8 a 12 semanas. Una vez obtenida la remisión debe valorarse en forma individual la necesidad de dar tratamiento de mantenimiento con base en la severidad de la enfermedad.
El objetivo principal del tratamiento es la remisión histológica a un nivel <15 eosinófilos/CAP (de preferencia por debajo de 5) en las biopsias de esófago ya que este factor se asocia con mayor fuerza a la progresión de la enfermedad y al desarrollo de estenosis e impactación alimentaria. Sin embargo, también deberán incluirse como objetivos, la desaparición de los síntomas, la mejoría de la calidad de vida y la desaparición de las anormalidades endoscópicas70. Desafortunadamente, existe discordancia entre la remisión histológica y los síntomas esofágicos por lo que la endoscopia de control con toma de biopsia tiene por fuerza que realizarse.
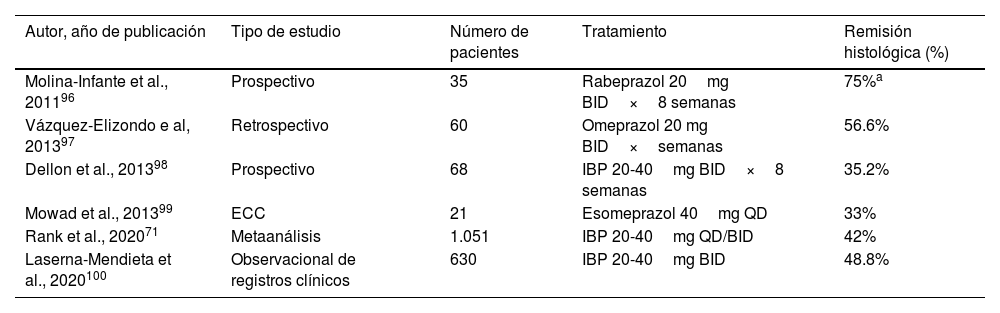
Inhibidores de la bomba de protones (tabla 3)Los IBP se consideran como el tratamiento de primera línea para la EEo en nuestro medio. En un metaanálisis con 23 estudios observacionales se observó una tasa del 42% de remisión histológica en los pacientes tratados con IBP vs. 13% de los tratados con placebo71. En otro metaanálisis de 33 estudios observacionales (11 prospectivos) se reportaron tasas de respuesta histológica con IBP del 50.5% (IC 95%: 42.2-55.7) y de respuesta sintomática del 60.8% (IC 95%: 48.38-72.2). Sin embargo, hubo heterogeneidad alta y sesgos de publicación en algunos estudios positivos72.
Estudios de eficacia de los IBP como tratamiento de inducción a remisión en la esofagitis eosinofílica
| Autor, año de publicación | Tipo de estudio | Número de pacientes | Tratamiento | Remisión histológica (%) |
|---|---|---|---|---|
| Molina-Infante et al., 201196 | Prospectivo | 35 | Rabeprazol 20mg BID×8 semanas | 75%a |
| Vázquez-Elizondo e al, 201397 | Retrospectivo | 60 | Omeprazol 20 mg BID×semanas | 56.6% |
| Dellon et al., 201398 | Prospectivo | 68 | IBP 20-40mg BID×8 semanas | 35.2% |
| Mowad et al., 201399 | ECC | 21 | Esomeprazol 40mg QD | 33% |
| Rank et al., 202071 | Metaanálisis | 1.051 | IBP 20-40mg QD/BID | 42% |
| Laserna-Mendieta et al., 2020100 | Observacional de registros clínicos | 630 | IBP 20-40mg BID | 48.8% |
ECC: ensayo clínico controlado; IBP: inhibidor de la bomba de protones.
Recientemente, se descubrieron propiedades antinflamatorias de los IBP. Estas incluyen, inhibición sobre la quimiotaxis de eosinófilos, disminución de la producción de radicales libres por células inflamatorias y reducción en la expresión de citocinas propias de la respuesta Th2 como la IL-131. Además, su efecto inhibitorio del ácido gástrico contribuye al restablecimiento de la integridad de la mucosa del esófago y menor exposición a antígenos alimentarios ligados a la respuesta Th273–75.
En conclusión, los IBP son una opción de tratamiento muy atractiva, debido a su bien establecida seguridad a largo plazo, buena tolerancia, bajo costo, administración oral y amplia disponibilidad. La administración de una dosis terapéutica cada 12h es suficiente para producir respuesta clínica e histológica y no parece haber diferencias terapéuticas entre los diversos IBP6. Los IBP ofrecen mejor respuesta en pacientes con fenotipo inflamatorio, no son efectivos en pacientes con fenotipo fibroestenótico o en aquellos en los que ya falló la terapia con esteroides y/o restricción dietética76. También la respuesta es mayor en pacientes que además de EEo tienen ERGE documentado por monitorización del pH esofágico en 24h. Al completar 8 semanas de tratamiento se debe repetir una endoscopia con toma de biopsias para corroborar la respuesta histológica.
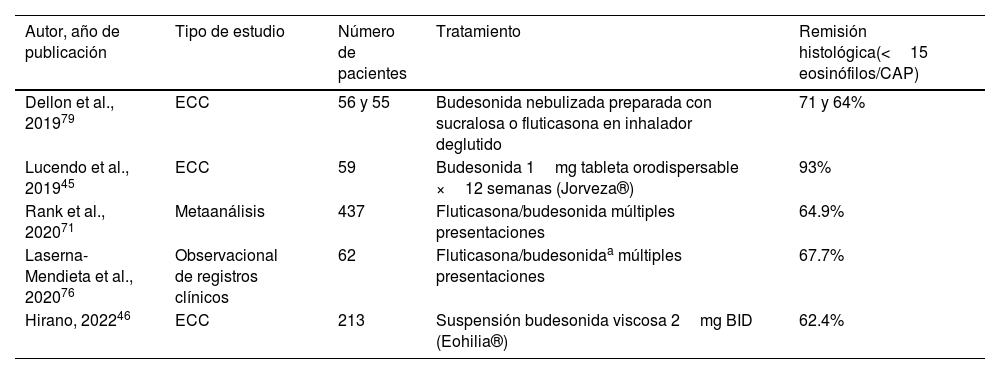
Esteroides tópicos (tabla 4)Los esteroides tópicos son los medicamentos que más frecuentemente se han utilizado en el tratamiento de EEo desde que se describió la enfermedad. Su potente efecto antiinflamatorio suprime la respuesta Th2 en el esófago. Los esteroides tópicos más estudiados son la budesonida y la fluticasona. Múltiples estudios demuestran su superioridad vs. placebo para inducir la respuesta histológica, endoscópica y sintomática77–79. Un metaanálisis de estudios con budesonida y fluticasona encontró tasas de respuesta histológica del 64.9% con una media de seguimiento de 8 semanas71. La dosis recomendada de budesonida es de 1 a 2mg/cada 12h por vía oral y la dosis de fluticasona es de 880 a 1.760μg por día por vía oral.
Estudios de eficacia de los esteroides tópicos como tratamiento de inducción a remisión en la esofagitis eosinofílica
| Autor, año de publicación | Tipo de estudio | Número de pacientes | Tratamiento | Remisión histológica(<15 eosinófilos/CAP) |
|---|---|---|---|---|
| Dellon et al., 201979 | ECC | 56 y 55 | Budesonida nebulizada preparada con sucralosa o fluticasona en inhalador deglutido | 71 y 64% |
| Lucendo et al., 201945 | ECC | 59 | Budesonida 1mg tableta orodispersable ×12 semanas (Jorveza®) | 93% |
| Rank et al., 202071 | Metaanálisis | 437 | Fluticasona/budesonida múltiples presentaciones | 64.9% |
| Laserna-Mendieta et al., 202076 | Observacional de registros clínicos | 62 | Fluticasona/budesonidaa múltiples presentaciones | 67.7% |
| Hirano, 202246 | ECC | 213 | Suspensión budesonida viscosa 2mg BID (Eohilia®) | 62.4% |
ECC: ensayo clínico controlado.
La duración optima de tratamiento para obtener la remisión parece ser de 12 semanas en comparación con 6 semanas de acuerdo con un estudio aleatorizado (84.7 vs. 57.6%, respectivamente)45. El efecto adverso más común con esteroides tópicos es la candidiasis esofágica asintomática reportada en hasta 12-15% de los pacientes. La supresión de la función suprarrenal es rara79. Se ha señalado que los esteroides tópicos podrían ser más efectivos que los IBP en pacientes con mayor grado de inflamación esofágica y con fibroestenosis.
Desafortunadamente en México no se dispone de presentaciones galénicas específicas de esteroides tópicos para esta enfermedad por lo que la preparación artesanal del fármaco es necesaria. La budesonida en solución para nebulización indicada para tratamiento de asma puede mezclarse con sucralosa para darle consistencia viscosa y se administra por vía oral. La fluticasona puede administrarse en nebulizaciones deglutidas a la dosis de 880 a 1760μg por día. Es importante evitar la ingesta de líquidos o solidos 30min después de la administración del fármaco80.
Recientemente en EE. UU. se autorizó por la FDA una suspensión oral de budesonida (Eohilia®)46 y en Europa se autorizó una presentación en tableta oro dispersable de budesonida (Jorveza®)45. Sin embargo, el alto costo y la escasa disponibilidad de estos medicamentos hacen su uso privativo en nuestro país por ahora.
Terapia dietéticaExisten 3 tipos de terapia dietética en el tratamiento de la EEo: dieta elemental; dietas dirigidas por pruebas de sensibilidad alérgica y dietas de eliminación empírica de alimentos.
La dieta elementalConsiste en la administración exclusiva de formulaciones libres de alergenos. Tiene las tasas de respuesta más altas (90%), pero es cara, difícil de administrar y poco tolerada, además de que puede llevar a la sensibilización de novo y producir reacciones alérgicas agudas mediadas por IgE68. Por lo anterior es escasamente utilizada y se deja como último recurso terapéutico.
Las dietas de eliminación dirigidaSe basan en los resultados de las pruebas alérgicas (prueba del parche o el prick test o las pruebas de alergia alimentaria mediada por IgE sérico). Hay que señalar que la IgE no es mediadora en la patogénesis de la EEo. En cuanto a su efectividad, un metaanálisis de 11 estudios encontró tasas de respuesta histológica del 50.8%71. Otro metaanálisis encontró respuesta histológica del 45.7%81. Debido a la dificultad para implementar este tipo de dieta y la baja tasa de respuesta histológica prácticamente no se usa en forma amplia.
Las dietas de eliminación empíricaSe basan en la exclusión de alimentos alergénicos frecuentemente implicados en la EEo (lácteos, trigo, huevos, soya, frutos secos y mariscos). Existen varios tipos de dietas restrictivas: de 1, 2, 4 y 6 alimentos. La dieta más estudiada es la de 6 alimentos. A las 8 semanas de iniciada la dieta se debe corroborar la respuesta clínica e histológica y si es necesario se reintroducen secuencialmente los grupos alimenticios para encontrar al responsable. Cada vez que se reintroduce un grupo de alimentos se debe evaluar la respuesta histológica con endoscopia. Un metaanálisis de estudios con dieta restrictiva de 6 alimentos encontró tasas de respuesta histológica del 67.9%, los alimenticios más implicados fueron los lácteos, el trigo y los huevos71. La dieta restrictiva de 6 alimentos es difícil de implementar debido al bajo apego, además puede requerir al menos 7 endoscopias en intervalos de 8 semanas para evaluar el efecto de la reintroducción de alimentos por lo que la duración del proceso es de alrededor de un año. Por lo anterior es cara y molesta. Ante estas desventajas se han evaluado dietas restrictivas más simples de 4, 2 o incluso un alimento. Un metaanálisis reciente comparó dietas de eliminación de 6, contra 4 (lácteos, trigos, huevo y soya) y 1 alimento (lácteos) en 1762 pacientes niños y adultos con EEo, encontrando tasas de respuesta histológica y clínica del 61.3 y 92.8% con la eliminación de 6 alimentos, del 49.4 y 74.1% con la eliminación de 4 y del 51.4 y 87.1% con la de un alimento, respectivamente81,82.
En México no existe experiencia documentada con el uso de dietas de restricción empírica en el tratamiento de estos pacientes. La recomendación pragmática con base a los resultados del metaanálisis previamente descrito sería empezar con la eliminación únicamente de lácteos y en pacientes sin respuesta histológica favorable escalar a dietas más restrictivas.
Terapia de mantenimientoEstudios demuestran que los pacientes con EEo sin tratamiento (ya sea porque nunca lo han recibido o dejaron de tomarlo después de obtenida la remisión histológica) tienen elevada recurrencia sintomática, histológica y endoscópica, reducción de la calidad de vida y alto riesgo de estenosis e impactación alimentaria83–86, por lo que se ha sugerido terapia de mantenimiento después de obtenida la remisión. Sin embargo, parece ser que no en todos los pacientes está indicada la terapia de mantenimiento y existen controversias con relación a cuáles pacientes pueden tener mayor beneficio. Por otro lado, no se ha determinado cuál es el fármaco que confiere el mejor efecto a largo plazo. Las guías de la AGA recomiendan terapia de mantenimiento con dosis bajas de esteroides tópicos, con base en un estudio aleatorizado que comparó la administración de 0.25mg de budesonida 2 veces al día durante un año vs. placebo, en pacientes con respuesta inicial a esteroides. Este estudio observó menor carga de eosinófilos tisulares en el grupo con budesonida vs. grupo con placebo, pero en solo el 36% de los pacientes se mantuvo la remisión histológica al año87. Recientemente, Straumman et al. en un estudio en pacientes con EEo tratados con budesonida oro dispersable (la nueva presentación del fármaco) a la dosis de 1mg y 0.5mg diarios contra placebo, demostraron mantenimiento de la remisión a 48 semanas en el 80, 80.4 y 5.3% en los pacientes, respectivamente88.
Para pacientes con IBP o con dietas restrictivas, la decisión de mantener el tratamiento a largo plazo es más difícil ante la ausencia de evidencias robustas. En estos casos, la decisión debe tomarse en conjunto con el paciente y los familiares, entendiendo que probablemente exista beneficio. Si se decide suspender el tratamiento de mantenimiento (cualquiera que éste sea) se debe mantener la observación estrecha clínica y endoscópica en busca de reactivación de la enfermedad.
Tratamientos biológicosEl dupilumab es un anticuerpo monoclonal humano, de tipo IgG4 dirigido contra el receptor de la IL-4 y la IL-13, citocinas implicadas en la respuesta inflamatoria de tipo Th2 relacionada con la patogénesis de la EEo. Desde hace tiempo, se usa para el tratamiento de dermatitis atópica, asma, rinosinusitis crónica con pólipos nasales y recientemente ha sido aprobado por la FDA para la EEo. Este medicamento demostró en un ensayo clínico controlado de fase III, remisión histológica (definida como reducción <6 eosinófilos/CAP) en el 60% en pacientes con EEo resistente a otras terapias después de 24 semanas de tratamiento con dosis subcutánea de 300mg/cada semana o 300mg/cada 2 semanas. Los efectos adversos más comunes fueron reacciones locales en el sitio de inyección e infecciones de vías aéreas superiores89. Una publicación reciente evaluó la experiencia en el mundo real del uso de dupilumab en pacientes con EEo refractaria a tratamiento y enfermedad fibroestenótica. Encontró mejoría sustancial de la respuesta histológica (<15 eosinófilos/CAP) en comparación con valores antes del tratamiento (80 vs. 11%; p≤0.001), del EREFS (4.62±1.84 vs. 1.89±1.31; p≤0.001) y del diámetro del esófago posdilatación (16.0±2.3 vs. 17.0±2.0; p≤0.001)90. El dupilumab es la opción de tratamiento más cara, por lo que se debe reservar para casos refractarios a las terapias convencionales o con padecimientos alérgicos severos concomitantes91.
Otros tratamientos biológicos que se han investigado o se encuentran actualmente en investigación, incluyen a los anticuerpos contra IL-5 (mepolizumab y reslizumab) los anticuerpos contra IL-13 (cendakimab) y anticuerpos contra el receptor de IL-5 (benralizumab)92. En relación con este último, en un estudio fase III, se observó respuesta histológica del 87.4 vs. 6.5% con placebo, pero sin mejoría sintomática o endoscópica93.
Dilatación esofágicaLa dilatación esofágica por endoscopia con bujías o balones puede ser necesaria en pacientes con EEo con estenosis esofágica y/o disfagia persistente a pesar de terapia médica. Ha demostrado ser un procedimiento efectivo y seguro47.
Un metaanálisis de estudios retrospectivos reportó mejoría clínica en el 95% de los pacientes con tasas bajas de perforación (0.38%) y requerimientos de hospitalización (0.67%). El efecto adverso más común fue dolor torácico en 23.6% de los casos y la mediana de duración de la mejoría sintomática fue de 12 meses94. El diámetro esofágico requerido para el alivio de disfagia es de 16mm. Se requieren varias sesiones con incrementos de 2mm cada vez para cumplir este objetivo. Un desenlace aceptable para dar fin a la sesión de dilatación es el desgarro de la mucosa47. La dilatación siempre debe de realizarse en conjunto con la terapia médica para mejores resultados, aunque la inflamación activa histológica no es una contraindicación para la dilatación.
No se ha demostrado que los dilatadores en bujía son mejores que los de balón95, por lo que la técnica empleada dependerá de la experiencia del endoscopista y de las características de la estenosis.
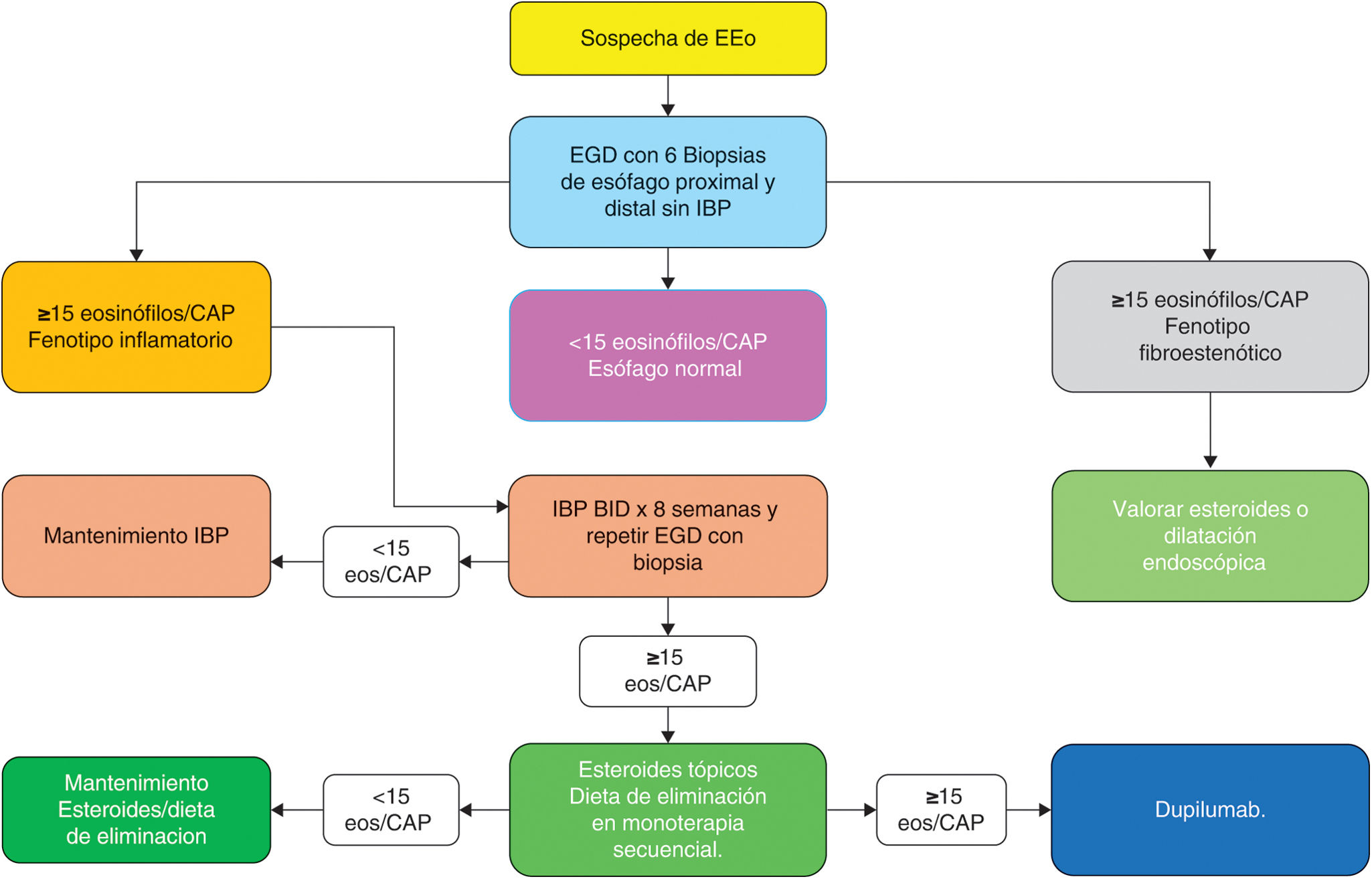
ConclusionesLa incidencia y la prevalencia de EEo reportadas en México y Latinoamérica son bajas en comparación con las observadas en los países desarrollados. La explicación de la baja prevalencia probablemente dependa en mayor proporción de factores ambientales que genéticos. Podrían intervenir diferentes grados de reactividad inmunológica a los alérgenos ambientales como resultado de la modificación de las vías de respuesta inflamatoria (Th1 y Th2) facilitados por factores socioeconómicos, culturales y étnicos propios de nuestra población. Otros factores importantes que hay que tomar en cuenta serían la pobre sospecha diagnóstica, el uso inadecuado de IBP, la no suspensión de IBP antes de la endoscopia y la omisión de biopsias en pacientes con perfil clínico sugestivo de EEo. Para corregir estas deficiencias técnicas se requiere una mayor difusión mediante educación continua con médicos generales, familiares y especialistas sobre la naturaleza de la enfermedad y las claves para sospecharla. Ante una sospecha razonable de EEo la conducta más adecuada sería evitar el uso de IBP de prueba y realizar una endoscopia con toma de biopsias y al confirmar el diagnóstico, iniciar un tratamiento acorde al fenotipo de la EEo. En la figura 4 se describe un algoritmo simplificado para el diagnóstico y el tratamiento de la EEo en nuestro medio.
En conclusión, se requieren más estudios en nuestra población mexicana y latinoamericana, de preferencia multicéntricos o multinacionales para caracterizar mejor el perfil clínico del paciente latino con EEo y definir los factores de riesgo, para aplicar estrategias de diagnóstico más adecuadas y dirigir el manejo terapéutico tomando en cuenta la disponibilidad de medicamentos y la relación riesgo y costo/beneficio en nuestros países.
Pese a que desconocemos con precisión los factores involucrados en la urgencia y en la progresión de la enfermedad en México, no dudamos que en el futuro la incidencia de esta patología se incrementará como ha sucedido en el pasado con otras enfermedades autoinmunitarias inicialmente raras (como la enfermedad inflamatoria intestinal), como consecuencia de la modificación de los factores ambientales y socioculturales de nuestra población.
Responsabilidades éticasLos autores declaran siendo este un artículo de revisión de la literatura, las consideraciones éticas no se aplican.
FinanciaciónNo se recibió financiación alguna para la realización de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.