Los pacientes con trastornos del eje intestino-cerebro, como el síndrome de intestino irritable (SII), a menudo muestran sobrecrecimiento bacteriano en el intestino delgado (SBID). Su tratamiento incluye rifaximina (RF), ciprofloxacino (CF), neomicina, sulfametoxazol-trimetoprima y metronidazol (MZ). La RF es un antibiótico no absorbible, que se ha observado que tiene pocos efectos secundarios. Nuestro objetivo fue evaluar la respuesta sintomática y la erradicación del SBID en pacientes con SII, utilizando 3 regímenes antibióticos.
MétodosSe realizó un estudio doble ciego, aleatorizado y prospectivo con pacientes con SII mayores de 18 años, utilizando el cuestionario de Roma IV y la prueba de aliento con lactulosa. Los pacientes diagnosticados con SBID fueron asignados aleatoriamente para recibir tratamiento con antibiótico. El grupo A recibió tratamiento con RF, el grupo B con CF y el grupo C con MZ, cada uno durante 10 días. La respuesta al tratamiento fue evaluada en función de la tasa de erradicación del SBID 15 días después de completar la terapia, utilizando pruebas de aliento con hidrógeno y metano con lactulosa. Los síntomas autorreportados fueron registrados en una escala de Likert de 10 puntos, antes, durante y después del tratamiento.
ResultadosSe incluyó a 97 pacientes con SII y SBID, de los cuales el 81% completó el tratamiento. El 59% de los pacientes tratados con RF logró la erradicación del SBID, frente al 53% y 79% de los pacientes tratados con CR y MZ, respectivamente. En el grupo de metronidazol los niveles de metano disminuyeron más que en los otros 2 grupos. Sin embargo, la mayor disminución en dolor abdominal e inflamación fue observada en el grupo de RF, con un menor porcentaje de eventos adversos.
ConclusionesLos pacientes con SII y SBID se benefician de la terapia con antibióticos. El MZ mostró la mejor tasa de erradicación de SBID, pero la RF mostró una mejoría sintomática más importante y una menor tasa de eventos adversos.
Patients with disorders of the gut-brain axis, such as irritable bowel syndrome (IBS), often exhibit small intestinal bacterial overgrowth (SIBO). Its treatment includes rifaximin (RF), ciprofloxacin (CF), neomycin, sulfamethoxazole-trimethoprim, and metronidazole (MZ). RF is a non-absorbable antibiotic, postulated to have fewer adverse effects. Our aim was to assess symptomatic response and SIBO eradication in patients with IBS, using three antibiotic regimens.
MethodsA prospective, randomized, double-blind study was conducted on IBS patients over 18 years of age, utilizing the Rome IV questionnaire and lactulose breath test. Those diagnosed with SIBO were randomly assigned to receive antibiotic treatment. Group A was treated with RF, group B with CF, and group C with MZ, each for 10 days. Treatment response was evaluated based on the SIBO eradication rate 15 days after completing therapy, utilizing hydrogen and methane breath tests with lactulose. Self-reported symptoms were recorded on a 10-point Likert scale before, during, and after treatment.
ResultsNinety-seven patients with IBS and SIBO were included, 81% of whom completed treatment. Fifty-nine percent of the patients treated with RF achieved SIBO eradication, compared with 53% and 79% of those treated with CR and MZ, respectively. Metronidazole reduced more methane levels, compared with the other groups. However, the greatest reduction in abdominal pain and bloating was observed in the RF group, with a lower percentage of adverse events.
ConclusionsPatients with IBS and SIBO benefit from antibiotic therapy. MZ exhibited the best SIBO eradication rate, but RF demonstrated greater symptomatic improvement and a lower rate of adverse effects.
Las enfermedades del eje intestino-cerebro (EIC) se definen como alteraciones en la comunicación de la microbiota del EIC, las cuales se manifiestan como síntomas digestivos crónicos y recurrentes. El síndrome de intestino irritable (SII) es el más común y se define según los criterios de Roma IV como un dolor abdominal crónico asociado con cambios en el hábito intestinal, en los patrones de defecación, o ambos, con una duración de al menos 12 semanas en los últimos 6 meses1. El SII representa el 28% de las consultas gastroenterológicas en Estados Unidos. De manera local, una encuesta de los criterios de Roma II aplicada aleatoriamente en Santiago de Chile mostró una incidencia similar, con 29% para SII y 64% para síntomas digestivos compatibles con un trastorno funcional2.
El origen de los síntomas es multifactorial y varios mecanismos fisiopatológicos han sido demostrados en estos pacientes. Estos incluyen la presencia de sobrecrecimiento bacteriano en el intestino delgado (SBID), el cual ha sido descrito en hasta en el 78%3–7. El diagnóstico de SBID se define como la presencia de más de 10^3 unidades formadoras de colonias (UFC) en la luz del intestino delgado, determinadas por medio de cultivos de aspirado yeyunal4,8,9. Sin embargo, existen técnicas indirectas menos invasivas como las pruebas de aliento, que detectan productos del metabolismo bacteriano con varios hidratos de carbono (lactulosa, xilosa o glucosa), como son el hidrógeno y el metano9–11.
El SBID provoca síntomas que principalmente incluyen alteraciones en los hábitos intestinales, inflamación, dolor abdominal, y de manera poco frecuente, en casos severos, malabsorción. Estos síntomas pueden coincidir con síntomas de otros trastornos del EIC. Ante la presencia de SBID las guías clínicas sugieren dirigir las estrategias de terapia a las causas posibles, las cuales se reporta que incluyen estreñimiento crónico, daño hepático crónico, obesidad y esclerosis sistémica, entre otras12. Existe evidencia en la literatura de que los tratamientos con antibióticos ayudan a mejorar los síntomas de estos pacientes, una vez que el SBID ha sido erradicado, especialmente en casos recurrentes, atribuido a la presencia de disbiosis en el intestino delgado13.
Se recomiendan múltiples antibióticos para el tratamiento del SBID, los cuales incluyen metronidazol y ciprofloxacino, ambos con una tasa de respuesta de cerca del 50%14. El uso de la rifaximina está creciendo rápidamente en el entorno médico. Es un antibiótico no absorbible de amplio espectro, administrado por vía oral, que ha probado ser efectivo para tratar microorganismos aeróbicos y anaeróbicos, grampositivo y gramnegativo, con un perfil de seguridad más favorable. Algunos estudios han reportado una tasa de erradicación del 84% para SBID y una mejoría en los síntomas con un rango del 33% al 92% en pacientes con SII15. Sin embargo, en nuestro entorno, la tasa de respuesta para estos antibióticos y su tolerancia oral, con respecto a los síntomas asociados al SII, se desconoce. Por lo tanto, nuestro objetivo fue comparar el uso de rifaximina con el de metronidazol y ciprofloxacino como tratamiento para el SBID en pacientes con SII y determinar su efecto en la disminución de síntomas digestivos.
MétodosSe realizó un estudio prospectivo, longitudinal, aleatorizado, de doble ciego, con pacientes mayores de 18 años que presentaran un panorama clínico compatible con el SII, según los criterios de Roma IV1.
Se utilizó la lista de verificación CONSORT. El diagnóstico de SBID fue confirmado por medio de la prueba de aliento de hidrógeno y metano con lactulosa, en el Laboratorio de Enfermedades Funcionales del Hospital Clínico de la Universidad de Chile. El cuestionario de Roma IV para enfermedades gastrointestinales, validado en español, fue utilizado para el diagnóstico de SII2. Los pacientes fueron aleatorizados en ciego en 3 grupos: con tratamiento oral de 400mg de rifaximina-α cada 12horas por 10 días (grupo A), 500mg de ciprofloxacino cada 12horas por 10 días (grupo B) y 500mg de metronidazol cada 8horas por 10 días (grupo C). Los pacientes recibieron un kit que contenía la dosis del tratamiento correspondiente indicado solamente por un número, junto con un cuestionario de síntomas y un reporte de efectos adversos. Se levantó el ciego una vez que se utilizaron los 97 kits y se realizó el control de la prueba de aliento de hidrógeno y metano con lactulosa. Los criterios de exclusión fueron el uso de antibióticos en las últimas 12 semanas y/o uso de procinéticos en los últimos 15 días, pacientes con otras enfermedades gastrointestinales o cardiovasculares, diabetes, nefropatía o cirrosis, uso prolongado de fármacos cardiotónicos, mujeres embarazadas o dando pecho e individuos o miembros de la familia con alergia conocida a cualquiera de los antibióticos a utilizar en el ensayo.
Prueba de aliento de hidrógeno y metano con lactulosaTodos los pacientes se sometieron a una prueba de aliento de hidrógeno y metano, con lactulosa como sustrato, utilizando una técnica estandarizada por 180minutos8,9,15,16, al comienzo del estudio y 15 días después de completar el tratamiento antibiótico. Se les pidió a los pacientes hacer ayuno durante 12horas, seguir una dieta baja en hidratos de carbono 48horas antes de la prueba, no utilizar antibióticos en los 15 días anteriores a la prueba y evitar someterse a preparación intestinal para colonoscopia en el mes anterior. Se obtuvieron muestras de aliento de línea de base utilizando una jeringa con una boquilla, y después cada 10minutos, hasta completar 180minutos. Esto se realizó con la ingesta de 10g de lactulosa disuelta en 20ml de agua destilada. Las muestras fueron analizadas utilizando un cromatógrafo de gas (Quintron BreathTracker®, EE. UU.) y los resultados fueron expresados en partes por millón (ppm). Una prueba se consideró positiva para SBID cuando existieron 2 o más lecturas>20ppm de H2 o>10ppm de CH4 por encima de las líneas de base, durante los primeros 60minutos, o los valores de las lecturas fueron 20ppm por encima de la línea de base15.
Además, se evaluó el tiempo de tránsito orocecal (OCTT, por sus siglas en inglés), el cual corresponde al tiempo transcurrido entre la ingesta de lactulosa y el inicio de la curva de elevación después de 60minutos (rango normal de referencia 80-100). Dicho tiempo refleja el metabolismo de lactulosa por parte de la flora bacteriana normal del colon. En presencia de SBID se observan 2 elevaciones en la curva de la línea de base: una elevación temprana causada por la degradación de la lactulosa por parte de las bacterias del intestino delgado, y una segunda elevación sostenida determinada por el OCTT.
Evaluación de la respuesta clínica a la terapia y eventos adversosSe realizó diariamente una encuesta de autorreporte de síntomas al inicio del estudio, durante el estudio y 10 días después de completar el tratamiento. La encuesta evaluó la intensidad del dolor, la inflamación o meteorismo, el número de movimientos intestinales por día y la consistencia de las heces en función de la escala de heces de Bristol. Los síntomas fueron reportados usando una escala de intensidad de tipo Likert del 0 al 10. Los síntomas y los eventos adversos relacionados con los fármacos fueron registrados durante el periodo de ingesta del antibiótico, observando la presencia de síntomas digestivos como náuseas, ardor epigástrico, acidez, sabor metálico en la boca y vómitos. También se evaluaron los síntomas no digestivos como dolor de cabeza, dolor de articulaciones, erupción alérgica y fiebre.
Análisis estadísticoLa tasa de respuesta al tratamiento de comparación de los 3 grupos fue evaluada utilizando la prueba de Chi cuadrado. Los niveles de línea de base y de postratamiento de H2 y CH4 y el OCTT fueron comparados en los 3 tratamientos, utilizando la prueba no paramétrica de Kruskal-Wallis, después de la prueba de normalidad de D’Agostino-Pearson. Los niveles pretratamiento y postratamiento de H2 y CH4 durante la prueba de hidrógeno control fueron evaluados utilizando un modelo de efectos mixtos (ANOVA de 2 vías) con un postest Sidak para comparaciones múltiples. La reducción de síntomas fue evaluada en los 3 grupos de pacientes utilizando un modelo de regresión lineal, calculando las pendientes de los síntomas durante y después del tratamiento. La asociación entre el uso de drogas, la presentación de efectos adversos y la tasa de respuesta SBID fue evaluada utilizando la prueba Baptista-Pike para la razón de momios. Se consideró estadísticamente significativo el resultado con valor de p<0.05.
Consideraciones éticasSe solicitó a los pacientes su consentimiento informado para recibir el tratamiento y participar en la investigación descrita anteriormente. No se incluyó a menores de edad. El estudio fue aprobado por el Comité de Ética Científica del Hospital Clínico de la Universidad de Chile, con el número de aprobación OAIC No546/16. Los autores declaran que el presente artículo no contiene información personal que permita identificar a los pacientes.
ResultadosErradicación del sobrecrecimiento bacteriano del intestino delgado en respuesta a diferentes regímenes de tratamiento.
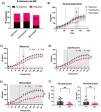
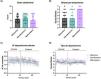
Noventa y siete pacientes fueron incluidos en el estudio: 32 en el grupo A, 32 en el B y 33 en el C. En la tabla 1 se describen las características clínica y demográficamente relevantes. De los 97 pacientes 41 (42%) cumplieron con los criterios para diagnóstico de SII-D, 36 para el diagnóstico de SII-E y 20 (21%) se consideraron SII-M. Los pacientes fueron asignados aleatoriamente a los 3 grupos de tratamiento, sin diferencias entre ellos. Del número total de pacientes, 27, 28 y 24 pacientes en los grupos A, B y C respectivamente, terminaron el estudio, sin diferencias en términos de edad, sexo o tipo de SII. Respecto a la erradicación del SBID (tabla 1), el 79% de los pacientes que recibieron metronidazol tuvo una prueba control de lactulosa sin SBID, en comparación con 59% del grupo rifaximina y el 54% de los tratados con ciprofloxacino (fig. 1A). En la comparación de los niveles de H2 en la prueba de aliento postratamiento el metronidazol redujo los niveles de H2 significativamente, en comparación con la rifaximina y el ciprofloxacino, haciendo mediciones a 120, 130 y 140minutos (valor de p=0.04, 0.03 y 0.04, respectivamente) (fig. 1B), sin diferencias en los tiempos restantes. No se presentaron diferencias postratamiento en la reducción de CH4 entre los 3 grupos (fig. 1A del material suplementario), o en los niveles pretratamiento de H2 y CH4 (figs. 1B y C del material suplementario).
Características clínicas de los pacientes, eficacia del tratamiento y efectos adversos. Los pacientes fueron aleatorizados en ciego en 3 grupos, recibiendo tratamiento oral con 400mg de rifaximina cada 12 horas por 10 días (grupo A), 500mg de ciprofloxacino cada 12horas por 10 días (grupo B) y 500mg de metronidazol cada 8 horas por 10 días (grupo C)
| Grupo A | Grupo B | Grupo C | ||
|---|---|---|---|---|
| Pacientes al inicio del estudio | 32 | 32 | 33 | |
| Pacientes al finalizar el estudio | 27 | 28 | 24 | |
| Pacientes perdidos en el seguimiento | 5 | 4 | 9 | |
| Edad mediana (rango) | 43 (20-68) | 42 (18-66) | 47 (20-66) | |
| Sexo (M:F) | (2:25) | (0:27) | (3:21) | |
| IMC | 26 (19- 46) | 25 (17-32) | 25 (17-37) | |
| OCTT de línea de base (min) | 80 (70-150) | 90 (70-140) | 85 (70-170) | |
| OCTT postratamiento (min) | 80 (60- 170) | 80 (60-120) | 70 (60-130) | |
| H2 de línea de base (ppm) | 16.56±23.17 | 12.33±15.09 | 21.42±18.64 | |
| H2 postratamiento | 11.04±14.89 | 11.63±13.78 | 8.04±13.92 | |
| CH4 de línea de base | 9.89±10.28 | 9.3±10.44 | 10.83±8.93 | |
| CH4 postratamiento | 9.81±10.11 | 6.44±7.02 | 6.83±10.09 | |
| SBID negativo postratamiento, n (%) | 16 (59%) | 15 (54%) | 19 (79%) | |
| SBID positivo postratamiento, n (%) | 11 (41%) | 13 (46%) | 5 (21%) | |
| Efectos adversos | Con base en el número total de pacientes por grupo | |||
| Total | N (%) | 3 (9%) | 13 (41%) | 13 (40%) |
| Náuseas | 0 | 4 (12%) | 6 (18%) | |
| Vómitos | 1 (3%) | 1 (3%) | 1 (3%) | |
| Diarrea | 0 | 1 (3%) | 2 (6%) | |
| Alergia/erupción | 0 | 2 (6%) | 1 (3%) | |
| Cefalea | 2 (6%) | 4 (12%) | 3 (9%) | |
| Fiebre | 0 | 1 (3%) | 0 | |
CH4: metano; F: femenino; H2: hidrógeno; IMC: índice de masa corporal; M: masculino; OCTT: tiempo de tránsito orocecal; SBID: sobrecrecimiento bacteriano de intestino delgado.
A) Tasa de erradicación del SBID en los grupos tratados con rifaximina (n=27), ciprofloxacino (n=28) y metronidazol (n=24). Los datos están graficados como número de pacientes. El rosa ilustra el porcentaje que logró erradicar SBID y el negro representa los que mantuvieron el SBID después del tratamiento. B) Los niveles de H2 en partes por millón (ppm), obtenidos al medir H2 y CH4 en aliento con lactulosa, en los sujetos después del tratamiento. Los valores están expresados como media con desviación estándar. Prueba con modelo de ajuste para efectos mixtos y post hoc de Tukey para comparaciones múltiples. *Valor de p<0.05. C) La comparación entre niveles de H2 en ppm antes y después del tratamiento antibiótico con rifaximina. Los valores están expresados como media y desviación estándar. Prueba con ANOVA de 2 colas y Bonferroni post hoc para comparaciones múltiples. *Valor de p<0.05. D) Comparación de niveles de H2 en ppm antes y después de tratamiento con ciprofloxacino. Los valores están expresados como media y desviación estándar. Prueba con modelo de ajuste para efectos mixtos y post hoc de Tukey para comparaciones múltiples. *Valor de p<0.05. E) comparación de niveles de H2 en ppm antes y después de tratamiento antibiótico con metronidazol. Los valores están expresados como media y desviación estándar. Prueba con modelo de ajuste para efectos mixtos y post hoc de Tukey para comparaciones múltiples. *Valor de p<0.05. F) Comparación de niveles de H2 y CH4 de línea de base en ppm antes y después del tratamiento con antibiótico con metronidazol. Los valores están expresados como mediana con rango intercuartílico y analizados con la prueba de Wilcoxon. **Valor de p<0.01.
Respecto a la producción de H2 y CH4 postratamiento, la rifaximina redujo la producción de H2 en la medida de los 80minutos, en comparación con la prueba de aliento pretratamiento (p=0.0492), sin diferencias en las medidas a otros tiempos (fig. 1C). El tratamiento con ciprofloxacino disminuyó significativamente los niveles de H2 a partir de los 40 minutos (p=0.0143) (fig. 1D). Por otro lado, observamos una disminución significativa en H2 (fig. 1E) y en CH4 (fig. 1F del material suplementario) en sujetos tratados con metronidazol, tanto en la línea de base (fig. 1F) como a los minutos 20 (p≤0.02) y 110 (p<0.05), respectivamente, hasta el final de la prueba, lo cual sugiere una reducción efectiva tanto del SBID como de la microbiota del colon que produce ambos gases. No observamos diferencias significativas en los niveles de CH4 pretratamiento y postratamiento en los grupos tratados con rifaximina o ciprofloxacino (figs. 1D y E del material suplementario). También determinamos el OCTT antes y después del tratamiento, sin observar diferencias entre los grupos y sin efectos adversos atribuibles al tratamiento con antibiótico (tabla 1).
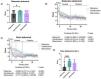
Respuesta sintomáticaNo existieron diferencias significativas respecto a los síntomas al inicio del estudio, en términos de la puntuación de la intensidad del dolor abdominal o la Escala de Heces de Bristol (figs. 2A y B del material suplementario). Sin embargo, los sujetos del grupo con ciprofloxacino reportaron una mayor intensidad de meteorismo antes del tratamiento antibiótico (fig. 2A). Utilizamos un modelo de regresión lineal para evaluar la sintomatología a lo largo del tiempo, en relación con cada antibiótico, observando una disminución significativa en la intensidad del dolor abdominal (fig. 2B) y meteorismo (fig. 2C) en todos los grupos durante el tratamiento, alcanzando el mínimo dolor abdominal al cuarto día de tratamiento con rifaximina (fig. 2D), en comparación con el ciprofloxacino. A la terminación del tratamiento, la puntuación para cada síntoma permaneció baja por 15 días previo a la prueba control de aliento, sin diferencias entre los grupos, independientemente de la erradicación del SBID. No se presentaron cambios en la frecuencia y consistencia de movimientos intestinales, de acuerdo con la Escala de Heces de Bristol, durante o después de los tratamientos (figs. 2C y D del material suplementario).
A) La escala de distensión abdominal previa al tratamiento en sujetos tratados con rifaximina, ciprofloxacino o metronidazol. Los valores están expresados como mediana y rango intercuartílico, analizados con la prueba de Kruskall-Wallis y post hoc de Dunn. *Valor de p<0.05. B) Distensión abdominal antes, durante y después del tratamiento antibiótico. Los valores están expresados como media con desviación estándar y se aplicó un modelo de regresión lineal para evaluar la disminución de síntomas a lo largo del tiempo, además de comparar las diferencias entre tratamientos. C) Dolor abdominal antes, durante y después del tratamiento antibiótico. Los valores están expresados como media y desviación estándar y se aplicó un modelo de regresión lineal para evaluar la disminución de síntomas a lo largo del tiempo, además de comparar las diferencias entre los tratamientos. El día 4 está en gris, donde se observa la mayor diferencia entre los tratamientos. D) La comparación de la escala de dolor abdominal al cuarto día después del tratamiento antibiótico de la figura 2C. Los valores están expresados como mediana y rango intercuartílico, y fueron analizados con la prueba de Kruskall-Wallis y post hoc de Dunn. ****Valor de p<0.001.
Solamente 3 de los 32 sujetos tratados con rifaximina (9%) reportaron efectos adversos debidos al tratamiento (tabla 1), 2 de ellos presentaron cefalea y uno presentó vómitos. Al contrario, 13 de los sujetos tratados con metronidazol y 13 de los tratados con ciprofloxacino reportaron efectos adversos (41% y 40%, respectivamente) (p=0.0026) que incluyeron náuseas y cefalea, al igual que otros efectos, aunque en menor medida.
DiscusiónLos pacientes con SII y SBID mostraron una mejoría de síntomas significativa con el uso de los diferentes antibióticos en nuestro estudio, y la presencia de SBID medida por medio del H2 se redujo. Los pacientes con SII a menudo experimentan síntomas relacionados con el SBID16, pero también pueden estar presentes en individuos aparentemente sanos, con una frecuencia del 3% al 20%10,12. El presente estudio evaluó la respuesta a 3 antibióticos (rifaximina, ciprofloxacino y metronidazol) en sujetos con SII y SBID, con miras a profundizar en nuestra comprensión de la efectividad de dichos tratamientos en una población chilena. Nuestros hallazgos coinciden con los de investigaciones anteriores, que sugieren que el SBID es una comorbilidad significativa en pacientes con SII. Nuestro grupo ha observado un alto porcentaje de SBID en pacientes con SII, dispepsia funcional e intolerancia a la lactosa, entre otras enfermedades17–20.
En nuestro estudio demostramos un alto porcentaje de erradicación de SBID en 3 grupos de pacientes tratados con antibióticos orales. También observamos una mejoría sintomática significativa durante el tratamiento en los 3 grupos, particularmente respecto al dolor abdominal y el meteorismo. Esto permaneció sin cambios a lo largo del estudio, independientemente de los resultados subsiguientes en las pruebas de aliento, lo cual nos llevó a concluir que otros mecanismos fisiopatológicos están involucrados, más allá del SBID. La rifaximina demostró ser particularmente efectiva al reducir síntomas después del tratamiento, independientemente de la erradicación de SBID, lo cual coincide con estudios previos que destacan su selectividad bacteriana y su perfil de seguridad21–25.
Al comparar la eficacia de los 3 antibióticos, en términos de erradicación del SBID, encontramos que el metronidazol tuvo mejor eficacia, en comparación con la rifaximina y el ciprofloxacino, mientras que estos 2 últimos mostraron respuestas comparables. Este hallazgo podría atribuirse a las diferencias en el espectro de actividad y la absorción en los tejidos de los antibióticos26–28. Un estudio sistemático, recientemente publicado29, demostró una mayor respuesta sintomática al SBID en pacientes con SII, como se observó en nuestro estudio. En un metaanálisis realizado por Shah et al.14, el 51% de los pacientes tratados con metronidazol presentaron remisión, identificada con una prueba de aliento. La tasa de remisión después del tratamiento con quinolonas es más difícil de evaluar debido al número limitado de estudios al respecto. Se sabe que el ciprofloxacino es efectivo contra las bacterias gramnegativas, mientras que el metronidazol es efectivo contra los microrganismos anaeróbicos o microaerofílicos. Otro estudio aleatorizado mostró que la normalización de la prueba de aliento ocurre más frecuentemente después del tratamiento con rifaximina que con el metronidazol (63.4% vs. 43.7%, respectivamente)30. Otro aspecto a considerar es el costo del tratamiento en Latinoamérica, lo cual nos motiva a buscar alternativas a la rifaximina. El precio promedio en Chile de un tratamiento de 14 días con metronidazol es de 4.80 dólares norteamericanos, en comparación con los significativamente más altos 70.9 dólares de la rifaximina.
Entre las limitaciones de nuestro estudio se encuentra no haber incluido un grupo placebo, lo cual nos puede haber llevado a sobrevalorar la mejoría de los síntomas relacionada con los tratamientos. Aunque los pacientes fueron aleatorizados sin saber qué tratamiento recibían, eran conscientes de que recibirían antibióticos. Aunque en la práctica clínica de rutina en Chile utilizamos 400mg 2 o 3 veces al día, el Instituto de Salud Pública Nacional solo ha aprobado la rifaximina a dosis de 200mg cada 8horas, o 600mg por día para el tratamiento de diarrea del viajero, pero no para SBID. Por lo tanto, para la presente intervención nuestro comité de ética aceptó un máximo de 800mg por día, o 400mg cada 12horas, sin exceder esta dosis, lo cual es similar a los 550mg cada 12horas recomendado internacionalmente. La eficacia de este régimen demostró ser similar a lo descrito en estudios con dosis de 550mg 2 veces al día. Esta dosis también ha sido probada en la población asiática, con buena respuesta.
Por otro lado, la duración limitada del seguimiento (15 días) podría no ser suficiente para evaluar la erradicación sostenida de SBID o la reaparición de síntomas futuros. Por lo tanto, se requieren estudios de mayor alcance en nuestra población para evaluar la durabilidad de la respuesta de los antibióticos que analizamos y para evaluar las posibles combinaciones terapéuticas. Nuestros hallazgos mostraron la efectividad de la rifaximina, reflejada en los niveles reducidos de hidrógeno, pero no de metano, a diferencia del metronidazol, el cual disminuyó los niveles de ambos gases. Por lo tanto, investigaciones futuras sobre el perfil de la microbiota intestinal resistente a terapia podrían contribuir a optimizar el uso de la rifaximina en esta población. En resumen, nuestro estudio destaca la efectividad de la rifaximina, ciprofloxacino y metronidazol para mejorar síntomas del SII en pacientes con SBID. Nuestros resultados respaldan la consideración de la rifaximina como el tratamiento de preferencia para el tratamiento de pacientes con SII y SBID, dada su eficacia y perfil de seguridad. Sin embargo, la elección del antibiótico debe estar basada en la evaluación individual del paciente y en el análisis de posibles efectos secundarios y resistencia bacteriana. Estos hallazgos respaldan de manera colectiva la necesidad de considerar el tratamiento con antibióticos en el manejo amplio de pacientes con SII. Sin embargo, se requiere de más investigación para mejorar nuestra comprensión de dichos tratamientos y optimizar las estrategias terapéuticas en casos de recurrencia.
Declaración de contribución de autoría CRediTCVM: Redacción, revisión y traducción. GL: Reclutamiento pacientes, procedimientos y análisis estadístico. AM: Idea original, Revisión, reclutamiento de pacientes.
Declaración sobre el uso de la IANo se utilizaron herramientas de IA.
FinanciaciónEl presente estudio fue financiado por la Sección de Gastroenterología del Hospital Clínico de la Universidad de Chile, con fondos internos destinados a la investigación.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.