Los inhibidores de la bomba de protones (IBP) son fármacos ampliamente conocidos, son utilizados con bastante frecuencia e indicados en múltiples enfermedades relacionadas al ácido, tanto a corto como a largo plazo.
ObjetivoEsta es una revisión de expertos que establece recomendaciones de buena práctica clínica para la adecuada prescripción y deprescripción de los IBP.
MétodosLas recomendaciones de buena práctica clínica se generaron por un grupo de expertos en uso de los IBP, miembros de la Asociación Mexicana de Gastroenterología (AMG), después de hacer una extensa revisión de la literatura publicada y de discutir cada recomendación en una reunión presencial. Este documento no pretende ser una guía de práctica clínica con la metodología que este formato requiere.
ResultadosUn total de 18 expertos en el uso de los IBP elaboraron 22 recomendaciones de buena práctica clínica para la prescripción a corto, largo plazo y a demanda, reconocimiento de efectos adversos y finalmente la deprescripción de los IBP en las enfermedades relacionadas al ácido.
ConclusionesActualmente, existe evidencia científica para el uso de los IBP en múltiples enfermedades, en algunas de ellas a corto plazo (4-8 semanas), en otras a demanda (por cortos periodos de tiempos hasta mejorar los síntomas) o a largo plazo (sin suspender). Se les han atribuido múltiples efectos adversos, sin embargo, la mayoría no tienen una asociación causal bien establecida. No obstante, los IBP debe ser suspendidos cuando no exista una indicación clara. Estas recomendaciones pretenden ayudar a médicos generales y especialistas en la prescripción y deprescripción de los IBP.
Proton pump inhibitors (PPIs) are widely known drugs that are used quite frequently and indicated in both the short and long terms, in numerous acid-related diseases. Our aim was to produce an expert review that establishes recommendations for the adequate prescription and deprescription of PPIs.
MethodsA group of experts in PPI use that are members of the Asociación Mexicana de Gastroenterología (AMG), after extensively reviewing the published literature and discussing each recommendation at a face-to-face meeting, prepared the present document of good clinical practice recommendations. This document is not intended to be a clinical practice guideline or utilize the methodology said format requires.
ResultsEighteen experts on PPI use developed 22 good clinical practice recommendations for prescribing short-term, long-term, and on-demand PPIs, recognizing adverse events, and lastly, deprescribing PPIs, in acid-related diseases.
ConclusionsAt present, there is scientific evidence on PPI use in numerous diseases, some in the short term (4-8 weeks), others on-demand (for short periods until symptoms improve), or in the long term (without suspending). Numerous adverse effects have been attributed to PPIs, but the majority have no well-established causal association. Nevertheless, PPIs should be suspended when there is no clear indication for their use. These recommendations aim to aid general physicians and specialists, with respect to PPI prescription and deprescription.
.
Los inhibidores de la bomba de protones (IBP) se encuentran entre los medicamentos más prescritos a nivel mundial; aproximadamente una cuarta parte de los pacientes que consumen IBP continúan tomándolos por al menos 1 año1 y en estudios observacionales dos terceras partes de los pacientes los toman sin una indicación apropiada2. En los últimos años, han surgido preocupaciones por la creciente prevalencia de los pacientes que reciben tratamiento con IBP a largo plazo, sobre los efectos adversos y su uso inadecuado. Por lo tanto, esta revisión tiene por objetivo hacer recomendaciones basadas en la evidencia científica reciente, discutida por un grupo de expertos para la adecuada prescripción y deprescripción de los IBP.
MétodosEsta revisión de 18 expertos fue comisionada por la Asociación Mexicana de Gastroenterología (AMG). Los especialistas se seleccionaron en función de su trayectoria académica docente, de investigación y asistencial con especial conocimiento en el uso y deprescripción de los IBP. Se realizó una extensa revisión de la literatura de los últimos 20 años sobre los IBP, indicaciones, dosis a corto y largo plazo, uso a demanda, efectos adversos, así como la deprescripción adecuada de los IBP. Los expertos se dividieron en 6 grupos de trabajo para revisar las publicaciones y elaborar recomendaciones sobre: 1) Definición de los IBP disponibles en México, diferencias farmacodinámicas y farmacocinéticas de los IBP; 2) Indicaciones y dosis de los IBP a corto plazo; 3) Indicaciones y dosis de los IBP a demanda; 4) Indicaciones y dosis de los IBP a largo plazo; 5) Efectos adversos a largo plazo con el uso de IBP y 6) Deprescripción de los IBP. La versión 1.0 de las recomendaciones realizadas por cada uno de los grupos fue discutida y votada por todos los expertos en una reunión presencial. La versión 2.0 de los enunciados, creada en la reunión presencial, fue nuevamente revisada y corregida por cada uno de los grupos dando por resultado la versión 3.0. Esta última fue sometida a una lectura final por todos los participantes para su aprobación y se generó el documento que aquí se presenta.
Inhibidores de bombas de protonesLos IBP H+-K+-ATPasa de las células parietales de las glándulas de la mucosa gástrica son derivados imidazólicos formados por anillos de piridina y benzimidazol unidos por un grupo metilsulfinil. El primero de los medicamentos con uso clínico aprobado en el año 1989 fue el omeprazol (OME); posteriormente se hicieron sustituciones en los anillos de piridina y/o benzimidazol para crear alternativas farmacológicas tratando de mejorar la rapidez y eficacia de estos fármacos, así como la prevención de posibles efectos colaterales.
Los IBP son bases débiles, lábiles al ácido, que necesitan protección con capa entérica o gránulos cubiertos, a veces en combinación con bicarbonato, para obtener una neutralización temporal del pH intragástrico que garantice su integridad y paso al duodeno para su absorción y mejor efecto; de ahí la importancia de que al ingerirlos no se abran las cápsulas o se fraccionen las tabletas. Una vez absorbidos llegan a través de la circulación sistémica a las células parietales de las glándulas gástricas que, a su vez, requieren la expresión canalicular activa de las bombas de H+-K+-ATPasa para que ocurra el enlace en respuesta a una comida3. No todas las bombas están activas al momento de una comida, por lo que solo dos terceras partes de las bombas pueden ser inhibidas y se requieren entre 3 a 5 días para poder obtener el máximo efecto de los IBP.
Los IBP se metabolizan en el sistema citocromo P450 (CYP450) en el hígado, teniendo como principales vías la del citocromo 2C19 (CYP2C19) y 3A4 (CYP3A4)4. Estas vías son compartidas con otros medicamentos y potencialmente puede haber interacciones con los IBP en menor o mayor grado5.
Por otra parte, a pesar de ser medicamentos seguros para el paciente, el uso de los IBP por periodos prolongados no está exento de eventos adversos. La mayoría de los eventos adversos se han descrito en estudios de asociación y solo en algunos se ha demostrado causalidad.
La llegada de los IBP estableció un paradigma en el tratamiento de todas las enfermedades relacionadas al ácido clorhídrico. Su superioridad con respecto a otros medicamentos en la prevención, así como en el control de los síntomas y la cicatrización de las erosiones y úlceras, su papel en el manejo de las complicaciones, así como su beneficio en la erradicación del Helicobacter pylori (H. pylori) está bien establecido6.
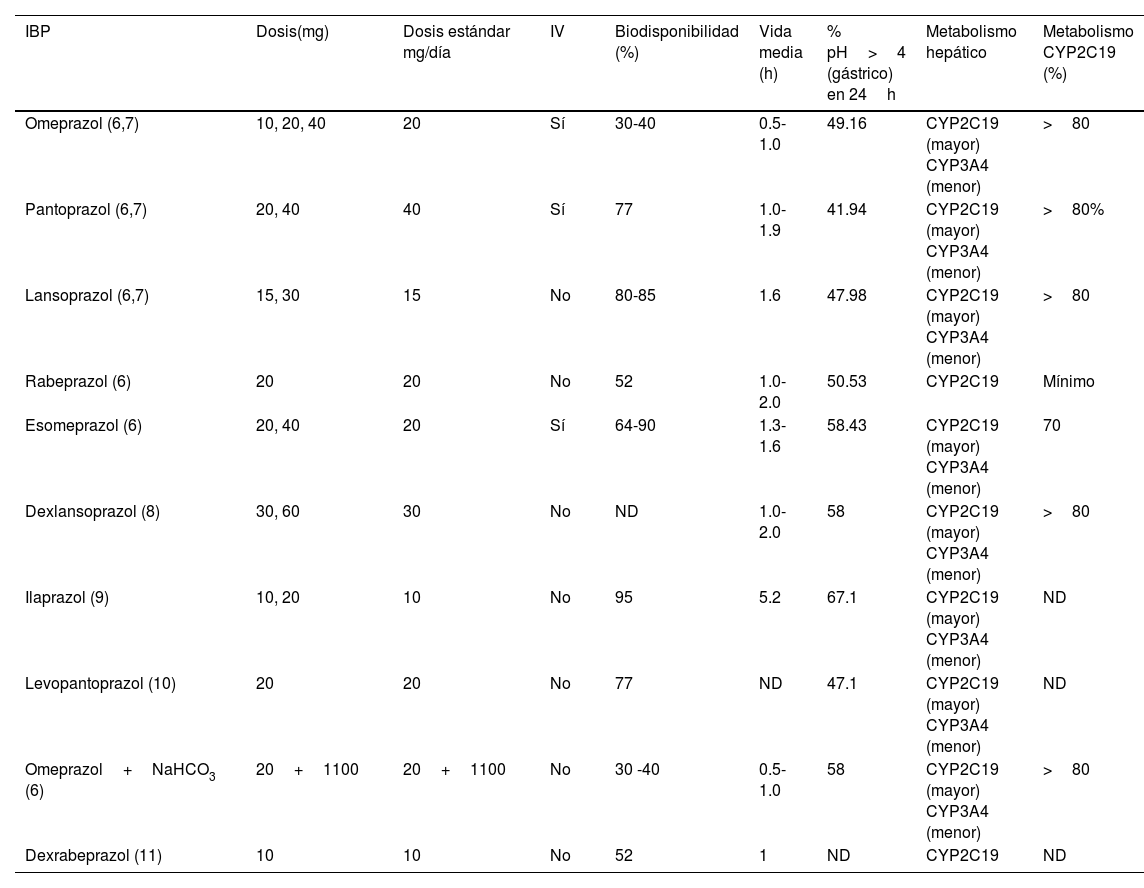
Los IBP que comercialmente se encuentran disponibles en México se agrupan en la tabla 1, incluyendo sus dosis, vía de administración, vida media y vía principal de metabolismo hepático.
IBP comercialmente disponibles en México y sus características farmacocinéticas y farmacodinámicas
| IBP | Dosis(mg) | Dosis estándar mg/día | IV | Biodisponibilidad (%) | Vida media (h) | % pH>4 (gástrico) en 24h | Metabolismo hepático | Metabolismo CYP2C19 (%) |
|---|---|---|---|---|---|---|---|---|
| Omeprazol (6,7) | 10, 20, 40 | 20 | Sí | 30-40 | 0.5-1.0 | 49.16 | CYP2C19 (mayor) CYP3A4 (menor) | >80 |
| Pantoprazol (6,7) | 20, 40 | 40 | Sí | 77 | 1.0-1.9 | 41.94 | CYP2C19 (mayor) CYP3A4 (menor) | >80% |
| Lansoprazol (6,7) | 15, 30 | 15 | No | 80-85 | 1.6 | 47.98 | CYP2C19 (mayor) CYP3A4 (menor) | >80 |
| Rabeprazol (6) | 20 | 20 | No | 52 | 1.0-2.0 | 50.53 | CYP2C19 | Mínimo |
| Esomeprazol (6) | 20, 40 | 20 | Sí | 64-90 | 1.3-1.6 | 58.43 | CYP2C19 (mayor) CYP3A4 (menor) | 70 |
| Dexlansoprazol (8) | 30, 60 | 30 | No | ND | 1.0-2.0 | 58 | CYP2C19 (mayor) CYP3A4 (menor) | >80 |
| Ilaprazol (9) | 10, 20 | 10 | No | 95 | 5.2 | 67.1 | CYP2C19 (mayor) CYP3A4 (menor) | ND |
| Levopantoprazol (10) | 20 | 20 | No | 77 | ND | 47.1 | CYP2C19 (mayor) CYP3A4 (menor) | ND |
| Omeprazol+NaHCO3 (6) | 20+1100 | 20+1100 | No | 30 -40 | 0.5-1.0 | 58 | CYP2C19 (mayor) CYP3A4 (menor) | >80 |
| Dexrabeprazol (11) | 10 | 10 | No | 52 | 1 | ND | CYP2C19 | ND |
IBP: inhibidores de la bomba de protones; ND: no disponible.
La deprescripción es un proceso clínico cuidadosamente planeado y supervisado que implica reducir o suspender medicamentos que no son útiles, necesarios, pueden causar daño o no proporcionan beneficios adicionales a largo plazo. El objetivo principal de la deprescripción es reducir la cantidad de medicamentos, minimizar los posibles daños y mejorar la calidad de vida del paciente. Sin embargo, este proceso puede ser difícil, especialmente si el medicamento no está causando daño aparente y el paciente está acostumbrado a su uso. En el caso específico de los IBP, hay poca evidencia sólida sobre cómo deprescribirlos de manera efectiva7,8.
Todos los pacientes que toman IBP deben someterse a una revisión periódica de las indicaciones a las 4 u 8 semanas del uso de estos medicamentos y en el caso de no existir una indicación, estos fármacos deben ser considerados para una estrategia de deprescripción8,9.
A continuación, se presentan algunas definiciones operacionales8–11:
- –
Deprescripción: proceso de reducción y/o suspensión de un medicamento tras considerar la indicación terapéutica, riesgos y beneficios.
- –
Deprescripción abrupta/rápida: suspensión total inmediata de un medicamento desde la dosis habitual.
- –
Tratamiento a demanda: administración de un medicamento decidida por el paciente con base en la presencia de síntomas. El paciente tomará el medicamento cuando presente síntomas y lo suspenderá al desaparecer las molestias.
- –
Tratamiento intermitente: administración diaria del antisecretor por períodos predeterminados, usualmente de 2-8 semanas, seguidos por el mismo tiempo de suspensión.
- –
Tratamiento largo plazo o continuo: cualquier forma de tratamiento ininterrumpido, sea a dosis doble o estándar.
- –
Deprescripción gradual: reducción de la dosis total diaria del antisecretor en forma paulatina, en un período determinado de tiempo, hasta llegar a la dosis mínima de mantenimiento que controle los síntomas. Puede dividirse en intermitente o dosis menor, la cual puede ser de dosis doble a estándar, de dosis estándar a cada tercer día, o dividida en 2-3 veces por semana.
El proceso de deprescripción de un medicamento consiste en una serie de 5 pasos11:
- 1.
Revisar indicaciones y efectividad.
- 2.
Evaluar el balance entre riesgo y beneficio de uso crónico.
- 3.
Evaluar las preferencias del paciente.
- 4.
Decidir si continuar, reducir dosis, o suspender el medicamento.
- 5.
Deprescribir y monitorizar.
Recomendación 1: En la enfermedad por reflujo no erosiva (ERNE) recomendamos los IBP a dosis estándar por 4 semanas.
El objetivo del tratamiento en la ERNE a corto plazo con los IBP es lograr un adecuado control sintomático, el cual se alcanza en el 50-60% de los pacientes, con una dosis estándar y con tasas de respuesta sintomática similares entre todos los IBP. Sin embargo, esta baja respuesta se puede explicar debido a la gran heterogeneidad, ya que la mayoría de los ensayos clínicos solo consideran como ERNE a los pacientes con síntomas típicos de enfermedad por reflujo gastroesofágico (ERGE) y endoscopia sin erosiones, sin realizar medición objetiva de reflujo por pHmetría12,13. En un metaanálisis se observó que la respuesta a corto plazo por 4 semanas de los IBP a dosis estándar en los pacientes con enfermedad erosiva (EE) fue del 72%, en ERNE sin pHmetría fue del 50% y en ERNE con pHmetría positiva del 73%, concluyendo que en los pacientes con ERNE bien definida, la tasa de respuesta a las 4 semanas con los IBP es comparable a la tasa de respuesta en los pacientes con EE14.
Recomendación 2: Se recomienda tratamiento de cicatrización para la ERGE con dosis estándar para esofagitis leves (Los Ángeles A y B) por 8 semanas, a dosis doble en esofagitis grave (Los Ángeles C y D) por 8 semanas, los pacientes con esofagitis grado B, C y D deberá pasar posterior a dosis de mantenimiento.
Los IBP son los fármacos de primera elección en la ERGE erosiva12. El objetivo del tratamiento es el control sintomático y la curación de la mucosa, lo cual se logra con el uso de IPB en casi el 80% de los casos de esofagitis erosiva a dosis estándar15. El uso de dosis doble se recomienda en aquellos que no responden al tratamiento con dosis estándar y en los casos con esofagitis grave (Los Ángeles C y D), con el propósito de lograr una mayor supresión ácida16.
En los casos de esofagitis erosiva grado B, C y D de Los Ángeles, se recomienda continuar con dosis de mantenimiento una vez pasadas las primeras 8 semanas del tratamiento para mantener la curación de la mucosa. En estos casos recurrencia de las erosiones puede ocurrir en tan solo 1 a 2 semanas después de la suspensión del IBP17, y recurrencia en casi el 100% de los casos de esofagitis grado C después de 6 meses.
La esofagitis grado A no se considera una complicación de la ERGE erosiva y menos del 60% de estos pacientes tiene síntomas de reflujo18, por lo que no se recomienda la terapia de mantenimiento.
Recomendación 3: En la dispepsia funcional (DF) para ambos subtipos (síndrome de malestar postprandial y síndrome de dolor epigástrico) los IBP se recomiendan a dosis estándar por 4 semanas.
Diferentes guías recomiendan como tratamiento de primera línea para los pacientes con DF la terapia estándar con IBP una vez al día durante 4 semanas19,20. Un metaanálisis de Cochrane, que incluyó 6172 pacientes de 18 ensayos clínicos aleatorios (ECA), confirmó que los IBP son más efectivos que el placebo en la reducción de los síntomas globales en la DF (RR: 0.88; IC 95%: 0.82-0.94; NNT 11). No hubo diferencia entre las dosis bajas y altas de IBP, el tipo de IBP y la presencia de H. pylori21. Recientemente un metaanálisis en red de 16 ECA con 6017 pacientes con DF, analizó la mejoría de síntomas con IBP a dosis baja <20mg, dosis estándar ≥20 a ≤30mg y dosis alta >30mg. Se concluyó que los IBP son más efectivos que el placebo tanto en el grupo de los IBP en dosis estándar (RR: 0.86; IC 95%: 0.78-0.95) como en dosis bajas (RR: 0.89; IC 95%: 0.81-0.97), sin beneficio con los IBP en dosis altas (RR: 0.86; IC 95%: 0.74-1.01)22.
Aunque los IBP son antisecretores, algunos estudios han demostrado que los pacientes con DF tienen incremento de la permeabilidad e inflamación duodenal, con infiltración de eosinófilos y mastocitos cerca de las neuronas del plexo submucoso23. Recientemente, en un estudio prospectivo, el pantoprazol a dosis de 40mg/día por 4 semanas no solo produjo una mejoría de los síntomas en los pacientes con DF, sino también una disminución de la permeabilidad y eosinofilia duodenal, así como del recuento de mastocitos, lo que podría explicar el efecto de los IBP en la DF24.
Recomendación 4: En la erradicación de Helicobacter pylori recomendamos dosis doble de los IBP por 14 días.
La supresión ácida inadecuada puede disminuir la eficacia del tratamiento de erradicación de la infección por H. pylori por medio de varios mecanismos. Con frecuencia, la dosificación óptima de los IBP se pasa por alto por lo que la prescripción adecuada de los mismos puede mejorar las tasas de erradicación de H. pylori. En caso de infección por H. pylori, el utilizar doble dosis de IBP y los esquemas de antibióticos adecuados durante 14 días puede aumentar la probabilidad de éxito en la erradicación de H. pylori25.
Recomendación 5: En hemorragia aguda de tubo digestivo alto no variceal recomendamos un bolo inicial intravenoso (IV) de IBP de 80mg seguido de infusión o dosis altas IV de IBP cada 12h.
El objetivo del tratamiento médico es mantener un pH intragástrico >6 con la finalidad de promover la agregación plaquetaria, estabilizar el coágulo y la cicatrización26. Los ensayos clínicos han demostrado que la infusión IV de dosis altas de IBP fue superior a placebo para disminución del riesgo de resangrado por úlcera péptica.
En los pacientes con hemorragia activa o hemorragia de tubo digestivo alto no variceal, un reciente metaanálisis de Laine et al. encontró un beneficio significativo del uso de IBP IV a altas dosis posterior a terapia endoscópica al disminuir el riesgo de hemorragia recurrente27; no obstante, en un metaanálisis más reciente de 6 ECA solo demostró una reducción en la necesidad de tratamiento endoscópico en la endoscopía índice sin que esto tenga un impacto en la mortalidad o necesidad de cirugía28. Dos consensos sugieren un esquema con dosis alta de IBP (80mg en bolo a dosis única seguido por infusión de 8mg/h durante 72h)29,30. No obstante, la dosificación intermitente en comparación con el esquema de bolo con infusión ha mostrado tasas de efectividad similares31.
Recomendación 6: En el tratamiento de la úlcera gástrica, se recomienda el uso de los IBP a dosis estándar por 4-8 semanas.
Desde la llegada de los IBP en la década de los noventa, múltiples ensayos clínicos demostraron que estos fármacos eran más eficaces que los antagonistas de los receptores de la histamina tipo 2 (ARH2) en el tratamiento de las úlceras gastroduodenales32, debido a su mayor potencia y duración de la inhibición de la producción ácida. La dosis recomendada es la dosis estándar (p. ej., esomeprazol 20mg, OME 20mg, pantoprazol 40mg, etc.) una vez al día. La resolución de los síntomas es rápida y en la mayoría de los pacientes la cicatrización se produce a las 4 semanas de tratamiento. Para aquellos pacientes que no cicatrizan por completo después del tratamiento inicial, la cicatrización ocurre generalmente durante las cuatro semanas siguientes de la terapia33,34. Si la úlcera estaba asociada a H. pylori es necesario dar el tratamiento de erradicación para evitar la recurrencia.
Los pacientes con úlceras (idiopáticas) negativas para H. pylori y sin consumo de medicamentos antiinflamatorios no esteroideos [AINE]/aspirina pueden tener una alta tasa de recurrencia y es probable que requieran un tratamiento a largo plazo (>8 semanas)35.
Recomendación 7: En el tratamiento de la úlcera duodenal, se recomienda el uso de los IBP a dosis estándar por 4 semanas.
A dosis estándar los IBP por 4 semanas, brindan tasas de cicatrización en el caso de úlceras duodenales por arriba del 90%32. La dosis recomendada en pacientes con úlcera duodenal activa es la estándar una vez al día. La resolución de los síntomas es rápida y en la mayoría de los pacientes se produce la cicatrización en 2 semanas26,32. Para aquellos pacientes que no cicatrizaron después del tratamiento inicial, la cicatrización ocurre generalmente durante las 2 semanas siguientes de tratamiento. En un metaanálisis de 24 ensayos clínicos controlados que incluyen 6,188 pacientes se demuestra que, en comparación con los ARH2, pantoprazol 40mg/día y lansoprazol 30mg/día por 4 semanas aumentan significativamente la tasa de curación (RR: 2.96; IC 95%: 1.78-5.14 y RR: 2.04; IC 95%: 1.13-3.53, respectivamente)36. Además, un metaanálisis en red demostró que no había diferencias significativas en la tasa de curación a las 4 semanas de la úlcera duodenal tratada con los diferentes IBP.
Al igual que en la ulcera gástrica, si existe infección por H. pylori, deberá de tratarse con el esquema de erradicación apropiado.
Recomendación 8: Se recomienda el uso de profilaxis con los IBP en los pacientes admitidos a la unidad de terapia intensiva con factores de riesgo para úlceras por estrés.
Las úlceras por estrés (parte de la enfermedad de la mucosa inducida por estrés) son una entidad que se presenta en los pacientes admitidos a la unidad de terapia intensiva (UTI) y representa una de las causas significativas de estancia prolongada, así como de mortalidad incrementada37. Se estima que aproximadamente del 75 al 100% de los pacientes a quienes se les realiza una endoscopía en las primeras 72h posterior a la aparición de entidades críticas presentan lesiones en la mucosa y clínicamente se presenta con manifestaciones como sangrado oculto positivo en heces, melena, emesis por sonda nasogástrica en posos de café hasta hematoquecia que condiciona inestabilidad hemodinámica38.
Estimaciones en metaanálisis sugieren que el sangrado clínicamente significativo se estima alrededor del 1% que, no obstante, su baja frecuencia, representa una causa de mortalidad significativa en este grupo de enfermos37. Los principales factores de riesgo incluyen la ventilación mecánica por más de 48h (RR: 15.6) y la presencia de coagulopatía (RR: 4.3)39. En diferentes metaanálisis, el uso de profilaxis en este grupo de enfermos reduce el riesgo en un 60%. No existe diferencia entre la frecuencia de los IBP (una o 2 veces al día), la dosis y la vía de administración (enteral vs. IV) para disminuir el riesgo de sangrado, por lo que se recomienda utilizar la dosis estándar y la duración se mantendrá hasta que el paciente ya no presente factores de riesgo37,40,41.
Indicaciones y dosis de IBP a demandaRecomendación 9: Recomendamos el uso de los IBP a demanda en el tratamiento de mantenimiento de la ERNE y de la esofagitis leve.
El tratamiento a demanda con los IBP consiste en que el paciente decide tomar la dosis de IBP cuando presenta síntomas de ERGE y lo suspende cuando desaparecen las molestias. Este esquema es diferente del tratamiento intermitente en el cual el médico prescribe una dosis diaria de IBP por un tiempo corto (1-2 semanas) independientemente de la presencia de síntomas. Se utilizan dosis estándar de los IBP y se recomienda utilizar la dosis mínima necesaria para controlar los síntomas12,42,43.
Las indicaciones de tratamiento con los IBP a demanda son dos: la ERNE y la esofagitis leve grado A de los Ángeles12,42,43. La eficacia de este tratamiento en ERNE y esofagitis leve ha sido evaluada en 2 metaanálisis recientes44,45. En el primero, se evaluaron 10 ECA con 4,574 pacientes en los cuales se comparó el tratamiento a demanda vs. tratamiento diario o placebo. Los resultados mostraron que el tratamiento a demanda fue mejor que el tratamiento diario con IBP (RM: 0.50; IC 95%: 0.35-0.72) en ambos grupos de pacientes. Comparado contra placebo, el tratamiento a demanda fue efectivo en los pacientes con ERNE o con esofagitis leve (RM: 0.22; IC 95%: 0.13-0.36 y RM: 0.18; IC 95%: 0.11-0.31, respectivamente). En el segundo metaanálisis, se incluyeron 11 ECA en los pacientes con ERNE y esofagitis leve cuyos resultados mostraron que el tratamiento a demanda tuvo desenlaces similares al tratamiento continuo con los IBP en términos de falla terapéutica (RM: 1.26; IC 95%: 0.76-2.07). Ambos metaanálisis concluyen que la terapia a demanda es efectiva en el manejo de la ERNE y la esofagitis leve. Cabe aclarar que en la evaluación de estos estudios la definición de esofagitis leve se basó en el grado I de la clasificación de Savary Miller equivalente al grado A de la clasificación de Los Ángeles. Aunque es opinión de expertos que el tratamiento de mantenimiento a demanda puede recomendarse en los pacientes con esofagitis B de Los Ángeles se requieren de ensayos clínicos controlados que apoyen esta recomendación12,42,43.
Además, el uso de los IBP a demanda ha mostrado ser la estrategia más costo/efectiva en el tratamiento de mantenimiento de la ERNE46.
Indicaciones y dosis de los IBP a largo plazoRecomendación 10: Se recomienda tratamiento de mantenimiento a dosis estándar en los pacientes con variantes erosivas B, C y D de la ERGE.
La naturaleza crónica y recurrente de la enfermedad por reflujo afecta la calidad de vida y ocasiona complicaciones por lo que requiere de un control óptimo para evitar dichas afectaciones. Esto es especialmente importante con el fenotipo erosivo de la enfermedad por reflujo ya que tiene potencial de inducir complicaciones (hemorragia, estenosis). Los IBP son los fármacos con mayor evidencia científica que respalda su uso en la enfermedad por reflujo en particular en el fenotipo erosivo.
El espectro del fenotipo erosivo de la enfermedad por reflujo se basa actualmente en la clasificación de Los Ángeles, la cual ha sido extensamente validada47. Investigaciones subsecuentes han determinado que la variabilidad interobservador del grado A de la clasificación de los Ángeles es alta, y que no se puede realizar un diagnóstico concluyente de ERGE en este subgrupo de pacientes48. Por otra parte, se ha demostrado que los pacientes con clasificación B de Los Ángeles tienen diagnóstico concluyente de reflujo, al demostrar presencia de una exposición al ácido elevada y respuesta al tratamiento similar a la variante C de Los Ángeles49.
Derivado de lo anterior, se requiere utilizar tratamiento para inducir la cicatrización, pero también de mantenimiento en estas variantes erosivas (B, C y D). La evidencia sugiere que la tasa de recaída de las variantes erosivas, tras 6 meses de suspender el tratamiento a dosis simple de los IBP, es del 6 al 42%. Estudios sugieren que 6 meses después de suspender la terapia con los IBP, solo el 10% de los pacientes con esofagitis erosiva todavía están en remisión50. Por lo tanto, los IBP están indicados como terapia de mantenimiento para prevenir las recurrencias tanto de los síntomas como de las lesiones de las mucosas y el uso a largo plazo de los IBP ha sido aprobado por la Administración de Drogas y Alimentos (FDA) de los EE. UU.51-56.
Un ECA mostró que OME 20mg/una vez al día fue capaz de mantener al 80% de los pacientes con esofagitis erosiva libres de lesiones de la mucosa después de 12 meses de tratamiento continuo, además de observar que este fármaco fue significativamente superior tanto a ranitidina como a cisaprida50. Posteriormente se obtuvieron resultados similares con lansoprazol (15 y 30mg/una vez al día), que demostró ser capaz de mantener alrededor del 80% de los pacientes con esofagitis erosiva en remisión al año57. Por tanto, los IBP son útiles como terapia de mantenimiento para prevenir recurrencias tanto de síntomas como de lesiones mucosas en los pacientes con variante erosiva, especialmente en aquellos con las lesiones más graves (de B a D, según la clasificación de Los Ángeles). Con pocas excepciones, como grados graves de erosiones, la mitad de la dosis de curación de un IBP suele ser adecuada para el mantenimiento58. Por ello, se recomienda que el objetivo de tratamiento a largo plazo sea mantener la dosis más baja de IBP necesaria para controlar los síntomas y la cicatrización de la mucosa esofágica.
Recomendación 11: Se recomienda el uso de los IBP de mantenimiento a la dosis que logre el control sintomático en los pacientes con esófago de Barrett, así como dosis estándar para quimioprevención.
El esófago de Barrett es el reemplazo del epitelio escamoso normal de la parte distal del esófago con metaplasia especializada (con células caliciformes) y es la complicación más importante de la ERGE, porque se considera una lesión premaligna. Se asocia con la exposición máxima al ácido en comparación con las otras formas de esta enfermedad, por lo que el uso de una potente terapia antisecretora con los IBP tiene una fuerte justificación59. Algunos estudios han demostrado que los IBP pueden disminuir su progresión a adenocarcinoma60.
Un metaanálisis realizado con base en estudios observacionales concluyó que la administración de los IBP lleva a una reducción de riesgo de progresión a displasia de bajo y alto grado, así como de adenocarcinoma (RM: 0.29; IC 95%: 0.12-0.79). A su vez, el mismo metaanálisis detalla que la reducción del riesgo es mayor con un consumo de los IBP mayor a 2-3 años vs. menos de 2-3 años (RM: 0.45; IC 95%: 0.19-1.06 vs. RM: 1.09; IC 95%: 0.47-2.56, respectivamente)61.
Por tanto, se recomienda una dosis estándar de los IBP una vez al día para prevenir la transformación de la metaplasia en displasia y neoplasia y este tratamiento debe continuarse de por vida34,62,63. Con base en estos resultados se recomienda que los pacientes asintomáticos con esófago de Barrett mantengan tratamiento con un IBP a largo plazo, si bien no se dispone de una sólida evidencia al respecto.
Recomendación 12: En estenosis péptica se recomienda el tratamiento con dosis estándar de los IBP en forma continua a largo plazo.
La incidencia de estenosis esofágicas ha disminuido dramáticamente en las últimas 2 décadas y esto ha ocurrido en paralelo con un marcado aumento en el uso de los IBP. Por esta razón, la cantidad de estudios y su calidad, ha disminuido y la evidencia es escasa. Un estudio, comparó lansoprazol 30mg una vez al día vs. ranitidina 300mg/2 veces al día. El brazo de lansoprazol requirió menos dilataciones y una mayor proporción de pacientes sin disfagia que el brazo de ranitidina64.
Otro estudio comparó OME 20mg/una vez al día y ranitidina 150mg/2 veces al día en los pacientes con variante erosiva y estenosis péptica concomitante. Se demostró que la administración de OME mejoró la disfagia y requirió de menor frecuencia de dilatación de la estenosis en comparación con ranitidina65.
En los pacientes con estenosis péptica, se requiere la intervención por expertos en endoscopía terapéutica para realizar dilatación y rehabilitar el esófago. Es necesario el uso concomitante de los IBP en forma ininterrumpida en esta población con el fin de prevenir progresión y recurrencias.
Recomendación 13: En los pacientes con síndromes de hipersecreción ácida se recomienda el tratamiento con dosis continua de los IBP suficiente para el control de los síntomas a largo plazo.
Los síndromes de hipersecreción ácida, por ejemplo, el síndrome de Zollinger-Ellison (SZE), se caracterizan por una secreción ácida extrema debido a un tumor neuroendocrino que secreta ectópicamente gastrina, resultando en enfermedades como la úlcera péptica y ERGE grave, continua, recidivante dependiente de tratamientos antiácidos66. La prevalencia e incidencia exacta se desconoce; aunque es una enfermedad rara. En EE. UU. se estima una frecuencia de un caso por cada millón de habitantes y la edad de presentación es de 7 a 90 años de edad67.
El diagnóstico se establece con una gastrina plasmática >1000pg/ml y la secreción ácida basal es >15mEq/h o bien >5mEq/h en los pacientes con gastrectomía o con hipergastrinemia asociada a un pH<2. Si no es posible obtener la secreción ácida basal, el síndrome de hipersecreción puede ser excluido con un pH gástrico >2 en ausencia de medicamentos antisecretores. Si el pH es >2 y la gastrina plasmática se encuentra entre 100-1000ng/ml, se debe realizar una prueba de estimulación con secretina67.
Los síntomas más comunes son: dolor abdominal, diarrea y pirosis, seguido de náusea y vómito en algunos pacientes. La presencia de pliegues gástricos prominentes son un signo de hipersecreción ácida por endoscopia y el 25% pueden presentar hemorragia de tubo digestivo67.
En la década de 1980, con el uso generalizado de inhibidores de la H+-K+-ATPasa gástrica, el control médico de la hipersecreción de ácido gástrico se hizo posible en casi todos los pacientes. Debido a su mayor potencia y duración de acción de los IBP, lo que permite dosificarlos una o 2 veces al día, los IBP se han convertido en los fármacos de elección para el tratamiento de esta enfermedad. Numerosos estudios de control de la secreción de ácido en los pacientes con estados hipersecretores respaldan el uso de los IBP a dosis variables y deben titularse individualmente utilizando criterios establecidos para la supresión de ácido en estos pacientes. En los pacientes con estómagos intactos, sin ERGE o neoplasia endócrina múltiple tipo 1 (NEM1) de moderada a grave, el criterio generalmente aceptado son los fármacos antisecretores que inducen la supresión ácida a <10mEq/h durante la hora anterior a la siguiente dosis del fármaco. En los pacientes complicados (ERGE moderada/grave, cirugía Billroth 2 previa o NEM1) puede ser necesaria una mayor inhibición ácida a <1mEq/h dependiendo de los hallazgos endoscópicos del tubo digestivo alto66. Lansoprazol demostró ser seguro y eficaz en el control de la secreción para el tratamiento de hipersecretores durante 10 años68. La serie de cohorte más grande, con 303 pacientes reportó una mediana de 14 años de tratamiento con los IBP y/o ARH2 y hasta por 48 años66.
Los pacientes con síndrome de hipersecreción ácida tienen 2 problemas: el control de la hipersecreción ácida y el tratamiento de los gastrinomas, que son malignos entre el 60 y el 90% de los pacientes. La cirugía sigue siendo la única posibilidad de cura y tratamiento para ambos problemas66.
Recomendación 14: En la esofagitis eosinofílica recomendamos el uso continuo de los IBP a dosis estándar a largo plazo.
La esofagitis eosinofílica (EoE) es una enfermedad que ocasiona síntomas de disfunción esofágica y en las biopsias se observan al menos 15 eosinófilos por campo de alto poder (60 eos/mm2), en este grupo de pacientes debemos descartar otras causas de eosinofilia esofágica69.
La primera evidencia sobre la utilidad potencial de los IBP para lograr la remisión clínica e histológica de la EoE se publicó en la literatura pediátrica70. El tratamiento con los IBP en dosis altas solía ser una estrategia de diagnóstico para diferenciar la EoE de la esofagitis péptica, actualmente se utiliza como tratamiento para la EoE71. Las dosis recomendadas de los IBP en adultos son de 20 a 40mg de OME/2 veces al día o su equivalente; en niños, 1-2mg/kg de OME/al día o equivalente. La estrategia a largo plazo es utilizar la dosis mínima eficaz para mantener la remisión. Los IBP a la mitad de la dosis inicial mantienen la remisión clínica e histológica en al menos el 75% de los pacientes después de al menos un año de seguimiento. La mayoría de los pacientes que recaen recuperan la remisión después del aumento de la dosis. No hay datos publicados sobre los problemas de seguridad de los IBP en los pacientes con EoE70.
Los beneficios del tratamiento con los IBP en la EoE probablemente sean multifactoriales, incluida la reparación de la barrera epitelial esofágica, así como posibles efectos antiinflamatorios directos sobre ciertas citocinas72–74. In vitro, los IBP inhiben la expresión de eotaxina-3 inducida por la citocina Th2 al interferir con la unión del promotor del transductor de señal y el activador de la transcripción75. Un metaanálisis reciente demostró que el tratamiento con IBP indujo respuesta clínica y remisión histológica en el 60.8 y el 50.5% de los pacientes, respectivamente71,74.
Recomendación 15: En los pacientes con uso crónico de AINE/ASA y riesgo alto de hemorragia digestiva alta recomendamos el uso continuo de los IBP a dosis estándar.
Tanto los AINE como el ASA son indicados con frecuencia de forma crónica, especialmente en adultos mayores, sobre todo ASA para prevención de eventos cerebrovasculares y cardiopatía isquémica. Sin embargo, existe riesgo de desarrollar complicaciones en el tracto digestivo superior como enfermedad ulcero-péptica y hemorragia digestiva, en este contexto se han realizado múltiples estudios con resultados que favorecen el uso de los IBP en combinación con AINE o ASA para disminuir dicho riesgo. En la tabla 2 se identifican los factores de riesgo para hemorragia digestiva y profilaxis. En una revisión sistemática de 41 ECA, el IBP demostró reducción en el riesgo endoscópico de úlceras duodenales (RR: 0.44; IC 95%: 0.26-0.74) y gástricas (RR: 0.40; IC 95%: 0.32-0.51) asociadas a uso crónico de AINE76.
Factores de riesgo para la hemorragia digestiva alta
| Antecedente de complicaciones por úlcera péptica, especialmente hemorragia digestiva alta |
| Edad>60 años |
| AINE/COXIB a dosis altas o en combinación con otros fármacos asociados a daño mucoso gástrico como anticoagulantes, esteroides, ISRS o warfarina |
| Uso de aspirina, aún a baja dosis en adultos mayores, o en combinación con otros fármacos (AINE, COXIB, esteroides, antiagregantes, anticoagulantes) |
| Uso agudo de AINE/COXIB en los pacientes que toman crónicamente anticoagulantes o antiagregantes |
AINE: antiinflamatorios no esteroideos; COXIB: fármacos que inhiben de manera específica la ciclo-oxigenasa-2; ISRS: inhibidores selectivos de la recaptura de serotonina.
En un metaanálisis, se evaluó el efecto de coadministrar IBP en los pacientes sin historia de enfermedad úlcera péptica tomando de forma crónica ASA a dosis baja (30-325mg) se demostró que el uso concomitante de los IBP se asoció con una reducción de riesgo del 73% de desarrollar úlcera péptica comparado con no usar los IBP (RR: 0.27; IC 95%: 0.17-0.42; p<0.001) y del 50% (RR: 0.50; IC 95%: 0.32-0.80) de hemorragia digestiva, respectivamente77.
Por otro lado, en un análisis de casos y controles realizado en 1382 usuarios de AINE/COX-2 con complicaciones gastrointestinales, se evidenció que la combinación de un inhibidor de COX-2 con los IBP ofrece una reducción de riesgo mayor de complicaciones gastrointestinales altas asociadas a AINE (OR: 0.36; IC 95%: 0.28-0.47); siendo celecoxib superior a la combinación de un AINE no selectivo con IBP78.
Recomendación 16: En los pacientes tratados con esteroides no recomendamos el uso crónico de los IBP al menos que estos sean prescritos en combinación con AINE/ASA.
En los pacientes tomando esteroides solos por cualquier condición médica, no está indicado utilizar de rutina los IBP, al menos que estén asociados con AINE. En un estudio realizado en 138 pacientes con enfermedad autoinmune tratados con corticoesteroides, se encontró un 20% de enfermedad ulcerosa péptica. En el análisis multivariado se identificaron factores de riesgo: edad ≥60 años (OR: 6.80; p=0.001), tabaquismo (OR: 7.94; p=0.004) y el uso de AINE diferente a inhibidores COX-2 (OR: 4.71; p=0.030); mientras que tener infección por H. pylori fue un factor protector (OR: 0.20; p=0.022)79. De igual forma, en un metaanálisis que incluyó a 6,602 pacientes se comparó la frecuencia de complicaciones gastrointestinales entre un grupo placebo (n=3,267) y esteroides (n=3,335). En el grupo placebo 0.3% desarrollaron úlcera péptica vs. un 0.4% en el grupo de esteroides (p>0.05); concluyendo, que la enfermedad ulcerosa péptica es una complicación rara de la terapia con esteroides80. En un metaanálisis más reciente, también se reportó una baja prevalencia de enfermedad ulcerosa péptica en los pacientes con corticoides sistémicos, ocurriendo en 0.4-1.8% de los pacientes, por lo tanto, no se recomienda profilaxis con los IBP de forma rutinaria75.
Recomendación 17: En los pacientes con antiagregantes plaquetarios o anticoagulantes y factores de riesgo para hemorragia digestiva alta recomendamos profilaxis con los IBP.
La hemorragia gastrointestinal es la complicación de sangrado más frecuente en los pacientes con uso de antiagregantes de forma crónica. En una revisión sistemática, se evaluaron 71,277 participantes, evidenciando que el uso de los IBP en los pacientes con terapia antiagregante plaquetaria dual (ASA y clopidogrel) se asoció con una reducción significativa en eventos adversos gastrointestinales (OR: 0.38; IC 95%: 0.21-0.68; p=0.001); específicamente, la hemorragia digestiva alta en los pacientes con clopidogrel más exposición a los IBP (OR: 0.31 IC 95%: 0.19-0.51; p<0.001)81.
El estudio fase III COGENT (Clopidogrel and the Optimization of Gastrointestinal Events Trial), aleatorizado, doble ciego y controlado con placebo, se evaluó la eficacia y seguridad de la combinación de clopidogrel (75mg) más OME (20mg) vs. clopidogrel solo. Por razones financieras el estudio se detuvo con 3,761 pacientes, se reportó un 1.1% de eventos gastrointestinales altos en el grupo de OME y un 2.9% en placebo a los 180 días tras la aleatorización (OR: 0.34; IC 95%: 0.18-0.63; p<0.001). Aún más importante, es que no hubo un aumento significativo en el riesgo de eventos cardiovasculares con el uso concomitante de OME y clopidogrel (p=0.98)82. El riesgo de hemorragia gastrointestinal es mayor en los pacientes con terapia antiagregante plaquetaria dual en la forma de ticagrelor o prasugrel comparado con clopidogrel. La Sociedad Europea de Cardiología, en su guía del 2017 sobre terapia antiagregante plaquetaria dual en enfermedad arterial coronaria, recomienda el uso de los IBP en este contexto (clase I, nivel de evidencia B)83.
Recomendación 18: En los pacientes con 2 o más antiagregantes plaquetarios o con antiagregante más anticoagulación oral, recomendamos profilaxis con los IBP.
El Colegio Americano de Cardiología (ACC) en su revisión de expertos del 2020 sobre antiagregación y anticoagulación en los pacientes con fibrilación auricular o enfermedad cardiovascular ateroesclerótica, recomienda iniciar o continuar un IBP en los pacientes con ≥2 agentes antitrombóticos, así como evitar el uso concomitante de AINE para reducir el riesgo de hemorragia digestiva. Una vez el paciente se queda solo con la anticoagulación oral, se recomienda la deprescripción del IBP, al menos que exista otra indicación para continuarlo84.
Recomendación 19: En la pancreatitis crónica con insuficiencia pancreática exocrina no recomendamos la adición de los IBP, ya que en México solo contamos con enzimas pancreáticas con capa entérica.
La suplementación de enzimas pancreáticas, en el contexto de pancreatitis crónica, tiene como finalidad la supresión de la esteatorrea causada por esta condición. Se deben tomar en cuenta, todos los factores implicados en la adecuada respuesta a la terapia, incluso si no se ha presentado falla terapéutica. Por ello, el factor más importante a tomar en cuenta es corroborar que la dosis de enzimas pancreáticas suplementadas sea la correcta. Los estudios fisiológicos llevados a cabo en la correcta absorción de las enzimas pancreáticas se enfocaron en los efectos mismos del tracto digestivo sobre la formulación. Así, se observó que el pH gástrico disminuye a <4 después de 40min posprandiales, y el duodenal después de 100min posprandiales85. Dicho valor de pH es el punto en el que la lipasa se inactiva de forma irreversible y disminuye considerablemente su actividad en sitios más avanzados del tracto digestivo. Esta es la justificación detrás de la teoría de que inhibir el ácido, manteniendo así pH gástrico y duodenal por arriba de 4, es un factor implicado a considerar en la suplementación de enzimas pancreáticas. Dicha evidencia se estableció en publicaciones de los años 70s, y derivó en la evolución de las formulaciones a tener capa entérica. Este avance, permite que el fármaco no se degrade de forma dependiente del pH, preservando su actividad lipolítica. La recomendación de inhibir el ácido a través de un IBP se mantiene absoluta para formulaciones sin capa entérica86. Sin embargo, existe un subgrupo de pacientes, que tienen secreción ácida gástrica normal a alta en conjunto con secreción insuficiente de bicarbonato pancreático para neutralizar el pH del quimo. En ellos, se sugiere la administración de los IBP, incluso al utilizar formulaciones con capa entérica87. Así, la recomendación de inhibir el ácido con un IBP se mantiene vigente, únicamente como factor implicado que puede ayudar en la correcta absorción, junto con la dosis adecuada y la capa entérica88.
Efectos adversos a largo plazo con el uso de los IBPRecomendación 20: En todo paciente con tratamiento de IBP a largo plazo recomendamos que el médico vigile la posible presentación de efectos adversos e indique la deprescripción cuando el paciente ya no necesite o no exista una indicación para el IBP.
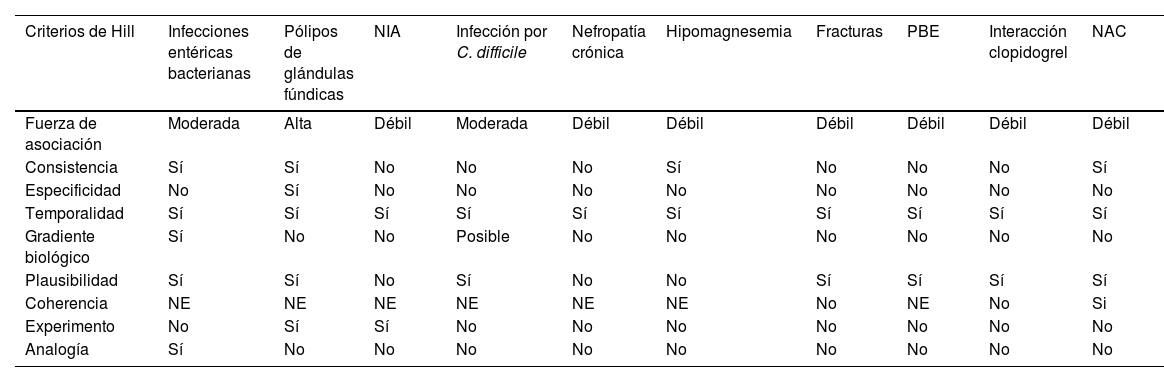
Este panel de expertos analizó la evidencia y estos son los efectos adversos en donde existe causa y efecto (causalidad) (tabla 3).
Criterios de Bradford Hill para causalidad de efectos adversos de IBP
| Criterios de Hill | Infecciones entéricas bacterianas | Pólipos de glándulas fúndicas | NIA | Infección por C. difficile | Nefropatía crónica | Hipomagnesemia | Fracturas | PBE | Interacción clopidogrel | NAC |
|---|---|---|---|---|---|---|---|---|---|---|
| Fuerza de asociación | Moderada | Alta | Débil | Moderada | Débil | Débil | Débil | Débil | Débil | Débil |
| Consistencia | Sí | Sí | No | No | No | Sí | No | No | No | Sí |
| Especificidad | No | Sí | No | No | No | No | No | No | No | No |
| Temporalidad | Sí | Sí | Sí | Sí | Sí | Sí | Sí | Sí | Sí | Sí |
| Gradiente biológico | Sí | No | No | Posible | No | No | No | No | No | No |
| Plausibilidad | Sí | Sí | No | Sí | No | No | Sí | Sí | Sí | Sí |
| Coherencia | NE | NE | NE | NE | NE | NE | No | NE | No | Si |
| Experimento | No | Sí | Sí | No | No | No | No | No | No | No |
| Analogía | Sí | No | No | No | No | No | No | No | No | No |
IBP: inhibidores de la bomba de protones; NAC: neumonía adquirida en la comunidad; NE: no evaluado; NIA: nefritis intersticial aguda; PBE: peritonitis bacteriana espontánea.
El principal mecanismo de acción de los IBP es la inhibición de la secreción ácida gástrica, una de las funciones principales del ácido clorhídrico es la acidificación gástrica, esto previene el paso de bacterias de la cámara gástrica al intestino delgado, incluso la inhibición de ácido gástrico se ha asociado de manera inconsistente al sobrecrecimiento bacteriano intestinal (SIBO, por sus siglas en inglés)89. En un estudio de cohorte de 17,598 pacientes con uso anticoagulante y ASA que fueron aleatorizados a recibir pantoprazol 40mg contra placebo, se demostró que el uso prolongado de los IBP (23 meses) confirió un riesgo de diarrea aguda de HR: 1.33; IC 95%: 1.01-1.75 con una p 0.04 y un número necesario a dañar 90090.
La evidencia demuestra que el uso de los IBP incrementa el riesgo de nefritis intersticial agudaLa nefritis intersticial aguda (NIA) es una de las principales causas de lesión renal aguda (LRA). Las etiologías comunes de NIA son las enfermedades autoinmunes inducidas por medicamentos, infecciosas e idiopáticas. La asociada a medicamentos es responsable de más de dos tercios de los casos. La etiología de la NIA cambia con el envejecimiento ya que es más frecuente en los ancianos, especialmente debido a los IBP91.
Ruffenach et al. en 1992 hicieron el reporte del primer caso de NIA y después le siguieron varios informes anecdóticos y múltiples estudios transversales y de cohortes que informaron una asociación consistente entre el uso de los IBP y el riesgo de NIA92. En este aspecto, se ha documentado que el uso actual de los IBP se ha asociado con un riesgo significativamente mayor de NIA. De los primeros reportes sobre NIA relacionada al uso de los IBP se mencionaba que era una condición rara, idiosincrásica y difícil de predecir. Suarez et al. reportaron el análisis de 64 casos (59 confirmados con histología) y la mayoría asociados al consumo de OME y en menor proporción a pantoprazol, esomeprazol, lanzoprazol y rabeprazol93.
En una revisión sistemática realizada por Nochaiwong et al. reportaron los resultados de 3 estudios (n=585,296), que el uso de los IBP se asoció con un riesgo significativamente mayor de NIA en comparación con ningún uso de los IBP, con un RR combinado: 3.61; IC 95%: 2.37-5.51; p<0.00194.
Por lo anterior, debido a la publicación de varios estudios epidemiológicos no aleatorizados sobre la posible asociación entre los IBP y la NIA y debido a que éstos presentan limitaciones criticas inherentes a las fuentes de datos, es posible el riesgo de sesgo de vigilancia. Para evitar estos factores de confusión, Rajan et al.. hicieron un estudio que revisó sistemáticamente la literatura y evaluó el riesgo de sesgo utilizando la herramienta riesgo de sesgo en estudios no aleatorios de intervenciones (ROBINS-I). De 620 registros identificados inicialmente, 26 estudios cumplieron con los criterios de elegibilidad a priori y se sometieron a una evaluación del riesgo de sesgo, de ellos solo 3 estudios evaluaron NIA, los cuales informaron la asociación entre los IBP y la NIA, con un HR ajustado: 3.00; IC 95%: 1.47-6.14 informado en un único estudio entre 581,184 pacientes en Canadá, mientras que los OR ajustados oscilaron entre 2.05; IC 95%: 1.52-2.72 a 3.20; IC 95%: 0.80-12.79 entre 4,143 pacientes de EE. UU. y 3,415 pacientes del Reino Unido, respectivamente95.
Otro escenario que se ha estudiado es el desarrollo de complicaciones renales como causa de hospitalizaciones en usuarios de los IBP. Varios reportes han demostrado que existe un mayor riesgo de ingreso hospitalario por LRA y NIA dentro de los 120 días posteriores a la exposición a un IBP. La tasa de NIA reportada fue mayor entre los pacientes que recibieron IBP frente a los controles, 0.32 frente a 0.11 por 1000 personas/año, respectivamente; con HR: 3.00; IC 95%: 1.47-6.1496.
En conclusión, se ha documentado la asociación entre el uso de IBP y el riesgo de NIA. Sin embargo, se justifica realizar más investigaciones para dilucidar los mecanismos subyacentes y establecer la relación causal precisa entre los IBP y la NIA.
La evidencia demuestra que el uso de los IBP incrementa el riesgo de pólipos de las glándulas fúndicasEl primer reporte donde informaron de pólipos en las glándulas fúndicas (PGF) durante el tratamiento con OME fue realizado en 1992 por Graham97. Los PGF son el tipo más prevalente de pólipos gástricos en estudios recientes de poblaciones occidentales y se han encontrado hasta en el 5% de los pacientes sometidos a endoscopia alta. El mecanismo exacto por el cual los IBP inducen PGF aun no es conocido por completo, pero puede estar relacionado con el estancamiento de líquido en las glándulas oxínticas lo cual condiciona dilataciones quísticas, esto sin asociación directa de la hipergastrinemia secundaria que genera el IBP98. Huang et al. reportaron una prevalencia del 2% en un estudio de 10,094 pacientes sometidos a endoscopia gastroduodenal, aunque existen reportes con prevalencia más elevadas como en el 28%. Adicionalmente, este grupo encontró que el 66.8% de los pacientes con PGF presentaba infección por H. pylori, que la edad, el uso prolongado de los IBP fueron factores de riesgo para la presencia de PGF y que el uso a largo plazo de los IBP fue un factor de riesgo particularmente fuerte para la aparición de estos pólipos99. Martin et al. en 2016 publican de los primeros metaanálisis que buscaban aclarar la relación de los IBP con PGF, analizando 339 artículos y resúmenes revisados por pares de los cuales 20 artículos cumplieron todos los criterios, con un total de 40,218 sujetos. El metaanálisis de 12 estudios reveló un aumento en los PGF entre los usuarios de IBP en comparación con los controles (OR: 2.46; IC 95%: 1.42-4.27; p=0.001), particularmente entre personas que tomaron los IBP durante al menos 6 meses (OR: 4.71; IC 95%: 2.22-9.99; p<0.001) o 12 meses (OR: 5.32; IC 95%: 2.58-10.99; p<0.001). Si bien este metaanálisis estuvo limitado por la calidad de los estudios agrupados, proporcionó evidencia sólida de una asociación entre el uso de los IBP y el desarrollo de PGF que probablemente sea causal100. Otro metaanálisis que analizó 12 estudios con 87,324 pacientes coincide que el uso a largo plazo de los IBP (≥12 meses) se asocia con un mayor riesgo de PGF101.
Con causalidad no establecidaRecomendación 21: No recomendamos la suspensión de los IBP ya que no se ha establecido una relación causa/efecto en las siguientes condiciones: infección por Clostridioides difficile o COVID-19, deficiencia de vitamina B12e hipomagnesemia, eventos cardio-cerebrovasculares, uso de clopidogrel, sobrecrecimiento bacteriano, osteoporosis/fracturas, tumores gastrointestinales, demencia, neumonía, nefropatía crónica y peritonitis bacteriana espontanea en el contexto de cirrosis.
Aunque el uso de IBP se ha asociado a un mayor riesgo de infección por Clostridioides difficile (C. difficile), no queda claro el mecanismo fisiopatológico implicado en el aumento del riesgo102. En un metaanálisis de estudios observacionales se encontró que los usuarios de los IBP tienen un riesgo aumentado de infección por C. difficile (RR: 1.3; IC 95%: 1.1-1.4) y de recurrencia de la infección (RM: 1.5; IC 95%: 1.2-1.9)103,104. Sin embargo, al limitar el análisis a cohortes y ensayos aleatorizados la mayor heterogeneidad y calidad de la evidencia limita el riesgo solo a adultos mayores y los pacientes críticos hospitalizados105.
El tratamiento a largo plazo con los IBP se ha asociado con deficiencia de vitamina B12 debido al papel del ácido gástrico y la pepsina en la liberación de esta de los nutrientes ingeridos106,107. Aunque un metaanálisis de 25 estudios observacionales encontró que los usuarios de los IBP tienen un riesgo ligeramente aumentado (RM: 1.42; IC 95%: 1.16-1.73; I2=54%), la mayor heterogeneidad e inconsistencia en los niveles para definir deficiencia y la baja RM reducen la certeza para establecer causalidad107.
El uso de los IBP podría causar hipomagnesemia debido a mutaciones que provocan disminución de la afinidad de los receptores transitorios potenciales de los canales 6 y 7 de melastatina (TRPM6 y 7) en los enterocitos por cambios en el pH intraluminal, aunque la mayor absorción de magnesio a nivel intestinal ocurre por vía paracelular108. Un metaanálisis de 14 estudios observacionales encontró un riesgo incrementado (RR: 1.44; IC 95%: 1.13-1.76, I2=85.2%) en usuarios de los IBP, pero la gran heterogeneidad de los mismos no permite establecer asociaciones definitivas109.
El clopidogrel es un profármaco que requiere la activación del CYP2C19 para ejercer su efecto antiplaquetario, pero el OME también se metaboliza por dicha enzima. Se ha teorizado que el OME interfiere con la activación del clopidogrel, disminuyendo su eficacia terapéutica y aumentando el riesgo de eventos cardiovasculares en los pacientes con terapia antiplaquetaria dual. Inicialmente, hubo preocupación sobre esta interacción y se realizaron estudios ex vivo y observacionales que mostraron resultados mixtos110. Sin embargo, los análisis posteriores de ensayos clínicos, como PRINCIPLE-TIMI 44 y TRITON-TIMI 38, no encontraron diferencias significativas en los resultados clínicos adversos entre los usuarios y no usuarios de los IBP82. Finalmente, la FDA advirtió en 2009 contra la combinación de OME con clopidogrel y a pesar de la evidencia de la seguridad de la combinación, la FDA reiteró en 2016 evitar la combinación; cabe mencionar que no existe tal restricción con otros IBP.
El riesgo de desarrollar SIBO se ha asociado con el uso de los IBP. Un metaanálisis realizado en 2017 reportó que la razón de momios combinada para el desarrollo de SIBO fue de (RM: 1.71; IC 95%: 1.20-2.43)111,112. Un estudio realizado en nuestro país mostró que un curso corto de 7 días de los IBP produjo SIBO en el 7.8% de los sujetos sanos113. Es posible que se necesiten investigaciones adicionales para comprender mejor los mecanismos subyacentes a esta asociación y para desarrollar estrategias que ayuden a reducir el riesgo de SIBO en los pacientes tratados con los IBP114.
La hipoclorhidria inducida por los IBP puede aumentar la actividad osteoclástica y reducir la absorción de calcio, disminuyendo así la densidad ósea115. Aunque se ha postulado una asociación entre el uso de los IBP y las fracturas óseas (RM: 1.41; IC 95%: 1.16-1.71; I2=73%)116, no se ha demostrado mayor riesgo en mujeres con artritis reumatoide, mayores de 80 años o posmenopáusicas sanas117, y un estudio prospectivo de 17598 adultos mayores con enfermedad cardiovascular o arterial periféricas estable tratados con rivaroxabán y/o ASA, con seguimiento a 3 años, no mostró mayor riesgo de fracturas en usuarios de pantoprazol (RM: 0.96; IC 95%: 0.79-1.17; p=0.71)118.
Estudios observacionales y metaanálisis han mostrado un vínculo entre los IBP y un mayor riesgo de cáncer gástrico119. Sin embargo, si la enfermedad subyacente para la que se administra el IBP está asociada con el cáncer gástrico, esto puede resultar en una aparente asociación entre los IBP y el cáncer gástrico. Una revisión sistemática y metaanálisis reciente no encontró asociación entre el uso de los IBP y cáncer gástrico120.
Los IBP se han asociado con un aumento en el riesgo de demencia121. Gomm et al. analizaron datos de más de 73,000 adultos mayores sin demencia al inicio del estudio y evaluaron el riesgo de desarrollar demencia en función del uso de los IBP, encontrando que su uso regular se asoció con mayor riesgo de desarrollar demencia en comparación con aquellos que no lo usaban. Además, observaron que esta asociación era más fuerte en aquellos con un mayor número de prescripciones de los IBP. Sin embargo, es importante tener en cuenta que este estudio es observacional y no puede demostrar una relación causal entre el uso de los IBP y la demencia122.
En el estudio de cohorte realizado por Laheij et al. se encontraron una asociación entre el uso de los IBP y mayor riesgo de neumonía adquirida en la comunidad123. Entre los mecanismos que podrían explicar dicho efecto se incluyen el aumento del pH gástrico que favorece la colonización bacteriana y viral, así como la inhibición de la función de ciertas células inmunes, lo que podría aumentar la susceptibilidad a infecciones respiratorias. Se destaca que los pacientes con ventilación mecánica asistida tienen un mayor riesgo de neumonía asociada al uso de los IBP por la colonización de patógenos intestinales en el tracto respiratorio y el riesgo de aspiración gástrica124.
Un estudio publicado por Klatte et al. que involucra a más de 100,000 usuarios de los IBP en Suecia revelan que tanto el inicio como el uso acumulativo de los IBP se asocian con mayor riesgo de progresión de la nefropatía crónica (ERC) en comparación con otros antiácidos124. Sin embargo, se reconoce que la asociación observada no demuestra causalidad y que los mecanismos exactos por los cuales los IBP pueden contribuir a la progresión de la ERC aún no están claros, aunque se mencionan la alteración de la microbiota intestinal e hipomagnesemia, pero enfatizando que se necesitan más investigaciones125.
La asociación del uso de los IBP y riesgo de infección por COVID-19 o desarrollo de complicaciones no está bien definida105,126,127. Existen algunos metaanálisis de estudios retrospectivos y cohortes, uno publicado por Alhumaid et al., donde se observó un OR: 1.80; IC 95%: 1.41-2.31; I2: 72% estos resultados son muy heterogéneos, si se toman solamente las cohortes OR: 1.55; IC 95%: 1.16-2.06; p<0.00001; I2: 74%, la heterogeneidad de los resultados es importante en este metaanálisis con una fuerza de asociación baja128.
Respecto a la peritonitis bacteriana espontánea en un metaanálisis diseñado para búsqueda de complicaciones infecciosas y mortalidad en los pacientes con cirrosis publicado por Wong et al. encontraron HR: 1.75; IC 95%: 1.64-1.85; p<0.001, la I2 fue del 0% en este estudio a pesar de que la heterogeneidad es baja la fuerza de asociación también lo es. Sin embargo, debemos considerar este efecto posible de los IBP en los pacientes con cirrosis y suspenderlos cuando no tienen una indicación clara129.
¿Cómo deprescribir un IBP?Recomendación 22: Recomendamos la deprescripción abrupta, gradual o intermitente en los pacientes con uso de los IBP sin indicación.
La deprescripción de los IBP está justificada en aquellas condiciones donde no existe una indicación para uso continuo o una vez que los síntomas por los cuales se haya iniciado la terapia con los IBP se hayan resuelto (tabla 4); después de 4 a 8 semanas de tratamiento, se puede recomendar la deprescripción. A la fecha no contamos con estudios que identifiquen cuál es la mejor forma de deprescripción: abrupta, gradual o intermitente (a demanda). La deprescripción abrupta, puede llevar a un rebote en la secreción ácida, debido a un estado de hiperacidez, esto se ha reportado con terapias desde 4 semanas en adelante, aún a dosis bajas de los IBP131.
Indicaciones para deprescripción de IBP130
| Esofagitis leve A de los Ángeles con control de síntomas después de 8 semanas |
| ERNE controlado después de 4 semanas |
| Dispepsia controlada después de 4 semanas |
| Tratamiento de úlcera gástrica después de 4-8 semanas |
| Tratamiento de úlcera duodenal después de 4 semanas |
| Después de la terapia de erradicación de Helicobacter pylori por 14 días |
| Indicación inapropiada para gastroprotección en los pacientes con comorbilidades |
| Pacientes admitidos a la unidad de terapia intensiva que ya no presenten factores de riesgo para úlceras por estrés |
ERNE: enfermedad por reflujo no erosiva; IBP: inhibidores de la bomba de protones.
La deprescripción gradual se realizar en un periodo de reducción de 2 a 4 semanas, disminuyendo de dosis doble a dosis estándar por 2 semanas y suspender, otro abordaje es de dosis estándar a una dosis cada 48h y después suspender, y otros autores han utilizado de la dosis estándar, cambiar a ARH2 y después suspender132.
En el estudio de Inadomi et al. se estudiaron a 73 pacientes con ERGE con adecuado alivio de los síntomas en tratamiento con los IBP, e iniciaron la deprescripción de la siguiente manera: disminuyendo la dosis doble a dosis estándar, y después suspendieron el medicamento, si los síntomas de pirosis y regurgitación recurrían antes de las 2 semanas de la cita de seguimiento, reiniciaban con la dosis más baja de los IBP, si los síntomas recurrían después de las 2 semanas, se iniciaba tratamiento con ARH2 y/o procinéticos; en caso de persistencia de los síntomas se utilizaban los 2 y si los síntomas persistían regresaban a terapia con los IBP, los resultados fueron: de los 73 sujetos el 58% estaba asintomático al año, sin tratamiento y de estos el 34% requirieron ARH2, el 7% procinéticos y el 1% ambos fármacos, el 15% no requirió ningún medicamento durante el seguimiento a un año, en el análisis multivariado detectaron que la pirosis y una edad menor, pueden predecir el requerimiento de los IBP133.
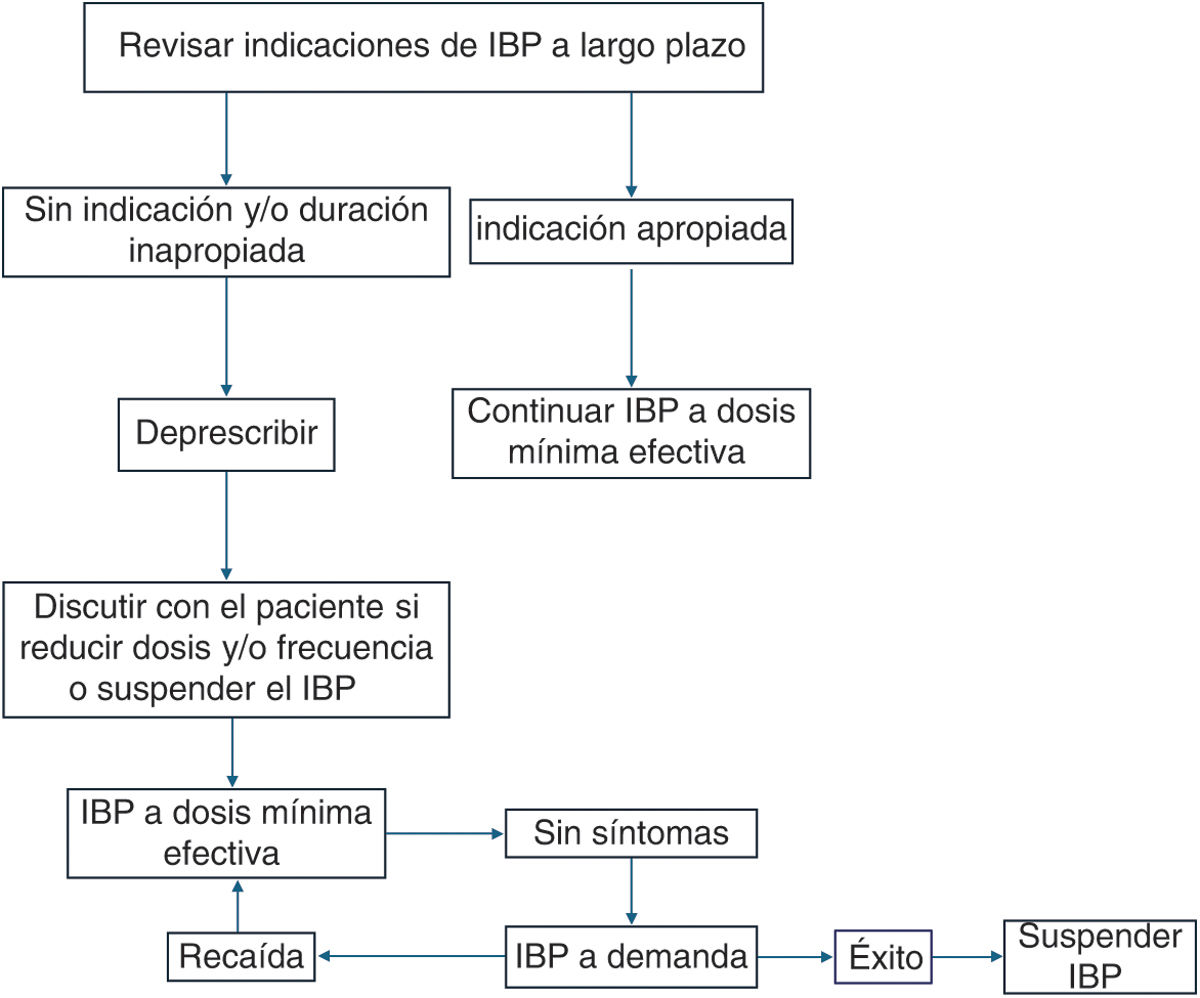
A la fecha la reducción gradual, es la deprescripción más recomendada, aunque falta más evidencia al respecto, ya que disminuye el riesgo de recurrencia y síntomas asociados a la deprescripción (fig. 1).
Algoritmo de como deprescribir un IBP. Los pacientes que se encuentran tomando IBP se debe revisar la indicación y de no existir suspenderlos. Si existe indicación se debe prescribir con dosis y duración apropiada; si la dosis o duración no es la apropiada se debe suspender. Se debe personalizar, de acuerdo con el paciente, cuál será la estrategia más adecuada para la deprescripción y qué maniobras realizar ante la recaída de los síntomas.
Fuente: Adaptado de Helgadottir H, Bjornsson ES11.
Por otro lado, la deprescripción mediante tratamiento intermitente es útil en los pacientes con adecuado control, pero recurrencia sintomática a las 2-4 semanas.
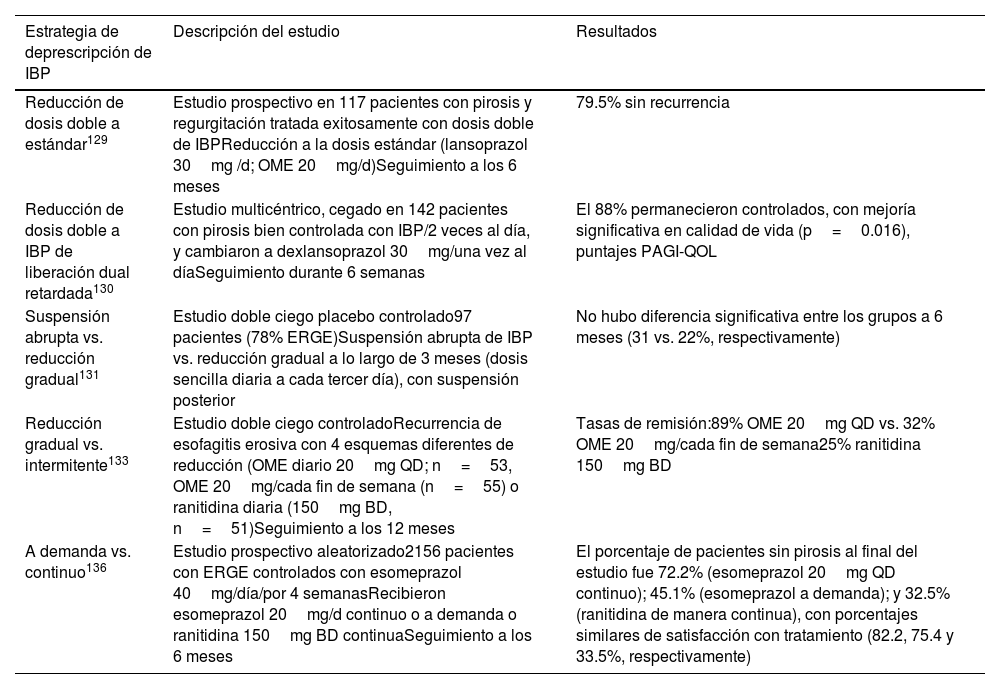
La evidencia clínica de estas estrategias se resume a continuación (tabla 5):
Evidencia clínica de estrategias de deprescripción
| Estrategia de deprescripción de IBP | Descripción del estudio | Resultados |
|---|---|---|
| Reducción de dosis doble a estándar129 | Estudio prospectivo en 117 pacientes con pirosis y regurgitación tratada exitosamente con dosis doble de IBPReducción a la dosis estándar (lansoprazol 30mg /d; OME 20mg/d)Seguimiento a los 6 meses | 79.5% sin recurrencia |
| Reducción de dosis doble a IBP de liberación dual retardada130 | Estudio multicéntrico, cegado en 142 pacientes con pirosis bien controlada con IBP/2 veces al día, y cambiaron a dexlansoprazol 30mg/una vez al díaSeguimiento durante 6 semanas | El 88% permanecieron controlados, con mejoría significativa en calidad de vida (p=0.016), puntajes PAGI-QOL |
| Suspensión abrupta vs. reducción gradual131 | Estudio doble ciego placebo controlado97 pacientes (78% ERGE)Suspensión abrupta de IBP vs. reducción gradual a lo largo de 3 meses (dosis sencilla diaria a cada tercer día), con suspensión posterior | No hubo diferencia significativa entre los grupos a 6 meses (31 vs. 22%, respectivamente) |
| Reducción gradual vs. intermitente133 | Estudio doble ciego controladoRecurrencia de esofagitis erosiva con 4 esquemas diferentes de reducción (OME diario 20mg QD; n=53, OME 20mg/cada fin de semana (n=55) o ranitidina diaria (150mg BD, n=51)Seguimiento a los 12 meses | Tasas de remisión:89% OME 20mg QD vs. 32% OME 20mg/cada fin de semana25% ranitidina 150mg BD |
| A demanda vs. continuo136 | Estudio prospectivo aleatorizado2156 pacientes con ERGE controlados con esomeprazol 40mg/día/por 4 semanasRecibieron esomeprazol 20mg/d continuo o a demanda o ranitidina 150mg BD continuaSeguimiento a los 6 meses | El porcentaje de pacientes sin pirosis al final del estudio fue 72.2% (esomeprazol 20mg QD continuo); 45.1% (esomeprazol a demanda); y 32.5% (ranitidina de manera continua), con porcentajes similares de satisfacción con tratamiento (82.2, 75.4 y 33.5%, respectivamente) |
BD: dos veces al día; ERGE: enfermedad por reflujo gastroesofágico; IBP: inhibidores de la bomba de protones; OME: omeprazol; QD: una vez al día.
Se ha descrito que el 15% de los usuarios de los IBP usan una dosis doble o mayor a la indicada por la FDA en diferentes enfermedades relacionadas con el ácido. Aunque hay evidencia que apoya el uso de dosis altas en sangrado gastrointestinal asociado a enfermedad ácido péptica o para prevención de sangrado en pacientes de alto riesgo, no hay evidencia que apoye el uso de dosis altas a largo plazo. El uso de dosis doble tampoco es superior a dosis estándar en esófago de Barrett o en reflujo laríngeo-faríngeo. Un trabajo con 117 pacientes con pirosis o regurgitación tratada exitosamente con dosis doble de IBP, y en los cuales se disminuyó la dosis en forma progresiva, el 80% permanecieron sin recurrencia134.
Cambio de los IBP de doble dosis a los IBP de liberación dual retardadaCote et al. con el cambio de lansoprazol 30mg/2 veces al día a rabeprazol 20mg/una vez al día, el 60% mantuvieron remisión sintomática, Fass et al. evaluaron pacientes con pirosis bien controlada con los IBP/2 veces al día, y cambiaron a dexlansoprazol 30mg/una vez al día, el 88% permanecieron controlados, con mejoría significativa en calidad de vida (p=0.016), puntajes PAGI-QOL, dieta y hábitos (p<0.001)135.
Suspensión abrupta vs. reducción gradualBjömsson et al. compararon en un estudio controlado la probabilidad de permanecer asintomático y sin los IBP, tras la suspensión abrupta de los IBP vs. reducción gradual a lo largo de 3 meses (dosis sencilla diaria a cada tercer día), con suspensión posterior. No hubo diferencia significativa entre grupos a 6 meses (31 vs. 22%, respectivamente)136.
Reducción gradual vs. intermitenteSe han ensayado diferentes variantes de tratamiento intermitente. El tradicional consiste en administración de medicamentos desde una a 4 semanas por el mismo tiempo de descanso. Un estudio evaluó las tasas de recurrencia con 2 dosis de OME y ranitidina con cursos administrados cada 2-4 semanas a la dosis que controlaba completamente los síntomas, y observaron que el 72% se mantenía en remisión a 12 meses con tratamiento intermitente cada 2-4 semanas, y el 93% tenían menos de 3 recurrencias a 12 meses137. Variantes de este tipo de deprescripción incluyen administración de medicamento solo los fines de semana (viernes, sábado y domingo), cada tercer día, y 2 o 3 veces por semana. Las tasas de recurrencia de esofagitis erosiva con 4 esquemas diferentes de reducción fueron: el 75% (ranitidina 150mg BD); el 68% (OME 20mg cada fin de semana), y el 11% (OME 20 QD)138.
A demanda vs. continuoEn los pacientes con ERGE erosiva, se ha descrito un mayor número de remisiones endoscópicas permanentes cuando el paciente lleva tratamiento continuo a dosis baja, al compararlo con terapia a demanda. Nagahara et al. reportaron mayores tasas de remisión (85.3 vs. 44.4%; p<0.01) con OME 20mg QD vs. OME a demanda/por 8 semanas139. Otro estudio reportó que el 5% de un grupo con ERNE tratado con IBP a demanda desarrollaron erosiones esofágicas vs. ningún paciente con tratamiento continuo140.
Un estudio evaluó control sintomático en los pacientes con ERNE y tratamiento previo con esomeprazol 40mg/una vez al día, mediante 3 estrategias: reducción a 20mg QD en forma continua, uso a demanda, o cambiar a ranitidina 150mg BD en forma continua/durante 6 meses. El porcentaje de pacientes sin pirosis al final del estudio fue del 72.2% (esomeprazol 20mg QD continuo); del 45.1% (esomeprazol a demanda); y del 32.5% (ranitidina de manera continua), con porcentajes similares de satisfacción con tratamiento (82.2, 75.4 y 33.5%, respectivamente)141.
Recomendación 23: En los pacientes en programa de deprescripción de los IBP recomendamos informar la posible recidiva de síntomas gastrointestinales superiores como pirosis, regurgitación y/o epigastralgia posteriores al retiro del tratamiento.
Al indicar la deprescripción de los IBP es importante informar a los pacientes que pueden experimentar síntomas gastrointestinales superiores como pirosis, regurgitación y síntomas dispépticos dentro de las 2 a 4 semanas posteriores al retiro del tratamiento y que esto no necesariamente significa que tienen que volver inmediatamente a usar los IBP de manera continua. Esto se explica debido a la hipersecreción ácida de rebote, definida como un aumento en la secreción del ácido gástrico por encima de los niveles previos al tratamiento después de la terapia con los IBP9.
En un ECA doble ciego de 120 personas sin antecedentes de síntomas gastrointestinales superiores se demostró que la deprescripción de los IBP después de un tratamiento de 8 semanas ocasionó una mayor incidencia de síntomas gastrointestinales (pirosis, regurgitación y/o epigastralgia) en comparación con los sujetos en los que se continuaron los IBP137. En otro estudio de 48 voluntarios sanos (24 mujeres) negativos para H. pylori fueron asignados al azar para recibir tratamiento con 40mg de pantoprazol o placebo una vez al día durante 28 días. Los síntomas dispépticos se registraron diariamente utilizando la puntuación de dispepsia de Glasgow (GDS)/2 semanas antes, durante y 6 semanas después del tratamiento. Después de la primera y segunda semana los pacientes experimentaron puntuaciones más altas de dispepsia vs. placebo142.
En una revisión sistemática que incluyó 5 estudios, de los cuales 2 involucraron a voluntarios sanos, encontraron que el 44% experimentó síntomas relacionados con el ácido hasta 4 semanas después de retirar el tratamiento, fueron leves a moderados y principalmente consistieron en pirosis y regurgitación. Tres estudios, en los que participaron pacientes con enfermedad por reflujo, no encontraron síntomas causados por la hipersecreción ácida de rebote. Si bien los estudios en voluntarios sanos demostraron que ocurren síntomas gastrointestinales altos al deprescribir los IBP, la importancia clínica sigue siendo desconocida143.
FinanciaciónEl presente documento fue realizado bajo el apoyo de la Asociación Mexicana de Gastroenterología (AMG), la AMG ha realizado el pago de trasporte de las ciudades sede de los autores y hospedaje de todos ellos para realizar el documento. No se recibieron honorarios.
Consideraciones éticasNo se ha requerido consentimiento informado de ningún paciente para realizar este documento, ya que está basado solo en bibliografía publicada en revistas indexadas, al ser una guía de buena práctica clínica no se solicitó autorización a ningún comité de bioética. Este documento fue autorizado por el comité científico de la AMG y comité de la revista mexicana de gastro de la AMG y no contiene información que pueda identificar o reconocer a paciente alguno.
Conflicto de interesesL.R. Valdovinos García fue conferencista para Carnot, Asofarma y Chinoin.
A.S. Villar Chávez fue conferencista para Carnot, Siegfreid, Grunenthal. Megalabs y Asofarma.
F.M. Huerta Iga fue conferencista para Carnot y Asofarma.
M. Amieva Balmori fue conferencista para Carnot y Asofarma.
R. Bernal-Reyes fue conferencista para Asofarma.
E. Coss-Adame fue conferencista para Asofarma, Alfasigma, Carnot, Ferrer y Grunenthal.
O. Gómez fue conferencista para Carnot, Chinoin y Asofarma.
P.C. Gómez Castaños fue conferencista para Carnot.
M. González-Martínez declaró no tener ningún conflicto de intereses.
E.C. Morel Cerda fue conferencista para Alfasigma, Chinoin y Megalabs.
J.M. Remes-Troche es asesor y miembro del consejo consultivo para Asofarma, Carnot y Pisa; conferencista para Asofarma, Abbot, Carnot, Chinoin, Johnson y Johnson, Medix y Medtronic.
M.C. Rodríguez Leal declara no tener ningún conflicto de intereses.
D. Ruiz-Romero fue conferencista de Asofarma, Olympus, Alfasigma y Carnot
M.A. Valdovinos Díaz fue conferencista para Carnot, Grunenthal, Asofarma, Megalabs y Bayer.
G. Vázquez-Elizondo fungió como investigador para Carnot, Chinoin y Novo Nordisk de México; asesor y miembro de consejos consultivos para Chinoin, M8 Moksha y Eurofarma, y conferencista para Chinoin, Asofarma de México, Carnot y Eurofarma.
J.A. Velarde-Ruiz Velasco declara no tener ningún conflicto de intereses.
M.R. Zavala-Solares fue conferencista para Carnot, Ferrer, Alfasigma y Siegfreid-Rhein.
J.S. Arenas-Martinez declara no tener ningún conflicto de intereses.