La dispepsia funcional (DF) es un padecimiento de alta prevalencia que se caracteriza por la presencia de síntomas del tracto gastrointestinal superior sin causa orgánica evidente. Es una enfermedad compleja y multifactorial, que frecuentemente se traslapa con otros trastornos de la interacción cerebro intestino; es recurrente, tiene una respuesta terapéutica variable y afecta la calidad de vida de quienes lo padecen.
ObjetivoElaborar recomendaciones de buena práctica para el manejo de este trastorno, que surjan de una revisión consensuada de la DF, que actualicen y complementen el consenso sobre la dispepsia de la Asociación Mexicana de Gastroenterología (AMG) 2017.
MétodosDieciséis expertos convocados por la AMG, realizaron una revisión de la literatura (2017-2024) y elaboraron recomendaciones de buena práctica clínica en el diagnóstico y tratamiento de la DF, que fueron discutidas hasta alcanzar un consenso, calificando la evidencia más reciente sobre el tema con base en el sistema GRADE.
ResultadosSe elaboraron 23 recomendaciones de buena práctica clínica para el manejo de la DF que abarcaron las siguientes áreas: 1) definición, fisiopatología y epidemiología; 2) diagnóstico; 3) tratamiento no farmacológico; 4) erradicación de Helicobacter pylori; 5) antisecretores y terapia contra el ácido; y 6) procinéticos y neuromoduladores.
ConclusionesLa DF es uno de los padecimientos digestivos más frecuentes en la práctica diaria. Presentamos las recomendaciones de buena práctica en el manejo específico de este trastorno, tomando en cuenta los avances más recientes, que complementan y actualizan el consenso sobre la dispepsia publicado por la AMG en 2017.
Functional dyspepsia (FD) is a highly prevalent condition characterized by upper gastrointestinal symptoms with no apparent organic cause. It is a complex and multifactorial disease that frequently overlaps with other disorders of gut-brain interaction. It is recurrent, has a variable therapeutic response, and affects patient quality of life. Our aim was to formulate good practice recommendations for the management of FD through a consensus review of the disease, updating and complementing the 2017 consensus on dyspepsia from the Asociación Mexicana de Gastroenterología (AMG).
MethodsSixteen experts summoned by the AMG carried out a literature review (2017-2024) and formulated good clinical practice recommendations for the diagnosis and treatment of FD. They were discussed until reaching a consensus, and the most recent evidence on the theme was evaluated, utilizing the GRADE system.
ResultsTwenty-three good clinical practice recommendations for the management of FD were developed that addressed the following aspects: 1) definition, pathophysiology, and epidemiology; 2) diagnosis; 3) nonpharmacologic treatment; 4) Helicobacter pylori eradication; 5) antisecretory and anti-acid therapy; and 6) prokinetics and neuromodulators.
ConclusionsThe FD is one of the most frequent gastrointestinal conditions seen in daily practice. We present good clinical practice recommendations for the specific management of this disorder, taking into account the most recent advances that complement and update the consensus on dyspepsia published by the AMG in 2017.
La dispepsia funcional (DF) es un trastorno de la interacción cerebro intestino (TICI) que afecta a una alta proporción de la población general, y se caracteriza por la presencia de síntomas del tracto gastrointestinal superior, sin causa orgánica evidente luego de una evaluación diagnóstica apropiada1. Este padecimiento es un reto para el médico debido a su compleja fisiopatogenia, a la frecuente sobreposición con otros síndromes digestivos, a su patrón recurrente y a su respuesta terapéutica variable.
En el 2016 un grupo de gastroenterólogos de la Asociación Mexicana de Gastroenterología (AMG) elaboró el consenso sobre la dispepsia que fue publicado un año después2. Sin embargo, con el paso del tiempo se ha desarrollado mayor conocimiento sobre esta enfermedad y han aparecido nuevas alternativas terapéuticas, lo que justifica la generación de un nuevo documento que actualice el consenso del 2017. En marzo del 2024, la AMG convocó a un grupo de trabajo para que realizara una revisión, evaluara la evidencia y elaborara las recomendaciones de buenas prácticas en el diagnóstico y tratamiento, con enfoque especifico en la DF.
El objetivo de este documento es presentar una revisión consensuada del estado actual de la DF, mediante la elaboración de recomendaciones de buena práctica clínica en el diagnóstico y tratamiento de la DF, que actualice y complemente el consenso de la dispepsia del 2017 integrando las nuevas evidencias científicas publicadas a nivel mundial para su aplicación práctica.
MétodosEsta revisión de expertos fue comisionada por la AMG. Los integrantes del grupo de trabajo fueron seleccionados con base en su reconocida trayectoria académica, docente, de investigación y asistencial con especial interés en la dispepsia y los TICI. La elaboración de este documento se basó en el método empleado en el Consenso Mexicano sobre la Dispepsia de la AMG 20172. Se formaron subgrupos de trabajo en las siguientes áreas: 1) definición, fisiopatología y epidemiología; 2) diagnóstico; 3) tratamiento no farmacológico; 4) erradicación de Helicobacter pylori (H. pylori); 5) antisecretores y terapia contra el ácido; y 6) procinéticos y neuromoduladores. Los integrantes de cada subgrupo realizaron una revisión de la bibliografía utilizando como criterios de búsqueda las palabras «functional dispepsia», combinada con los siguientes términos: «epidemiology», «incidence», «prevalence», «pathophysiology», «inflammation», «microbiota», «diagnosis», «differential diagnosis», «treatment», «therapy», «management», «review», «guidelines» y «meta-analysis», así como los términos equivalentes en español. La búsqueda se realizó en PubMed de enero de 2016 a mayo del 2024 y luego fue complementada por uno de los coordinadores (RCS) hasta septiembre del 2024. Se incluyeron todas las publicaciones en inglés y español. Se dio preferencia a los consensos, guías, revisiones sistemáticas y metaanálisis, pero no se limitó a este tipo de artículos. También se realizaron búsquedas electrónicas y manuales complementarias en los archivos de la Revista de Gastroenterología de México y en todas las publicaciones que los coordinadores consideraron relevantes hasta septiembre del 2024.
Luego de realizar la revisión en cada tema, se elaboraron enunciados con recomendaciones para una buena práctica clínica, que fueron enviados a todos los miembros del grupo para su discusión por vía electrónica. La segunda versión de los enunciados fue discutida en una reunión presencial en Guadalajara, Jalisco (México) en mayo del 2024. En esta reunión se estableció el nivel de la evidencia que sustentaba cada enunciado empleando el sistema Grading of Recommendations Assessment, Development and Evaluation (GRADE, por sus siglas en inglés)3. El código del sistema GRADE se muestra en la tabla 1. La tercera versión de los enunciados fue sometida a una votación anónima final por vía electrónica. Los votos se emitieron usando una escala de 5 puntos: A) totalmente de acuerdo; B) parcialmente de acuerdo; C) incierto; D) parcialmente en desacuerdo; y E) totalmente en desacuerdo. A continuación, se presentan los enunciados finales consensuados.
Sistema GRADEa
| Calidad de la evidencia | Código |
|---|---|
| AltaEs muy poco probable que más investigaciones cambien nuestra confianza en la estimación del efecto:• Varios estudios de alta calidad con resultados consistentes• En casos especiales: un ensayo multicéntrico grande y de alta calidad | A |
| ModeradaEs probable que más investigaciones tengan un impacto importante en nuestra confianza en la estimación del efecto y puedan cambiar el estimado:• Un estudio de alta calidad• Varios estudios con algunas limitaciones | B |
| BajaEs muy probable que futuras investigaciones tengan un impacto importante en nuestra confianza sobre la estimación del efecto y es probable que cambie dicha estimación:• Uno o más estudios con limitaciones graves | C |
| Muy bajaCualquier estimación del efecto es muy incierta:• Opinión de expertos• No hay evidencia de investigación directa• Uno o más estudios con limitaciones muy graves | D |
La DF es un trastorno crónico y heterogéneo que se caracteriza por síntomas del aparato digestivo proximal, en ausencia de enfermedades metabólicas o estructurales detectables mediante una evaluación diagnóstica apropiada, que incluya una endoscopia digestiva superior.
Nivel de la evidencia: A.
Nivel de acuerdo: Totalmente de acuerdo: 81%; parcialmente de acuerdo: 19%.
La DF se define como la presencia de síntomas crónicos que se originan en la región gastroduodenal y se caracteriza principalmente por 4 síntomas cardinales: plenitud posprandial, saciedad temprana, dolor epigástrico y epigastralgia ardorosa, que pueden tener o no relación con la ingesta de alimentos1,2. Cuando el paciente se presenta con síntomas gastroduodenales, pero aún no ha sido estudiado, no se puede establecer un diagnóstico definitivo y se debe clasificar con dispepsia no investigada. Debido a que solo por la sintomatología es imposible descartar la presencia de organicidad, si las condiciones del individuo o sus factores de riesgo lo ameritan, deben realizarse los estudios necesarios para evaluar los síntomas, incluyendo una endoscopia superior4. Así, el diagnóstico de la DF requiere que los síntomas se presenten en ausencia de enfermedad orgánica y que esto se confirme, al menos mediante la realización de una endoscopia1,2.
Se ha informado que, luego de hacer una investigación apropiada, aproximadamente el 80% de los individuos con dispepsia no tienen alteraciones orgánicas, sistémicas o metabólicas que expliquen sus síntomas y estos son los que se deben catalogar con DF5. Sin embargo, en la práctica clínica hay algunas excepciones a estas consideraciones. Aunque la endoscopia se considera mandatorio para el diagnóstico de DF, esto no aplica para jóvenes, sin factores de riesgo o datos de alarma, quienes pueden abordarse mediante estrategias que serán discutidas en las recomendaciones de «diagnóstico». Otra excepción controversial, es la infección por H. pylori cuya presencia no descarta el diagnóstico de DF a pesar de tratarse de una condición orgánica. Esta situación se discutirá en el enunciado «Infección por Helicobacter pylori».
En los últimos años se han desarrollado y perfeccionado criterios diagnósticos basados en síntomas, con la intención de hacer un diagnóstico positivo y directo. La más reciente versión de los criterios de Roma (Roma IV), que son los más aceptados para definir y clasificar los diferentes TICI, definen a la DF como un desorden caracterizado por al menos uno de los siguientes síntomas: plenitud posprandial, saciedad temprana, dolor o ardor epigástrico, sin evidencia de trastorno orgánico que explique la sintomatología1. Se deben cumplir ambas condiciones y los síntomas deben estar presentes en los últimos 3 meses (por uno o más días a la semana) y deben haber iniciado al menos 6 meses antes del diagnóstico6,7. Otros síntomas como la náusea, los eructos y la distensión abdominal pueden estar presentes en los pacientes con DF y son considerados parte del espectro. Su presencia puede reflejar mecanismos fisiopatológicos en común como la motilidad gastroduodenal alterada e hipersensibilidad8. A pesar de la ausencia de anormalidades estructurales en el tracto gastrointestinal, los pacientes con DF experimentan una reducción en la calidad de vida y disminución en su productividad. Además, esta enfermedad produce elevados costos derivados de la atención, tanto para el paciente como para los sistemas de salud9.
FisiopatologíaLa fisiopatología de la DF es multifactorial. Los síntomas se generan por una compleja interacción de factores dietéticos, genéticos, alérgicos, infecciosos, inflamatorios y comorbilidades psicológicas, entre otros.
Nivel de la evidencia: B.
Nivel de acuerdo: Totalmente de acuerdo: 94%; parcialmente de acuerdo: 6%.
Los mecanismos involucrados en la generación de síntomas dispépticos son múltiples, suelen coexistir, pueden potenciarse y no son excluyentes entre sí. Se han descrito el aumento de la permeabilidad de la mucosa duodenal, la inflamación de bajo grado, la alteración en la señalización y activación del sistema inmune, además de las anormalidades en la acomodación gástrica, la hipersensibilidad y la hipervigilancia, entre otros10,11.
Los criterios de Roma IV (como se abordará en las siguientes secciones) clasifican a los pacientes con DF en aquellos con síndrome de distrés posprandial (SDP) y síndrome de dolor epigástrico (SDE)1. En los sujetos con SDP se ha informado una estrecha relación entre los síntomas con la alteración de la acomodación gástrica10,12. El vaciamiento gástrico se ha encontrado significativamente retardado en al menos el 35% de los pacientes con DF y se ha implicado en la náusea, el vómito y la plenitud, aunque se ha observado gran disparidad entre los subgrupos por lo que los patrones no son concluyentes8,9,13. La inhibición del ácido nítrico sintetasa en voluntarios sanos ha mostrado suprimir la acomodación gástrica y conducir a la sensación de saciedad temprana. Esta alteración en respuesta a los alimentos representa un elemento clave en la patología de la DF, particularmente en los pacientes con SDP que lo presentan en un 40% de los casos9,12,14.
El ácido gástrico se ha implicado como agente causal de la DF. La infusión de ácido en el estómago induce síntomas dispépticos en adultos sanos y los incrementa en los pacientes con dispepsia9,12. La hipersensibilidad al ácido en el duodeno se asocia con náusea y la hipersensibilidad a la distensión gástrica se asocia a llenura posprandial y eructos10–12.
La gastroenteritis infecciosa aguda incrementa más de 2 veces el riesgo de presentar DF (razón de momios [RM]: 2.54, intervalos de confianza [IC] 95%: 1.76-3.65) y se han informado signos de microinflamación en el duodeno como la presencia de eosinófilos y mastocitos10,15,16. Estudios recientes han mostrado que la alteración en la función de la barrera epitelial duodenal y un bajo grado de inflamación se correlaciona con infiltración de células inmunes y la activación de la inmunidad localizada que pueden causar hipersensibilidad mecánica y química. La densidad de eosinófilos duodenales y el grado de desgranulación se han asociado a la saciedad temprana9,15,16.
Existen múltiples informes sobre el papel de la microbiota intestinal en la fisiopatología de la DF. Las alteraciones en su composición pueden afectar la permeabilidad intestinal e influir en el desarrollo y exacerbación de los síntomas17,18. En los últimos años, se ha acumulado evidencia que destaca la importancia de las alteraciones de la microbiota duodenal en la generación de la dispepsia. Una revisión sistemática que incluyó 9 estudios que compararon la microbiota duodenal de 391 sujetos con dispepsia y 132 controles sin dispepsia, identificó un incremento significativo en la abundancia del filo Fusobacteria y los géneros Alloprevotella, Corynebacterium, Peptostreptococcus, Staphylococcus, Clostridium y Streptococcus. Por el contrario, se observó una disminución pronunciada en las poblaciones de los géneros Actinomyces, Gemella, Haemophilus, Megasphaera, Mogibacterium y Selenomonas en aquellos con DF. También se encontró una correlación negativa en los cambios de la abundancia relativa entre Streptococcus y Prevotella, que se correlacionó con la gravedad de los síntomas en aquellos con DF. Estas alteraciones en la microbiota duodenal están asociadas con mayor carga sintomática, que a su vez, afecta la calidad de vida18. Estos hallazgos sugieren que las alteraciones en la microbiota duodenal pueden ser cruciales para la aparición y expresión de los síntomas de la DF, y resalta el papel significativo de la microbiota duodenal en las interacciones cerebro-intestino en la DF.
Las experiencias adversas en infancia (tales como el abuso físico, mental o emocional) tienen un profundo impacto en la salud física y mental de las personas a largo plazo, aumentan el riesgo de desarrollar hipersensibilidad visceral en la adultez y son reconocidas como parte importante en la fisiopatogenia de los TICI. Estudios poblacionales han encontrado que la historia de abuso físico o sexual en la infancia, así como el estrés psicológico son significativamente más prevalentes en los sujetos con dispepsia y se ha informado que el 37% de ellos presentan hipersensibilidad a la distensión gástrica7,9. Debido a que el sistema nervioso central y el sistema inmunológico no están completamente maduros al nacer y continúan madurando durante el período posnatal, se ha planteado la hipótesis de una interacción bidireccional entre el sistema nervioso central y el sistema inmunológico, en la que los factores estresantes en la infancia son fundamentales para preparar a los individuos para la psicopatología adulta posterior. Estudios preclínicos han indicado que el estrés puede llevar a disbiosis intestinal que altera la función del sistema nervioso central y el comportamiento, reforzando el concepto de la comunicación bidireccional del eje cerebro-intestino19. El estrés psicológico incrementa la permeabilidad duodenal a través de la activación de los mastocitos, mediada por la liberación de la hormona corticotropina, dando por resultado el incremento de la permeabilidad y micro inflamación.
Estudios de neuroimagen en los pacientes con DF han concluido que varias regiones cerebrales, como la corteza frontal y somatosensorial, muestran anomalías10,20. Los desórdenes del sueño, el ejercicio insuficiente, los patrones irregulares en la ingesta de alimentos y diversos componentes de la dieta se han asociado con DF19,21. La ingesta de grasa y otros alimentos agravan los síntomas en algunos pacientes21,22.
Algunas alteraciones genéticas se han relacionado con la DF, como los polimorfismos GNB3 825>T, SCL6A4 5HTTLPR y CCK-1R 779>C. Un metaanálisis encontró que el alelo menor (T) en GNB3 825C>T se asocia con susceptibilidad incrementada al SDE23.
La relación entre alergias alimentarias e infiltración de células inflamatorias en la mucosa gastroduodenal es controversial10,24.
EpidemiologíaLa prevalencia mundial de la DF se ha informado entre 10 y 40% de la población general.
Nivel de la evidencia: A.
Nivel de acuerdo: Totalmente de acuerdo: 69%; parcialmente de acuerdo: 31%.
La prevalencia de la DF varía ampliamente debido a diversos factores, como los criterios utilizados para definir su presencia, las poblaciones estudiadas, los métodos usados para entrevistar a los sujetos, entre otros. Una encuesta realizada en población abierta de 3 diferentes países, que utilizó los criterios de Roma IV, demostró que la prevalencia de DF fue del 10% (8% en Reino Unido, 12% en Canadá y 12% en los EE. UU. de Norteamérica): el 61% de los entrevistados tuvieron SDP, 18% SDE y 21% sobreposición de ambos tipos25. Un estudio realizado en 4 países de Latinoamérica (Argentina, Brasil, Colombia y México) en el que analizaron las encuestas aplicadas por Internet a más de 8000 pacientes, utilizando los criterios de Roma IV, encontró una prevalencia de DF entre el 6.59 y el 10.6%, con predominio del SDP y en las mujeres26.
Los estudios poblacionales que han utilizado la realización previa de endoscopia para establecer el diagnóstico de DF proveen las mejores estimaciones de prevalencia en la comunidad. Solo el 30% de los adultos con dispepsia no investigada sin datos de alarma tienen lesiones significativas en la endoscopia27. A este respecto, se han realizado estudios en Escandinavia y en Italia que han informado una prevalencia entre el 10 y 16%7. En México, no contamos con estudios que evalúen la dispepsia mediante endoscopia en población abierta.
Una revisión sistemática y metaanálisis de 44 estudios, que representaron 80 poblaciones independientes de adultos e incluyó 256,915 participantes de 40 países de todo el mundo, estableció que la prevalencia global de la DF es del 8.4% (IC 95%: 7.4-9.5). Los criterios de Roma I mostraron la prevalencia más alta (11.9%; IC 95%: 5.1-25.4), mientras que Roma IV la más baja (6.8%; IC 95%: 5.8-7.9) 28. La DF fue más frecuente en los países en desarrollo que en los países desarrollados (9.1 vs. 8.0%), y en las mujeres que en los varones (9.0 vs. 7.0%). El análisis mostró que la prevalencia ha disminuido con el tiempo, pasando del 12.4% (1990-2002) al 7.3% (2013-2020). Al parecer, la variación en la prevalencia depende del país, nivel económico, región geográfica y sexo, con una tendencia general a la baja.
La incidencia de la DF ha sido mucho menos estudiada. Un informe belga cuyos datos se obtuvieron de una red de registro de morbilidad basada en la práctica general, estableció una incidencia de 109/100,000 habitantes, analizando más de medio millón de registros en 2 décadas29.
La DF es más frecuente en las mujeres, en individuos con índice de masa corporal alto, en adultos de mediana edad y en sujetos con comorbilidades psicológicas. Entre los factores predisponentes se encuentra el tabaquismo, el uso de antiinflamatorios no esteroideos, los cuadros previos de gastroenteritis aguda, infección por H. pylori y uso de antibióticos2,8,25,26,29.
Reconocimiento de la dispepsia funcionalCriterios diagnósticos y sobreposición con otros trastornosCriterios diagnósticos basados en síntomas y descripción de los subgrupos que integran la dispepsia funcionalLos síntomas que caracterizan a la DF son el dolor, el ardor en epigastrio, la plenitud posprandial y la saciedad temprana. La DF se clasifica en 2 subtipos: el síndrome de dolor en epigastrio y el síndrome de plenitud-saciedad (distrés) posprandial.
Nivel de la evidencia: B.
Nivel de acuerdo: Totalmente de acuerdo: 100%.
Con respecto a las versiones previas, en los criterios de Roma IV se introdujeron cambios menores con el fin de mejorar la especificidad de los síntomas y definir los umbrales mínimos que permitan establecer la frecuencia y la gravedad de cada síntoma individual con mayor precisión. La gravedad debe ser al menos suficiente para identificar los síntomas como «molestos», que se define clínicamente como «lo suficientemente graves para afectar a las actividades habituales». También se puede usar la definición semicuantitativa de «molesto» si la intensidad del síntoma se estima en 2 o más puntos de una escala de 5. De igual forma se propuso introducir una frecuencia mínima para distinguir a las personas con enfermedad. Por lo tanto, los límites para la frecuencia de los síntomas se basaron en datos que indicaban que no más del 5% de la población normal experimentaría cada síntoma con tanta frecuencia1.
Para el diagnóstico de DF, se requiere la presencia de uno o más de los siguientes 4 síntomas: dolor epigástrico, ardor en epigastrio, plenitud posprandial (lo suficientemente grave como para afectar las actividades habituales) o saciedad temprana (lo suficientemente grave como para evitar terminar una comida de tamaño regular). Los síntomas deben estar presentes al menos una vez por semana en los últimos 3 meses, con inicio de los síntomas al menos, 6 meses antes del diagnóstico.
En el SDE típicamente se presentan dolor y/o ardor epigástrico, pero también pueden manifestar distensión posprandial, náusea y eructos, el dolor puede provocarse o mejorarse con el alimento o puede ocurrir durante el ayuno. De igual forma, los síntomas tampoco deben modificarse con la defecación o la flatulencia.
En el SDP, además de la plenitud posprandial y/o la saciedad temprana, los pacientes pueden informar dolor o ardor epigástrico posprandial, distensión epigástrica, eructos excesivos y náusea. Los síntomas que se modifican con la defecación o la flatulencia no deben considerarse como parte de la dispepsia y la presencia de vómito justifica considerar un problema diferente.
Durante el interrogatorio deben investigarse en forma dirigida datos de alarma o factores de riesgo para enfermedades orgánicas y excluir posibles efectos secundarios de otros tratamientos. La DF se diagnostica cuando no se identifica etiología orgánica que explique los síntomas y el diagnóstico definitivo requiere en casi todos los casos de endoscopia superior, salvo las excepciones ya mencionadas sobre las que se abundará más adelante1,2,8.
El uso del término «distrés» posprandial fue motivo de discusión al interior del grupo de trabajo en la preparación de estas recomendaciones, ya que en estricto sentido dicho término no existe en el idioma español. Aunque consideramos que la plenitud y la saciedad describen bien a este subgrupo de sujetos con DF, decidimos utilizar el término «distrés» para estar en concordancia con la versión más reciente de los criterios de Roma. En lo subsecuente usaremos el término síndrome de distrés posprandial (SDP) para hacer referencia al subgrupo con DF que se caracteriza por presentar plenitud y saciedad posprandial en forma predominante.
Sobreposición con otros trastornos digestivosEs común que los pacientes con DF presenten otros trastornos de la interacción cerebro-intestino.
Nivel de la evidencia: A.
Nivel de acuerdo: Totalmente de acuerdo: 100%.
Es bien conocido que algunos pacientes con DF pueden tener más de un TICI, probablemente por compartir mecanismos fisiopatológicos comunes, lo cual ha sido informado principalmente en centros de referencia o de atención terciaria8,26,30.
Si bien los criterios de Roma han demostrado su utilidad, sobre todo para estudios epidemiológicos, no toman en cuenta los trastornos superpuestos. Esta sobreposición de síntomas puede complicar el diagnóstico y, por ende, el tratamiento. En estos casos puede ser necesaria la colaboración entre diferentes especialidades médicas para su manejo óptimo31.
En varios países asiáticos se ha informado que más del 80% de los pacientes con DF tienen una superposición con otro TICI. Un grupo de trabajo de la Asociación de Gastroenterología de Asia y el Pacífico, con base en estudios de análisis factorial de agrupamiento de síntomas, ha propuesto 4 grupos de DF con sobreposición de síntomas32:
- a)
Enfermedad por reflujo gastroesofágico (ERGE)-DF: ardor epigástrico o sensación de plenitud posprandial asociada con eructos, acidez y posiblemente disfagia.
- b)
Síndrome de intestino irritable (SII)-SDE: dolor o ardor epigástrico asociado con la ingestión de alimentos, que mejoraba después de evacuar el intestino o de expulsar gases, y que estaba precedido por un cambio en el número de evacuaciones.
- c)
SII-SDP: sensación de plenitud, distensión abdominal, eructos y flatulencia.
- d)
Estreñimiento-DF: dolor o malestar en la parte superior del abdomen asociado con evacuaciones menos frecuentes o más duras.
La prevalencia de cada uno de estos 4 grupos se estimó mediante una encuesta entre los miembros del panel de expertos, reconociendo que podría haber otras posibles superposiciones entre los diferentes trastornos de la interacción cerebro-intestino 32.
Estudios asiáticos y occidentales han encontrado sobreposición de la DF con síntomas de la ERGE en 40-50%: el SDE se ha asociado a ERGE no erosiva y el SDP se superpone más frecuentemente con pirosis funcional. El SII se ha encontrado que es 8 veces más frecuente en personas con DF. En México, el estudio SIGAME 2 que evaluó 1,000 encuestados en población abierta, encontró sobreposición de dispepsia y ERGE en el 8.1%, dispepsia y SII en el 6.5%, así como ERGE, dispepsia y SII en el 3.1%33. Un estudio realizado en una cohorte retrospectiva de 308 individuos con estreñimiento funcional refractario determinó que el 38.6% tenía DF en forma concurrente34. Una encuesta realizada en residentes el condado de Olmsted (Minnesota, EUA) demostró que la prevalencia del síndrome de rumiación y de la DF fue del 5.8 y del 7.1%, respectivamente, pero la superposición fue 3.83 veces mayor de lo esperado de manera fortuita35. Identificar la sobreposición entre la DF y otros TICI podría representar oportunidades terapéuticas adicionales, además de abonar al conocimiento sobre posibles factores fisiopatológicos comunes.
Recomendaciones para el diagnóstico de la dispepsia funcionalEndoscopiaEs necesario realizar una endoscopia digestiva proximal para establecer el diagnóstico de DF.
Nivel de la evidencia: A.
Nivel de acuerdo: Totalmente de acuerdo: 100%.
De acuerdo con la definición actualmente aceptada de DF (Roma IV), se debe descartar que los síntomas dispépticos se deban a alteraciones orgánicas1. Con base en esta definición, una endoscopia es útil y necesaria para detectar posibles causas orgánicas causantes de la dispepsia y este procedimiento se considera mandatorio para el diagnóstico de la DF8. Sin embargo, es importante distinguir entre el manejo de la dispepsia no investigada y el diagnóstico de DF, conceptos que con frecuencia se confunden y sobreponen.
Es bien sabido que la mayoría de los pacientes con dispepsia no investigada no tiene hallazgos endoscópicos significativos incluyendo la presencia de neoplasias malignas12,27. Por esta razón, la mayoría de las guías clínicas y consensos actualmente recomiendan la endoscopia cuando los pacientes con dispepsia no investigada presentan factores de riesgo (incluyendo la edad) o datos de alarma10,36. La baja prevalencia de lesiones esofágicas y gastroduodenales clínicamente relevantes observadas por endoscopia, aunado al alto costo y a los riesgos inherentes de un procedimiento invasivo, ha llevado a un cambio en las recomendaciones de diversas guías clínicas con respecto a las indicaciones para realizar endoscopia en los pacientes con dispepsia no investigada, buscando un enfoque que sea más costo-efectivo a nivel individual y social8,10. Una revisión sistemática y metaanálisis reciente, que incluyó 15 estudios clínicos y 41,763 participantes37 mostró que más del 85% de las endoscopias de los pacientes con dispepsia fueron normales y el hallazgo de cáncer gastroesofágico fue muy raro (<0.4%). La lesión más frecuentemente observada por endoscopia en los pacientes con dispepsia fue la esofagitis erosiva (prevalencia acumulada 11.0%; IC 95%: 8.9-13.2%), seguida por úlcera péptica (prevalencia acumulada 4.4%; IC 95%: 2.5-6.7%). Al comparar la prevalencia de lesiones entre sujetos con y sin dispepsia, solo la úlcera péptica fue más frecuente en los primeros (RM: 1.61; IC 95%: 1.08-2.39).
Las indicaciones para realizar una endoscopia en los pacientes con dispepsia no investigada son8,10,38,39:
- a)
Inicio reciente de síntomas en los pacientes con edad ≥ 55 años.
- b)
Datos de alarma: pérdida de peso significativa, anemia, ferropenia, trombocitosis, hemorragia gastrointestinal, vómito persistente, disfagia progresiva, odinofagia.
- c)
Presencia de factores de riesgo en sujetos que aún no se han realizado endoscopia: familiares de primer grado de pacientes con cáncer esofágico, gástrico o familiares con síndromes genéticos que aumentan riesgo de cáncer.
- d)
Dispepsia refractaria (sin respuesta posterior a tratamiento de primera y segunda línea o con recurrencias) si no se cuenta con endoscopia previa.
Bajo una perspectiva de costo/efectividad, existe controversia en las diversas guías clínicas respecto a la edad a partir de la cual se debe realizar una endoscopia como abordaje inicial de la dispepsia: puede considerarse a partir de los 40 años en áreas con alto riesgo de cáncer gástrico y algunas guías sugieren 60 años como la edad de riesgo. También se debate si se debe o no realizar para descartar neoplasias en los pacientes jóvenes con datos de alarma, ya que se considera que estos datos son frecuentemente inespecíficos lo cual limita su valor predictivo positivo33,35. Sin embargo, existe evidencia de que la presencia de datos de alarma aumenta 2-3 veces el riesgo de neoplasias. Consideramos que debido a que México es un país de riesgo intermedio para el desarrollo de adenocarcinoma gástrico con incidencia de 6.3 casos/100,000 habitantes40,41 está justificado realizar una endoscopia cuando hay datos de alarma aun cuando el riesgo de neoplasia no sea elevado, particularmente si se busca realizar diagnóstico oportuno de casos de cáncer gástrico incipiente40.
Las guías japonesas enfatizan que el médico puede diagnosticar la DF directamente en casos en los que no se sospecha una enfermedad orgánica a partir de la historia clínica, el estado de infección por H. pylori y otros criterios de detección iniciales, indicando así que la endoscopia debe utilizarse solo como una modalidad adjunta en el diagnóstico de la DF 10. Consideramos que, en nuestro entorno, cuando se trata de establecer el diagnóstico de la DF la endoscopia es obligatoria ya que se trata de un TICI, que se manifiesta frecuentemente con síntomas recurrentes y refractarios, que se sobreponen a otros síndromes digestivos. La endoscopia en este escenario no solo permite descartar neoplasias malignas, sino también trastornos orgánicos benignos que pueden explicar los síntomas8.
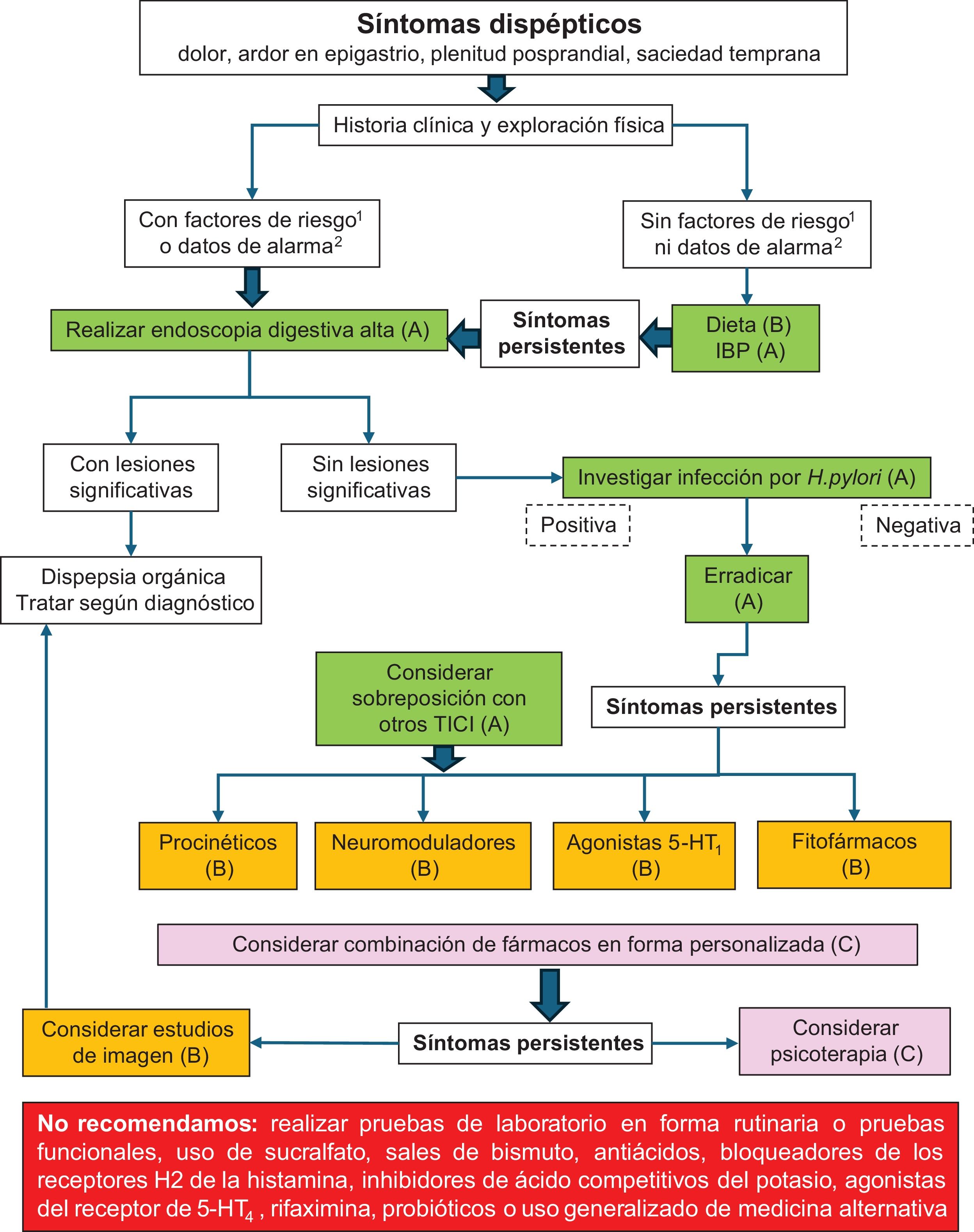
Así, en el paciente con dispepsia no investigada que se somete a una endoscopia digestiva alta en la que no se encuentran lesiones significativas, se establece el diagnóstico de DF. Contar con un diagnóstico certero y preciso de DF es sumamente relevante ya que abre diversas opciones terapéuticas, una vez descartados los trastornos orgánicos. En la figura 1 se muestra un algoritmo de diagnóstico que proponemos en los sujetos con dispepsia.
Síntomas dispépticos.
1 Factores de riesgo: edad >55 años, familiares de primer grado con cáncer esofágico o gástrico, familiares con síndromes genéticos que aumentan el riesgo de cáncer.
2 Datos de alarma: pérdida de peso significativa, anemia, ferropenia, trombocitosis, hemorragia gastrointestinal, vómito persistente, disfagia progresiva, odinofagia.
Entre paréntesis se muestra el grado de evidencia para cada intervención.
Cuando se realiza la endoscopia en pacientes con dispepsia, se recomienda tomar biopsias en los siguientes casos4,12:
- a)
Biopsias de las lesiones mucosas relevantes.
- b)
Biopsias gástricas con protocolo de Sydney para detectar infección por H. pylori si no ha sido previamente descartada.
- c)
Biopsias duodenales en caso de serología para enfermedad celiaca positiva. Se puede además considerar la toma de biopsias para descartar eosinofilia duodenal en casos particulares de acuerdo con el contexto clínico.
Dos revisiones sistemáticas y metaanálisis42,43 demostraron un aumento en el número de eosinófilos y mastocitos en los pacientes con DF al compararlos con sujetos sin dispepsia. Sin embargo, este no puede ser considerado un biomarcador de la enfermedad ya que, aunque es un hallazgo frecuente en los pacientes con DF postinfecciosa, no hay un punto de corte bien definido y hay considerable sobreposición con otras enfermedades.
Infección por Helicobacter pyloriRecomendamos investigar la infección por Helicobacter pylori en todo paciente con DF.
Nivel de la evidencia: A.
Nivel de acuerdo: Totalmente de acuerdo: 63%; parcialmente de acuerdo: 37%.
El abordaje de la infección por H. pylori en los pacientes con dispepsia suele ser confuso. La recomendación de búsqueda y tratamiento de la bacteria en los pacientes con dispepsia no investigada, conocida como la estrategia de «probar y tratar», no debe confundirse con el manejo de la infección en la DF propiamente dicha2,8,36.
Como ya se comentó, el diagnóstico de DF requiere que se descarten trastornos orgánicos, pero la elevada prevalencia de la infección por H. pylori y de la DF puede hacer que ambas entidades coexistan en un mismo enfermo, lo que no necesariamente indica causalidad. Como se discutirá en la sección de «tratamiento» (enunciado «Erradicación del Helicobacter pylori en la dispepsia funcional»), la erradicación de H. pylori puede mejorar los síntomas de un subgrupo de pacientes con dispepsia, aún si la endoscopia es macroscópicamente normal, pero los estudios sugieren que el beneficio sintomático solo se alcanza a largo plazo y no en todos los casos36,44. La DF que responde al tratamiento de erradicación se ha denominado «dispepsia asociada a H. pylori» y podría ser considerada como una enfermedad orgánica, pero en estricto sentido esta asociación causal solo puede confirmarse con el seguimiento a largo plazo8.
Existe una proporción variable de pacientes con DF que no logran alivio a pesar de la erradicación exitosa. Por otro lado, aunque la gastritis crónica superficial puede afectar una variedad de funciones gástricas, no hay evidencia de que la inflamación de la mucosa gástrica (con o sin atrofia) pueda ser causa de síntomas. Por lo tanto, la sola detección de gastritis por H. pylori no descarta el diagnóstico de DF.
Dado que es necesaria la realización de la endoscopia para establecer el diagnóstico de DF, se deben obtener biopsias durante el procedimiento para evaluar el estado de H. pylori al momento del estudio.
Estudios de imagenRecomendamos realizar estudios de imagen en aquellos pacientes con DF con síntomas refractarios al tratamiento o que presenten datos de alarma.
Nivel de la evidencia: B.
Nivel de acuerdo: Totalmente de acuerdo: 81%; parcialmente de acuerdo: 19%.
El diagnóstico de la DF se establece por medio de los criterios de Roma IV, la valoración de la historia médica personal, la realización de endoscopia cuando está indicada, la detección de H. pylori y en ocasiones, la realización exámenes clínicos de laboratorio o gabinete10. En ausencia de datos de alarma (enunciado «Endoscopia») no se recomienda la realización de estudios de imagen y suele iniciarse el tratamiento2,8,36.
Existe cierta controversia sobre el significado del dolor abdominal en la dispepsia. Se ha estimado que el dolor abdominal en este grupo de enfermos podría enmascarar las enfermedades pancreatobiliares, como litiasis vesicular, coledocolitiasis, colecistitis o cáncer pancreático o de las vías biliares. Esto fue evaluado en 2 metaanálisis conducidos por Kraag et al.45 y Berger et al.46 en los cuales se demostró que solo el dolor tipo cólico biliar se correlaciona con la presencia de litiasis vesicular. Por lo tanto, el ultrasonido se recomienda solamente en el contexto de la dispepsia, cuando el dolor se ubica en el hipocondrio derecho o se irradia hacia la espalda8. Por otra parte, la tomografía computarizada y la resonancia magnética nuclear se recomiendan cuando se sospechan cambios anatómicos o lesiones orgánicas como neoplasias2.
Pruebas funcionalesNo recomendamos el uso rutinario de estudios funcionales gastrointestinales (prueba de saciedad o de vaciamiento gástrico) para el diagnóstico de la DF.
Nivel de la evidencia: A.
Nivel de acuerdo: Totalmente de acuerdo: 94%; parcialmente de acuerdo: 6%.
Los estudios funcionales han sido de gran utilidad para avanzar en el conocimiento de la fisiopatogenia de la DF, pero no existe evidencia sobre su utilidad práctica. Aunque el retraso del vaciamiento gástrico se ha asociado con la presencia de síntomas dispépticos47, otros estudios han demostrado que este fenómeno sucede tanto en los pacientes con DF como en sujetos sanos48,49. Existe controversia con respecto al posible traslape de los síntomas de gastroparesia con los de la DF50; sin embargo, los resultados de estudios que basan el tratamiento en este hallazgo no han mostrado consistencia51. Más aún, estudios recientes realizados en sujetos con síntomas gastrointestinales superiores han encontrado que aquellos con DF o gastroparesia presentan resultados similares entre ellos, comparable a lo observado en sujetos normales8. De esta manera, las diferentes asociaciones médicas recomiendan utilizar estos estudios solamente en el contexto de ensayos clínicos8,10,36,38,39.
Exámenes de laboratorioNo recomendamos realizar exámenes de laboratorio de manera rutinaria en los pacientes con DF.
Nivel de la evidencia: B.
Nivel de acuerdo: Totalmente de acuerdo: 81%; parcialmente de acuerdo: 19%.
Los exámenes de laboratorio como parte del abordaje diagnóstico de la dispepsia deben fundamentarse en la sospecha clínica de una condición orgánica, pero no recomendamos que se realicen de manera generalizada en todos los pacientes38. Algunas pruebas de laboratorio resultan útiles para orientar hacia posibles causas orgánicas o descartarlas8. Por ejemplo, la biometría hemática permite detectar casos de anemia y ferropenia que pueden alertarnos sobre posibles causas orgánicas subyacentes.
Ya se ha mencionado el papel que juegan las infecciones entéricas en la fisiopatogenia de la DF. Un metaanálisis demostró que la gastroenteritis aguda se asoció con un riesgo 2.5 veces mayor de desarrollar DF, con una prevalencia calculada de 9.55% (RM: 2.54; IC 95%: 1.76-3.65), siendo los microorganismos más frecuentemente asociados: Norovirus, Giardia intestinalis, Giardia duodenalis (antes Giardia lamblia), Salmonella spp., Escherichia coli O157 y Campylobacter spp52. Debido a la alta prevalencia de giardiasis (prevalencia global 20-60%), especialmente en los países en vías de desarrollo y su asociación con DF, podría ser conveniente investigar dicha infección en este contexto. Además, existe evidencia de que la giardiasis se asocia con duodenitis (detectable por endoscopia y análisis histopatológico). La determinación del ADN de la Giardia en la materia fecal tiene mejor rendimiento diagnóstico que el aspirado o las biopsias duodenales53. Algunos casos de dispepsia postinfecciosa parecen estar relacionados con la persistencia de Giardia, particularmente cuando se asocia con síntomas de SII, por lo que su diagnóstico permitiría un tratamiento específico54.
Un estudio realizado en México informó acerca de la alta prevalencia de enfermedad celiaca en los pacientes con DF55. Sin embargo, una publicación más reciente del mismo grupo de investigadores, que incluyó a un mayor número de sujetos demostró que la seroprevalencia de enfermedad celiaca en donadores de sangre con síntomas dispépticos (detectados mediante el cuestionario validado, PAGI-SYM) no fue diferente de los controles sin dispepsia (1.15 vs. 1.18%)56. De forma similar, diversas revisiones sistemáticas y metaanálisis han demostrado que la seroprevalencia de enfermedad celiaca en sujetos con dispepsia puede ser discretamente mayor, pero sin alcanzar signifiacación en comparación con los controles57. Con base en esta evidencia consideramos que, no se justifica realizar serología para detección de enfermedad celiaca de manera rutinaria en todos los pacientes con DF. En casos seleccionados, como en aquellos con síntomas dispépticos refractarios y diarrea o sobreposición de DF/SII, podría ser de utilidad la serología para enfermedad celiaca y la detección de Giardia intestinalis con antígenos fecales o PCR.
Recomendaciones para el tratamiento de la dispepsia funcionalDietaNo existe una dieta específica efectiva para el tratamiento de la DF, por lo que debemos hacer recomendaciones dietéticas en forma individual y promover una alimentación personalizada.
Nivel de la evidencia: B.
Nivel de acuerdo: Totalmente de acuerdo: 100%.
La mayor parte de los sujetos con dispepsia reconocen alimentos que detonan sus síntomas. A pesar de que existen múltiples mecanismos fisiopatológicos que pueden explicar esta asociación, la evidencia de causalidad es débil y ha sido relativamente poco estudiada. Las grasas, el trigo y algunos hidratos de carbono han sido frecuentemente señalados como causantes de síntomas dispépticos, mientras que el picante, el café y el alcohol son restringidos o eliminados de la dieta por iniciativa propia del enfermo o por indicación médica sin bases objetivas21,22. La mayoría de los consejos dietéticos son empíricos y a menudo conducen a dietas de exclusión, que refuerzan en los pacientes la percepción de «daño» o «intolerancia» a los alimentos y propician la hipervigilancia y la anticipación de los síntomas14. La modificación de hábitos alimentarios como ingerir comidas en cantidades pequeñas varias veces al día y disminuir los alimentos con elevado contenido de grasa son recomendaciones de expertos cuya evidencia científica es insuficiente8. Esto puede dar lugar a dietas nutricionalmente desequilibradas e incluso podría fomentar conductas alimentarias innecesariamente restrictivas. Las dietas de exclusión pueden poner a algunos pacientes en riesgo de desarrollar el trastorno por evitación/restricción de la ingesta de alimentos (avoidant/restrictive food intake disorder o ARFID, por sus siglas en inglés) y la evitación continua de alimentos puede perpetuar los síntomas preexistentes de ARFID58. Se ha descrito una notable sobreposición entre los TICI y el ARFID59, y se informado que entre el 13 y el 40% de los pacientes con TICI cumplen todos los criterios del ARFID, o tienen síntomas clínicamente significativos de ARFID58.
Por otro lado, existen relaciones bidireccionales entre la DF y los trastornos de la conducta alimentaria (TCA). Se ha informado que más del 90% de los individuos con TCA no especificado tienen malestar posprandial y náuseas, mientras que el 94% de las personas con anorexia nervosa cumplen con criterios clínicos de DF (Roma IV)60,61. El vaciamiento gástrico y la acomodación pueden verse alterados por la ingesta de grandes volúmenes de alimentos en un breve lapso, lo que podría explicar la frecuente presencia de DF en los pacientes con trastornos por atracón y bulimia nervosa61. Aunque no existe evidencia de una relación causa/efecto entre los TCA y los TICI, la sintomatología común requiere una correcta identificación y una terapia personalizada de cada trastorno62.
Por otro lado, la eficacia de la terapia nutricional en la DF es marginal. En los últimos años, el interés se ha centrado en el posible efecto de la dieta baja en oligo-mono-disacáridos y polioles fermentables (fermentable oligosaccharides, disaccharides, monosaccharides, and polyols o FODMAP, por sus siglas en inglés), la dieta restringida en fructosa o lactosa, la dieta sin gluten y la dieta mediterránea en la DF. Las revisiones sistemáticas que analizaron la intervención con estas dietas han demostrado efectos marginales en grupos específicos de enfermos, pero también han destacado la falta de estudios de alta calidad63,64. La dieta baja en FODMAP ha sido la más estudiada en el tratamiento de la DF65–67, pero los hallazgos iniciales muestran un beneficio modesto y no significativo para la mayoría de los pacientes. De manera similar, la sensibilidad al gluten o al trigo no celíaca también se ha asociado con síntomas dispépticos y eosinofilia duodenal, lo que sugiere una superposición entre estas 2 condiciones68. La evidencia acumulada hasta ahora indica que estas intervenciones podrían ser razonables en aquellos pacientes con DF que tengan sobreposición con SII o distensión abdominal, que muestren interés y motivación por estas intervenciones dietéticas, por un período de prueba de 4 a 8 semanas67.
En la figura 1 se muestra un algoritmo de tratamiento que proponemos para el manejo del paciente con dispepsia.
Medicamentos de acción local y bloqueadores de los receptores H2 de la histaminaNo recomendamos el uso de sucralfato, sales de bismuto, antiácidos o bloqueadores de los receptores H2de la histamina para el tratamiento de la DF.
Nivel de la evidencia: B.
Nivel de acuerdo: Totalmente de acuerdo: 94%; parcialmente de acuerdo: 6%.
Hasta el momento, no existen estudios adecuados que demuestren la eficacia de los antiácidos, sales de bismuto y agentes protectores de la mucosa como sucralfato en la DF 2,5. Una revisión sistemática que evaluó el efecto de varios agentes protectores de la mucosa y antiácidos69, encontró una tendencia de mayor efectividad de las sales de bismuto en comparación con el placebo, pero con una significación estadística marginal (p=0.07). En esa misma revisión, 2 estudios que evaluaron el efecto del sucralfato en 246 pacientes mostraron una reducción de los síntomas dispépticos, pero sin significación estadística en comparación con placebo. Por su parte, los antiácidos no fueron mejores que el placebo en un estudio aleatorizado que incluyó a 109 pacientes69. Un estudio aleatorizado en el que 63 pacientes recibieron bismuto o sucralfato durante 4 semanas y se compararon con placebos de aspecto similar, no demostró diferencia estadísticamente significativa con respecto al alivio sintomático entre los grupos70. Otro estudio aleatorizado y controlado comparó la eficacia de la simeticona (105mg/3 veces al día), la cisaprida (10mg/3 veces al día) y el placebo/durante 8 semanas en 185 pacientes con DF, demostró que ambos fármacos lograban mejorar los síntomas dispépticos, aunque la simeticona fue significativamente mejor que cisaprida en las primeras 2 semanas de tratamiento71. Por otro lado, aunque han sido considerados compuestos seguros, se sabe que algunos de ellos pueden causar diversos efectos secundarios, como la ingestión aguda excesiva de bismuto o su abuso durante un período prolongado de tiempo, que puede provocar toxicidad72. A pesar de que los antiácidos y protectores de la mucosa son una opción relativamente económica y disponible, no se cuenta con evidencia actualizada y de calidad, lo que no permite recomendar su uso en la DF.
El uso de bloqueadores H2 de la histamina (BH2) para el manejo de los síntomas de dispepsia se ha evaluado en múltiples ensayos clínicos, pero la mayoría de los estudios se realizaron antes del surgimiento de los criterios de Roma38. Un metaanálisis que incluyó 12 estudios de buena calidad demostró que el uso de los BH2 disminuye el riesgo relativo de síntomas en comparación con el placebo (riesgo relativo [RR]: 0.79, IC 95%: 0.71-0.98) con un número necesario a tratar (NNT) de 773. Al parecer, el efecto antihistamínico de estos fármacos mejora la eosinofilia duodenal, que está relacionada con el SDP32,73–75. En las guías recientes de Asia-Pacífico para el manejo de la DF y la sobreposición se destacan al menos 2 estudios en los que el uso de ranitidina (en combinación con loratadina o hidroxizina) mejoran la eosinofilia duodenal e incluso predice respuesta sintomática32,74,75. Sin embargo, cuando se comparan los BH2 con los inhibidores de la bomba de protones (IBP), existe una tendencia a favor de IBP con respecto a la mejoría sintomática. Además, hay que recordar que la taquifilaxia asociada a los BH2 limita su uso prolongado39. Es importante mencionar que desde el 2019 la ranitidina fue retirada del mercado debido a la detección de un metabolito potencialmente carcinogénico, aunque la famotidina se sigue comercializando en México.
Inhibidores de la bomba de protonesRecomendamos el uso de los inhibidores de la bomba de protones para el tratamiento de la DF.
Nivel de la evidencia: A.
Nivel de acuerdo: Totalmente de acuerdo: 81%; parcialmente de acuerdo: 19%.
Los IBP son frecuentemente utilizados en el manejo de los síntomas dispépticos. Tomando en cuenta que las lesiones orgánicas más frecuentemente detectadas en los pacientes con dispepsia no investigada son la esofagitis erosiva y la enfermedad ulcerosa (ambas susceptibles de tratamiento con IBP) y que las lesiones malignas son raras76–78, se ha sugerido el inicio empírico con IBP en este grupo de enfermos, siempre que no presenten datos de alarma76. Sin embargo, esta recomendación no puede ser trasladada íntegramente a los sujetos con DF, sin antes tomar en cuenta diversos aspectos.
Un metaanálisis que incluyó 7 ensayos clínicos controlados y 3725 pacientes encontró que los IBP eran más efectivos que el placebo para reducir los síntomas en sujetos con DF (NNT: 14.6; IC 95%: 8.7-57.1)78, pero el análisis estratificado demostró que su eficacia se alcanzó solo en los pacientes con dispepsia «tipo ulcerosa» y «tipo reflujo», pero no en aquellos con dispepsia «tipo dismotilidad». Otro metaanálisis que incluyó 25 ensayos clínicos controlados y 8453 participantes, que estudió el efecto de los IBP versus placebo, BH2 o procinéticos para el alivio de los síntomas globales y la calidad de vida de pacientes con DF, demostró que los IBP tuvieron una eficacia similar a dosis baja y estándar, que los IBP fueron más eficaces que el placebo (NNT: 11), que su efectividad fue discretamente mayor o similar a los BH2 y ligeramente mayor a los procinéticos79. Un estudio poblacional llevado a cabo en India demostró que el control sintomático mediante el uso de IBP fue diferente de acuerdo con el fármaco utilizado80. Lo anterior demuestra que la respuesta en la DF al tratamiento con IBP no es completa ni homogénea y hace pensar que, debido su heterogeneidad, puede haber subgrupos de enfermos con DF que experimenten alteraciones en la sensibilidad al ácido y se beneficien directamente de la terapia con IBP81.
Diversas guías reconocen que el uso de IBP es una terapia efectiva en la DF8,36,38,39. Algunas sugieren el uso de IBP a dosis bajas38 y otras sugieren su empleo solo en quienes persisten sintomáticos después de la erradicación de H. pylori o en quienes son negativos para la bacteria36,39. La evidencia más reciente ha demostrado que no hay diferencias significativas entre los distintos tipos de IBP, en el uso de dosis altas o bajas, así como su efectividad entre los subgrupos de la DF8,82. Sugerimos un tratamiento a corto plazo con IBP en dosis bajas en estos pacientes, siempre que haya una revisión periódica para evitar el riesgo de sobre prescripción a largo plazo. Todos los pacientes tratados crónicamente con IBP deben ser revisados a intervalos regulares para evaluar si realmente existe una necesidad continua de tomar esta terapia o, si es posible, reducir la dosis o suspenderlos por completo para evitar una sobre prescripción y favorecer un menor costo de esta terapia.
Inhibidores competitivos del potasioNo recomendamos el uso de los inhibidores de ácido competitivos del potasio para el tratamiento de la DF.
Nivel de la evidencia: C.
Nivel de acuerdo: Totalmente de acuerdo: 44%; parcialmente de acuerdo: 37%; incierto: 19%.
Los inhibidores de ácido competitivos del potasio (potassium-competitive acid blockers o P-CAB por sus siglas en inglés) son una nueva clase terapéutica que inhiben selectivamente a la bomba de protones mediante el bloqueo reversible de los canales de potasio83. Debido a sus propiedades farmacológicas ofrecen importantes ventajas sobre los IBP: actúan rápidamente y desde la primera toma, elevan el pH intragástrico por arriba de 6 desde el primer día y no requieren ser administrados antes de la ingesta de los alimentos. Vonoprazan fue el primer P-CAB aprobado y registrado en Asia y EE. UU. de Norteamérica, mientras que tegoprazan es el primer P-CAB aprobado y registrado en Latinoamérica84,85. Si bien existen múltiples estudios en ERGE, erradicación de H. pylori, profilaxis de lesiones gástricas y manejo de úlcera péptica, la evidencia del uso de P-CAB en DF es muy limitada85–88. En un estudio, 43 pacientes con DF fueron tratados con vonoprazan 20mg diarios o placebo/durante 4 semanas, observando disminución de la intensidad de los síntomas a favor del fármaco (45.3 vs. 28.2%)86. Otro trabajo comparó la eficacia de vonoprazan 10mg al día (n=48) vs. acotiamida 100mg/3 veces al día (n=37)/durante 4 semanas, encontrando que las puntuaciones de dolor epigástrico y malestar posprandial mejoraron significativamente en ambos grupos y el grado de mejora de cada puntuación fue similar87. En el estudio más recientemente publicado, abierto y no comparativo, 173 pacientes con DF (Roma IV) fueron tratados con tegoprazán 50mg/una vez al día, documentando alivio satisfactorio de los síntomas a las 8 y 4 semanas en 86.7 y 74.6%, respectivamente. También se observó mejoría significativa a las 8 y 4 semanas en las escalas de calidad de vida en comparación con las puntuaciones iniciales, sin eventos adversos graves relacionados con el fármaco88.
Por lo anterior, aunque los P-CAB son una opción prometedora, la evidencia actual no es suficiente para recomendar su uso en la DF.
ProcinéticosRecomendamos el uso de procinéticos para el tratamiento de la DF.
Nivel de la evidencia: B.
Nivel de acuerdo: Totalmente de acuerdo: 69%; parcialmente de acuerdo: 31%.
Debido a que los síntomas de la DF se asocian a anormalidades en la motilidad gástrica que incluyen el retraso en el vaciamiento y la falta de acomodación luego de consumir alimentos, los procinéticos se consideran parte del enfoque terapéutico. Sin embargo, la relación entre la mejoría de los síntomas y las funciones motoras gastrointestinales, sigue siendo controvertida y su eficacia a largo plazo se encuentra limitada por los efectos secundarios de algunos de ellos. Este grupo se compone de diversas clases de fármacos que mejoran el funcionamiento motor gastrointestinal actuando por diferentes vías e incluye: antagonistas de los receptores de la dopamina-2, inhibidores de la acetilcolinesterasa, agonistas de motilina y agonistas de grelina. Aunque los agonistas 5-HT1 y 5-HT4 también tienen efecto procinético, serán abordados aparte por sus distintos efectos y perfil farmacológico. Aunque la recomendación emitida se hace tomando a los procinéticos como grupo, debemos reconocer que la evidencia que sustenta su uso en DF no es homogénea (tabla 2).
Clasificación de los procinéticos y nivel de evidencia sobre su efectividad en dispepsia funcional
| Grupo farmacológico | Fármaco | Nivel de evidencia |
|---|---|---|
| Antagonistas de los receptores de la dopamina-2 | Metoclopramida, domperidona, itoprida, levosulpirida, cleboprida | B |
| Inhibidores de la acetilcolinesterasa | Acotiamida | |
| Agonistas de motilina | Eritromicina | |
| Agonistas de grelina | Relamorelina | C |
| Agonistas del receptor de 5-HT4 de la serotonina | Cisaprida, mosaprida, prucaloprida, tegaserod, velusetrag y renzaprida | |
| Agonistas 5-HT1A | Buspirona, tandospirona | B |
Un metaanálisis que evaluó a los procinéticos como grupo e incluyó 29 estudios y 10,044 pacientes, demostró que son significativamente más efectivos que el placebo en la reducción de los síntomas de la DF, con una ganancia terapéutica de 14% sobre el placebo y un NNT: 789. A pesar de los buenos resultados, este estudio ha sido cuestionado debido a la heterogeneidad de los ensayos incluidos y los potenciales sesgos.
Los antagonistas de los receptores de la dopamina-2 (metoclopramida, domperidona, itoprida, levosulpirida y cleboprida), disminuyen los síntomas en pacientes con DF al favorecer el vaciamiento gástrico y el aumento en la motilidad gastrointestinal.
La metoclopramida, el primer antagonista del receptor D2, tiene efectos procinéticos al actuar como agonista del receptor 5-HT4. Su fácil paso a través de la barrera hematoencefálica se relaciona con posibles efectos neurológicos irreversibles, lo que ha generado una advertencia debido a la inducción de síntomas extrapiramidales90. Diversos ensayos y un metaanálisis que compararon la eficacia de metoclopramida con placebo u otras terapias farmacológicas en la DF mostraron una mejoría significativa de los síntomas a favor del fármaco, destacando sus limitaciones por los potenciales efectos adversos90–94.
La domperidona además de sus propiedades procinéticas periféricas tiene efecto antiemético. Aunque son pocos los estudios publicados, algunos indican una reducción significativa de los síntomas de dispepsia con la domperidona en comparación con el placebo, llegando hasta el 76% con resultados similares a la metoclopramida, pero con menos efectos secundarios, aunque solo se recomienda su uso a corto plazo95. Un metaanálisis de Cochrane sugirió que los efectos benéficos se logran a dosis de 10-20mg/3 veces al día en comparación con placebo en la tasa global de síntomas dispépticos96. La efectividad de la domperidona en subgrupos específicos de la DF aún no se ha investigado debido al riesgo de prolongación del intervalo QT y mayor riesgo de arritmia ventricular90.
La itoprida, es un antagonista de los receptores D2 e inhibidor de la colinesterasa que promueve la contractilidad gástrica, aumenta la presión del esfínter esofágico inferior y acelera el vaciamiento gástrico. Cuatro de 6 ensayos clínicos informaron una mejoría significativa en los síntomas de la DF después de 2 a 8 semanas de tratamiento con itoprida, mientras que 2 ensayos no demostraron mejoría en comparación con el placebo36,89,90,97. Un estudio que evaluó los efectos de la itoprida utilizando medidas validadas informadas por los pacientes, demostró la eficacia de la itoprida, especialmente en los pacientes con superposición de PDS con EPS98.
La levosulpirida actúa a través de las vías dopaminérgicas que controlan la motilidad gastrointestinal y su componente serotoninérgico (5-HT4), también puede aumentar su eficacia terapéutica. Algunos estudios, han respaldado la eficacia de levosulpirida en el control de síntomas dispépticos como dolor o malestar epigástrico, náusea, distensión abdominal y aerofagia, así como en los síntomas globales, además de contar con un perfil de seguridad favorable99,100. Una revisión sistemática informó que la incidencia de eventos adversos con levosulpirida fue del 11%, siendo la mayoría leves y rara vez resultando en la interrupción del tratamiento. Comparado con cisaprida, levosulpirida mostró eficacia similar en la reducción de los tiempos de vaciamiento gástrico en un ensayo aleatorizado101.
La cleboprida es una benzamida no selectiva con gran afinidad por los receptores D2, D3 y D4, que actúa como antagonista de receptores de dopamina. Aunque ha demostrado ser eficaz en el alivio de síntomas, la evidencia que sustenta su efectividad en DF es limitada y no ha sido actualizada con estudios recientes102.
De los inhibidores de la acetilcolinesterasa, solo la acotiamida cuenta con amplia evidencia de su utilidad clínica en la DF, fundamentalmente por su efecto como procinético gástrico. La acotiamida mejora la liberación de acetilcolina en el sistema nervioso entérico a través del antagonismo del receptor muscarínico y la inhibición de la acetilcolinesterasa. Tiene baja afinidad por los receptores de serotonina 5-HT2, 5-HT3, 5-HT4 y por los receptores D2 en comparación a otros procinéticos103. En varios ensayos clínicos, la acotiamida ha mostrado lograr mejoría significativa de la sensación de plenitud, distensión y saciedad temprana en comparación con placebo104. Un ensayo controlado y comparativo con placebo en el que se evaluó la mejoría sintomática mediante una escala de Likert de 7 puntos y el vaciamiento mediante ultrasonografía, antes y después de la intervención mostró mejoría sintomática del 31.6% con acotiamida y del 16.7% con placebo105. La dosis más apropiada de acotiamida ha sido motivo de estudio. Un metaanálisis incluyó 7 ensayos clínicos controlados y comparativos con placebo en los que utilizaron dosis variables desde 50 a 900mg/3 veces al día por periodos variables de tiempo106, mientras que Tack et al.107 y Matsueda et al.108 utilizaron 50 y 300mg adicionales a la dosis convencional de 100mg de acotiamida. La dosis de 100mg/3 veces al día mostró mejores resultados, por lo que se considera la más apropiada para el tratamiento de la DF.
Los agonistas de motilina son fármacos que imitan la acción de este neurotransmisor interactuando de manera selectiva con su receptor, incrementando la presión del esfínter esofágico inferior, estimulando la motilidad gástrica y mejorando la acomodación. De este grupo solo la eritromicina, un antibiótico macrólido, cuenta con evidencia en DF109. En un ensayo clínico controlado, llevado a cabo en pacientes con DF y vaciamiento gástrico retardado, la administración de eritromicina no mejoró significativamente los síntomas globales, además de un riesgo importante de taquifilaxia110.
Los agonistas de grelina estimulan la función motora gástrica a través del vago y se han relacionado con la motilidad y con la regulación del apetito. La relamorelina, un agonista de la grelina, se ha mencionado como un fármaco prometedor en la dispepsia. Sin embargo, la evidencia de su uso en DF es escasa con resultados contradictorios111.
Diversas guías reconocen que el uso de los procinéticos es una terapia efectiva en la DF8,36,38,39. Algunas sugieren su empleo solo en quienes persisten sintomáticos después de la erradicación de H. pylori o luego del tratamiento con IBP36. Otras recomiendan su uso como parte de la primera línea de tratamiento, en especial en los pacientes con SDP, bajo la lógica de la mayor frecuencia de alteraciones motoras en este grupo39. Sin embargo, los estudios han encontrado una prevalencia similar de anomalías motoras gástricas en SDP, SDE y en aquellos con superposición de ambos subtipos. En general, se considera que la evidencia que respalda el uso de procinéticos en la DF es de menor calidad en comparación con otras opciones terapéuticas, a lo que se ha sumado el hecho de que no todos están disponibles en todos los países112. En México contamos con una amplia gama de procinéticos, con un buen perfil de seguridad si se selecciona adecuadamente a los enfermos y se usan apropiadamente, por lo que consideramos que son una alternativa terapéutica en la DF.
Agonistas del receptor 5-HT4 de serotoninaNo recomendamos el uso de los agonistas del receptor de 5-HT4de la serotonina para el tratamiento de la DF.
Nivel de la evidencia: C.
Nivel de acuerdo: Totalmente de acuerdo: 56%; parcialmente de acuerdo: 38%; incierto: 6%.
Los agonistas de los receptores 5-HT4 (cisaprida, mosaprida, prucaloprida, tegaserod, velusetrag y renzaprida) liberan acetilcolina desde el plexo mientérico y estimulan la contracción del músculo liso acelerando el vaciamiento gástrico. Pero la amplia distribución de estos receptores de serotonina contribuye a su participación en una gran cantidad de funciones que aún no han sido completamente estudiadas, incluyendo la modulación del dolor visceral113.
La cisaprida, uno de los primeros agonistas no selectivos del receptor 5-HT4 que fue utilizado en pacientes con DF y gastroparesia, demostró mejoría acelerando el vaciamiento y potencializando la acomodación gástrica en sujetos sanos. Sin embargo, los efectos de la cisaprida en los síntomas gastrointestinales son controvertidos, ya que algunos estudios no muestran diferencias significativas debido a respuestas elevadas al placebo114. Fue retirado del mercado en los EE. UU. de Norteamérica debido a su potencial arritmogénico, relacionado con su afinidad por el canal humano ether-a-gogo (HERG)115.
Se han desarrollado varios agonistas selectivos del receptor 5-HT4. La mosaprida se utiliza como agente procinético en países asiáticos, pero un ensayo controlado en Europa no demostró eficacia en la DF116. En un ensayo clínico controlado que comparó mosaprida de liberación controlada con nortriptilina en pacientes con DF por 4 semanas, ambos fármacos mostraron una eficacia similar no solo en el alivio sintomático sino también en el control de la ansiedad y en la mejoría de la calidad de vida, independientemente del subtipo de dispepsia117. Prucaloprida es un potente agonista del receptor 5-HT4 con alta especificidad por este receptor, que ha demostrado mejorar el vaciamiento gástrico, así como en el tránsito del intestino delgado y colónico en pacientes con estreñimiento crónico idiopático. Estudios en voluntarios sanos indican también que prucaloprida puede aumentar el vaciamiento gástrico con beneficios sintomáticos después de 120 min118. Aunque se ha sugerido su eficacia potencial en la DF, aún no se han realizado ensayos a gran escala para evaluar su acción en esta condición. Tegaserod, un agonista parcial del receptor 5-HT4 que originalmente fue desarrollado para el SII con predominio de estreñimiento (SII-E) y estreñimiento funcional, demostró tener beneficios en el tratamiento de la DF. Un estudio aleatorizado y controlado con placebo mostró una mejoría del 4.6% en los días con alivio de los síntomas después de 6 semanas de tratamiento comparado con placebo. Aunque estos resultados fueron estadísticamente significativos, el valor clínico es insuficiente para su recomendación. Cabe destacar que el efecto del tratamiento fue mayor en los pacientes con síntomas moderados o graves119. Otro estudio en las mujeres con DF que recibían tratamiento concomitante con IBP para pirosis, no demostró beneficios estadísticamente significativos120. Tegaserod fue retirado del mercado en 2008 debido a un presunto aumento de efectos secundarios cardiovasculares, pero la Food & Drug Administration recientemente aprobó su reintroducción para las mujeres menores de 65 años con SII-E. Velusetrag y renzaprida aún no han sido evaluados en los pacientes con DF.
Un metaanálisis que incluyó 10 ensayos clínicos, controlados y comparativos con placebo, que evaluó la eficacia de los agonistas de serotonina en el tratamiento de la DF, demostró una alta eficacia de estos fármacos para el control sintomático en comparación con placebo121. Sin embargo, la selección de los estudios fue muy heterogénea, involucrando, fármacos de diferentes clases e incluyendo los pacientes diagnosticados con diversos criterios, lo que impide establecer conclusiones claras.
Por lo anterior, la evidencia que sustenta en empleo de los agonistas de los receptores 5-HT4 de la serotonina en la DF es escasa y, en algunos casos nula, limitada por los efectos indeseables de algunos de ellos, lo que no permite recomendar su uso.
Agonistas del receptor 5-HT1A de serotoninaRecomendamos el uso de los agonistas 5-HT1Aen los pacientes con DF.
Nivel de la evidencia: B.
Nivel de acuerdo: Totalmente de acuerdo: 56%; parcialmente de acuerdo: 44%.
Los agonistas 5-HT1A inducen relajación gástrica mejorando los síntomas de DF en los pacientes con alteración de la acomodación e hipersensibilidad a la distensión gástrica122. Un ensayo clínico controlado en el que los sujetos recibieron buspirona 10mg/3 veces al día/durante 4 semanas, mejoró significativamente los síntomas globales e individuales de saciedad temprana, sensación de plenitud posprandial y distensión abdominal superior, pero no demostró mejoría en el dolor y ardor epigástrico, por lo que podría ser más útil en el subgrupo de pacientes con SDP123. La tandospirona mostró mejoría significativa en un ensayo clínico controlado y comparativo con placebo de 4 semanas en pacientes con DF llevado a cabo en Japón124. Un estudio aleatorizado y comparativo con placebo mostró que la tandospirona mejoró eficazmente tanto los síntomas gastrointestinales como la ansiedad de los pacientes con DF125. Se ha propuesto que estos efectos terapéuticos pueden estar asociados con la modulación del factor neurotrópico derivado del cerebro y citocinas inflamatorias que fueron medidas en este ensayo.
Aunque la evidencia que sustenta el empleo de los agonistas de los receptores 5-HT1A en la DF aun es poca, en comparación con otros fármacos, consideramos que puede ser una opción terapéutica, por lo que recomendamos su uso en casos seleccionados.
Erradicación del Helicobacter pylori en la dispepsia funcionalRecomendamos prescribir tratamiento de erradicación en los pacientes con DF que tienen infección por Helicobacter pylori.
Nivel de la evidencia: A.
Nivel de acuerdo: Totalmente de acuerdo: 88%; parcialmente de acuerdo: 12%.
Un metaanálisis y una revisión sistemática reciente que incluyó 29 ensayos clínicos y 6,781 pacientes con DF positivos para H. pylori, ha proporcionado evidencia de alta calidad que muestra que la erradicación de la bacteria es un tratamiento efectivo y seguro en este escenario126. El análisis demostró que la erradicación de H. pylori fue superior al tratamiento control (antisecretores, procinéticos, con o sin placebo de antibióticos o solo placebo) en la curación de síntomas (NNT: 14) y en la mejoría de síntomas dispépticos (NNT: 9). Los pacientes con erradicación exitosa del H. pylori tuvieron curación o mejoría de los síntomas en comparación con aquellos sin erradicación exitosa (NNT: 4.5). El beneficio terapéutico se observó hasta por 12 meses. Los efectos adversos en general (número necesario para dañar [NND]: 3) y los eventos adversos que obligaron a la suspensión del tratamiento fueron más comunes con el tratamiento de erradicación (NND: 71)120. Otros metaanálisis han documentado que la erradicación del H. pylori en DF disminuye los riesgos de desarrollar úlcera péptica o cáncer gástrico127.
Los hallazgos de estas nuevas evidencias permiten hacer las siguientes conclusiones que apoyan la recomendación arriba mencionada:
- a)
La infección por H. pylori es causa de la DF, aunque los mecanismos por los cuales esta infección produce los síntomas dispépticos aún no están claros. Su erradicación cura o mejora los síntomas.
- b)
La erradicación del H. pylori debe ser considerada como tratamiento de elección en un paciente con síntomas dispépticos, endoscopia negativa y biopsias o pruebas que demuestren infección por este microorganismo.
- c)
Un tratamiento que erradica el H. pylori exitosamente incrementa las tasas de curación o mejora de los síntomas en DF. Por lo tanto, en DF es imperativo utilizar esquemas de erradicación con eficacia comprobada en la población a tratar.
- d)
Se plantea el concepto de que la DF que responde al tratamiento de erradicación podría ser considerada como una enfermedad orgánica y denominarse dispepsia asociada a H. pylori, como lo sugieren el consenso de Kyoto128 y los criterios de Roma IV1.
- e)
Aunque los eventos adversos con el tratamiento de erradicación son más comunes, estos son leves y rara vez evitan terminar el tratamiento.
- f)
En estos metaanálisis se incluyeron estudios en poblaciones de pacientes dispépticos con baja prevalencia (EE. UU. de Norteamérica, Europa) y elevada prevalencia (países asiáticos como China) de infección por H. pylori, encontrándose el mismo efecto benéfico del tratamiento de erradicación, lo cual sugiere que esta estrategia terapéutica es efectiva independientemente de la prevalencia de la infección.
No existen ensayos controlados en México que permitan evaluar la eficacia de la erradicación de H. pylori en DF. Sin embargo, la evidencia mencionada permite recomendar el tratamiento de erradicación en mexicanos con DF e infección por H. pylori.
NeuromoduladoresRecomendamos el uso de neuromoduladores para el manejo de la DF.
Nivel de la evidencia: B.
Nivel de acuerdo: Totalmente de acuerdo: 94%; parcialmente de acuerdo: 6%.
Los neuromoduladores son moléculas que actúan regulando la actividad de los canales iónicos y potenciales de membrana en las células neurales, estimulando o inhibiendo en forma total o parcial, uno o más transportadores o receptores pre y postsinápticos serotoninérgicos, muscarínicos, colinérgicos o noradrenérgicos, con efectos sobre la motilidad y el tono gastrointestinal, la acomodación gástrica, con efecto antinociceptivo o sobre el procesamiento central del dolor de acuerdo al grupo farmacológico129,130. Existen 8 grupos farmacológicos, y de acuerdo con el sitio de acción, pueden ser centrales (todos excepto delta ligandos) y periféricos (delta ligandos)131. Aunque la recomendación emitida se hace tomando a los neuromoduladores como grupo, debemos reconocer que la evidencia que sustenta su uso en DF no es homogénea (tabla 3).
Clasificación de los neuromoduladores y nivel de evidencia sobre su efectividad en dispepsia funcional
| Grupo farmacológico | Fármaco | Nivel de evidencia |
|---|---|---|
| Antidepresivos tricíclicos | Amitriptilina, imipramina, nortriptilina, desipramina | A |
| Inhibidores selectivos de recaptura de serotonina (ISRS) | Citalopram, escitalopram, fluoxetina, sertralina, paroxetina | C |
| Inhibidores de recaptura de norepinefrina y serotonina (IRNS) | Duloxetina, desvenlafaxina, milnacepran, venlafaxina | C |
| Antidepresivos noradrenérgicos y serotoninérgicos tetracíclicos | Amoxapina, mianserina, mirtazapina, trazodona | Ba |
| Azapironas | Buspirona, tandospirona | B |
| Antipsicóticos atípicos | Aripiprazol, brexpiprazol, flupentixol, levosulpirida, olanzapina, quetiapina, sulpirida | Ab |
| Anticonvulsivantes | Ácido valpróico, topiramato, carbamazepina, lamotrigina, oxcarbazepina | D |
| Neurolíticos y delta-ligandos | Gabapentina, pregabalina | C |
Modificado de referencia 125.
Los estudios y revisiones sistemáticas iniciales agrupaban a los neuromoduladores en una sola categoría o los catalogaban como antidepresivos o ansiolíticos, mostrando resultados heterogéneos132. Pero el mejor entendimiento de los TICI ha podido demostrar que existen diferentes importantes entre grupos y así lo han confirmado los estudios controlados y metaanálisis subsecuentes132–137. Bajo esta nueva visión como grupo, los neuromoduladores han mostrado ser útiles para el tratamiento de la DF, con un NNT de 6132.
Varios estudios han demostrado la utilidad de los antidepresivos tricíclicos (ATC) en la DF y es el grupo que cuenta con el mejor grado de evidencia. La amitriptilina e imipramina han demostrado ser superiores al placebo y al escitalopram en SDE, con NNT: 6 para mejoría sintomática y NNT: 7 para la reducción de los puntajes de dolor133. Un ensayo clínico controlado en pacientes con EPS, que comparó el efecto de pantoprazol contra dosis baja de amitriptilina (25mg por la noche/durante 4 semanas), demostró mejoría significativa en los síntomas en el grupo tratado con amitriptilina, aunque sin lograr impacto en los puntajes de estrés psicológico o ansiedad134. Un estudio que incluyó 107 pacientes con DF refractaria a esomeprazol y domperidona analizó el efecto de imipramina contra placebo, demostrando mejoría significativa en los puntajes de síntomas globales de dispepsia, con un NNT: 4135. Aunque el incremento de la dosis de imipramina fue gradual, una mayor proporción de los pacientes tratados con el fármaco lo suspendieron por efectos adversos en comparación con placebo (18 vs. 8%, respectivamente), siendo los más comunes boca seca, estreñimiento y somnolencia. Un estudio clínico, controlado, aleatorizado y comparativo entre nortriptilina y duloxetina, demostró la superioridad de la nortriptilina en la mejoría sintomática de pacientes con DF, aunque duloxetina fue más efectiva para reducir ansiedad136. Los metaanálisis más recientes han confirmado la eficacia de los ATC en el tratamiento de la DF con NNT bajos73,132,137.
Por el contrario, los inhibidores selectivos de recaptura de serotonina (ISRS) y los inhibidores de recaptura de norepinefrina y serotonina (IRNS) no han mostrado ser superiores al placebo, a los ATC o a los tetracíclicos para control sintomático en la DF132,138. Algunas guías consideran a este grupo como el de segunda elección para control de dolor cuando hay intolerancia a ATC, pero la evidencia es insuficiente130. Su uso puede considerarse en los pacientes con DF que tienen ansiedad (ISRS e IRNS) o trastornos obsesivos compulsivos o depresión (ISRS).
De los antidepresivos noradrenérgicos y serotoninérgicos tetracíclicos, la mirtazapina ha demostrado ser de utilidad en el SDP, particularmente cuando se asocia a pérdida de peso. La mirtazapina fue mejor que placebo en la mejoría global, saciedad temprana, calidad de vida y recuperación paulatina de peso, al parecer relacionado a un efecto sobre relajación fúndica y acomodación gástrica139. Un estudio que comparó el efecto de mirtazapina con nortriptilina en la DF demostró disminución significativa del dolor epigástrico, los eructos, la distensión y la depresión en el grupo tratado con mirtazapina, sin encontrar diferencias en la ansiedad140. A pesar de estos buenos resultados, la mirtazapina no logró eficacia estadísticamente significativa en el metaanálisis de Ford et al.132.
Las azapironas con efecto antagonista de receptores 5-HT1 han demostrado utilidad en el SDP (buspirona) y en el SDE (tandospirona)73. Pero su efecto parece ir más allá del que ejercen sobre la motilidad gástrica, ya que la tandospirona ha mostrado reducir los puntajes de ansiedad en sujetos con DF125.
De los antipsicóticos atípicos, la levosulpirida y sulpirida cuentan con la mejor evidencia en el tratamiento de la DF. Ambos fármacos tienen una acción dual ya que, además de ser antagonistas de los receptores D2 y agonistas parciales D3, son agonistas 5-HT1 y antagonistas 5-HT2, por lo que actúan como procinéticos y neuromoduladores. En el metaanálisis de Ford et al.132, el grupo de antipsicóticos atípicos mostró un riesgo de persistencia de los síntomas por debajo de la unidad (RR: 0.50; IC 95%: 0.37-0.67), con un NNT: 3 y NNH: 21.
Los anticonvulsivantes no cuentan con estudios clínicos en la DF.
Los delta-ligandos pertenecen al grupo de los anticonvulsivantes, pero también han sido clasificados como neuromoduladores de acción periférica con actividad ansiolítica. La pregabalina y la gabapentina han sido evaluados en series de casos, estudios abiertos y ensayos clínicos controlados y comparativos contra placebo y en combinación con omeprazol, demostrando mejoría global y en percepción y puntaje de síntomas141–143.
Algunos neuromoduladores parecen tener efecto en más de un mecanismo asociado al dolor, incluyendo hipersensibilidad gastroduodenal y visceral, alteración en el procesamiento central de dolor y sobre la acomodación gástrica. El efecto es acumulativo a lo largo de 6 a 8 semanas, tras lo cual se logra el beneficio clínico máximo, que puede estar limitado por la presencia de efectos secundarios. Estos efectos pueden presentarse desde el inicio del tratamiento, por lo que deben usarse a dosis escalada gradual de acuerdo con tolerancia. La selección del fármaco debe tomar en cuenta diversos factores como la efectividad demostrada, la comorbilidad psicológica asociada, los efectos indeseables y la tolerancia.
Probióticos y rifaximinaNo recomendamos el empleo de probióticos ni de rifaximina para el tratamiento de la DF.
Nivel de la evidencia: C.
Nivel de acuerdo: Totalmente de acuerdo: 69%; parcialmente de acuerdo: 31%.
En la DF se ha demostrado que la disbiosis y las alteraciones de la barrera mucosa contribuyen a la inflamación de bajo grado e influyen en la disfunción sensorial, generando síntomas dispépticos que se modifican por factores ambientales como la dieta y el consumo de medicamentos, en especial los inhibidores de la secreción del ácido gástrico144–146. Hay un interés creciente por modular la microbiota para lograr un efecto terapéutico en la DF y, para ello se han utilizado probióticos y rifaximina.
Los probióticos han sido evaluados en múltiples estudios de cohorte y ensayos clínicos controlados utilizando cepas específicas y combinaciones, en forma exclusiva o combinados con tratamientos convencionales como procinéticos y antisecretores147,148. Algunos probióticos han demostrado cierto beneficio fisiológico o sintomático, pero el diseño de los estudios y la falta de claridad en sus mecanismos de acción impiden sacar conclusiones sólidas y reproducibles. La eficacia de los prebióticos y probióticos fue estudiada en un metaanálisis que incluyó exclusivamente ensayos clínicos controlados149. Los investigadores concluyeron que el uso de probióticos no se asoció con una mejoría significativa en los síntomas de la DF (RR: 1.13; IC 95%: 0.99-1.28; p=0.67). El análisis cuidadoso de estos trabajos mostró diferencias importantes en la cepa, la dosis y la duración del tratamiento, así como los subgrupos de enfermos, los desenlaces clínicos y las definiciones de mejoría.
La utilidad potencial de la rifaximina con el fin de tratar la disbiosis en pacientes con DF ha sido explorada en algunos estudios. Un ensayo clínico controlado y comparativo demostró que la administración del antibiótico (400mg/3 veces al día/por 2 semanas) logró alivio global de los síntomas dispépticos en una proporción de sujetos significativamente mayor en comparación con placebo (78 vs. 52%; p=0.02), así como mejoría en los eructos y distensión posprandial a las 4 semanas, principalmente en las mujeres150. Aunque el número de pacientes incluidos fue relativamente bajo, un aspecto relevante de este estudio fue que se excluyeron activamente a los sujetos que tenían síntomas sugestivos o un diagnóstico de SII, por lo que la superposición de DF con SII no influyó en los resultados. Otro ensayo clínico y controlado comparó la efectividad de rifaximina, mosaprida y la combinación de ambos en el tratamiento de la sobrepoblación bacteriana en sujetos con DF151. La rifaximina redujo los gases espirados y alivió algunos síntomas, pero el pequeño número de sujetos estudiados, la superposición con SII, la elevada tasa de abandono y la falta de un grupo placebo hacen difícil interpretar los resultados. Otro pequeño estudio abierto en el que 21 pacientes con DF (con y sin SII) fueron tratados en forma consecutiva con 550mg de rifaximina/2 veces al día/por 10 días, demostró alivio significativo en los puntajes de la escala de síntomas empleada, sin encontrar aparente influencia de la presencia de SII en los resultados152. Las obvias limitaciones del estudio limitan su interpretación.
Ante la evidencia actual, el potencial de los probióticos y la rifaximina es innegable, pero se requieren más y mejores estudios antes de recomendar su empleo en el tratamiento de la DF, en especial en aquellos con sobreposición con el SII.
Compuestos herbolarios y fitofármacosRecomendamos en uso de STW-5 y menta piperita para el tratamiento de la DF.
Nivel de la evidencia: B.
Nivel de acuerdo: Totalmente de acuerdo: 63%; parcialmente de acuerdo: 31%; incierto: 6%.
En años recientes ha habido un incremento en los estudios publicados sobre la potencial utilidad de productos de herbolarios en algunos TICI, principalmente en la DF153,154. La mayoría de estos productos de herbolarios son preparaciones de varios componentes, con una amplia variedad de efectos en la función gastrointestinal, que hasta ahora no contaban con evidencia de alta calidad sobre su eficacia155–157. Pero, también se ha retomado la investigación formal en la herbolaria a través de la fitofarmacología, que se orienta al estudio de los extractos estandarizados de plantas medicinales. Los fitofármacos son medicamentos cuya sustancia activa contiene el extracto de una determinada planta o de la combinación de diversas plantas, raíces y vegetales, y su mecanismo de acción es conocido. Por ejemplo, el rikkunshito (compuesto por 8 hierbas y raíces) disminuye los síntomas dispépticos al promover la relajación adaptativa e incrementar el vaciamiento gástrico. Un metaanálisis reciente que incluyó 5,475 pacientes mostró una mayor eficacia del rikkunshito en comparación con el tratamiento occidental y con el placebo al reducir significativamente la escala de síntomas de dispepsia y mejorar el vaciamiento gástrico158.
Algunos fitofármacos han sido comercializados y se encuentran disponibles para su uso clínico desde hace varios años. Uno de los fitofármacos que cuenta con mayor número de estudios es el STW-5, un compuesto de 9 hierbas y raíces de origen alemán que ha demostrado mejorar los síntomas de la DF al producir la relajación del fondo y favorecer el vaciamiento gástrico. Varios estudios clínicos, controlados y comparativos contra placebo, así como metaanálisis, han evaluado el STW-5 en los pacientes con DF y comprobado su eficacia en el control sintomático luego de 4-8 semanas de uso, con un buen perfil de seguridad159–162. Este fitofármaco ha sido descrito como «multipropósito», pues cuenta con evidencia sobre su efectividad en el tratamiento del SII, lo que lo vuelve una alternativa práctica en los pacientes con sobreposición de DF-SII163–165.
El aceite de menta piperita, cuyo principio activo es el mentol, tiene propiedades antiespasmódicas debido a su capacidad para bloquear los canales de calcio del músculo liso intestinal, aunque existe evidencia de otros posibles mecanismos de acción como la modulación de la sensibilidad visceral y central, efectos antioxidantes, antiparasitarios, antifúngicos, moduladores de la microbiota y antiinflamatorios directos166,167. Un metaanálisis que incluyó 5 ensayos clínicos controlados y 578 pacientes evaluó la utilidad de la combinación de aceite de menta piperita y aceite de alcaravea en el tratamiento de la DF demostrando alivio significativo en los síntomas globales y el dolor epigástrico (NNT: 3, para ambos objetivos) con buena tolerancia y sin efectos indeseables graves168. Ya que ha demostrado buen efecto clínico en el SII169 podría ser una buena opción terapéutica para aquellos pacientes con sobreposición de DF y SII.
Terapias psicológicasNo recomendamos el uso generalizado de terapia psicológica en los sujetos con DF, pero puede ser de utilidad en aquellos con síntomas severos, refractarios y con comorbilidades psicológicas.
Nivel de la evidencia: C.
Nivel de acuerdo: Totalmente de acuerdo: 88%; parcialmente de acuerdo: 12%.
Varios tipos de psicoterapia, como la terapia cognitiva conductual, terapia de afrontamiento flexible e hipnoterapia han sido investigadas en pacientes con DF. Algunos estudios han sugerido agregar la psicoterapia al tratamiento médico estándar de la DF porque produce resultados más favorables que solo el tratamiento médico170–172. Un estudio demostró que la terapia cognitiva conductual para manejo del estrés fue más efectiva en el control de los síntomas dispépticos comparada con un grupo control170. Otro estudio comparativo demostró mejoría sintomática y de la calidad de vida en el 59% de pacientes con DF tratados con sesiones semanales de hipnoterapia por 3 meses vs. 41% aquellos con tratamiento médico convencional vs. 34% de los que recibieron solo tratamiento de apoyo172. Un pequeño estudio piloto que evaluó la hipnoterapia autoaplicada utilizando un programa de audio totalmente automatizado, que no requiere la participación de un terapeuta o médico, demostró una mejora significativa en los síntomas de la DF, la calidad de vida y el bienestar emocional 173. Una revisión sistemática y metaanálisis que incluyó 9 estudios controlados mostró que las intervenciones psicológicas ofrecen un beneficio significativo y persistente en la reducción de los síntomas globales de la DF, pero la calidad de los estudios fue baja debido a los sesgos y la heterogeneidad174. Otra revisión sistemática reciente encontró que la hipnoterapia en la DF brinda resultados alentadores, pero concluyó que se necesitan más estudios de mejor calidad antes de recomendar este tratamiento en los pacientes con DF175.
Las terapias psicológicas tienen desventajas importantes: consumen mucho tiempo y hay poca disponibilidad de terapistas expertos, por lo que son relativamente costosas. La evidencia más reciente apunta a que los formatos de administración de terapias más rentables (por teléfono, por Internet, terapia de grupo, menos sesiones con terapeuta o terapias autoadministradas) pueden ser eficaces para tratar los trastornos gastrointestinales176. Es posible que, mediante la adopción de las tecnologías disponibles, las terapias psicológicas puedan convertirse en opciones que mejoren los resultados clínicos en un futuro cercano, incluso en casos refractarios de DF.
Aunque en este documento no recomendamos el uso generalizado de terapia psicológica en los sujetos con DF, cabe señalar que es muy importante realizar el tamizaje de factores psicológicos en individuos con síntomas moderados, intensos y/o refractarios177,178. Es fundamental investigar factores específicos como la ansiedad, la depresión y las experiencias adversas en la infancia, así como evaluar la calidad del sueño, ya que existen mecanismos compartidos que se ven involucrados en el ritmo circadiano, la hipersensibilidad visceral y las respuestas inmunitarias179. Mejorar la calidad del sueño y la ansiedad, mejora los puntajes de síntomas en la DF180. Cada vez hay más evidencia que sugiere que los factores psicológicos son la causa de los síntomas en un subconjunto de pacientes con TICI y que no se explican por la búsqueda de atención médica, mientras que, en otros casos los factores psicológicos pueden surgir de manera secundaria a la enfermedad intestinal181. Una revisión de las guías de manejo de la DF elaboradas por la Sociedad Británica de Gastroenterología, destacó que hay 4 intervenciones conductuales principales del intestino y el cerebro que pueden tener eficacia en el tratamiento de los síntomas globales de la DF: hipnoterapia, manejo del estrés, psicoterapia informada psicodinámica interpersonal y terapia cognitivo conductual182. Por otro lado, los factores psicológicos predicen respuesta al tratamiento, ayudan a seleccionar las opciones terapéuticas y a mejorar el pronóstico y la calidad de vida de las personas con DF, por lo que su identificación y evaluación es de gran relevancia.
Medicina personalizadaRecomendamos personalizar el tratamiento de la DF y combinar distintas opciones terapéuticas de acuerdo con las características de cada paciente.
Nivel de la evidencia: C.
Nivel de acuerdo: Totalmente de acuerdo: 100%.
La DF muestra características peculiares que la convierten en un síndrome complejo. Su fisiopatología es diversa, intrincada y en muchos casos, aún no es completamente entendida. La DF tiene una elevada prevalencia en la población general, por lo que puede coexistir con otros padecimientos orgánicos de alta frecuencia que pueden generar síntomas similares, pero también se sobrepone con otros TICI. Aquellos pacientes con sobreposición con otros TICI tienen síntomas más intensos, responden en forma menos eficiente al manejo y muestran mayor comorbilidad psicológica183,184. Aunque la DF es un padecimiento estable, de curso crónico y benigno, se caracteriza por exacerbaciones y remisiones de duración e intensidad variables a lo largo del tiempo185. Al igual que otros TICI, muestra una elevada respuesta al placebo, lo que impone exigencias especiales a las distintas intervenciones terapéuticas186. Por otro lado, no debemos olvidar que los objetivos del tratamiento de la DF son lograr el control sintomático y mejorar la calidad de vida2.
Es importante seguir la dirección que tome la investigación en el futuro, ya que las nuevas técnicas de imagen neuronal, las multiómicas y la inteligencia artificial están renovando la forma de diagnosticar y tratar la DF. Las características de la red cerebral funcional determinadas por resonancia magnética nuclear podrían ser utilizadas como biomarcadores para la identificación de pacientes con DF187. Estudios experimentales han revelado características del microbioma, transcriptoma y metaboloma que podrían regular la inflamación duodenal de bajo grado en la DF188. Se han desarrollado modelos de diagnóstico basados en inteligencia artificial que utilizan imágenes de la actividad cerebral y la preferencia por los alimentos para distinguir a aquellos con DF de los controles sanos189. La inteligencia artificial también se ha utilizado para desarrollar modelos de predicción que ayuden a evaluar mejor a los sujetos con DF, predecir la respuesta, adaptar y ajustar el tratamiento, así como mejorar la eficacia terapéutica190,191.
Tomando en cuenta todo lo anterior, es fácil entender que no todos los pacientes responderán al mismo manejo, que será muy difícil lograr los objetivos terapéuticos con una sola intervención o fármaco, que las necesidades de tratamiento no serán exactamente las mismas para todos los pacientes e incluso, no serán las mismas para un mismo sujeto a lo largo del tiempo. Recomendamos personalizar el tratamiento y combinar distintas opciones terapéuticas de acuerdo con las características de cada paciente. En la figura 1 se muestra un algoritmo de diagnóstico y tratamiento que proponemos para el manejo de la dispepsia.
ConclusionesLa DF es uno de los padecimientos digestivos más frecuentes en la práctica diaria. Es un trastorno complejo, con múltiples factores fisiopatológicos y diversas opciones terapéuticas. En esta revisión consensuada, presentamos los avances logrados en el conocimiento de esta enfermedad en los últimos años y emitimos recomendaciones de buena práctica para su manejo, con lo que queremos complementar y actualizar el documento de consenso sobre la dispepsia publicado por la Asociación Mexicana de Gastroenterología en 2017.
FinanciaciónEste documento se realizó con el apoyo económico de Laboratorios Carnot con el que se costeó parcialmente la reunión de votación presencial (transportación y hospedaje). Los autores no recibieron honorarios por su participación.
Consideraciones éticasLos autores declaran que en la elaboración de este trabajo: 1) no se realizó investigación activa alguna con pacientes, por lo que no se solicitó consentimiento informado; 2) que el trabajo cumple con la normativa vigente en investigación bioética; 3) que no se solicitó la autorización de un comité de ética por tratarse de una revisión bibliográfica temática, en la que no se realizó intervención alguna con sujetos, muestras biológicas, medicamentos o productos sanitarios, y 4) que este artículo no contiene información personal que permita identificar a los pacientes.
Conflicto de interesesGenaro Vázquez-Elizondo participa como investigador para laboratorios Chinoin y Carnot, Novo Nordisk de México. Es asesor de Chinoin, M8 Pharmaceuticals y Eurofarma. Es conferencista para M8 Pharmaceuticals, Chinoin, Menarini, Alfasigma, Asofarma, Pfizer, Roche, Takeda México, Ferrer, Novo Nordisk, MSD, Laboratorio Carnot y Eurofarma.
Octavio Gómez-Escudero es conferencista para laboratorios Chinoin, Alfasigma, Faes Pharma y Carnot.
Enrique Coss-Adame es consultante Medtronic de México, Adium de México, Grunenthal de México, y conferencista para Medtronic, Adium, Grunenthal, Alfa-Sigma, Sanfer, Medix, Megalabs y Carnot.
Miguel Morales-Arámbula es conferencista para los laboratorios Grünenthal, Menarini, Carnot, Eurofarma, ProMedCS, Praha y M8 Pharma.
Eliana Carolina Morel-Cerda es conferencista para laboratorios Alfasigma y Megalabs.
Alejandra Noble-Lugo ha sido conferencista para los laboratorios Alfasigma, Adium, AstraZeneca y Ferrer. Ha participado en el desarrollo de material académico y como conferencista para laboratorios Chinoin, Liomont y M8 Pharma.
José María Remes-Troche es asesor y miembro de consejo consultivo para Asofarma, Carnot, Pro.Med.CS. Praha A.S. y PISA. Conferencista para Asofarma, Abbot, Carnot, Chinoin, Ferrer, Johnson & Johnson, Medix y Medtronic.
Omar Edel Trujillo-Benavides es conferencista para laboratorio Adium, Chinoin, Carnot, Grünenthal y Medix.
Miguel Ángel Valdovinos-Díaz es conferencista para los laboratorios Carnot, Asofarma y Faes Farma.
Todos los demás participantes declaran no tener conflictos de intereses.