La alimentación complementaria (AC) se define como la alimentación de los lactantes que complementa a la lactancia materna o en su defecto, a la lactancia con un sucedáneo de la leche materna, y es un proceso que va más allá de simplemente una guía sobre qué y cómo introducir los alimentos. La información brindada por parte de los profesionales de la salud debe ser actualizada y basada en evidencia. Existen diferentes guías o documentos de posición a nivel internacional, que, aunque la mayoría de las recomendaciones pueden ser aplicables, hay algunas otras que requieren una regionalización o adecuación a las condiciones y realidad de cada zona. El grupo de trabajo de Nutrición de la Sociedad Latinoamericana de Gastroenterología, Hepatología y Nutrición Pediátrica convocó a un grupo de expertos, representantes de cada uno de los países que conforman la sociedad, con el objetivo de desarrollar un consenso sobre la AC, que incorporó cuando así fue posible, información local que se adapte a la realidad de la región. El objetivo de este documento es mostrar los resultados de dicho trabajo. A través de metodología Delphi, se evaluaron, discutieron y votaron un total de 34 declaraciones o enunciados con respecto a aspectos relevantes de la AC.
Complementary feeding (CF) is defined as the feeding of infants that complements breastfeeding, or alternatively, feeding with a breast milk substitute, and is a process that is more than simply a guide as to what and how to introduce foods. The information provided by healthcare professionals must be up-to-date and evidence-based. Most of the recommendations that appear in the different international guidelines and position papers are widely applicable, but some must be regionalized or adapted to fit the conditions and reality of each geographic zone. The Nutrition Working Group of the Latin American Society for Pediatric Gastroenterology, Hepatology and Nutrition (LASPGHAN) summoned a group of experts from each of the society's member countries, to develop a consensus on CF, incorporating, whenever possible, local information adapted to the reality of the region. The aim of the present document is to show the results of that endeavor. Utilizing the Delphi method, a total of 34 statements on relevant aspects of CF were evaluated, discussed, and voted upon.
La alimentación complementaria (AC), definida como la alimentación de los lactantes que complementa a la lactancia materna o en su defecto, a la lactancia con un sucedáneo de la leche materna, es un proceso que va más allá de simplemente una guía sobre qué y cómo introducir los alimentos. Es un proceso en el que se tienen que tomar en cuenta diversos aspectos, tales como el momento correcto de la introducción de alimentos, favorecer una AC perceptiva (crear un ambiente correcto, considerar aspectos sensoriales, interpretar las señales de hambre y saciedad), los aspectos culturales y, la percepción de los padres y/o cuidadores. Implica también una progresión en el cambio de texturas para promover los movimientos de la lengua, labios y mandíbula, con la finalidad de asegurar el correcto desarrollo de los órganos involucrados en la masticación, el habla y la pronunciación. Además, es un periodo muy importante de establecimiento de preferencias alimentarias que perdurarán en etapas posteriores1. Es importante analizar cada uno de los factores para llevar a cabo un proceso de alimentación adecuado y satisfactorio para cada lactante, sus padres y/o cuidadores. La información brindada por parte de los profesionales de la salud debe ser actualizada y basada en evidencia. Existen diferentes guías o documentos de posición a nivel internacional, que, aunque la mayoría de las recomendaciones pueden ser aplicables, hay algunas otras que requieren una regionalización o adecuación a las condiciones y realidad de cada zona2,3. En una encuesta reciente en un grupo de profesionales de salud de Latinoamérica, se mostró que los conocimientos sobre AC aún son incompletos e insuficientes4. Es por lo anterior, que el grupo de trabajo de Nutrición de la Sociedad Latinoamericana de Gastroenterología, Hepatología y Nutrición Pediátrica (LASPGHAN, por sus siglas en inglés, Latin American Society for Pediatric Gastroenterology, Hepatology and Nutrition) convocó a un grupo de expertos, representantes de cada uno de los países que conforman la sociedad, con el objetivo de desarrollar un consenso sobre AC, que incorporó cuando así fue posible, información local que se adapte a la realidad de la región. El objetivo de este documento es mostrar los resultados de dicho trabajo.
Material y métodosDesde el grupo de trabajo de nutrición de la LASPGHAN se convocó a un grupo de especialistas expertos, representantes de cada uno de los países que la conforman, incluidos España y Portugal. Se formaron 5 subgrupos de trabajo para abordar los diferentes tópicos de la AC, los cuales fueron coordinados por miembros del grupo de trabajo de nutrición de LASPGHAN (RVF, LLM, MCBM, VHR y EO) y quienes fungieron como facilitadores. Cada uno de los participantes fue asignado de forma aleatoria a uno de los 5 subgrupos de trabajo. Los facilitadores elaboraron una serie de declaraciones acorde con los diferentes tópicos y posteriormente buscaron la evidencia que diera soporte a dichas declaraciones. Se realizó una búsqueda inicial de información en las siguientes bases de datos: CENTRAL (The Cochrane Central Register of Controlled Trials), MEDLINE (PubMed), EMBASE (Ovid), que comprendan un período entre el 1 de enero de 1990 al 31 octubre del 2019. Los criterios de búsqueda bibliográfica (Keywords), para ello, los términos MeSH que se utilizaron fueron: «breastfeeding», «bottle feeding», «complementary feeding», «dietary sucrose», «dietary sugars», «feeding behaviors», «feeding methods«, «honey», «immune tolerance», «infant feeding», «infant food», «infant formula», «infant nutrition», «meals», «micronutrients», «responsive feeding», «sugar-sweetened beverages», «toddler feeding», «water requirements», «weaning» y sus equivalentes en español. Se identificaron todas las publicaciones en inglés y español (artículos originales, consensos, guías, revisiones sistemáticas y metaanálisis), y publicaciones que los coordinadores consideraron relevantes y se compartieron con todo el grupo. Dentro de cada subgrupo se analizó la información correspondiente y se trabajó en la adecuación y perfeccionamiento de los diferentes enunciados o declaraciones. Se realizó una primera reunión de trabajo de forma presencial en el congreso de la LASPGHAN, realizado en noviembre de 2019, donde se tuvo la primera presentación de las declaraciones, y se contó con la participación de un asesor externo, experto en el tema (BK). Cada subgrupo trabajó extrayendo la información que diera soporte a las diferentes declaraciones a través de la generación de cuadros de evidencia, cuando así fuera posible. Luego, se realizó una segunda reunión virtual donde se presentaron las declaraciones finales y se mostró el sustento para cada uno de ellos. Todos los participantes asistentes tuvieron la oportunidad de emitir comentarios y cuestionamientos sobre las diferentes declaraciones. Posteriormente, se procedió a evaluar cada una de las declaraciones mediante un proceso Delphi, de voto anónimo (con posibilidad de escribir comentarios), vía electrónica, para determinar el nivel de acuerdo en los enunciados/declaraciones; cada enunciado o declaración fue evaluado acorde con la escala Likert de 3 puntos: a) de acuerdo, b) en desacuerdo y c) abstención. En las votaciones participaron únicamente los representantes de cada uno de los países; los coordinadores/facilitadores no participaron en la votación. Después de una primera vuelta de votación, se presentaron los resultados en una reunión de trabajo virtual, donde los participantes emitieron sus comentarios con respecto a los enunciados presentados. Aquellos enunciados para los que existió consenso (> 75% de acuerdo) fueron aceptados; aquellos para los que no hubiera existido consenso (menos del 75% de acuerdo) serían revalorados para su eliminación o bien, para ser reformulados por los miembros de la mesa de trabajo que los elaboró y fueron sometidos para una segunda ronda de votación anónima y así sucesivamente, cuantas veces fuera necesario. Los coordinadores/facilitadores de cada mesa elaboraron de forma analítica y sintética la parte correspondiente del manuscrito.
ResultadosParticiparon 21 representantes de países miembros de LASPGHAN: Argentina, Bolivia, República Brasil, Chile, Colombia, Costa Rica, Cuba, Ecuador, El Salvador, España, Guatemala, Honduras, México, Nicaragua, Panamá, Paraguay, Perú, Portugal, República Dominicana, Uruguay y Venezuela. El 90.5% (19) de los participantes representantes fueron médicos, la mitad de los cuales cuentan con una formación en gastroenterología y nutrición pediátrica; el resto fueron nutricionistas (licenciadas en nutrición como su formación troncal) con formación en nutrición pediátrica. Se elaboraron un total de 34 declaraciones, después de una única ronda de votación y discusión, fueron incluidas las 33 declaraciones, con un porcentaje mayor al 75% de consenso, con las que se realizó el presente documento.
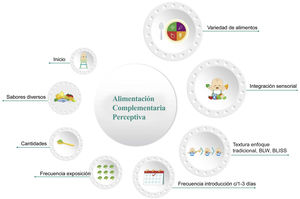
El proceso de AC va más allá de la simple selección del momento de inicio de la misma o la elección del primer alimento. A pesar de que existan nuevas corrientes o enfoques sobre introducción de texturas, éstas solo representan un solo punto de todos los aspectos importantes a tomar en cuenta. La figura 1 destaca los más importantes de todo el proceso de la AC. Declaración 1. En los lactantes sanos de la región Iberoamericana se recomienda la lactancia materna exclusiva durante los primeros 6 meses de edad (acuerdo 100%)
La leche materna es la mejor opción de alimentación por sus beneficios a corto y largo plazo5,6; tiene un impacto positivo en la supervivencia de los lactantes, no solo por el aporte energético y de nutrientes sino por los factores inmunológicos protectores7. En una revisión sistemática se muestra que haber recibido algún tiempo de lactancia materna disminuye en un 65% las gastroenteritis y en un 36% el síndrome de muerte súbita; la lactancia materna exclusiva por 3 meses disminuye en un 50% la otitis media y en un 40% la dermatitis atópica; así mismo el aporte de leche materna por lo menos 3 meses reduce en un 40% la posibilidad de desarrollar asma, y en un 20% la posibilidad de obesidad y diabetes; también la lactancia materna durante 4 meses reduce un 70% de las enfermedades respiratorias y hasta los 6 meses, reduce el 20% de posibilidad de desarrollar leucemia aguda8. La lactancia materna exclusiva tiene influencia en aspectos claves como el crecimiento físico, el desarrollo neurológico, la aceptación de sabores, la disminución del riesgo alérgico, la mal oclusión dental y el vínculo afectivo9. Declaración 2. La alimentación complementaria debe promoverse y explicarse bajo el esquema de alimentación perceptiva (acuerdo 100%)
Diversos documentos y estudios resaltan la reciprocidad entre el niño y el cuidador que implica el proceso de alimentación10. La AC perceptiva se basa en las señales de hambre y saciedad emitidas por el niño, el reconocimiento de las mismas y la respuesta acertada del cuidador, y finalmente la reacción predecible del niño. Es importante que los cuidadores comprendan que los lactantes tienen una capacidad gástrica limitada y por lo tanto necesitan ser alimentados con porciones y volúmenes apropiados a su edad y etapa de desarrollo, con la frecuencia necesaria para satisfacer sus necesidades nutricionales11. Declaración 3. En los lactantes sanos de la región Iberoamericana que son alimentados de forma exclusiva con leche materna, se recomienda el inicio de la alimentación complementaria a los 6 meses de edad (acuerdo 100%)
A partir de los 6 meses se torna difícil cubrir los requerimientos nutricionales exclusivamente con leche materna, en especial energía, hierro y cinc12; además la mayoría de los lactantes ha alcanzado el desarrollo suficiente que les permite recibir otros alimentos y en zonas geográficas donde las condiciones ambientales son poco favorables, la lactancia materna exclusiva durante este período ayuda a reducir la exposición a enfermedades infecciosas o trasmitidas por alimentos2,13. La interrupción prematura o poco aporte de leche materna, puede contribuir a un aporte insuficiente de nutrimentos y energía que llevaría a un riesgo elevado de desnutrición en caso de ofrecer alimentos de baja calidad nutricional y en cantidades no adecuadas, antes de tiempo14,15. Una revisión sistemática16 muestra que la intervención educativa mejora las prácticas de AC en cuanto a duración de lactancia materna exclusiva, edad de introducción de alimentos complementarios y hábitos de higiene asociados. Declaración 4. El establecimiento de la alimentación complementaria no supone la suspensión de la leche materna, la cual debe mantenerse al menos hasta los primeros 2 años de edad (acuerdo 90.5%, abstención 9.5%)
La leche materna puede aportar la mitad o más de los requerimientos de energía del niño de 6 a 12 meses y un tercio de los requerimientos de energía, además de otros nutrimentos en niños de 12 a 24 meses13,17. La leche materna continúa aportando nutrimentos de mejor calidad que los que pueden ofrecer los alimentos complementarios, así como factores protectores. La leche materna es una fuente clave para la obtención de energía y nutrimentos durante la enfermedad y reduce la mortalidad entre los niños desnutridos18. Asimismo, durante el período de los 6 a los 24 meses se establecen la mayor parte de los hábitos, preferencias y aversiones alimentarias que condicionarán en gran medida el tipo de alimentación futura19,20. Declaración 5. En lactantes alimentados con fórmula infantil (parcial o totalmente) se puede iniciar la alimentación complementaria a partir de los 4 meses de edad (acuerdo 85.7%, en desacuerdo 4.7%, abstención 9.5%)
Actualmente el único parámetro para decidir el inicio de la AC en un lactante que no tiene problema de seguridad en la deglución es la edad. Existe una ventana de tiempo para el inicio de esta, entre los 4 y 6 meses de edad2,3. Contrario a lo que previamente se refería, la supuesta inmadurez gastrointestinal, renal, dental, etc., adicional al hito del desarrollo de sentarse sin ayuda, no son una limitante para decidir el inicio de la AC, ya que existe ausencia de evidencia que pruebe esto y lo cual ha sido reafirmado de forma reciente por la Autoridad Europea de Seguridad Alimentaria (EFSA)21. Los riesgos de la introducción precoz, antes de los 4 meses, de los alimentos complementarios podrían incluir: posibilidad de atragantamiento, aumento de gastroenteritis aguda e infecciones del tracto respiratorio superior, interferencia con la biodisponibilidad de hierro y cinc de la leche materna, y sustitución de tomas de leche por otros alimentos menos nutritivos (sustitutos inadecuados de la leche materna)22. Declaración 6. El peso de los lactantes no debe de ser un indicador para empezar o retrasar la alimentación complementaria (acuerdo 95.2%, abstención 4.7%)
La introducción de la AC en lactantes con bajo peso o exceso de peso no debe ser diferente de las recomendaciones del lactante sano; aunque la disponibilidad de información científica sobre este punto es escasa o nula. No hay evidencia consistente de una asociación entre el inicio de la AC y el riesgo posterior de sobrepeso y obesidad, por lo que no se tiene que retrasar el inicio de la misma para tener un efecto protector23. En nuestro contexto social, se recomienda la introducción de los alimentos complementarios a partir de los 6 meses, siguiendo las recomendaciones de la Organización Mundial de la Salud (OMS) para la promoción de la lactancia materna exclusiva durante los primeros 6 meses. Declaración 7. El inicio de la alimentación complementaria en el pretérmino puede realizarse entre los 4 y 6 meses de edad corregida (acuerdo 90.5%, en desacuerdo 4.7%, abstención 4.7%)
Existen guías que indican que el pretérmino está preparado para empezar este proceso cuando ha perdido el reflejo de extrusión, acepta la cuchara (disminuye hipersensibilidad oral), y su alimentación ya está cubriendo los requerimientos específicos24. El retraso en la introducción de la AC podría afectar el crecimiento y el neurodesarrollo, y una introducción precoz puede aumentar el riesgo de infección e ingreso hospitalario25,26. En función de la evidencia limitada disponible, lo recomendado sería esperar a los 6 meses de edad corregida, y se desaconseja introducir la AC antes de los 4 meses de edad corregida27,28. No hay evidencia de los efectos de la introducción de alimentos complementarios a los 4 o 6 meses de edad corregida, sobre el peso, la talla y el perímetro cefálico21. Declaración 8. La alimentación complementaria en lactantes que reciben leche materna de forma exclusiva debe iniciarse y mantenerse con alimentos con alta biodisponibilidad de hierro, cinc, calcio, vitamina A y folato, tales como: carnes rojas, vísceras y/o cereales infantiles fortificados sin azúcar añadida (acuerdo 100%)
Diferentes estudios han evaluado los efectos de utilizar carne y cereales infantiles fortificados como alimentos complementarios sobre los parámetros bioquímicos, antropométricos y del desarrollo en lactantes con lactancia materna exclusiva29–32. La recomendación es aportar entre 0.9 y 1.3mg/kg/día de hierro, primero con alimentos fuente y de no ser posible, con alimentos fortificados, antes de iniciar la suplementación, especialmente para niños entre los 6 y 12 meses de edad que han recibido lactancia materna exclusiva hasta los 6 meses. En lugares donde los alimentos de origen animal fuente de hierro, cinc, calcio, vitamina A y folato son escasos o no están disponibles, es necesario ofrecer alimentos complementarios fortificados con hierro13 ya que difícilmente se puede cubrir el requerimiento si no se utilizan2. Declaración 9. En el pretérmino la alimentación complementaria debe de incluir todos los grupos de alimentos, dando preferencia a los alimentos con mayor densidad energética, proteica y con aporte suficiente de hierro (acuerdo 100%)
La OMS describe un buen alimento complementario como aquel que es buena fuente de energía, proteína y micronutrimentos como hierro, cinc, calcio, vitamina A y folato. Así mismo, menciona la necesidad de incluir alimentos de origen animal fuentes de hierro y cinc, y utilizar alimentos fortificados como alternativa para llenar las brechas críticas. Los alimentos fuente de hierro y los fortificados, deben preferirse antes que la suplementación con hierro13. Los niños pretérminos tienen requerimientos mayores de energía, proteína y hierro comparados con los niños nacidos a término33,34. Por lo que, además de ofrecer una AC variada al igual que en todos los niños, se debe lograr cubrir los mayores requerimientos de energía y de estos nutrimentos33. Declaración 10. Un alimento nuevo puede introducirse cada día, sin retrasar la introducción de los alimentos nuevos más allá de cada 3 días (acuerdo 95.2%, abstención 4.7%)
La Academia Americana de Pediatría (AAP) menciona que los nuevos alimentos deben introducirse solos y durante varios días para identificar reacciones adversas3. No obstante, las reacciones adversas pueden presentarse de forma inmediata (horas, días) o de forma tardía (semanas)35, por lo que un alimento nuevo puede introducirse cada día o bien, cada 2 o 3 días, pero idealmente no más allá de este tiempo, ya que el número de alimentos nuevos que se lograría alcanzar durante el primer mes de iniciada la AC puede ser insuficiente para lograr una dieta diversa y por ende, una alimentación mínimamente aceptable36. Declaración 11. La alimentación complementaria debe ser variada, incluyendo desde el inicio alimentos de todos los grupos y asegurándose que los 5 sabores básicos están presentes. Cuatro semanas después del inicio de la alimentación complementaria, deberán de haberse incorporado al menos 2 alimentos de cada grupo (acuerdo 100%)
La OMS ha establecido el indicador de dieta mínima aceptable para niños entre 6 y 23 meses de edad, el cual está compuesto por la frecuencia diaria de comidas y la diversidad alimentaria diaria que hace referencia a recibir como mínimo 5 de los 8 grupos de alimentos: 1) leche materna; 2) granos, raíces, tubérculos; 3) frutas y verduras ricas en vitamina A; 4) carnes, pescados y aves; 5) legumbres, nueces y semillas; 6) huevos; 7) otras frutas y verduras; y 8) productos lácteos36. En concordancia también con lo estipulado por la AAP, la progresión de alimentos de los 4 grupos: granos, carnes, frutas y verduras, puede ser alcanzada razonablemente durante el primer mes de iniciada la AC3.
El número de alimentos depende del número de exposiciones que se haga con cada alimento. Si se quiere exponer al niño 3 días consecutivos a cada alimento como lo enmarcaba la AAP37 y se introduce al menos un alimento diferente de cada grupo, durante las primeras 2 semanas del inicio de la AC se estarán reconociendo los cuatro grupos de alimentos, por lo que hacia los 6 y ½ meses de edad, el lactante podrá tener en su plato todos los grupos de alimentos, tal como lo enmarca la Universidad de Harvard en su plato de la alimentación saludable para niños, el cual incluye 4 principales grupos de alimentos: verduras, frutas, cereales y proteínas38; y al mes de iniciada la AC, se habrán incorporado al menos 2 a 3 alimentos de cada grupo, para poder garantizar así, una alimentación sana13.
La programación del sabor o preferencias alimentarias inicia desde el embarazo con la alimentación de la madre y el transporte placentario hasta el feto39. Posteriormente, por medio de la leche materna y subsecuentemente, con la introducción de los alimentos complementarios donde ocurre la exposición directa a alimentos con diferentes sabores: dulce, salado, ácido, amargo y umami40. Estos sabores deben ser alcanzados durante las primeras dos semanas de iniciada la AC conservando las características de un buen alimento complementario OMS13. Por ejemplo, verduras: brócoli (predominio del sabor amargo) y tomate (predominio del sabor umami); frutas: fresa (frutilla) y mango (predominio de los sabores ácido y dulce respectivamente y dependiendo del grado de maduración); cereales: cereal infantil fortificado de arroz y trigo (sabor neutro o salado principalmente); proteínas: hígado de pollo o res (amargo) y huevo (salado principalmente o neutro) y grasas: aguacate (sabor neutro) y nueces (sabor neutro o salado). Declaración 12. En lactantes sanos alimentados con fórmula infantil la alimentación complementaria se puede iniciar con cualquier grupo de alimentos, pero a las 2 semanas de haber iniciado, se debe haber ofrecido al menos un alimento de cada grupo (acuerdo 100%)
Mientras la necesidad en niños con lactancia materna exclusiva es cubrir la brecha de hierro y cinc13; en niños alimentados con sucedáneos de la leche materna o fórmula infantil, estos nutrimentos son cubiertos casi que su totalidad por la fórmula41. Aunado a esto, no existe evidencia científica que soporte a un alimento o grupo de alimentos como mejor opción para el inicio de la AC, pues ello depende del aspecto cultural, religioso y de la situación socio económica de la familia3. Declaración 13. Desde el inicio de la alimentación complementaria se pueden ofrecer 3 tiempos de comidas, pudiendo agregar posteriormente uno o dos refrigerios (acuerdo 95.2%, abstención 4.7%)
La transición en el número de comidas ocurre de forma gradual durante este período de crecimiento13. El número apropiado de comidas a ofrecer dependerán del apetito del niño, de la cantidad de alimentos consumidos en cada tiempo, del requerimiento energético, así como de la densidad energética, la cual se sugiere que sea mínima 0.8kcal/g asumiendo una capacidad gástrica de 30g/kg de peso corporal/día; se recomiendan 4 comidas si la densidad es de 0.8kcal/g y 3 comidas con una densidad de 1kcal/g de los alimentos. La densidad energética se alcanza cuando se incluye mayor diversidad de alimentos12,13,42. Los refrigerios por su parte se definen como alimentos consumidos entre las comidas principales3. Si el niño recibe pocas comidas o con densidad menor a la recomendada no recibirá la cantidad de alimentos suficientes para cubrir sus necesidades energéticas13. Declaración 14. Se deberá promover la exposición diaria a verduras y frutas, ya que se logra mayor aceptación de estos grupos de alimentos a largo plazo (acuerdo 100%)
Los primeros sabores que experimenta el lactante son a través de la alimentación de la madre por medio del líquido amniótico y posteriormente a través de la leche materna, los lactantes que se encuentran alimentados con fórmula a menudo reciben un solo tipo y esto limita la experiencia a diferentes sabores, a pesar de la falta de variedad de sabor en las fórmulas, éstas varían en su sabor de acuerdo con el tipo, marca, composición y procesamiento. Se ha demostrado que los lactantes desarrollan preferencias de sabor que reflejan el tipo de fórmula con la que son alimentados43,44.
A pesar de que los niños nacen con una predisposición biológica para preferir los sabores dulces y evitar los sabores amargos como las verduras de hoja verde oscura, se presentan oportunidades de exposiciones repetidas y variadas antes del inicio de AC para aprender a disfrutar los sabores de los alimentos a los cuales se enfrentará el lactante durante este proceso43. Sin embargo, el desarrollo de las preferencias alimentarias inicia principalmente cuando los lactantes descubren los primeros sólidos, estas experiencias contribuyen a formar las conexiones cerebrales involucradas en el placer de los alimentos y en el control del consumo de estos, es probable que estos procesos de aprendizaje tengan un impacto a largo plazo, por lo que es apremiante establecer preferencias a verduras y frutas cuando los lactantes están aprendiendo a comer45. Las características sensoriales (textura, sabor y olor) y variedad de verduras y frutas son factores importantes en su aceptación, la textura es la característica que requiere mayor adaptación, esto debido a las habilidades orales limitadas propias de la edad45. Por lo anterior, se sugiere una introducción frecuente, oportuna y variada de los alimentos complementarios respecto a sabores y texturas para una mejor aceptación de verduras y frutas43,46,47. Declaración 15. Los lactantes sanos alimentados con leche materna requieren alrededor de 10 exposiciones a un alimento (particularmente verduras) para tener reacciones positivas y aceptación a largo plazo. En lactantes con mayor sensibilidad a sabores y texturas o alimentados con fórmula, se pueden requerir entre 10 y 15 exposiciones a verduras y frutas para su aceptación a corto y largo plazo (acuerdo 100%)
La exposición repetida a los alimentos es uno de los principales factores determinantes para su aceptación, debido a que se utilizan diferentes estímulos (auditivos, visuales, olfativos y táctiles), incrementando la familiaridad de los mismos y reduciendo las reacciones de neofobia. El efecto a la exposición repetida es lo suficientemente fuerte para incrementar la aceptación de los alimentos previamente identificados como rechazados, entre 8 y 10 exposiciones, incluso pueden ser necesarias entre 10 y 15 exposiciones para incrementar el gusto43,45,47,48. Varios estudios han encontrado que las exposiciones diarias a verduras durante el periodo de AC aumentan la ingesta, el gusto y el ritmo de alimentación49, al igual que una mayor aceptación a nuevos alimentos en lactantes que reciben una gran variedad de verduras al inicio de la AC, incluidas las verduras ofrecidas durante el mes siguiente, aumentando la ingesta y el gusto por estas mismas hasta por 6 años50,51. A pesar de la eficacia de la exposición de los alimentos para lograr su aceptación, los padres a menudo ofrecen un número limitado de repeticiones (<5), antes de que decidan que no le agrada al lactante. Este mecanismo de exposición repetida y en diferentes momentos y con el sabor original es completamente efectivo para incrementar la aceptación de los alimentos y el gusto por los mismos43,48,51. Declaración 16. La cantidad de alimentos por tiempo de comida durante el periodo de alimentación complementaria es aproximadamente entre 3 y 4 cucharadas para los lactantes de 6 a 8 meses de edad, entre 4 y 8 cucharadas para los lactantes de 9 a 11 meses de edad y entre 8 y 12 cucharadas para los lactantes entre los 12 y 23 meses de edad (acuerdo 95.2%, abstención 4.7%)
En el entendido de que una cucharada equivale aproximadamente a 15g. La cantidad de alimentos que se requiere se incrementa de forma gradual mes a mes, a medida que el niño tiene mayor edad y que la ingesta de leche se reduce. Esta cantidad dependerá de la densidad energética (kcal/ml o g) del alimento ofrecido. Se recomienda que los alimentos complementarios proporcionen una densidad energética de 0.8 a 1kcal/g13,52. En la práctica, las personas que alimentan a los niños no medirán la densidad energética de las comidas ofrecidas, por lo tanto, se recomienda que la cantidad de comida ofrecida se base en los principios de AC perceptiva, atendiendo a las señales de hambre y saciedad42. Declaración 17. Se recomienda iniciar con purés/papillas y progresar a texturas grumosas y sólidos blandos antes de los 10 meses de edad para disminuir el riesgo de aversión a texturas (acuerdo 100%)
Se sugiere que existe una ventana crítica de tiempo antes de los 10 meses para la introducción de texturas grumosas12, ya que se ha observado que los lactantes a los cuales se les introducen grumos después de los 10 meses de edad se muestran más selectivos en etapas posteriores y pueden presentar mayores problemas de alimentación, observándose también ingestas menores de verduras y frutas2,46,52,53. Los lactantes a los cuales se les introduce alimentos en textura grumosa después de los 9 meses de edad presentan de forma significativa, mayores problemas de alimentación a los 7 años. Ante ello, es de suma importancia que como profesionales de la salud se aliente a la progresión de las papillas o purés a alimentos con grumos antes de los 10 meses de edad53, debido a que es fundamental para el desarrollo y por razones nutricionales, ofrecer alimentos en la textura correcta2. Declaración 18. Los enfoques de introducción de texturas BLW (Baby-Led Weaning o destete guiado por el bebé) o BLISS (Baby-Led Introduction to SolidS o alimentación sólida guiada por el bebé) deben ser asesorados por un profesional de la nutrición o médico pediatra capacitado. Los padres deberán tener pleno conocimiento de los riesgos que pueden conllevar (acuerdo 95.2%, abstención 4.7%)
Este enfoque debe asesorarse por profesional médico o de nutrición capacitado con la finalidad de brindar recomendaciones individualizadas respecto a la ingesta de macro y micronutrimentos, debido a que el profesional deberá abordar las posibles inquietudes respecto al estado del hierro, periodos de atragantamiento y falla en el crecimiento por ingesta inadecuada de energía54–56. Declaración 19. Una vez iniciada la alimentación complementaria, se deben introducir todos los alimentos, incluidos los considerados potencialmente alergénicos, como son: el huevo, el pescado, el trigo, el maní o cacahuate, la soja o soya, el maíz, los mariscos y los derivados lácteos, independientemente de la historia de atopia familiar (acuerdo 85.7%, en desacuerdo 4.5%, abstención 9.5%) Declaración 20. La introducción de huevo cocido (sin necesidad de separar clara y yema), pescado y maní (cacahuate), puede realizarse a partir de los 4 meses de edad en aquellos lactantes en los cuales se haya considerado el inicio de la AC (acuerdo 76.2%, en desacuerdo 14.3%, abstención 9.5%) Declaración 21. La exposición a los alimentos considerados potencialmente alergénicos no solo debe realizarse de forma oportuna sino frecuente, al menos 2 veces a la semana, con la finalidad de inducir y mantener tolerancia inmunológica (acuerdo 85.7%, abstención 14.3%) Declaraión 22. En lactantes con alergia, no se debe retrasar la introducción de los alimentos considerados potencialmente alergénicos (acuerdo 76.2%, en desacuerdo 9.5%, abstención 14.3%)
No existe evidencia convincente de que el retraso en la introducción de alimentos proteja para el desarrollo de alergias alimentarias; esto incluye alimentos considerados altamente alergénicos: pescado, huevo, etc.2,57–60. Estudios recientes sugieren que la exposición vía oral a alérgenos alimentarios, entre los 3 y 6 meses reduce el riesgo de alergia alimentaria61. Sin embargo, la evidencia es poca aún, la mayoría de ella de baja a moderada certeza del efecto. Lo que sí se sabe es que no hay un incremento en el riesgo de alergia alimentaria, por lo que podría considerarse su introducción en este período. Ninguno de los estudios ha sido realizado en población latinoamericana. El objetivo de proteger la lactancia materna y con esto la recomendación de mantenerla de forma exclusiva los primeros 6 meses de vida, puede seguir siendo razonable62,63. Adicionalmente, la introducción de la AC no necesariamente propicia el destete, como se muestra en el estudio «EAT», en el que se evidenció que la introducción de alimentos entre los 3 y 6 meses no afectó el índice de alimentación con leche materna los 6 y 9 meses de edad64. Respecto a los derivados lácteos, estos deben considerarse como alimentos equivalentes a otros alimentos de origen animal, y de ninguna forma deben compararse y/o reemplazar a la leche materna o en su defecto a la fórmula infantil. Declaración 23. Se desaconseja la alimentación complementaria bajo los esquemas vegano crudivegano y macrobiótico (acuerdo 100%)
No se recomienda iniciar AC bajo un sistema vegano, crudivegano o macrobiótico, fundamentalmente porque en estos regímenes podrían darse deficiencia de hierro, cinc, calcio, vitamina B2, vitamina B12, vitamina D, vitamina A, omega 3 y proteínas3,65,66. No se identificaron estudios de seguridad para dietas de crudiveganos, macrobiotos o frutívoros, por lo cual estas prácticas no se recomiendan en el lactante. Existe una escasez de datos sobre el impacto a medio y a largo plazo de eliminar los productos de origen animal en la dieta de los niños, en especial en la de los más pequeños. Sin embargo, en los últimos años se han publicado herramientas (tablas de intercambios de alimentos, recomendaciones de suplementación) que facilitan el cumplimiento de una dieta vegana/vegetariana disminuyendo el riesgo de deficiencias67. Si un padre elige para su hijo(a) una dieta vegana, debe hacerse con regularidad supervisión dietética médica y experta y las madres deben recibir y seguir los consejos nutricionales. Los lactantes que no puedan recibir lactancia materna deberían recibir una fórmula a base de soya. Declaración 24. En la situación que los cuidadores soliciten asesoría para implementar un esquema de alimentación complementaria vegetariana, esta debe realizarse bajo estricta supervisión de un profesional médico y de nutrición capacitado (acuerdo 100%)
Las dietas veganas con los suplementos apropiados traducen un crecimiento y desarrollo adecuados. La supervisión médica y dietética periódica debe ser prioritaria. Los lactantes por su parte deben recibir suministro de vitamina B12, vitamina D, hierro, cinc, ácido fólico, omega-3 ácidos grasos de cadena larga polinsaturados, proteínas y calcio. Los riesgos de no seguir los consejos son graves, incluidos los daños cognitivos irreversibles por deficiencia de vitamina B12 y muerte3,67–69. Declaración 25. La ingesta de agua natural potable puede considerarse desde el inicio de la alimentación complementaria (acuerdo 100%)
La ingesta adecuada de agua para lactantes de 6 a 12 meses es de 800ml/día y está calculada con relación al aporte de agua por leche materna en un volumen promedio de 600ml/día adicional al agua presente en alimentos complementarios70. Es así que los lactantes alimentados adecuadamente con leche materna no requieren aporte adicional de agua. No obstante, podrían verse beneficiados de su introducción en la formación de hábitos sin impactar negativamente su estado nutricional71.
En lactantes no alimentados con leche materna, la carga renal de solutos es mayor, contribuyendo así a mayores pérdidas urinarias. De acuerdo con estimaciones matemáticas de la potencial carga renal por solutos de los alimentos complementarios, se debe incluir agua como parte de un adecuado patrón dietario de lactantes no alimentados con leche materna con el fin de cuidar el estado de hidratación y homeostasis renal30. Declaración 26. La cantidad diaria de agua natural potable durante el periodo de alimentación complementaria es aproximadamente entre 60 y 150ml para los lactantes de 6 a 8 meses de edad, entre 240 y 300ml para los lactantes de 9 a 11 meses de edad y entre 450 y 600ml para los lactantes entre los 12 y 23 meses de edad (acuerdo 81%, abstención 19%)
El requerimiento de líquidos para lactantes no amamantados dependerá de la carga renal de solutos de los alimentos complementarios, estimando entre 470 y 500ml/día para lactantes entre 6 y 9 meses, 450 y 530ml/día para lactantes de 9 a 12 meses y entre 340 y 470ml/día para aquellos entre 12 y 24 meses de edad. Estos líquidos podrían aportarse a partir de agua u otras bebidas o alimentos30. En un estudio realizado en Guatemala en lactantes entre 7 y 12 meses, alimentados con leche materna, se encontró que cubrían la ingestión recomendada de líquidos (797ml/día) principalmente por leche materna, seguida por agua en bebidas, sopas y caldos, posteriormente en menor proporción por el agua contenida en los alimentos sólidos y semisólidos y, únicamente por un porcentaje menor al 5%, proveniente de agua, alrededor de 30ml al día. Los autores hacen énfasis de la necesidad de tener alimentos complementarios de alta densidad nutricional y menor volumen para no desplazar el aporte por leche materna72. Esto podría conducir a poder aumentar el volumen de agua, un nutrimento esencial y poco estudiado en esta etapa de la vida. Declaración 27. Se desaconseja el uso de azúcar añadida a los alimentos durante los primeros dos años de edad (acuerdo 100%)
La preferencia innata por el sabor dulce se ha descrito en humanos incluso antes del nacimiento73; la leche materna tiene una intensidad de dulzor similar a la de una solución de azúcar al 2.12%, provocando materna respuesta hedónica y favoreciendo mayor ingestión de esta74. Asimismo, desde muy temprano aprendemos a relacionar el dulzor de la leche materna con el cariño y crianza75. La exposición frecuente a alimentos complementarios con azúcar puede incrementar la preferencia por el dulzor e impactar en su elección de alimentos, así como el riesgo de caries dentales76, riesgo de exceso de peso77 y enfermedades crónicas no transmisibles78. En una cohorte de Porto Alegre, Brasil, de familias de bajo ingreso se determinó la incidencia de caries dentales a los 38 meses de edad de acuerdo con 3 patrones dietarios, encontrando mayor incidencia en aquellos que recibieron alimentos dulces (dulces, galletas y bebidas azucaradas) a los 6 y 12 meses y siendo mayor el riesgo entre más ingerían. Estos resultados se mantuvieron aún eliminando las bebidas azucaradas76. Así mismo, alrededor del 40% de los niños ingieren azúcar libre y azúcar natural a los 12 meses de edad, lo cual se asocia con mayor riesgo de exceso de peso a los 30 meses de edad77. Declaración 28. Dada la potencial contaminación con esporas de Clostridioides botulinum en la miel de abeja, se desaconseja su ingesta en los lactantes menores de 2 años de edad (acuerdo 100%)
El botulismo infantil es causado por esporas de Clostridioides botulinum(C. botulinum) que colonizan el tracto gastrointestinal y producen la toxina botulínica, responsable del bloqueo de funciones motoras voluntarias y autonómicas79. Los menores de 12 meses son particularmente susceptibles, posiblemente por su microbiota80. La principal fuente de esporas de C. botulinum se encuentran en el ambiente (polvo y tierra) y son responsables de la contaminación de la miel. En 59.2% de los casos de botulismo infantil que se han descrito en Europa80 se ha reportado ingestión de miel. Es por esto que se desaconseja su ingestión en menores de 12 meses. Siguiendo la misma línea de recomendaciones sobre azúcar añadida, en que la introducción temprana favorece mayor ingestión a largo plazo y su impacto sobre el estado nutricional, no se recomienda introducir miel de abeja en los primeros 24 meses de edad77. Declaración 29. En los primeros 2 años de edad, se desaconseja la ingesta de jugos naturales e industrializados y bebidas con azúcares añadidos (acuerdo 100%)
Las bebidas azucaradas, específicamente jugos, representan un grupo de alimentos complementarios que son ofrecidos a lactantes con gran frecuencia. En México, de acuerdo con la encuesta nacional de salud de 2012, más del 35% de los lactantes entre 6 a 23 meses ingerían bebidas azucaradas81. Este tipo de prácticas se ha relacionado con mayor ingestión de estas bebidas en edad prescolar y escolar82, caries dentales83, riesgo de sobrepeso u obesidad84, mayor adiposidad85 y enfermedades cardiovasculares78. En niños de 6 años que ingieren al menos una bebida azucarada al día han sido expuestos a estas bebidas alguna vez antes de los 12 meses82. La prevalencia de obesidad a los 6 años es el doble entre aquellos niños que han ingerido bebidas azucaradas en el primer año y a su vez, aquellos lactantes que ingieren bebidas azucaradas tenían mayor puntuación Z de IMC/edad82. Lactantes de 12 meses cuya ingestión de jugos es mayor o igual a 480ml, presentaban mayor ingestión de bebidas azucaradas y mayor puntuación Z de IMC/edad en edad preescolar y escolar85. Es la recomendación de esta guía, al igual que de la OMS86, la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica87 y la Asociación Americana del Corazón78 evitar la exposición a alimentos con azúcar y bebidas azucaradas en los menores de 2 años. Declaración 30. Se desaconseja la ingesta de bebidas con cafeína, tés, infusiones, bebidas carbonatadas, bebidas vegetales (almendra, avena, arroz, soja o soya y coco, entre otras), bebidas con edulcorantes y caldos en los primeros 2 años de edad. Las sopas están permitidas considerando una preparación que aporte como mínimo 3/4 de alimentos sólidos (acuerdo 90.5%, en desacuerdo 9.5%)
Las bebidas de bajo valor nutricional se deben evitar en la AC, ya que pueden desplazar otros alimentos de mejor y mayor densidad nutricional. Adicionalmente, las bebidas como el té y el café, por su contenido de polifenoles pueden interferir con la absorción de otros nutrimentos críticos como el hierro88. Las bebidas vegetales no son sustitutos adecuados de la leche materna, ni de fórmulas infantiles, ni de la leche de vaca, y su composición nutricional puede ser inadecuada en relación con aporte proteico, azúcar añadida, calcio y vitamina D, por lo que puede incrementar el riesgo de desnutrición, anemia, desórdenes electrolíticos y otras deficiencias nutricionales89,90. El uso de bebidas vegetales de arroz se debe evitar particularmente por su probable contenido de arsénico. No se recomienda el uso de alimentos y bebidas con edulcorantes no calóricos ya que la evidencia científica es incierta e insuficiente para emitir una recomendación basada en evidencia91. Las sopas contribuyen al aporte de líquidos diarios, sin embargo, puede afectar la densidad energética y nutricional de los alimentos complementarios por lo que se debe buscar mayor concentración de sólidos que líquidos30,70. Declaración 31. El uso racional de sal en la preparación de los alimentos se considera aceptable (solo para las preparaciones) a partir de los 12 meses de edad (acuerdo 95.2%, abstención 4.5%)
Poco se ha estudiado sobre el requerimiento de sodio de lactantes y su necesidad en alimentos complementarios. La ingesta adecuada recomendada para lactantes de 7 a 12 meses por el Instituto de Medicina o (IOM, por sus siglas en inglés: Institute of Medicine) es de 370mg/día70. Este requerimiento es cubierto con la ingestión adecuada promedio de leche materna o fórmula infantil, así como el sodio contenido en los alimentos complementarios por lo que es totalmente innecesario adicionar sal a las preparaciones. El uso inadecuado de ciertos alimentos complementarios ricos en sodio (productos de panificación, quesos y cereales de desayuno) pueden contribuir a una ingesta excesiva de dicho mineral. La mayoría de los lactantes de 8 a 12 meses de edad, exceden la ingesta adecuada de 400mg/día por leche de vaca como principal bebida y 3 porciones de pan al día92. La ingesta temprana de sal favorece las preferencias alimentarias por este sabor40. Por dicha razón, es importante que los lactantes conozcan el sabor original de los alimentos previo a estar sazonado con sal u otros condimentos. Asimismo, existe evidencia que el exceso de sodio desde esta primera etapa de la vida puede también impactar en la presión sanguínea y el riesgo cardiovascular a largo plazo93. A partir del año de edad, la ingesta adecuada de sodio recomendada es de 1g al día70, permitiendo así adicionar sal en las preparaciones de alimentos. De igual forma, la mayoría de los alimentos ya tuvieron que haber sido introducidos y conocidos por el lactante en su presentación y sabor original. La leche materna contiene yodo; sin embargo, su concentración puede variar dependiendo la ingestión y las reservas maternas. Concentraciones de 150 a 180mg/l en leche materna, indican suficiencia de yodo madre-hijo 94. Los lactantes reciben del 40-45% del requerimiento de yodo por leche materna95,96. Durante el período de AC, el aporte de leche materna más el de los alimentos complementarios son indispensables para prevenir deficiencias97. El contenido de yodo en frutas y vegetales depende del contenido de yodo en la tierra, el uso de fertilizantes y las prácticas de riego. Esto, a su vez, afecta el contenido de yodo en productos de origen animal98. La OMS recomienda que en los lactantes de 6 a 23 meses de edad en países o regiones donde el uso de sal yodada no sea común (<90% hogares) y/o la mediana poblacional de yodo urinario materno sea <100μg/l, se mantenga la leche materna siempre que la madre esté suplementada con yodo, ya que es más eficiente la suplementación a la madre que al lactante99, conjunto con la ingesta de alimentos complementarios fortificados con yodo100. Para lactantes no alimentados con leche materna, la fortificación de fórmulas ayuda a cubrir el requerimiento de yodo, y al igual que en zonas con adecuada eficacia de los programas de sal yodada, no es necesaria la suplementación adicional101. Declaración 32. Durante la preparación de los alimentos se pueden utilizar especias para condimentar preferiblemente después de que el lactante haya estado expuesto a los alimentos en su sabor original (acuerdo 81%, en desacuerdo 9.5%, abstención 9.5%)
Los alimentos complementarios no solo deben cubrir requerimientos nutricionales, sino que deben ofrecer una variedad de texturas, sabores y temperaturas que permitan al lactante experimentar diversas sensaciones y respuestas. La preferencia innata por los sabores dulces y salados73 puede verse moldeado por estas experiencias de sabores en las que se ofrezcan sabores umami, amargo y ácido. El uso de condimentos aporta a estas experiencias y pueden ser usados una vez que el lactante haya sido expuesto al sabor original de los alimentos complementarios. La seguridad en la ingestión de hinojo (en forma de aceite y/o te) en niños, particularmente lactantes, ha sido sujeto a discusión por su contenido de estragol, su efecto genotóxico carcinógeno y la falta de evidencia para este grupo de edad102. Si bien, algunos estudios sugieren que el contenido de estragol en tés de hinojo o en alimentos con esencia de dicho alimento pueden superar las dosis máximas permitidas, también se han descritos modelos donde se cree que la extracción y absorción del estragol es alrededor de 2.5% (en comparación al 25-35% propuesto por EFSA en 2009) y que sería prácticamente imposible superar la dosis máxima. Es recomendación de esta guía, por seguridad, evitar el té y aceite de hinojo en los primeros dos años de vida; esto no contradice la posibilidad de introducir el alimento.
Suplementación con vitaminasDado que una AC variada supone que se cubre el aporte de vitaminas y minerales que se requiere, no se considera necesario la suplementación de vitaminas durante el tiempo de AC, a menos que se demuestre una deficiencia de alguna de ellas secundaria a un estado patológico que así lo amerite. Declaración 33. Los lactantes que reciben lactancia materna exclusiva pueden recibir suplementación diaria con 400UI de vitamina D3 durante los primeros 12 meses de edad. Nota: En el caso que se cuente con exámenes bioquímicos de algún nutrimento con resultados en valores normales, no se deberá iniciar la suplementación o bien, deberá suspenderse (acuerdo 95.2%, abstención 4.7%)
La deficiencia de vitamina D es común a nivel mundial, favoreciendo el raquitismo y osteomalacia que tienen un impacto sustancial en la salud, crecimiento y desarrollo de los lactantes, niños y adolescentes. Aun cuando la leche materna es la mejor opción para la alimentación de los lactantes, su nivel de vitamina D es bajo y los niños alimentados exclusivamente con leche materna están en riesgo de deficiencia de vitamina D. La suplementación de vitamina D a los lactantes a dosis 400UI/día incrementa los niveles de 25-OH vitamina D y reduce su incidencia de deficiencia103. Así mismo, la deficiencia de vitamina D se ha incrementado en los lactantes debido a cambios en el estilo de vida, hábitos en el vestir y el uso de preparaciones tópicas de protección solar.
Para mantener una adecuada concentración sérica de vitamina D todo lactante alimentado con leche materna de manera exclusiva o parcial, deberá recibir una suplementación diaria oral de vitamina D3 iniciando desde los primeros días de vida y continuarse hasta que el lactante haya sido destetado e ingiera al menos 1l/día de fórmula infantil fortificada con vitamina D104–106. Considerando que, en promedio, con 950ml de sucedáneo de la leche materna, se cubre el 85% de vitamina D.
En cuanto a la suplementación de hierro, no se alcanzó consenso, por lo que hasta el momento se tendrá que continuar de la forma en que se hace habitualmente. Dada la relevancia de este tópico, se deberá de realizar un análisis más profundo del mismo y se emitirá una recomendación en otro documento hecho de forma expresa para este punto.
Adopción y adaptación de este consensoDesde el grupo de trabajo de nutrición de la LASPGHAN invitamos a todos los profesionales de la salud a adoptar estas pautas de AC y enseñando las recomendaciones de AC a los padres y/o cuidadores de los niños de la región basados en la mejor evidencia disponible hasta el momento. Además, a sabiendas de que existen algunas diferencias entre diferentes países, incluso dentro de diferentes regiones de un solo país, es que invitamos a hacer adaptaciones de este consenso para hacerlo aplicable a la población que cada uno de nosotros, como profesionales de la salud, atendemos.
ConclusionesLa AC se debe de implementar bajo un esquema de alimentación perceptiva. El tiempo de inicio de la AC comprende un rango entre los 4 y los 6 meses, favoreciendo en el caso de los niños que reciben leche materna de forma exclusiva hasta los 6 meses. Desde el inicio de la AC se debe de favorecer una alimentación diversa que incluya los diferentes grupos de alimentos y con alimentos que estén disponibles en la región y de temporada. La AC no es diferente en los niños con o sin riesgo de alergias o incluso con otros diagnósticos de alergias. Se requieren de estudios realizados en la región con el objetivo de aumentar la robustez de las recomendaciones consensuadas.
Responsabilidades éticasDebido a que esto es un documento de consenso basado en la mejor evidencia científica publicada, y no se trata de un estudio de investigación sobre pacientes, no aplicó el solicitar a los pacientes el consentimiento informado para recibir el tratamiento para participar en la investigación. No se realizó experimento alguno en animales y/o humanos.
Dada la naturaleza descriptiva del documento y al ser un documento de posición de la asociación, no se requirió de la autorización de ningún comité de ética.
Los autores declaran que este artículo no contiene información personal que permita identificar a los pacientes.