El paciente críticamente enfermo puede desarrollar erosiones gástricas y, en ocasiones, úlceras por estrés con sangrado gastrointestinal grave que puede ser fatal.
ObjetivosEl propósito de esta revisión fue proporcionar información actualizada acerca de la fisiopatología, factores de riesgo y profilaxis por sangrado del tubo digestivo causado por ulceras de estrés en la unidad de cuidados intensivos.
MétodosIdentificamos artículos a través de una búsqueda en PubMed, que abarcaba de los años 1970 a 2013. Los artículos más relevantes fueron seleccionados utilizando las frases de búsqueda «úlceras de estrés», «profilaxis de sangrado por úlceras de estrés» y «sangrado de la mucosa relacionado con el estrés» en combinación con «unidad de cuidados intensivos».
ResultadosLa incidencia de sangrado clínicamente significativo ha disminuido drásticamente desde 1980. Los factores de riesgo más importantes son el fallo respiratorio y las coagulopatías. Los inhibidores de la bomba de protones (IBP) o los antagonistas de receptores H2 (H2RA) se utilizan en la profilaxis de sangrado por úlceras de estrés. Ambos medicamentos han mostrado ser superiores al placebo en la reducción del riesgo de sangrado gastrointestinal, y los IBP son por lo menos tan efectivos como los H2RA. Se ha mostrado que la alimentación enteral temprana reduce el riesgo de sangrado por úlceras de estrés, aunque solo en estudios retrospectivos.
ConclusionesLa hospitalización en la unidad de cuidados intensivos por sí sola no justifica la profilaxis. Los IBP son por lo menos tan efectivos como los H2RA. Debemos individualizar el tratamiento de cada paciente en la unidad de cuidados intensivos, determinando el riesgo y evaluando la necesidad de comenzar la profilaxis.
The critically ill patient can develop gastric erosions and, on occasion, stress ulcers with severe gastrointestinal bleeding that can be fatal.
AimsThe purpose of this review was to provide current information on the pathophysiology, risk factors, and prophylaxis of digestive tract bleeding from stress ulcers in the intensive care unit.
MethodsWe identified articles through a PubMed search, covering the years 1970 to 2013. The most relevant articles were selected using the search phrases “stress ulcer”, “stress ulcer bleeding prophylaxis”, and “stress-related mucosal bleeding” in combination with “intensive care unit”.
ResultsThe incidence of clinically significant bleeding has decreased dramatically since 1980. The most important risk factors are respiratory failure and coagulopathy. Proton pump inhibitors (PPIs) or H2 receptor antagonists (H2RAs) are used in stress ulcer bleeding prophylaxis. Both drugs have been shown to be superior to placebo in reducing the risk for gastrointestinal bleeding and PPIs are at least as effective as H2RAs. Early enteral feeding has been shown to reduce the risk for stress ulcer bleeding, albeit in retrospective studies.
ConclusionsAdmittance to the intensive care unit in itself does not justify prophylaxis. PPIs are at least as effective as H2RAs. We should individualize the treatment of each patient in the intensive care unit, determining risk and evaluating the need to begin prophylaxis.
El paciente críticamente enfermo puede desarrollar erosiones gástricas y, en ocasiones, úlceras por estrés con sangrado gastrointestinal grave que puede ser fatal. Las úlceras por estrés son lesiones de la mucosa gástrica, asociadas con eventos estresantes tales como quemaduras extensas, ventilación mecánica, cirugía mayor, sepsis, coagulopatía y traumatismo grave1. El propósito de esta revisión es presentar una actualización de la incidencia, factores de riesgo, fisiopatología y prevención del sangrado por úlceras de estrés en la unidad de cuidados intensivos.
MétodosLos artículos relevantes de la literatura en inglés fueron identificados a través de una búsqueda de PubMed (1970-marzo/2013) utilizando los términos de búsqueda «úlcera de estrés», «profilaxis de úlceras de estrés» y « sangrado de la mucosa relacionado con el estrés» en combinación con «unidad de cuidados intensivos». Seleccionamos las revisiones clínicas, ensayos clínicos aleatorizados, metaanálisis y guías de tratamiento. Se extrajo la información relevante sobre la fisiopatología, epidemiología, factores de riesgo, y profilaxis. Nuestro objetivo no fue llevar a cabo una revisión sistemática.
FisiopatologíaLa patogénesis de la enfermedad de la mucosa relacionada con el estrés y las úlceras por estrés es multifactorial2. Un factor importante es la hipoperfusión esplácnica debido a los efectos relacionados con estrés asociados con la enfermedad crítica. Estos efectos incluyen la activación del sistema nervioso simpático, el aumento de la liberación de catecolaminas y vasoconstricción, la hipovolemia, la disminución del gasto cardiaco y la liberación de citocinas proinflamatorias. Las respuestas relacionadas con el estrés lesionan la integridad de la mucosa gástrica al reducir el flujo sanguíneo gastrointestinal, la oxigenación y la secreción de bicarbonato. Al verse comprometida la permeabilidad de la barrera mucosa la subsecuente difusión de iones de hidrógeno y pepsina dañan aún más la capa de la mucosa epitelial. El flujo sanguíneo lento en la mucosa altera la cicatrización de la misma. La motilidad gástrica disminuida prolonga el tiempo de contacto del ácido con la mucosa gástrica, incrementando el riesgo de ulceración. Otro factor es el daño por reperfusión. Cuando el flujo sanguíneo se restituye tras largos periodos de hipoperfusión, los niveles elevados de óxido nítrico sintetasa llevan a la hiperemia, muerte celular y aumento de respuesta inflamatoria. Esto da como resultado aún más daño epitelial gastrointestinal y ulceración. Las lesiones de la mucosa relacionadas con el estrés típicamente se localizan en las zonas productoras de ácido en el estómago (por ejemplo porción superior del cuerpo y fondo). Los hallazgos endoscópicos comunes varían de erosiones superficiales a úlceras focales profundas que penetran la submucosa, y ocurren por lo general entre el tercer y el séptimo día después de ingresar en la unidad de cuidados intensivos (UCI)3.
EpidemiologíaEl sangrado importante por úlceras de estrés no es un evento frecuente. La evidencia endoscópica de daño de la mucosa se puede observar en la mayoría de los pacientes, 74 a 100%, pocas horas después de ser admitidos en la UCI4. La prevalencia de sangrado oculto (prueba de guayaco positiva) varía del 15 al 50%5. El sangrado visible se encuentra presente en el 5 al 25% de los pacientes críticamente enfermos5–8. La incidencia de sangrado clínicamente significativo (por ejemplo taquicardia, hipotensión y necesidad de transfusión sanguínea) ha disminuido desde 1980 a tasas del 3,7% en pacientes con factores de riesgo y a 0,1% en pacientes sin factores de riesgo9–12.
El decremento en la incidencia de sangrado importante se puede explicar por los avances tecnológicos que han mejorado la reanimación de los pacientes en la UCI, tal como la optimización del estatus hemodinámico, la mejoría en la oxigenación tisular, el tratamiento exitoso de la sepsis y la alimentación enteral temprana en lugar del uso de los IBP y los H2RA13,14. El sangrado gastroinestinal nosocomial debido a úlceras de estrés se asocia con tasas elevadas de mortalidad intrahospitalaria, por lo general en la UCI13,15. Esto ha fomentado la administración profiláctica de varios medicamentos, tales como antiácidos, sucralfato, H2RA e IBP.
Los antiácidos y sucralfato ya no son utilizados en la mayoría de las UCI. Los H2RA reducen la secreción del ácido gástrico a través de una inhibición reversible, inhibición competitiva de la secreción de ácido estimulado por histamina y frecuentemente se asocia con la taquifilaxia (efecto reducido después de 48h de uso). Los IBP suprimen de manera irreversible la producción de ácido gástrico a nivel de la bomba de hidrógeno/potasio adenosina trifosfatasa, proporcionando una inhibición de larga duración, y son los agentes antisecretores más potentes que se utilizan en la actualidad. En contraste con los H2RA, los IBPs inhiben la secreción de ácido gástrico tanto inducido por histamina como mediado vagalmente.
En años recientes los IBP se han convertido en los medicamentos que se utilizan con más frecuencia, en comparación con los H2RAs, para la prevención de úlceras por estrés y de sangrado gatrointestinal. Sin embargo, se ha demostrado que la sobreutilización de estos medicamentos en pacientes sin factores de riesgo en la UCI, así como en los pacientes hospitalizados que no se encuentran en la UCI, es muy frecuente. Esta prescripción inapropiada ha incrementado tanto la cantidad de efectos adversos como los costes por hospitalización16–19. Así mismo, la prescripción de estos medicamentos generalmente se continúa una vez que el paciente ha abandonado el hospital, con las mismas consecuencias en relación con los efectos adversos y costes20. En 2006 las ventas de inhibidores de la secreción gástrica en Gran Bretaña se elevo a 425 millones de libras (527 millones de euros; 701 millones de dólares americanos). Aproximadamente del 25 al 70% de estas recetas no tenían una clara indicación para su uso19.
La utilización de estos medicamentos por periodos largos no es inofensiva. Las complicaciones principales, aunque poco frecuentes, son: riesgo incrementado de neumonía nosocomial o adquirida en la comunidad21, baja absorción de calcio con osteoporosis y riesgo de fractura de cadera22,23 y riesgo incrementado de infección por Clostridium difficile24–26.
Factores de riesgo por sangrado de la mucosa relacionado con estrésSorprendentemente, no existen guías terapéuticas sobre la profilaxis por úlceras de estrés publicadas, ya sea por la Asociación Americana de Gastroenterología (AGA) ni por el Colegio Americano de Gastroenterología (ACG). En 1999 la Sociedad Americana de Farmacéuticos de los Sistemas de Salud (ASHP) publicó las guías para el uso de estos medicamentos27.
Estas guías basadas en evidencias solo han identificado 2 factores de riesgo principales en pacientes dentro de la UTI como predictores de sangrado inducido por estrés en quienes se sugiere la profilaxis (evidencia de grado A):
- A)
Falla respiratoria (ventilación mecánica por lo menos durante 48h).
- B)
Coagulopatía (pacientes hospitalizados en la UTI con un recuento de plaquetas <50,000; INR>1.5; TTP anormal).
Otros factores de riesgo con menor grado de evidencia son:
- 1)
Lesión cerebral <10 en la escala de Glasgow (B).
- 2)
Quemaduras con extensión mayor del 35% BSA28 (B).
- 3)
Hepatectomía parcial (C).
- 4)
Sangrado gastrointestinal o úlcera durante el año previo (D).
- 5)
Politraumatismo (puntuación de severidad de la lesión ≥16) (D).
- 6)
Fallo hepático (D).
- 7)
Lesiones de la médula espinal27 (D).
- 8)
Trasplante hepático o renal (D).
- 9)
Más de 2 de los siguientes: sepsis, estancia en la UCI >1 semana, dosis altas de corticoesteroides (>250mg de hidrocortisona [D], sangrado oculto o visible durante 6 días o más [D]).
Debido a que el sangrado gastrointestinal visible ocurre en una minoría de los pacientes en la UCI y el sangrado clínicamente importante ocurre solo en el 1-3%, algunos autores han argumentado que la profilaxis se encuentra sobreutilizada en la actualidad. Por lo tanto, la pregunta es: ¿qué pacientes en la UCI deben recibir profilaxis? Ciertamente, los pacientes con fallo respiratorio que requieren de ventilación mecánica >48h están en riesgo, así como los que sufren de coagulopatía grave. Los pacientes que se presentan con una lesión cerebral cerrada con una puntuación de Glasgow baja o con quemaduras graves también deben recibir terapia profiláctica. Los pacientes que no están dentro de ninguno de estos grupos tienen menos de 0.5% de riesgo de sangrado clínico significativo y probablemente no requieren de terapia profiláctica.
ProfilaxisLa eficacia de la inhibición de ácido gástrico para prevenir el sangrado gastrointestinal es controvertida. Previamente los H2RA se utilizaban exitosamente. Con una supresión de ácido más alta con los IBP, los médicos de cuidados intensivos esperan mejores resultados. Sin embargo, la evidencia no es sólida.
Varios ensayos clínicos han evaluado la eficacia de los H2RA en la prevención del sangrado gastrointestinal relacionado con estrés. Un metaanálisis publicado en 1998 mostró que los H2RA fueron significativamente más eficaces que el placebo en la reducción de la incidencia de sangrado evidente y clínicamente importante. Este estudio también reportó que los H2RA fueron significativamente más eficaces que el sucralfato en la reducción de sangrado clínicamente importante en pacientes con ventilación mecánica29.
Un metaanálisis publicado recientemente por Marik en 201030 evaluó si la administración profiláctica de H2RA para las úlceras por estrés reducía la incidencia de sangrado cuando se comparaba con el placebo. Este metaanálisis analizó 17 estudios con un total de 1,836 pacientes. El resultado principal fue una disminución en el riesgo de sangrado en pacientes con inhibidores de ácido en comparación con el placebo (razón de momios RM=0.47; IC 95%, 0.29-0.76; p>0.002; I2=44%). En contraste, varios estudios han mostrado que no existe una reducción significativa en el sangrado clínicamente importante utilizando los H2RA, en comparación con el placebo o el sucralfato11,12,31,32.
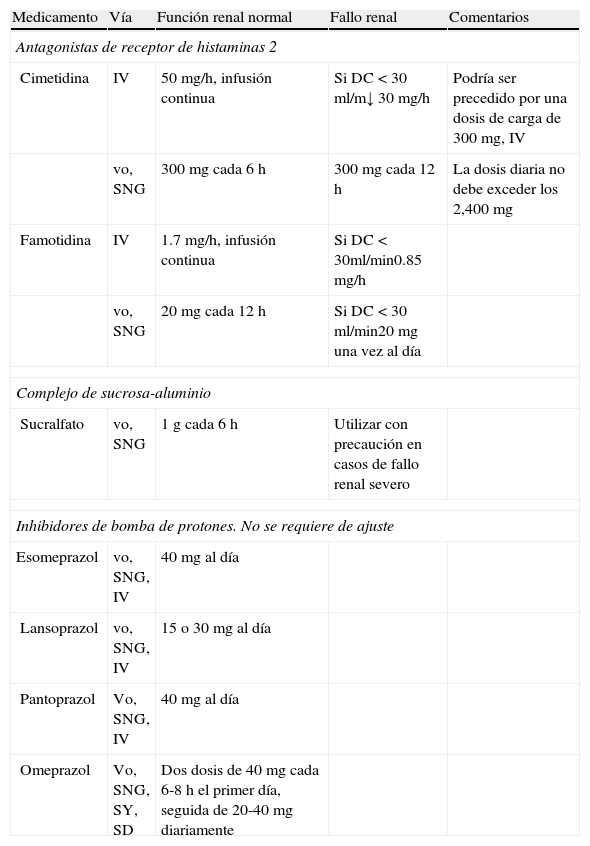
El uso de los IBP como profilaxis de úlceras por estrés ha incrementado recientemente. Al parecer, los IBP son por lo menos tan efectivos como los H2RA. El primer metaanálisis por Pongrasobchai en 2009 encontró que la profilaxis con IBP se asociaba con menos eventos de sangrado, comparado con los H2RA (RM=0.42, IC 95%, 0.20 a 0.91, número necesario de tratar [NNT]=22). No hubo diferencias en la frecuencia de eventos adversos, como la neumonía nosocomial33. Un segundo metaanálisis por Lin et al. comparó IBP con los H2RA como agentes profilácticos en pacientes críticamente enfermos. Este metaanálisis incluyó 7 ensayos y 936 pacientes. No hubo diferencia entre estos 2 grupos para esta variable de desenlace. Tampoco pudieron demostrar diferencias en la incidencia de neumonía y mortalidad entre los 2 grupos34. Otro metaanálisis importante fue publicado en 2012 por Barkun et al., el cual incluyó a un total de 13 estudios con 1,587 pacientes. Ellos encontraron que la administración profiláctica de IBP disminuyó significativamente la incidencia de sangrado en comparación con los H2RA (RM=0.30; IC 95% IC 0.17-0.54, NNT=39, sin heterogeneidad estadística p=0.93, I2=0.0%). No hubo diferencias en neumonía nosocomial, tiempo de estancia dentro de la UCI y mortalidad. Como ellos observaron las definiciones de sangrado variaban dentro de los estudios, y el tratamiento incluía diferentes medicamentos (omeprazol, pantoprazol, rabeprazol, lansoprazol, ranitidina, famotidina y cimetidina), dosis y vía de administración; los análisis incluyeron resúmenes, la calidad de varios de los estudios fue pobre, y algunos ensayos se llevaron a cabo en pacientes asiáticos conocidos como metabolizadores lentos35. El metaanálisis más reciente que evaluó la eficacia y seguridad de los IBP contra los H2RA fue publicado en el año 2013 por Alhazzani y Cook de la Universidad McMaster en Canadá. Incluyeron 14 ensayos con un total de 1,720 pacientes. Los IBP fueron más efectivos que los H2RA al reducir el sangrado gastrointestinal alto clínicamente importante (RR=0.36; IC 95% 0.19-0.68; p=0.002; I2=0%; NNT con profilaxis=78) y sangrado gastrointestinal alto visible (RR=0.35; IC 95% 0.21-0.59; p<0.001; I2=15%; NNT con profilaxis=30). No hubo diferencias entre los IBP y H2RA en el riesgo de neumonía nosocomial (RR=1.06; IC 95% 0.73-1.52; p=0.76; I2=0%), mortalidad en la UCI (RR=1.01; IC 95% 0.83-1.24; p=0.91; I2=0%) o extensión de la estancia en la UCI (diferencia media-0.54 días; IC 95% CI-2.20 a 1.13; p=0.53; I2=39%). Ningún estudio ha informado sobre la infección por C. difficile. Sin embargo, diversos factores sugieren que se debe tener precaución en la interpretación de estos resultados. El subanálisis basado en la calidad de los ensayos sugirió que no existían diferencias en el efecto del tratamiento entre los ensayos de mejor calidad. Es posible que diseños subóptimos, tal como la carencia de cegado, ha incrementado los beneficios reportados con los IBP36. En la actualidad la mayoría de las UCI utilizan los IBP en lugar de los H2RA como agentes profilácticos para las úlceras por estrés. En una encuesta limitada sobre los patrones utilizados el régimen profiláctico estándar rara vez incluye el uso de ranitidina intravenosa37. La mayoría de las instituciones en EE. UU. parecen estar utilizando una variedad de regímenes de IBP, incluyendo pantoprazol intravenoso 40mg/12h, 80mg/12h, o un bolo de 80mg seguido por 8mg/h en infusión continua. Otros regímenes utilizados incluyen lansoprazol 60mg/12h y esomeprazol 40mg/12h. Sin embargo, existen pocos datos publicados que apoyen el uso de IBP para la prevención de sangrado gastrointestinal alto en pacientes críticamente enfermos. Más aún, información sobre el pH con el uso del pantoprazol intravenoso en pacientes en UCI fue obtenido de pacientes con nutrición enteral, y se desconoce si el efecto farmacológico podría ser similar en pacientes en ayuno, por lo cual se requiere de más estudios38. tabla 1
Medicamentos comúnmente utilizados para la profilaxis de sangrado relacionada con el estrés
| Medicamento | Vía | Función renal normal | Fallo renal | Comentarios |
| Antagonistas de receptor de histaminas 2 | ||||
| Cimetidina | IV | 50mg/h, infusión continua | Si DC<30 ml/m↓ 30mg/h | Podría ser precedido por una dosis de carga de 300mg, IV |
| vo, SNG | 300mg cada 6h | 300mg cada 12h | La dosis diaria no debe exceder los 2,400mg | |
| Famotidina | IV | 1.7mg/h, infusión continua | Si DC <30ml/min0.85mg/h | |
| vo, SNG | 20mg cada 12h | Si DC<30 ml/min20mg una vez al día | ||
| Complejo de sucrosa-aluminio | ||||
| Sucralfato | vo, SNG | 1g cada 6h | Utilizar con precaución en casos de fallo renal severo | |
| Inhibidores de bomba de protones. No se requiere de ajuste | ||||
| Esomeprazol | vo, SNG, IV | 40mg al día | ||
| Lansoprazol | vo, SNG, IV | 15 o 30mg al día | ||
| Pantoprazol | Vo, SNG, IV | 40mg al día | ||
| Omeprazol | Vo, SNG, SY, SD | Dos dosis de 40mg cada 6-8h el primer día, seguida de 20-40mg diariamente | ||
DL: depuración de creatinina; IV: intravenoso; SD: sonda duodenal; SNG: sonda nasogástrica; SY: sonda yeyunal; vo: oralmente.
Finalmente, la alimentación enteral temprana ha sido propuesta como una herramienta útil en la prevención de sangrado gastrointestinal relacionado con el estrés. Los nutrientes enterales neutralizan el ácido y pueden actuar como fuente directa de energía para la mucosa, inducen la secreción de prostaglandinas citoprotectoras y de moco y mejoran el flujo sanguíneo de la mucosa39,40. Además, la alimentación enteral ha mostrado ser más efectiva en elevar el pH gástrico>3.5 cuando se compara con los IBP o los H2RA41. Por lo tanto, se ha sugerido que la alimentación enteral temprana podría ser beneficiosa en la prevención del sangrado gastrointestinal alto secundario a lesiones de la mucosa relacionadas con el estrés. Varios ensayos, principalmente en pacientes quemados, han concluido que la nutrición enteral temprana es efectiva en la prevención de sangrado gastrointestinal en relación con el estrés42–44. Sin embargo, la evidencia no es lo suficientemente sólida debido a que no existe ningún ensayo clínico aleatorizado controlado que haya probado prospectivamente el efecto de la nutrición enteral sobre el riesgo de profilaxis por úlceras de estrés. En un metaanálisis anterior, realizado por Marik, que incluyo 17 ensayos y 1,836 pacientes, se mostró que los pacientes que recibieron alimentación enteral (3 estudios con una total de 262 sujetos) no se beneficiaron por la profilaxis con H2RA para úlceras por estrés (RM=1.26; IC 95% 0.43-3.7). En conjunto, los H2RA no incrementaron el riesgo de neumonía intrahospitalaria (RM=1.53; IC 95% 0.89-2.61; p=0.12; I2=41%). Sin embargo, esta complicación se incrementó en el subgrupo de pacientes que recibieron profilaxis y fueron alimentados enteralmente (RM=2.81; IC 95% 1.20-6.56; p=0.02; I2=0%). Para sorpresa, la mortalidad hospitalaria fue mayor en esos estudios (n=2) incluyendo pacientes alimentados por vía enteral que recibieron H2RA (RM=1.89; IC 95% 1.04-3.44; p=0.04; I2=0%). Los resultados de este metaanálisis sugieren que en pacientes que reciben alimentación enteral por sonda la profilaxis de úlceras por estrés podría no ser requerida, y de hecho, podría incrementar el riesgo de complicaciones30.
ConclusionesLa incidencia de sangrado clínicamente importante relacionado con úlceras por estrés ha disminuido. La patogénesis de las lesiones de la mucosa relacionada con el estrés y las úlceras por estrés es multifactorial. La hospitalización o el ingreso en la UCI por sí solas nos son razones suficientes para comenzar la profilaxis. Únicamente los pacientes con fallo respiratorio que requieren de ventilación mecánica por más de 48h, y aquellos con coagulopatías, lesiones cerebrales y quemaduras graves tienen riesgo significativo para estos sangrados y es probable que se vean beneficiados por la profilaxis. Sin embargo, otros factores de riesgo deben considerarse. El agente profiláctico más apropiado para prevenir el sangrado relacionado con el estrés no ha sido determinado. Hace algunos años los H2RA fueron los agentes más utilizados para la profilaxis. Sin embargo, los IBP siguen incrementando en su aceptación. Los IBP son al menos tan efectivos como los H2RA, pero son más caros, y la evidencia sigue siendo muy limitada. Debemos individualizar cada paciente de la UCI, evaluar su riesgo y determinar la necesidad de comenzar con profilaxis de sangrado relacionado con el estrés.
FinanciaciónNo se recibió ningún apoyo económico en relación con este artículo.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de interés