Introducción
El síndrome de Budd-Chiari (SB-Ch) se caracteriza por anormalidades estructurales y funcionales del hígado producidas por la obstrucción al flujo de salida de la sangre venosa hepática. La obstrucción puede localizarse desde las venas centrales hasta la vena cava inferior y la aurícula derecha.1
La descripción clínica original fue mérito de Budd, en 1845,2 y Chiari, en 1899, efectuó la primera descripción patológica.3 La invasión vascular de las venas hepáticas por hongos es rara y sólo se han descrito 3 casos en la literatura. En este trabajo se informa el caso de un paciente que presentó una enfermedad aguda sugestiva de SB-Ch y en quien el estudio de autopsia demostró obstrucción de las venas suprahepáticas (VS-H) por Aspergillus sp.
Presentación del caso
Se trata de un hombre de 45 años de edad, originario y residente de Mexicali, B. C., con historia de diabetes mellitus de 16 años de evolución, alcoholismo crónico intenso y tuberculosis pulmonar diagnosticada y tratada con éxito 3 años antes de su ingreso. Acudió por un cuadro de un mes de evolución con disnea progresiva, dolor abdominal difuso, aumento del perímetro abdominal, astenia, diaforesis nocturna y pérdida de peso. El día de su ingreso manifestó disnea de reposo con incremento notable del dolor abdominal. A la exploración física se encontró con TA 110/60, frecuencia cardiaca de 98 latidos/min, frecuencia respiratoria de 32/min, temperatura de 37.5ºC. Se observó caquéctico, pálido y orientado en las tres esferas, con escleróticas ictéricas, mucosas deshidratadas, cuello sin adenomegalias. En el tórax se encontraron telangiectasias en cara anterior y disminución del murmullo vesicular en la base derecha. El abdomen se detectó globoso por líquido de ascitis, red venosa colateral visible, hepatomegalia dolorosa hasta fosa iliaca derecha, de superficie lisa y consistencia firme. Se observó una distribución ginecoide del vello púbico y el tacto rectal fue normal. Dos horas después de su ingreso, presentó pérdida del estado de alerta con paro cardiorrespiratorio en presencia del equipo médico, cuyos miembros iniciaron las maniobras de reanimación cardiopulmonar con buena respuesta. Se los asistió con ventilación mecánica. Se realizó paracentesis y se obtuvo un líquido de aspecto purulento.
Los exámenes de laboratorio mostraron 8.8 g/dL de hemoglobina, 16 320 leucocitos/dL, 1 471 UL de deshidrogenasa láctica (valores normales de 60-165), 0.9 g/dL de albúmina, 5.2 g/dL de globulinas, 362 mg/dL de glucosa, 83 mg/dL de urea, 1.7 mg/dL de creatinina, 1 564 U/L de transaminasa glutámica oxalacética (normal de 10-40), 391 U/L de transaminasa gutámica pirúvica (normal 0-40), 24/12.8 s de tiempo de protrombina, 45.5/27.2 s de tiempo parcial de tromboplastina y anticuerpos contra el virus de la inmunodeficiencia humana negativos. El análisis del líquido de ascitis mostró aspecto turbio, amarillo, con 2.9 g/dL de proteínas, 6 000 leucocitos/mm3 (mononucleares 20%, polimorfonucleares 80%). La tinción de Gram mostró cocos gramnegativos, y tinción para bacilos resistentes al ácido y al alcohol negativa. La tomografía axil computarizada abdominal mostró hepatomegalia importante, con lesión heterogénea en lóbulo hepático derecho de 10 x 12 cm, con bordes bien definidos, compatible con absceso, ascitis leve y esplenomegalia. Se efectuó una laparotomía exploradora en la que se encontraron 6 L de líquido libre purulento, absceso hepático de 18 x 13 cm en lóbulo derecho y perforación del ciego. Se realizó limpieza de cavidad, ileostomía y fístula mucosa, y se administraron ceftriaxona y metronidazol. Ingresó a la Unidad de Cuidados Intensivos (UCI) donde cursó con un posoperatorio tórpido con leucocitosis de 39 000 células/dL, anemia, trombocitopenia e hiperglucemia de difícil control, además de alteraciones en la coagulación. Permaneció en la UCI con asistencia mecánica de la ventilación y uso de vasopresores. Se efectuó una broncoscopia, durante la cual se observaron abundantes secreciones mucopurulentas desde la carina adheridas a los bronquios principales. Se realizaron lavados con solución fisiológica y se obtuvo una muestra para cultivo. Al décimo primer día de su estancia en la UCI, presentó paro cardiorrespiratorio que no respondió a las maniobras y falleció 14 días después de su intervención quirúrgica.
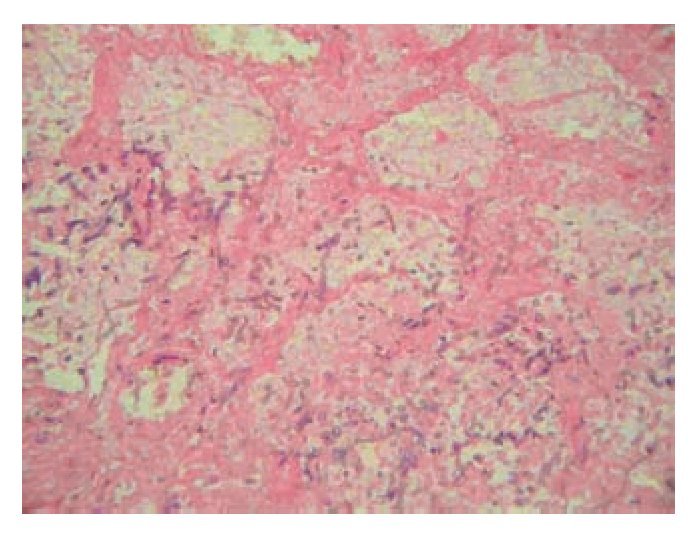
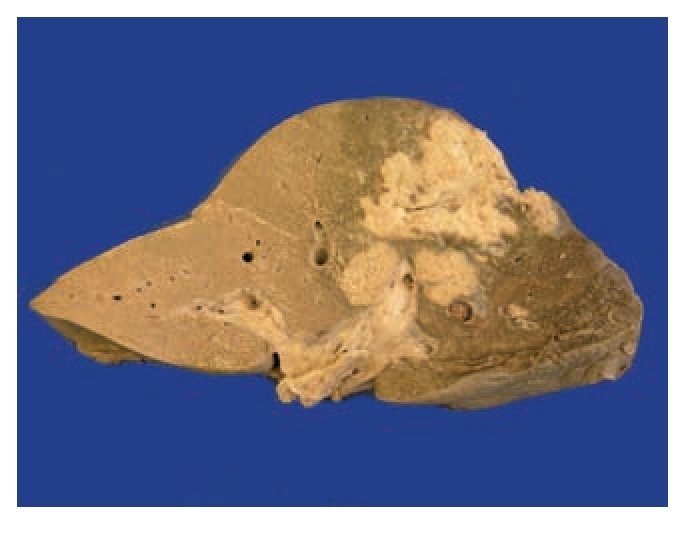
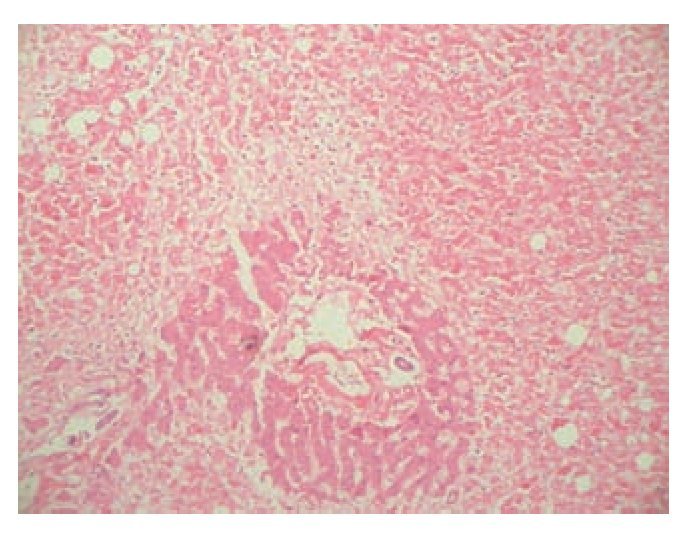
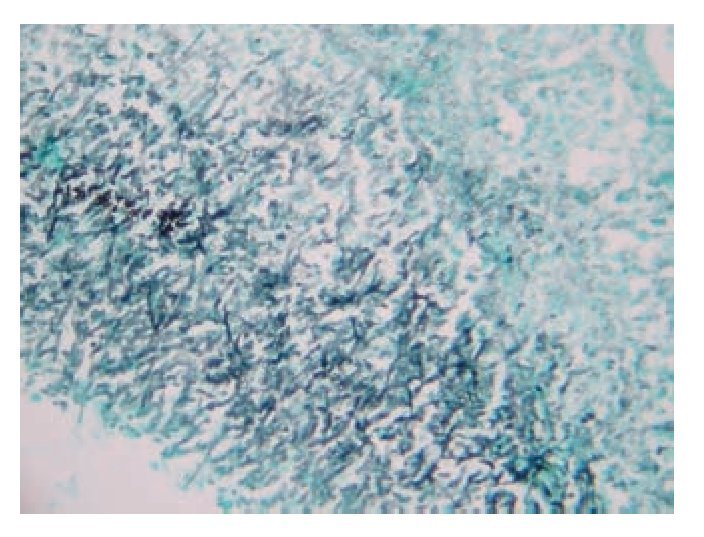
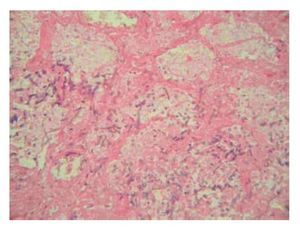
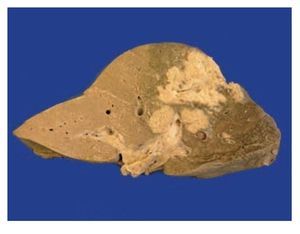
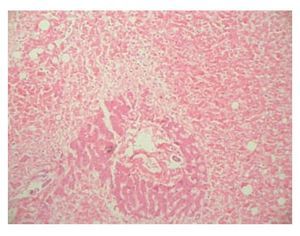
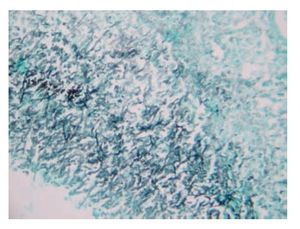
El análisis de la pieza quirúrgica de la hemicolectomía derecha mostró necrosis isquémica hemorrágica perforada en ciego con infiltrado de abundantes neutrófilos. Había úlceras de fondo necrótico con edema y congestión vascular en la mucosa cecal vecina a la zona de necrosis y en la mucosa del íleon distal. No se identificó ningún agente infeccioso. La autopsia reveló casi 2 litros de líquido de ascitis turbio y de color café. El hígado pesaba 1 400 g, estaba aumentado de tamaño, con una zona extensa de necrosis en el lóbulo derecho de 14 cm de diámetro. La luz de la vena hepática derecha y sus ramas estaban ocluidas por completo por un trombo y en los cortes histológicos la pared estaba infiltrada con neutrófilos. Por medio de las tinciones de hematoxilina y eosina y de Grocott, se identificaron escasas hifas septadas, bifurcadas en ángulo agudo, que por sus características morfológicas correspondían a Aspergillus. No había trombosis de la vena porta. En el parénquima del lóbulo hepático derecho existía necrosis hemorrágica confluente, panlobulillar, en la que se identificaban escasos hepatocitos residuales en el área periportal e infiltración focal por abundantes neutrófilos. En la periferia de las áreas de necrosis confluente, la zona 3 exhibía dilatación sinusoidal acentuada y necrosis hepatocelular. Las alteraciones hepáticas se interpretaron como trombosis de la vena hepática y sus ramas por aspergilosis angioinvasora, con necrosis hepática masiva y abscesos focales. Los espacios porta eran normales, no mostraban trombos ni infiltrado inflamatorio en las ramas de la vena porta, por lo que se descartó pileflebitis. El pulmón derecho presentaba atelectasias con abundantes tapones de moco que ocluían la luz de los bronquios principales, sobre todo el del lado derecho. La mucosa traqueobronquial se observó erosionada y cubierta por seudomembranas formadas por tejido necrótico mezclado con moco, células inflamatorias y escasas hifas de Aspergillus, lo que correspondía a traqueobronquitis seudomembranosa necrosante. En el parénquima pulmonar del lóbulo superior derecho había zonas de 1 a 2.5 cm de diámetro, triangulares, que correspondían a zonas de infarto hemorrágico rodeadas por neutrófilos, con abundantes hifas de Aspergillus, que también infiltraban la pared de los vasos sanguíneos vecinos en los que existían vasculitis y tromboémbolos de fibrina. Las alteraciones pulmonares se interpretaron como aspergilosis invasiva aguda. En el resto de los órganos, los cambios morfológicos correspondían a los de un estado de choque (Figuras 1-4).
Figura 1. Zona de infarto hemorrágico en parénquima pulmonar rodeada por abundantes hifas de Aspergillus (H.E., 10x).
Figura 2. Hígado: zona de necrosis que afecta todo el lóbulo hepático derecho, con zonas focales pálidas. Se observa un trombo que ocluye la luz de la vena hepática del mismo lado.
Figura 3. Necrosis confluente masiva del parénquima hepático que afecta predominantemente las zonas 3 y 2. Sólo se observan escasos hepatocitos residuales periportales (H.E., 10x).
Figura 4. Hifas de Aspergillus en la pared de la vena hepática derecha (Grocott, 10x).
Discusión
El síndrome de Budd-Chiari (B-Ch) es de etiología muy diversa. En los países occidentales, las enfermedades mieloproliferativas, estados de hipercoagulabilidad, anticonceptivos y tumores son los responsables de la mayoría de los casos. En los países asiáticos, la obstrucción membranosa de la vena cava inferior, embarazo, diafragmas e infecciones son las principales causas.1,4 Se han descrito dos formas de presentación clínica. La forma aguda, que se asocia a necrosis hepatocelular y se caracteriza por dolor abdominal, ascitis, encefalopatía, hepatoesplenomegalia y tiene mal pronóstico, y la forma crónica, con síntomas de más de 6 meses de duración en la que predominan las manifestaciones y complicaciones de hipertensión portal.5
La aspergilosis sistémica es una enfermedad que afecta de manera fundamental a pacientes inmunosuprimidos y tiene pronóstico fatal. El involucro hepático por el hongo ocurre en menos de la mitad de los casos6 y sólo por excepción se ha identificado invasión vascular a las venas suprahepáticas. Existen dos casos informados en la literatura de invasión por Aspergillus a las venas suprahepáticas en niños con leucemia7 y otro más de invasión por cigomicetos.8 El paciente de este caso presentaba dos factores de riesgo para el desarrollo de micosis sistémica: diabetes y alcoholismo.9 En virtud de su edad, parecieran ser insuficientes para explicar una enfermedad de evolución tan rápida y fatal. Cursó con choque séptico y falla orgánica múltiple, pero destaca en su evolución la insuficiencia hepática fulminante con extensa necrosis hepatocelular documentada en la autopsia y que fue secundaria a la obstrucción de las venas suprahepáticas por el hongo, con desarrollo de síndrome de B-Ch agudo. Se sabe que éste tiene mal pronóstico, por lo que se asume que contribuyó de manera significativa al desenlace fatal del enfermo. Como ocurre con frecuencia en las micosis sistémicas,10 el diagnóstico de la aspergilosis diseminada no se sospechó en vida. La aspergilosis invasora ha sido reconocida como una de las infecciones oportunistas más importantes en los receptores de trasplante hepático, con una frecuencia que varía entre 1% y 6% y una mortalidad de 90%.11,12 En estos pacientes, el diagnóstico precoz se logra con la detección del antígeno circulante de Aspergillus (prueba de galactomannan), tomografía computarizada de alta resolución, broncoscopia y lavado bronquioalveolar.13 Se han descrito resultados alentadores con la terapia antimicótica de combinación con voriconazol, saspofungina y anfotericina B lipídica.14,15 La autopsia constituye una herramienta valiosa e insustituible en la medicina pues la información que genera retroalimenta la práctica clínica. Lamentablemente, se realiza cada vez con menor frecuencia en los hospitales mexicanos
Correspondencia: Dr. Manuel Avendaño Reyes,
Hospital General de Mexicali, Calle del Hospital S/N, Centro Cívico, CP 21100, Mexicali, B. C.,
México. Teléfono: 5-82 00 95, Fax 5-54 03 05.
Correo electrónico:jmar001@hotmail.com