La combinación de sofosbuvir-velpatasvir (SOF/VEL) es una terapia antiviral de acción directa que está autorizada y disponible en México. Esto hace que la evaluación de la respuesta virológica sostenida (RVS) 12 semanas después del tratamiento, por medio de la realización de una revisión multicentro en el mundo real, sea una tarea relevante.
MétodosSe efectuó una revisión retrospectiva de los registros de 241 casos de pacientes atendidos en 20 hospitales en México para evaluar el tratamiento contra la hepatitis C con la combinación SOF/VEL (n = 231) y sofosbuvir/velpatasvir/ribavirin (SOF/VEL/RBV) (n = 10). El objetivo de eficacia primario fue el porcentaje de pacientes que lograron la RVS 12 semanas posterior a la finalización del tratamiento.
ResultadosEn general, la RVS fue de 98.8% (IC 95% 97.35 a 100%). Solo tres pacientes no lograron la RVS, de los cuales dos padecían cirrosis y una tenía historia previa de tratamiento con interferón pegilado (peg-IFN). De los subgrupos analizados, todos los casos con infección de virus de la inmunodeficiencia humana (VIH), tres con genotipo 3 y aquellos tratados con la combinación SOF/VEL/RBV, lograron RVS. Los subgrupos con tasas menores de éxito fueron los pacientes que tenían experiencia con tratamiento (96.8%) y pacientes con fibrosis F1 (95.5%). Los eventos adversos más frecuentes fueron fatiga, cefalea e insomnio. No se reportaron eventos adversos graves.
ConclusiónLos tratamientos con SOF/VEL y SOF/VEL/RBV fueron altamente seguros y efectivos y los resultados coinciden con los de otros estudios internacionales realizados en el mundo real.
The sofosbuvir-velpatasvir (SOF/VEL) combination is a direct-acting antiviral therapy that is authorized and available in Mexico, making the performance of a real-world multicenter study that evaluates the sustained virologic response at 12 weeks post-treatment a relevant undertaking.
MethodsA retrospective review of the case records of 241 patients seen at 20 hospitals in Mexico was conducted to assess hepatitis C treatment with the SOF/VEL combination (n = 231) and the sofosbuvir/velpatasvir/ribavirin (SOF/VEL/RBV) combination (n = 10). The primary efficacy endpoint was the percentage of patients that achieved SVR at 12 weeks after the end of treatment.
ResultsOverall SVR was 98.8% (95% CI 97.35-100%). Only three patients did not achieve SVR, two of whom had cirrhosis and a history of previous treatment with peg-IFN. Of the subgroups analyzed, all the patients with HIV coinfection, three patients with genotype 3, and the patients treated with the SOF/VEL/RBV combination achieved SVR. The subgroups with the lower success rates were patients that were treatment-experienced (96.8%) and patients with F1 fibrosis (95.5%). The most frequent adverse events were fatigue, headache, and insomnia. No serious adverse events were reported.
ConclusionTreatments with SOF/VEL and SOF/VEL/RBV were highly safe and effective, results coinciding with those of other international real-world studies.
El sofosbuvir (SOF) es un análogo nucleótido inhibidor de la polimerasa NS5B del virus de la hepatitis C (VHC). El velpatasvir (VEL) es un inhibidor del VHC NS5A de segunda generación. La combinación SOF/VEL ha demostrado tasas de respuesta virológica sostenida (RVS) altas en pacientes con características diversas, con o sin cirrosis compensada, se ha encontrado que es pangenotípica y panfibrótica, y que tiene una alta barrera a la resistencia1,2.
También existe evidencia clínica para recomendar el uso de la terapia con combinación SOF/VEL en el tratamiento del VHC causado por los seis genotipos, como lo confirman los estudios de fase III ASTRAL-I1, ASTRAL-23 y ASTRAL-33. Además, hay investigaciones del mundo real que han proporcionado buenos datos sobre esa combinación pangenotípica.
El objetivo principal del tratamiento para la hepatitis C es alcanzar la RVS posterior a la terapia a las 12 semanas. El logro de la RVS a las 12 y 24 semanas indica que la enfermedad ha sido curada, ya que los resultados en ambos intervalos tienen > 99% de coincidencia4. En estudios realizados en el mundo real con datos sobre pacientes tratados con agentes antivirales de acción directa (AAD) publicados previamente, con o sin ribavirin, se han logrado altas tasas de RVS, de entre 86.4 y 99%5–7.
La combinación de SOF/VEL fue una de las primeras terapias autorizadas en México que estuvieron disponibles en hospitales públicos, motivo por el cual el registro de resultados del mundo real es relevante. El objetivo del presente estudio fue evaluar la RVS en pacientes mexicanos con VHC, 12 meses posterior al tratamiento en el mundo real con SOF/VEL en un contexto multicentro.
Materiales y métodosLa presente revisión retrospectiva fue realizada utilizando datos de registros de pacientes de 20 hospitales en diferentes ciudades de México. Todos los casos incluidos habían sido diagnosticados con infección por VHC, e independientemente del genotipo y etapa de la fibrosis, fueron tratados con SOF/VEL o sofosbuvir/velpatasvir/ribavirin (SOF/VEL/RBV), durante, al menos, 12 semanas. Los registros que no contaban con datos completos o sin evaluación de RVS de 12 semanas después del tratamiento (RVS12) fueron excluidos del análisis.
El principal objetivo de eficacia fue el porcentaje de casos que lograron la RVS12. Los pacientes fueron divididos en dos grupos para el análisis: personas con experiencia de tratamiento y aquellas que no la tenían. Los subgrupos de pacientes fueron evaluados de acuerdo con sus características clínicas (genotipo de VHC, etapa de fibrosis, presencia de cirrosis, infección por virus de la inmunodeficiencia humana [VIH] y tratamiento de AAD recibido). El objetivo secundario fue identificar el porcentaje de pacientes que presentó eventos adversos.
Análisis estadísticoLos análisis estadísticos fueron realizados usando R 3.01. La prueba de X2 fue utilizada para las variables categóricas y la de Kruskal-Wallis para las variables continuas.
Consideraciones éticasLa presente investigación tuvo un diseño retrospectivo por lo que no se realizó ningún tipo de experimentación en animales o humanos. Dado que no se utilizaron nuevas moléculas, no fue necesario solicitar el consentimiento informado para la administración de medicamentos. Las variables de cada caso fueron revisadas y reportadas, manteniendo la privacidad de los pacientes en todo momento. En este estudio no aparecen datos personales y, debido a la naturaleza retrospectiva de la revisión de registros médicos, no fue requerida la autorización por parte de un comité de ética.
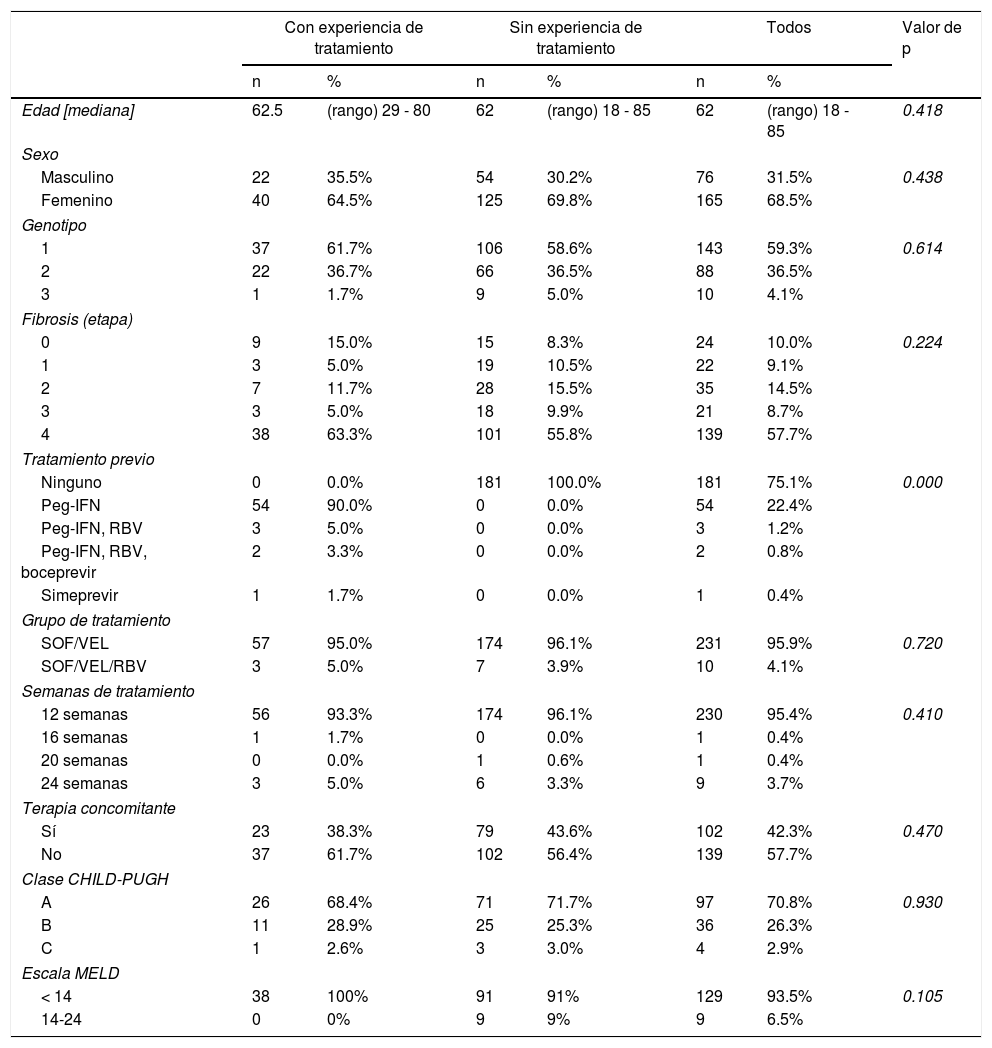
ResultadosSe seleccionó un total de 241 registros de entre cerca de 300 que fueron revisados. De estos pacientes, 62 tenían experiencia con tratamiento y 179 no la tenían. Los datos demográficos de las personas y las características de la enfermedad en línea base fueron balanceados entre grupos y resumidos en la tabla 1.
Características demográficas y de línea base de los pacientes
| Con experiencia de tratamiento | Sin experiencia de tratamiento | Todos | Valor de p | ||||
|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | ||
| Edad [mediana] | 62.5 | (rango) 29 - 80 | 62 | (rango) 18 - 85 | 62 | (rango) 18 - 85 | 0.418 |
| Sexo | |||||||
| Masculino | 22 | 35.5% | 54 | 30.2% | 76 | 31.5% | 0.438 |
| Femenino | 40 | 64.5% | 125 | 69.8% | 165 | 68.5% | |
| Genotipo | |||||||
| 1 | 37 | 61.7% | 106 | 58.6% | 143 | 59.3% | 0.614 |
| 2 | 22 | 36.7% | 66 | 36.5% | 88 | 36.5% | |
| 3 | 1 | 1.7% | 9 | 5.0% | 10 | 4.1% | |
| Fibrosis (etapa) | |||||||
| 0 | 9 | 15.0% | 15 | 8.3% | 24 | 10.0% | 0.224 |
| 1 | 3 | 5.0% | 19 | 10.5% | 22 | 9.1% | |
| 2 | 7 | 11.7% | 28 | 15.5% | 35 | 14.5% | |
| 3 | 3 | 5.0% | 18 | 9.9% | 21 | 8.7% | |
| 4 | 38 | 63.3% | 101 | 55.8% | 139 | 57.7% | |
| Tratamiento previo | |||||||
| Ninguno | 0 | 0.0% | 181 | 100.0% | 181 | 75.1% | 0.000 |
| Peg-IFN | 54 | 90.0% | 0 | 0.0% | 54 | 22.4% | |
| Peg-IFN, RBV | 3 | 5.0% | 0 | 0.0% | 3 | 1.2% | |
| Peg-IFN, RBV, boceprevir | 2 | 3.3% | 0 | 0.0% | 2 | 0.8% | |
| Simeprevir | 1 | 1.7% | 0 | 0.0% | 1 | 0.4% | |
| Grupo de tratamiento | |||||||
| SOF/VEL | 57 | 95.0% | 174 | 96.1% | 231 | 95.9% | 0.720 |
| SOF/VEL/RBV | 3 | 5.0% | 7 | 3.9% | 10 | 4.1% | |
| Semanas de tratamiento | |||||||
| 12 semanas | 56 | 93.3% | 174 | 96.1% | 230 | 95.4% | 0.410 |
| 16 semanas | 1 | 1.7% | 0 | 0.0% | 1 | 0.4% | |
| 20 semanas | 0 | 0.0% | 1 | 0.6% | 1 | 0.4% | |
| 24 semanas | 3 | 5.0% | 6 | 3.3% | 9 | 3.7% | |
| Terapia concomitante | |||||||
| Sí | 23 | 38.3% | 79 | 43.6% | 102 | 42.3% | 0.470 |
| No | 37 | 61.7% | 102 | 56.4% | 139 | 57.7% | |
| Clase CHILD-PUGH | |||||||
| A | 26 | 68.4% | 71 | 71.7% | 97 | 70.8% | 0.930 |
| B | 11 | 28.9% | 25 | 25.3% | 36 | 26.3% | |
| C | 1 | 2.6% | 3 | 3.0% | 4 | 2.9% | |
| Escala MELD | |||||||
| < 14 | 38 | 100% | 91 | 91% | 129 | 93.5% | 0.105 |
| 14-24 | 0 | 0% | 9 | 9% | 9 | 6.5% | |
MELD: modelo para enfermedad hepática en etapa final; Peg-IFN: interferón pegilado; RBV: ribavirin; SOF/VEL: sofosbuvir/velpatasvir; SOF/VEL/RBV: sofosbuvir/velpatasvir/ribavirin.
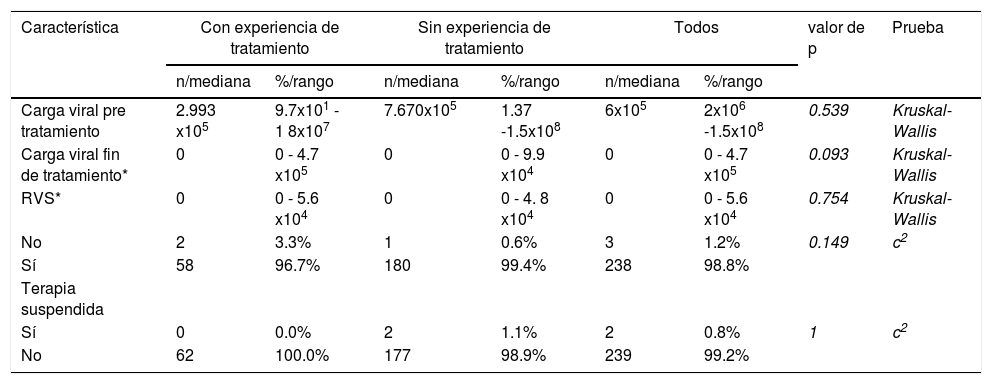
Del total de 241 casos, 230 (95.4%) fueron tratados por 12 semanas, uno fue tratado por 16 semanas, uno por 20 semanas y nueve por 24 semanas. La duración del tratamiento fue determinada por el médico. A las 12 semanas, habiendo terminado la terapia, 238 personas obtuvieron la RVS. La RVS general alcanzada por los pacientes del estudio fue de 98.8% (IC 95% 97.35 a 100%, p < 0.00001). Esta fue lograda en 99.4% de los casos sin experiencia de tratamiento y en 96.7% de aquellos con experiencia. Todos los pacientes con VIH, los que pararon la terapia y los tratados con combinación de SOF/VEL/RBV obtuvieron la RVS. La tabla 2 resume los resultados de RVS. No se observaron diferencias estadísticamente significativas entre los grupos analizados.
Respuesta virológica sostenida
| Característica | Con experiencia de tratamiento | Sin experiencia de tratamiento | Todos | valor de p | Prueba | |||
|---|---|---|---|---|---|---|---|---|
| n/mediana | %/rango | n/mediana | %/rango | n/mediana | %/rango | |||
| Carga viral pre tratamiento | 2.993 x105 | 9.7x101 - 1 8x107 | 7.670x105 | 1.37 -1.5x108 | 6x105 | 2x106 -1.5x108 | 0.539 | Kruskal-Wallis |
| Carga viral fin de tratamiento* | 0 | 0 - 4.7 x105 | 0 | 0 - 9.9 x104 | 0 | 0 - 4.7 x105 | 0.093 | Kruskal-Wallis |
| RVS* | 0 | 0 - 5.6 x104 | 0 | 0 - 4. 8 x104 | 0 | 0 - 5.6 x104 | 0.754 | Kruskal-Wallis |
| No | 2 | 3.3% | 1 | 0.6% | 3 | 1.2% | 0.149 | c2 |
| Sí | 58 | 96.7% | 180 | 99.4% | 238 | 98.8% | ||
| Terapia suspendida | ||||||||
| Sí | 0 | 0.0% | 2 | 1.1% | 2 | 0.8% | 1 | c2 |
| No | 62 | 100.0% | 177 | 98.9% | 239 | 99.2% | ||
RVS: respuesta virológica sostenida.
En el subanálisis de 137 pacientes con cirrosis (F4), 97 (70%) fueron clasificados como Child-Pugh A, 36 (26.3%) como Child-Pugh B y cuatro (2.9%) como Child-Pugh C, lo cual significa que la mayoría de los casos (70%) tenía cirrosis compensada y 30% tenía cirrosis descompensada al momento de tomar la decisión de tratarlos. La RVS en el grupo con cirrosis fue de 98.6%. Una vez en tratamiento, cualquier paciente con cirrosis compensada fue reportado como descompensado. El SOF en combinación con VEL es un tratamiento panfibrótico bien conocido que puede ser usado en cirrosis descompensada.
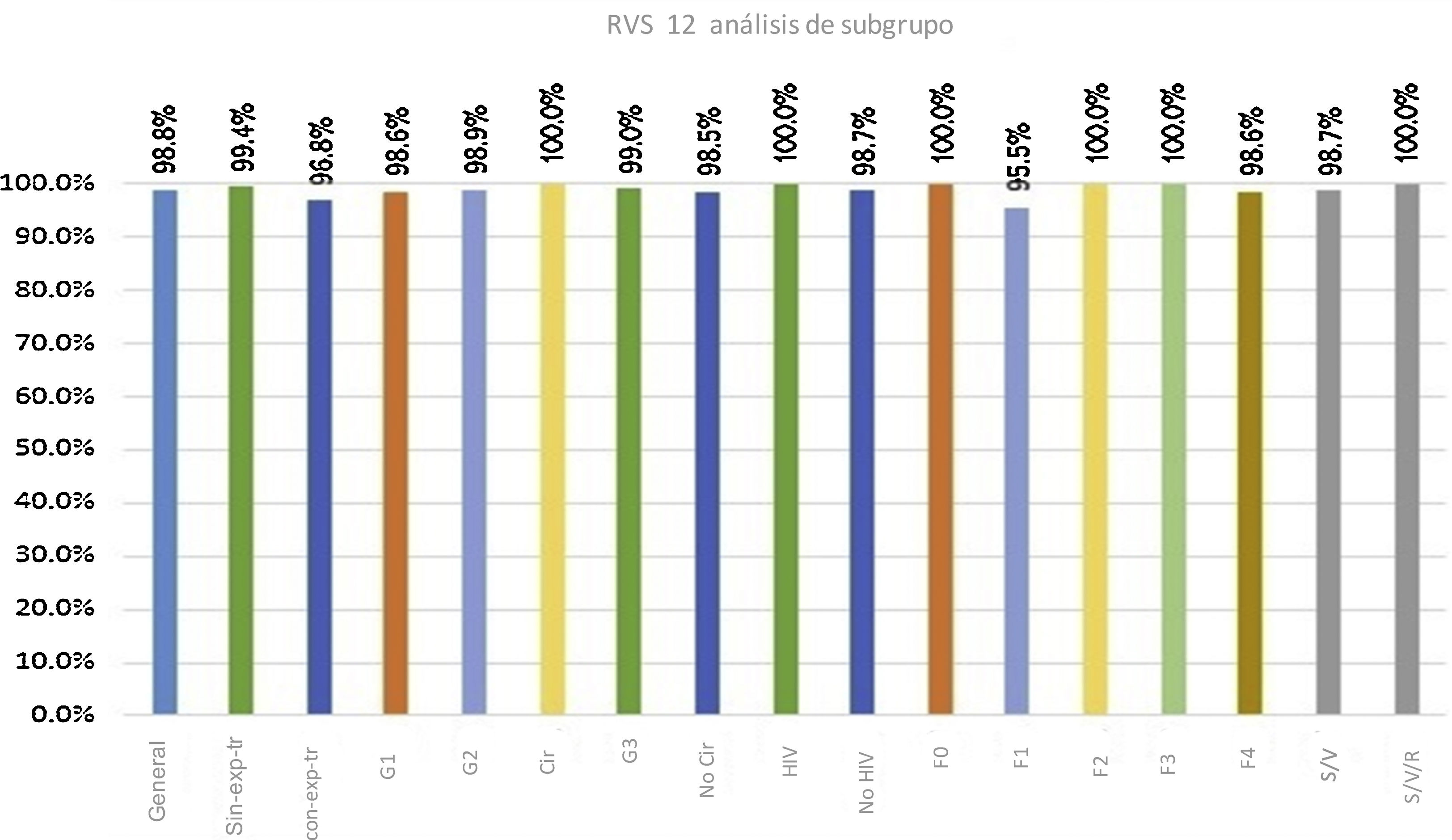
Tres pacientes no lograron la RVS. Dos de ellos tenían cirrosis (Child-Pugh A, escala MELD 8 y etapa cuatro de fibrosis) y el tercero no presentó esta patología, pero había sido tratado con peg-IFN previamente. Dos de esos pacientes tenían genotipo 1 y el tercero tenía genotipo 2. La figura 1 muestra las tasas de respuesta por subgrupo de pacientes, respuesta general, genotipo, presencia o ausencia de cirrosis, estatus de VIH, casos con experiencia de tratamiento, casos sin esta y etapa de fibrosis.
Respuesta virológica sostenida, general y por subgrupo, a las 12 semanas.
con-exp-tr: con experiencia de tratamiento; Cir: cirrosis; No Cir: sin cirrosis; sin-exp-tr: sin experiencia de tratamiento; HIV: human immunodeficiency virus (virus de la inmunodeficiencia humana [VIH]); RVS: respuesta virológica sostenida S/V: sofosbuvir/velpatasvir; S/V/R: sofosbuvir/velpatasvir/ribavirin.
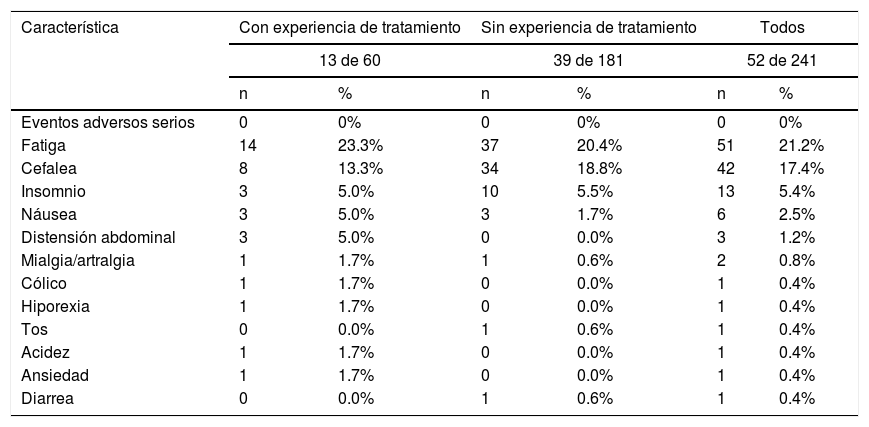
No se reportaron eventos adversos serios durante el período de tratamiento, confirmando el buen perfil de seguridad de este. En 21.6% de los pacientes se reportaron eventos adversos, de los cuales; en al menos 5% de la población analizada, fueron fatiga, cefalea e insomnio. La tabla 3 muestra todos los eventos adversos reportados en cada grupo y en el total de la población del estudio.
| Característica | Con experiencia de tratamiento | Sin experiencia de tratamiento | Todos | |||
|---|---|---|---|---|---|---|
| 13 de 60 | 39 de 181 | 52 de 241 | ||||
| n | % | n | % | n | % | |
| Eventos adversos serios | 0 | 0% | 0 | 0% | 0 | 0% |
| Fatiga | 14 | 23.3% | 37 | 20.4% | 51 | 21.2% |
| Cefalea | 8 | 13.3% | 34 | 18.8% | 42 | 17.4% |
| Insomnio | 3 | 5.0% | 10 | 5.5% | 13 | 5.4% |
| Náusea | 3 | 5.0% | 3 | 1.7% | 6 | 2.5% |
| Distensión abdominal | 3 | 5.0% | 0 | 0.0% | 3 | 1.2% |
| Mialgia/artralgia | 1 | 1.7% | 1 | 0.6% | 2 | 0.8% |
| Cólico | 1 | 1.7% | 0 | 0.0% | 1 | 0.4% |
| Hiporexia | 1 | 1.7% | 0 | 0.0% | 1 | 0.4% |
| Tos | 0 | 0.0% | 1 | 0.6% | 1 | 0.4% |
| Acidez | 1 | 1.7% | 0 | 0.0% | 1 | 0.4% |
| Ansiedad | 1 | 1.7% | 0 | 0.0% | 1 | 0.4% |
| Diarrea | 0 | 0.0% | 1 | 0.6% | 1 | 0.4% |
Los datos analizados en este trabajo fueron obtenidos de los registros médicos clínicos de 241 pacientes infectados con VHC que recibieron atención en 20 hospitales en México. Estos casos fueron tratados con SOF/VEL, la primera combinación pangenotípica autorizada y disponible en México. En el caso de 10 personas, se agregó RBV a su tratamiento.
La mayoría de los pacientes tenía genotipos VHC 1 y 2. Solo 10 de ellos (4.1%) tenían genotipo 3, así que los resultados obtenidos en ese subgrupo deben ser analizados con cautela.
La combinación de SOF/VEL en pacientes con VHC probó ser muy efectiva en todos los casos, incluso en los subgrupos evaluados. De los 241 pacientes evaluados, solo tres no lograron la RVS, lo cual dio una tasa de 98.76% (IC 95% 97.35 a 100%, p < 0.00001). Los resultados del presente estudio confirman las altas tasas de RVS logradas con el tratamiento con SOF/VEL.
En el estudio realizado en el mundo real por Chirino et al.5, el 96% de 81 pacientes con predominancia de genotipo 1 b (70.4%), tratados con diversos AAD de segunda generación lograron la RVS. La tasa general de RVS alcanzada en el presente estudio fue más alta, pero la proporción de casos con genotipo 1 fue ligeramente menor.
Wyles et al.8 estudiaron a pacientes con coinfección de VIH y VHC. Los resultados de la RVS general obtenidos indicaron que el 95% (IC 95% 89 a 99%) de los casos lograron RVS, mientras que aquellos con genotipos 1, 2, 3 y 4, lograron la RVS en 95% (87 a 99%), 100% (72 a 100%), 92% (62 a 100%) y 100% (48 a 100%) de los casos respectivamente. En el presente análisis todos los pacientes con coinfección de VIH y VHC lograron la RVS12.
Una de las limitaciones este estudio fue que, cuando los datos se obtuvieron por la misma característica de paciente, algunos de los subgrupos fueron pequeños, lo cual dificulta extraer conclusiones sólidas. Por ejemplo, solo 10 personas con genotipo 3 fueron analizadas y todas lograron la RVS. Sin embargo, se ha reportado que el genotipo 3 tiene respuestas menos favorables a cualquier tratamiento, incluso a los AAD de última generación. Esto también podría ser cierto para el subgrupo de 22 pacientes con fibrosis baja (F1). Ellos tuvieron una RVS ligeramente más baja (95.5%), en comparación con los 139 pacientes con fibrosis/cirrosis avanzada (F4) que lograron una tasa de RVS de 98.6%. En la mayoría de los estudios, se espera que los casos con mayor grado de fibrosis tengan una tasa de respuesta menor que aquellos con fibrosis leve.
Considerando dichos resultados, se debería mencionar la estrategia de la Organización Mundial de la Salud (OMS) para erradicar el VHC para el año 2030. Los objetivos son reducir en 90% el número de casos nuevos y en 65% la mortalidad, dado que el VHC puede ser causa de cirrosis y carcinoma hepatocelular, conduciendo a la muerte. Dos de los objetivos más relevantes de la estrategia son: diagnosticar al 90% de las personas infectadas y dirigirlas a recibir atención médica, y que 80% de ellos reciban tratamiento9,10.
Para lograr la eliminación del VHC, la estrategia para tratar la enfermedad se debe enfocar en grupos y sectores de alto riesgo. La intervención oportuna en estos podría resultar en una disminución sustancial en el número de personas infectadas en otras poblaciones. En ese contexto, la administración oral de la pangenotípica y panfibrótica combinación de SOF/VEL por un período de 12 semanas es una herramienta invaluable para lograr las metas de la OMS para el 2030, gracias a su alta RVS para eliminar la enfermedad en grupos de alto riesgo, independientemente del genotipo, al igual que en pacientes con o sin cirrosis, e incluso en aquellos con cirrosis descompensada.
ConclusionesLa RVS general obtenida en el presente estudio retrospectivo concurre con los resultados de ensayos clínicos aleatorizados y de estudios del mundo real llevados a cabo en múltiples locaciones y con poblaciones diversas. No se identificaron diferencias significativas en las características demográficas de los grupos analizados ni en los resultados generales de RVS y seguridad. Se mostró que los tratamientos con SOF/VEL y SOF/VEL/RBV son altamente efectivos y muy seguros.
AgradecimientosRecibimos apoyo del escritor médico Joaquín Herrera Rojas y la estadística Wayra Paz Ballesteros, ambos consultores independientes, para la publicación del presente estudio.
FinanciaciónGilead Sciences México apoyó esta publicación con una beca para servicios editoriales, sin embargo, no participó en la obtención de datos retrospectivos, el desarrollo del estudio o la escritura del presente artículo.
Conflicto de interesesLos autores J.A. Velarde Ruiz Velasco, G. Castro Narro y F. Higuera De La Tijera han sido ponentes para Gilead. J.L. Pérez Hernández ha recibido apoyo de Gilead para asistir a congresos médicos. El resto de los autores no tienen conflicto de intereses que declarar.


![Respuesta virológica sostenida, general y por subgrupo, a las 12 semanas. con-exp-tr: con experiencia de tratamiento; Cir: cirrosis; No Cir: sin cirrosis; sin-exp-tr: sin experiencia de tratamiento; HIV: human immunodeficiency virus (virus de la inmunodeficiencia humana [VIH]); RVS: respuesta virológica sostenida S/V: sofosbuvir/velpatasvir; S/V/R: sofosbuvir/velpatasvir/ribavirin. Respuesta virológica sostenida, general y por subgrupo, a las 12 semanas. con-exp-tr: con experiencia de tratamiento; Cir: cirrosis; No Cir: sin cirrosis; sin-exp-tr: sin experiencia de tratamiento; HIV: human immunodeficiency virus (virus de la inmunodeficiencia humana [VIH]); RVS: respuesta virológica sostenida S/V: sofosbuvir/velpatasvir; S/V/R: sofosbuvir/velpatasvir/ribavirin.](https://static.elsevier.es/multimedia/03750906/0000008700000001/v2_202202040701/S0375090620301567/v2_202202040701/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w97o/wdEXW47bqlyT1CqG6R0=)

