En 1942 Stout y Murray describieron por primera vez el hemangiopericitoma (HPC) como un tumor vascular compuesto por pericitos de Zimmermann1. En 1980, Wagner realizó la primera descripción histológica de un tumor fibroso solitario (TFS) en la pleura2. En 1931, Klemperer y Rabin lo reconocieron como una entidad distintiva3.
Ultraestructuralmente, tanto el HPC como el TFS muestran características variables de diferenciación pericítica, fibroblástica y/o miofibroblástica4.
Gracias al aumento exponencial de los reportes de TFS, se concluyó que este no solo se presentaba en las serosas5. Actualmente, debido a la superposición de las principales características histológicas y la falta de criterios específicos para determinar si una lesión es TFS o HPC, los patólogos han decidido abandonar el término de HPC en favor de TFS6.
El TFS localizado en el mesenterio del intestino delgado es una neoplasia extremadamente rara, con solo 3 casos reportados en PubMed7-9. El objetivo de la presentación de este caso fue proporcionar los conocimientos vigentes sobre la clasificación del TFS y reportar el 4.° caso de TFS en el mesenterio del intestino delgado.
Paciente varón de 82 años, acudió llevado por familiares al servicio de urgencias del Hospital Nacional Guillermo Almenara Irigoyen (HNGAI) con un tiempo de enfermedad de 10 días, por dolor abdominal tipo cólico, que aumentó de intensidad con el transcurrir de los días; acompañado de náuseas, vómitos, fiebre cuantificada de 40°C y trastorno del sensorio. Durante una minuciosa anamnesis, el paciente refirió un cuadro similar hace 4 meses, asociado a dispepsia y disminución involuntaria de 3 kg de peso en ese tiempo. El examen físico evidenció leve palidez, dolor moderado a la palpación en el hipocondrio derecho, el mesogastrio y el hipogastrio. Además, se palpó una masa dolorosa en hipogastrio, de 15×15cm, siendo el resto del examen físico no contributorio.
El tránsito intestinal indicó retardo en el mismo, discreta dilatación de asas yeyuno-ileales y signos de floculación, sin imágenes intraluminales. La tomografía abdominal con contraste reveló una lesión expansiva con hipervascularidad y en contacto con íleon distal, asociada a alteración de los tejidos adiposos circundantes y signos de hemoperitoneo, con predominio en recesos de la cavidad pélvica. Llamó la atención su drenaje venoso eferente dependiente de las venas mesentéricas, las cuales se encontraron incrementadas en su diámetro. Por ello, el servicio de diagnóstico por imagen recomendó considerar en los diagnósticos diferenciales a hemangioma, hemangiosarcoma, tumor carcinoide, hemangiopericitoma y tumor estromal.
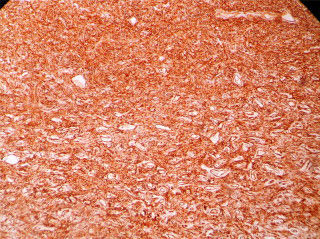
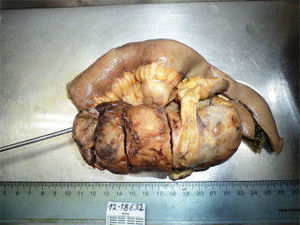
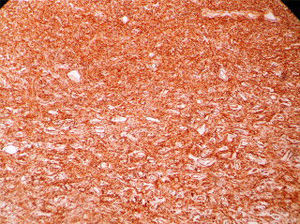
En resolución a la discusión de casos clínicos del servicio de coloproctología del HNGAI, se realizó una laparotomía exploratoria+resección de tumoración de íleon distal y mesenterio+anastomosis ileo-ileal. El informe anatomopatológico de la macroscopia fue segmento del intestino delgado de 21cm, serosa levemente congestiva, con formación tumoral a nivel de su meso de 13×5×4.5cm (fig. 1). Se concluyó HPC de riesgo intermedio alto, de comportamiento agresivo. La neoplasia midió 13cm de diámetro mayor y presentó zonas de necrosis, hemorragia, índice mitótico menor de 1 en 10 en campo de alta potencia (CAP), no pleomorfismo ni atipia. La neoplasia se encontró confinada al mesenterio del intestino delgado-íleon, sin compromiso intestinal. Intestino delgado y sus bordes de sección, sin evidencia de malignidad. El borde de sección del mesenterio correspondió al pleno de división de la neoplasia. CD 34 (+), CD 99 (+), CD 31 (−), CD 117 (−), S-100 (−), Actina (−) (fig. 2).
Si el TFS aparece en mesenterio del intestino delgado, se denomina TFS extrapleural o TFS peritoneal. La edad media de presentación es 54 años, con ligero predominio masculino. Los 3 casos reportados mostraron edades de 26, 53 y 71 años7-9. Su espectro de manifestaciones clínicas depende del tamaño y la localización del tumor. El diagnóstico definitivo se realiza por inmunohistoquímica, en la cual el TFS muestra una fuerte y difusa tinción para CD 34, vimentina y bcl-2, siendo rara vez positivo para actina, desmina, proteína S-100 y citoqueratinas4.
No existe una clara correlación entre la morfología y el resultado del TFS, siendo su comportamiento impredecible. Un 20% de los TFS poseen una variante maligna, caracterizada por gran tamaño del tumor (más de 5cm de diámetro), ser hipercelular, invasivo, con pleomorfismo nuclear, necrosis tisular y poseer un alto índice mitótico mayor de 4 mitosis por 10 CAP. Todo TFS tiene potencial de convertirse en maligno, por ello se recomienda el recuento sistemático de mitosis6.
En nuestro caso, el TFS presentó características de malignidad, como el gran tamaño (diámetro mayor de 13cm) asociado a zonas de necrosis, y particularidades de buen pronóstico, como ausencia de pleomorfismo e invasión, así como un índice mitótico de 1 en 10 CAP. El paciente fue dado de alta el día 12 del postoperatorio, con recuperación favorable.
Como corolario, la mayoría de los TFS presentan CD 34 (+), CD 99 (+) y CD 117 (−), como en nuestro caso. Sin embargo, los tumores estromales del tracto gastrointestinal (GIST) también expresan CD 34 (+) en un 66%, con la característica de que son CD 117 (+) en un 95% de los casos. La manera óptima de diferenciarlos consiste en conocer que la tinción con CD 117 (−) constituye el mejor marcador para distinguir entre el TFS y los GIST10.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.