Los tumores carcinoides fueron descritos por primera vez hace más de 100 años por Lubarsch, quien encontró múltiples tumores en el íleon distal de 2pacientes durante la autopsia1. Constituyen del 2 al 5% de todas las neoplasias del tracto gastrointestinal. Histológicamente, el diagnóstico se confirma mediante tinción inmunohistoquímica positiva de cromogranina A (CgA) y sinaptofisina2. El índice Ki-67 y el índice mitótico se correlacionan con la proliferación celular. Estos parámetros son utilizados para la clasificación de los tumores neuroendocrinos (TNE) (tabla 1)3.
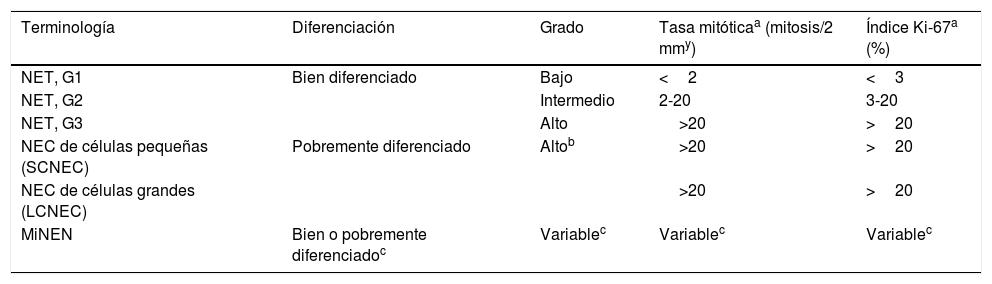
Criterios de clasificación y graduación de las neoplasias neuroendocrinas del tracto gastrointestinal y los órganos hepatobiliares, Organización Mundial de la Salud (OMS), 2019
| Terminología | Diferenciación | Grado | Tasa mitóticaa (mitosis/2 mmy) | Índice Ki-67a (%) |
|---|---|---|---|---|
| NET, G1 | Bien diferenciado | Bajo | <2 | <3 |
| NET, G2 | Intermedio | 2-20 | 3-20 | |
| NET, G3 | Alto | >20 | >20 | |
| NEC de células pequeñas (SCNEC) | Pobremente diferenciado | Altob | >20 | >20 |
| NEC de células grandes (LCNEC) | >20 | >20 | ||
| MiNEN | Bien o pobremente diferenciadoc | Variablec | Variablec | Variablec |
LCNEC: carcinoma neuroendocrino de células grandes; MiNEN: neoplasia mixta neuroendocrina-no neuroendocrina; NEC: carcinoma neuroendocrino; NET: tumor neuroendocrino; SCNEC: carcinoma neuroendocrino de células pequeñas.
Las tasas mitóticas deben expresarse como el número de mitosis/2 mmy (lo que equivale a 10 campos de alta potencia con un aumento de 40×y un diámetro de campo ocular de 0,5 mm) según se determina contando en 50 campos de 0.2mmy (es decir, en un área total de 10mmy); el valor del índice de proliferación de Ki-67 se determina contando al menos 500 células en las regiones de marcado más alto (puntos calientes), que se identifican con el aumento de exploración; la calificación final se basa en cualquiera de los 2índices de proliferación que coloque a la neoplasia en la categoría de grado superior.
Los NEC mal diferenciados no se clasifican formalmente, pero se consideran de alto grado por definición.
En la mayoría de los MiNEN, tanto los componentes neuroendocrinos como los no neuroendocrinos están pobremente diferenciados y el componente neuroendocrino tiene índices de proliferación en el mismo rango que otros NEC, pero esta categoría conceptual permite la posibilidad de que uno o ambos componentes puedan estar bien diferenciados; cuando sea posible, cada componente debe clasificarse por separado.
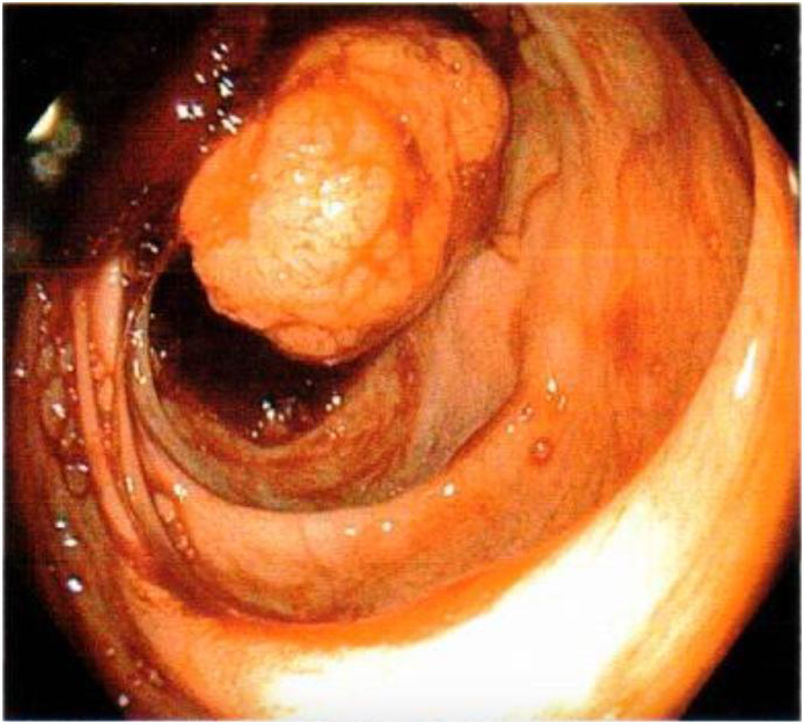
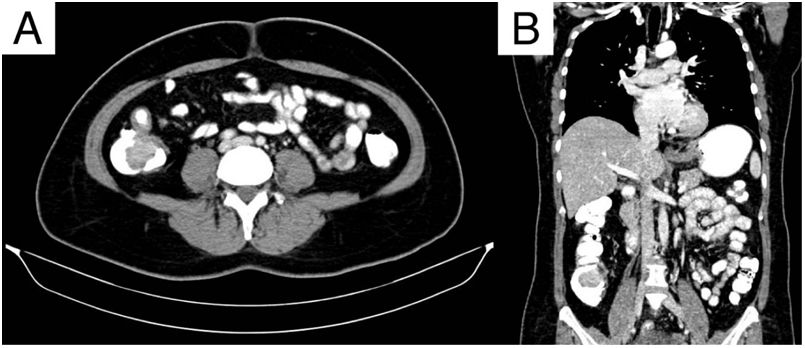
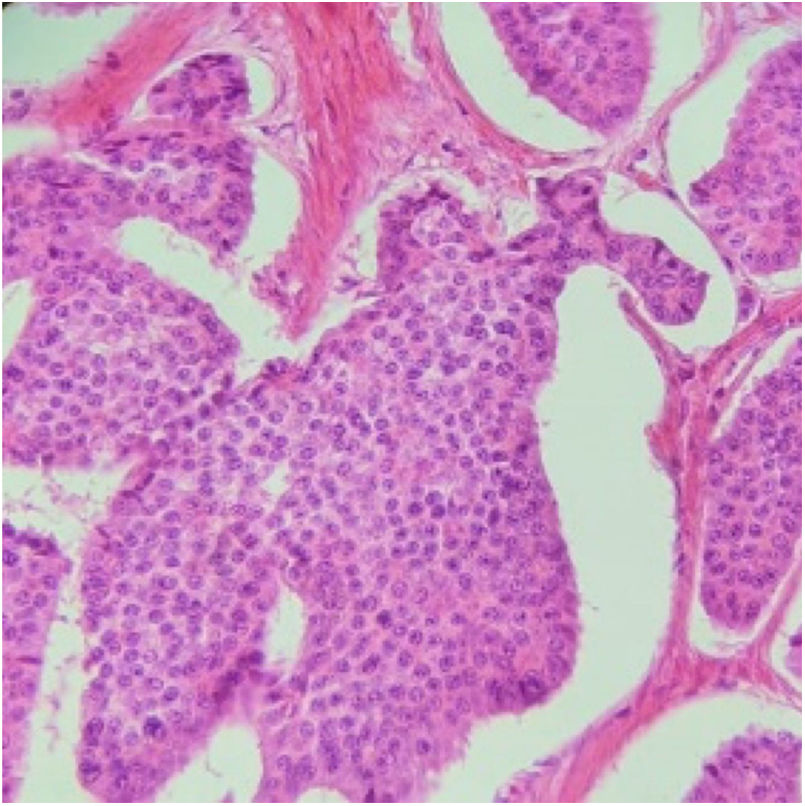
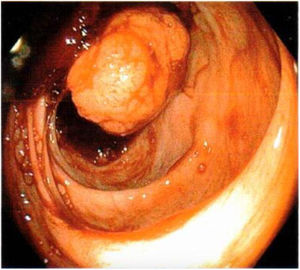
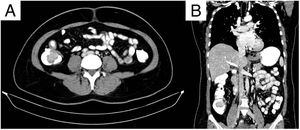
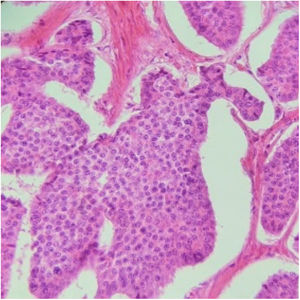
Presentamos a una paciente femenina de 53 años con antecedentes de ooforectomía derecha secundaria a tumoración benigna hace 30 años no especificada e histerectomía secundaria a pólipos endometriales hace 10 años. Inicia padecimiento actual presentando 4 episodios de hematoquecia en los últimos 10 meses, cambio de consistencia en las heces, astenia y adinamia. Múltiples transfusiones sanguíneas por sangrado agudo. A su ingreso a urgencias médicas se encontró síndrome anémico, los laboratorios reportaron anemia normocítica hipocrómica de 6.4g/dl, linfopenia de 0.65, TPT de 18.1s, glucosa de 117.9mg/dl y proteínas totales en suero de 6.5g/dl. Durante su estancia se transfundieron 3 paquetes globulares y se procedió a realizar colonoscopia diagnóstica, encontrando un pólipo sésil en el colon derecho de aproximadamente 4cm de diámetro ocluyendo un 30% de la luz intestinal (fig. 1); se realiza toma de biopsias que reportan pólipo con patrón morfológico compatible con un tumor carcinoide. Se solicita antígeno carcinoembrionario en suero encontrándose en 0.79 ng/ml. En la tomografía computarizada (TAC) abdominal con doble contraste se reporta como hallazgo a nivel del ciego un defecto de llenado por imagen hipodensa que refuerza a la aplicación del medio de contraste que mide 31×40×30mm (fig. 2). Se decide tratamiento, realizando hemicolectomía derecha laparoscópica oncológica con ileotransverso anastomosis mecánica, encontrando como hallazgo un tumor de ciego de aproximadamente 3×4×3cm con adherencias a la pared y los ganglios mesentéricos. En el posoperatorio evolucionó favorablemente, sin requerimientos de transfusión con inicio de la vía oral al tercer día. Se envía la pieza a enfermedad correspondiente a colon ascendente, íleon terminal y ciego, reportando tumor neuroendocrino bien diferenciado de 3×4×3cm localizado en válvula ileocecal con invasión a través de la muscular hasta el tejido subseroso, ganglios linfáticos con hiperplasia folicular linfoide Ki-67: 2% y apéndice cecal sin alteraciones con un estadio patológico pT3, pN0, pMX (fig. 3). La paciente egresó al quinto día de posoperatorio y continuó protocolo de estudio por parte de oncología encontrando en la tomografía por emisión de positrones (PET) datos con relación a enfermedad metastásica a nivel hepático, en sistema óseo (cuerpo vertebral T3) y en tercio proximal de húmero derecho. Actualmente, la paciente se encuentra en tratamiento con octreotida y vigilancia estrecha.
Tomografía computarizada con doble contraste en corte axial (A) y coronal (B), las cuales demuestran una lesión hipodensa exofítica en el ciego, dependiente de la pared medial, con dimensiones de 31×40×30mm, con pobre realce tras la administración del material de contraste. La lesión infiltra la válvula ileocecal y la base del apéndice cecal.
Corte histopatológico de tumor neuroendocrino bien diferenciado. Se muestra una proliferación de células pequeñas con núcleos redondos monótonos, con cromatina en sal y pimienta, y citoplasma eosinófilo con evidencia de mitosis, los cuales se disponen formando nidos sólidos, con empalizada periférica. La inmunohistoquímica con inmunofenotipo: sinaptofisina positiva, cromogranina positiva, CD56 positivo, CDX-2 positivo, CKAE1/AE3 positivo. Con un índice de proliferación del 2%.
Las neoplasias neuroendocrinas (NEN) surgen del sistema celular neuroendocrino; el término NEN engloba TNE bien diferenciados y carcinomas neuroendocrinos poco diferenciados4. El término «carcinoide» se utiliza en la literatura como referencia a TNE bien diferenciados; sin embargo, es un término que actualmente no se incluye en la clasificación de los TNE. Estos se encuentran más frecuentemente en el tracto gastrointestinal (54.5%) y los pulmones (30.1%)5. La incidencia de los TNE es de 5.25 por cada 100,000 habitantes6. Dentro del tracto gastrointestinal, se localizan más frecuentemente en el intestino delgado (44.7%) y el recto (19.6%). En el colon representan únicamente el 10.6%5.
Las manifestaciones clínicas de los tumores carcinoides dependen de la localización, presencia de metástasis o del síndrome carcinoide. Los síntomas más comunes son diarrea, dolor abdominal, sangrado gastrointestinal o pérdida de peso. Normalmente se manifiestan de forma tardía como tumores grandes y a menudo con metástasis al momento del diagnóstico. Generalmente, son localizados durante una endoscopia de rutina por otra causa o secundario a sangrado rectal7.
Los estudios por imagen desempeñan un papel fundamental e indispensable en el diagnóstico, el pronóstico y el tratamiento de los TNE. Existen varios métodos para el diagnóstico, incluyendo TAC, resonancia magnética nuclear (RM), ecografía, gammagrafía y PET. La TAC es la modalidad de imagen predominante para los TNE. La endoscopia gastrointestinal es el procedimiento de elección para el diagnóstico de los TNE gástricos, duodenales y colorrectales8.
Los TNE colónicos surgen de células de Kulchitsky o células enterocromafines ubicadas dentro de las criptas de Lieberkühn del colon. Los pacientes generalmente presentan dolor abdominal debido al efecto de masa o reacción desmoplásica inducida por el tumor, hemorragia gastrointestinal y pérdida de peso. En el momento del diagnóstico, el tamaño medio de los TNE de colon es de 5cm y la mayoría tiene metástasis local o distante2. Los TNE de colon tienen el peor pronóstico de supervivencia a 5 años de todos los TNE del tracto gastrointestinal; del 40 al 70% dependiendo del sitio y del estadio, en comparación con otros sitios del tracto gastrointestinal; los TNE con localización en recto tienen un pronóstico de supervivencia a 5 años del 74 al 84%. La supervivencia para la enfermedad localizada, regional y a distancia es de 261, 36 y 5 meses, respectivamente. Los TNE de colon son más frecuentes del lado derecho (70%) y a menudo han hecho metástasis al momento del diagnóstico2,9.
El principal objetivo del tratamiento es aumentar la supervivencia, controlar los síntomas y mejorar la calidad de vida. Esto es posible mediante una amplia resección quirúrgica. Esta es recomendada para el tratamiento de la enfermedad locorregional, avanzada y con obstrucción inminente10. La extensión quirúrgica depende del tamaño y extensión dentro del tracto gastrointestinal. Debido a la detección tardía y al mal pronóstico asociado a los TNE de colon, se recomienda: resección endoscópica en tumores <1cm, escisión transanal en tumores entre 1-2cm o posterior a la resección endoscópica con márgenes positivos y colectomía parcial con linfadenectomía regional en tumores>2cm y tumores invasivos11. El uso de quimioterapia es poco alentador y la respuesta terapéutica es baja (<30%)12. Los sitios más comunes de metástasis en orden de frecuencia son el hígado, el hueso y los pulmones13.
El pronóstico y el seguimiento de los pacientes depende de su estado clínico en el momento del diagnóstico y de la terapia que hayan recibido. Se recomienda el uso de TAC trifásica de abdomen y pelvis o RM cada año durante los primeros 3 años, posteriormente cada 1 a 2 años por al menos 10 años. No se recomienda el uso de marcadores en sangre u orina (incluidos CgA y ácido 5-HIAA) para el seguimiento de estos pacientes; no hay evidencia que demuestre el valor de realizar pruebas de rutina de estos marcadores14.
Los TNE son entidades infrecuentes en el tubo digestivo bajo en comparación con el resto de las estirpes del cáncer de colon, específicamente con localización en válvula ileocecal. El término carcinoide en la literatura actual se ha presentado como inadecuado y la incidencia en nuestro país no se tiene con exactitud. Se debe realizar un abordaje multidisciplinario para el tratamiento quirúrgico y el seguimiento posoperatorio ya que con el advenimiento de herramientas diagnósticas como el PET y la cirugía de mínima invasión de colon permiten un tratamiento dirigido.
Responsabilidades éticasLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales y han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes. Se ha obtenido el consentimiento informado por escrito y se omite toda información de identificación del paciente.
FinanciaciónLos autores declaran no haber recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.