La hemorragia digestiva alta de origen tumoral (HDT) es una causa rara, pero mortal de sangrado. El tratamiento endoscópico es desafiante debido al sangrado difuso, en capa y con altas tasas de resangrado con coagulación o hemoclips. Los polvos hemostáticos pueden ser una opción en estos pacientes. Nuestro objetivo es determinar la tasa de hemostasia inicial y de resangrado a 7 y 30 días con el uso de estos polvos en los pacientes con HDT en un centro de referencia nacional.
Material y métodosEstudio retrospectivo, observacional de pacientes con HDT tratados con polvo hemostático entre 2018-2023. Se analizaron las variables demográficas y clínicas, así como los hallazgos endoscópicos y los resultados del tratamiento. Se utilizó análisis de tendencia central, prueba de Chi-cuadrado.
ResultadosSe incluyeron 54 pacientes, edad media: 54 años, 57.4% masculinos, con diagnóstico de cáncer gástrico en el 40.7%, que presentaron un episodio de HDT. Entre los hallazgos endoscópicos: el 52% mostró HDT activa, la mayor parte presentaban sangrado en capa (57.4%). Se empleó EndoClot™ principalmente como monoterapia (81.5%) logrando hemostasia inicial en 100% La tasa de resangrado a 7 días fue del 22.2% y a 30 días del 44.4%, con una mortalidad acumulada a 30 días del 35.2%.
ConclusionesLa HDT es una complicación potencialmente mortal. El uso de polvo hemostático es altamente recomendable debido a su eficacia en el control inmediato del sangrado. No obstante, su efecto es temporal, por lo que se sugiere su uso como terapia puente, facilitando la estabilización de la hemorragia y permitiendo implementar tratamientos hemostáticos definitivos.
Upper gastrointestinal bleeding (UGIB) of neoplastic origin is a rare but life-threatening cause of bleeding. Endoscopic treatment is challenging due to diffuse oozing blood and high rates of rebleeding, despite coagulation and hemoclip use. Hemostatic powders can be an option in those patients. We aimed to determine the initial hemostatic rate and the rebleeding rate at 7 and 30 days, using hemostatic powders in patients with malignant UGIB at a national referral center in Mexico.
Material and methodsA retrospective, observational study was conducted on patients with malignant UGIB treated with hemostatic powder between 2018-2023. Demographic and clinical variables, endoscopic findings, and treatment results were analyzed. A central tendency analysis and the chi-square test were employed.
ResultsThe study included 54 patients (54.7% were men), with a mean age of 54 years. A total of 40.7% were diagnosed with gastric cancer and presented with an episode of malignant UGIB. Of the endoscopic findings, 52% of patients had active malignant UGIB, most presenting with oozing bleeding (57.4%). EndoClot™ was the main monotherapy employed (81.5%), achieving initial homeostasis in 100% of cases. The rebleeding rate was 22.2% at 7 days and 44.4% at 30 days, with a 30-day accumulated mortality rate of 35.2%.
ConclusionsMalignant UGIB is a potentially life-threatening complication. Hemostatic powder use is highly recommendable due to its efficacy in the immediate control of bleeding. Nevertheless, its effect is temporary, suggesting its use as bridging therapy, facilitating bleeding stabilization and enabling the implementation of definitive hemostatic treatments.
La hemorragia digestiva alta de origen tumoral (HDT) es una causa rara de sangrado digestivo proximal al ligamento de Treitz (5%)1,2; sin embargo, conlleva una elevada tasa de mortalidad (37.5%)2. La principal etiología del HDT es el cáncer gástrico entre un 36-58%3,4; en su mayoría, se presenta como melena o síndrome anémico, siendo el síntoma de inicio hasta en un 79%2–5. Lamentablemente, la mayoría de los pacientes con HDT se encuentran en etapas avanzadas (75%)4.
La endoscopia es importante para el diagnóstico y el tratamiento primario de esta enfermedad; se recomienda realizarla dentro de las primeras 24h de la presentación, una vez se realice la estabilización hemodinámica del paciente6. La terapia endoscópica (TE) reduce nuevos sangrados (OR: 0.38; IC 95%: 0.32-0.45), la necesidad de cirugía (OR: 0.36; IC 95%: 0.28-0.45) y la mortalidad (OR: 0.55; IC 95%: 0.40-0.76)6. Las tasas de hemostasia inicial con TE convencional varían entre el 67-100%: sin embargo, la tasa de resangrado por HDT es muy elevada: 41-80% comparado con el 8-24% en casos de etiología benignas6. Entre las herramientas endoscópicas convencionales se encuentran la terapia con inyección, terapia mecánica con hemoclips, terapia térmica y ablación con argón plasma1,6,7. Sin embargo, ni la colocación de hemoclips o termocoagulación han demostrado ser efectivas para HDT, debido a que los sangrados suelen ser difusos, multifocales o con úlceras induradas1,3,7,8. Por esta razón, existe la necesidad de utilizar otros métodos de TE, como lo son los polvos hemostáticos7,9. Estos consisten en agentes tópicos pulverizados con la capacidad de inducir hemostasia sin contacto directo, evitando la destrucción del tejido circundante, con la ventaja de poder dispersarlos cubriendo múltiples áreas como en los casos de HDT1.
El EndoClot™ PSH (EndoClot Plus Co., Santa Clara, CA, EE. UU.), fue el primero estos polvos, aprobado desde 20123. Consiste en un compuesto polimérico derivado del almidón que se aplica mediante un catéter plástico distribuyéndose mediante un flujo constante de aire, lo que permite su dispersión sobre la mucosa, absorbiendo el agua del lecho sangrante y, consecuentemente, formando una matriz gelatinosa que favorece la formación de coágulo1–3. Recientemente se han comparado diferentes polvos hemostáticos, como el Hemospray® (TC-325, Cook Medical Inc, Winston-Salem, NC, EE. UU.) compuesto de bentonita, un mineral inerte que se aplica mediante CO2 presurizado3 absorbiendo agua y formando barrera adhesiva y creando coágulo. Usado para todo tipo de sangrados digestivos, el Hemospray® demostró una hemostasia inicial del 92.3% y un resangrado del 20.6% en una revisión de estudios prospectivos y retrospectivos10.
El uso de los polvos hemostáticos representa una opción innovadora y segura para la hemostasia endoscópica; sin embargo, la evidencia sobre su indicación y eficacia para las HDT es limitada. Por este motivo, se desea conocer su eficacia en relación con la tasa de hemostasia inicial y frecuencia de resangrado a 7 y 30 días en los pacientes con HDT en un centro de referencia nacional.
Material y métodosTipo de estudio: Se realizó un estudio original, retrospectivo y observacional de acuerdo con los lineamientos STROBE, de expedientes de pacientes con antecedente de HDT a los que se realizó endoscopia y tratamiento con polvos hemostáticos de enero 2018 a mayo 2023 en un centro de referencia nacional (Instituto Nacional de Cancerología de México).
El objetivo primario fue conocer la eficacia en relación con la tasa de hemostasia inicial y tasa de resangrado a 7 y 30 días de los polvos hemostáticos empleados como ET en los pacientes con HDT en un centro de referencia nacional. Se utilizaron las siguientes definiciones operativas:
- •
HDT: la presencia de datos clínicos de sangrado digestivo (melena, hematemesis, hematoquecia) asociados con un descenso de 2g/dl de hemoglobina del valor inicial basal o una cifra de hemoglobina inicial menor a 10g/dl con datos de sangrado digestivo.
- •
Hemorragia activa: evidencia de hemorragia en chorro o sangrado en capa continuo durante la endoscopia, el cual no se autolimita durante la exploración.
- •
Hemostasia inicial: cese del sangrado durante 5min posteriores a la aplicación del agente hemostático en polvo.
- •
Resangrado: se consideró como positivo a aquellos pacientes con hemostasia inicial que presentaron nuevamente datos de hemorragia digestiva o presentaron un descenso en la hemoglobina de 2g/dl en el rango de tiempo determinado posterior al procedimiento.
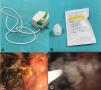
La decisión de aplicar polvo hemostático fue tomada en base a cada escenario clínico individual del paciente. La elección del tipo de polvo (EndoClot™ o Hemospray®) fue realizada en base a la preferencia del endoscopista y la disponibilidad del insumo. El procedimiento fue estandarizado: con el ensamblado del sistema, el compresor de aire conectado al catéter de aplicación, cuya punta era sellada con un fragmento de plastilina comercial no tóxica para prevenir la entrada de líquido y la oclusión del catéter. Una vez localizada la fuente de sangrado, se activaba el compresor en flujo bajo de aire y el frasco del polvo se percutía de manera intermitente y gentil para favorecer la liberación continua sobre el área deseada hasta cubrirla por completo. Posteriormente, se revisaba la hemostasia inicial y la necesidad de tratamientos adyuvantes (figs. 1A-D).
La muestra se obtuvo de manera secuencial e indistinta de todos los expedientes que cumplieran con los siguientes criterios de inclusión: mayores de 18 años, sexo indistinto, con diagnóstico de HDT que contaran con ET y aplicación de polvos hemostáticos entre enero 2018 a mayo 2023. Los criterios de exclusión fueron: hemorragias digestivas bajas, de etiología benigna, con estenosis no franqueable o alteraciones que impidan completar el estudio. Los criterios de eliminación: expedientes incompletos, sin reportes de endoscopia o tratamiento endoscópico, pérdida de seguimiento en el instituto. Se realizó un esfuerzo para minimizar los sesgos mediante selección de muestra acorde con los estrictos criterios de inclusión y exclusión, la recopilación de datos precisa y consistente. Además, se declara que no existen conflictos de interés por parte de los autores que ponga en riesgo de sesgo.
Análisis estadísticoSe recabaron las variables demográficas y clínicas de edad, sexo, estado funcional mediante escalas validadas de ECOG y Karnofsky, localización del tumor primario, tratamiento oncológico previo al episodio de HDT, manifestación clínica inicial del sangrado, laboratorios de ingreso, necesidad y cantidad de transfusiones de hemoderivados, así como puntajes de escalas pronósticas de Glasgow-Blatchford y AIM 65. Se describieron las características de los hallazgos endoscópicos: presencia de hemorragia activa, tipo de sangrado, localización. Además, se recabó el tipo de agente hemostático utilizado, si se aplicó como monoterapia o combinado con otras herramientas, si fue posible alcanzar la hemostasia inicial, eventos adversos, días de hospitalización, así como presencia de resangrado a 7 y 30 días y la mortalidad a 30 días, si requirieron un nuevo tratamiento endoscópico o terapia hemostática definitiva.
Para el análisis estadístico los datos se capturaron en hoja de cálculo de Excel® y posteriormente fueron migrados al programa estadístico SPSS® v.25.0. Se describieron los resultados utilizando medidas de tendencia central para las variables continuas con distribución normal. Se obtuvo el cálculo de la media, mediana, moda y desviación estándar, utilizando la t de Student para su comparación de medias. Para las variables cualitativas se reportaron sus frecuencias y porcentajes, se utilizó un análisis usando la prueba de Chi-cuadrado para su comparación.
ResultadosDemografía y características clínicasSe revisaron 70 expedientes de pacientes con HDT en nuestra institución durante el periodo de 2018-2023, de los cuales 54 casos cumplieron los criterios de inclusión. De los 16 pacientes restantes, 3 fueron excluidos por tener patología benigna, 3 fueron eliminados por carecer de expediente clínico completo y los 10 restantes eliminados por pérdida de seguimiento. Las características demográficas y clínicas de la muestra se especifican en la tabla 1.
Características demográficas y clínicas de la muestra
| Características (n=54) | Frecuencia o media (%/DE) |
|---|---|
| Características antropomórficas | |
| Masculino | 31 (57,4) |
| Edad (años) | 54 (14,9) |
| Karnofsky | 70 (13,9) |
| ECOG | 2 (0,8) |
| Antecedentes relevantes | |
| Diagnóstico oncológico | |
| Esófago | 4 (7,4) |
| Adenocarcinoma de estómago | 22 (40,7) |
| Linfoma MALT | 7 (13) |
| Duodeno | 5 (9,3) |
| Páncreas | 6 (11,1) |
| Otras neoplasias con infiltración del tracto digestivo | 10 (18,5) |
| Tratamiento oncológico previo al episodio | |
| Sin tratamiento | 12 (22,2) |
| Quimioterapia | 25 (46,3) |
| Quimio-radioterapia | 7 (13) |
| Cirugía | 5 (9,3) |
| Combinado quimioterapia y cirugía | 5 (9,3) |
| Episodio de HDT | |
| Manifestación clínica inicial | |
| Melena | 32 (59,3) |
| Hematemesis | 18 (33,3) |
| Hematoquecia | 1 (1,9) |
| Anemia crónica | 3 (5,5) |
| Laboratorio inicial | |
| Hemoglobina al ingreso g/dl | 7,82 (2,55) |
| Plaquetas al ingreso ×103/μl | 278 (127) |
| INR | 1,3 (1,22) |
| Transfusiones hemoderivados 24h peri-endoscopia | |
| N,° de PG | 1,56 (1,6) |
| N,° de PFC | 0,11 (0,5) |
| N,° de aféresis plaquetarias | 0,09 (0,2) |
| Al momento de la endoscopia: | |
| Hemoglobina g/dl | 9,16 (1,7) |
| Escala de Glasgow-Blatchford | 9 (4) |
| Escala de AIM 65 | 2 (1,62) |
DE: desviación estándar; ECOG: Eastern Cooperative Oncology Group; HDT: hemorragia digestiva tumoral; MALT: linfoma de tejido linfoide asociado a mucosas; PG: paquetes globulares; PPF: plasma fresco congelado.
El diagnóstico oncológico principal fue adenocarcinoma gástrico en 22 (40.7%), seguido de adenocarcinoma esofágico 4 pacientes (7.4%), linfoma gástrico en 7 (13%), adenocarcinoma duodenal en 5 (9.3%), cáncer de páncreas en 6 (11.1%) y otras neoplasias con infiltración en tracto digestivo alta en 10 (18.5%), entre las que se incluyen 5 casos de melanoma, 2 de adenocarcinoma de mama, 2 de cáncer de próstata y uno de cáncer de ovario. Las manifestaciones clínicas más frecuentes fueron melena en 32 pacientes (59.3%) y hematemesis en 18 casos (33.3%). La media de hemoglobina al ingreso fue de 7.82mg/dl (DE: 2.55), con un recuento de plaquetas normal (media de 278×103/μl; DE: 127) y un INR promedio de 1.3 (DE: 1.22). El promedio de hemoderivados transfundidos antes de la endoscopia fue de 1.56 paquetes globulares (DE: 1.6). Las puntuaciones promedio en las escalas pronósticas de sangrado digestivo previo a la endoscopia fueron 9 puntos (DE: 4) en la escala de Glasgow-Blatchford y 2 puntos (DE: 1.62) en la escala AIM 65.
Durante la endoscopia, el 52% (28) de los pacientes presentó hemorragia digestiva activa (definida como evidencia de hemorragia arterial o sangrado continuo que no se autolimita durante la exploración). Los hallazgos endoscópicos incluyeron sangrado en capa del lecho tumoral en 31 pacientes (57.4%), vaso visible en el tumor en 5 pacientes (9.3%), coágulo fresco adherido en 8 (14.8%) y lesión cubierta de fibrina con abundante necrosis en 10 pacientes (18.5%). La localización más frecuente del tumor fue en el estómago proximal (cardias, cuerpo y/o fondo) en 16 casos (29.6%), seguida de lesiones gástricas difusas en 13 pacientes (24.1%), gástricas distales en 7 casos (13%), en esófago inferior en 7 casos (13%) y en duodeno en 11 casos (20.3%) (tabla 2).
Características de endoscopia durante la HDT
| Hallazgos durante endoscopia (N=54) | Frecuencia o media (%/DE) |
|---|---|
| HDT activa durante procedimiento | 28 (52) |
| Hallazgo endoscópico | |
| Sangrado en capa | 31 (57,4) |
| Vaso visible en lecho tumoral | 5 (9,3) |
| Coágulo fresco adherido al lecho tumoral | 8 (14,8) |
| Lesión cubierta de fibrina/necrosis | 10 (18,5) |
| Localización del sangrado | |
| Esófago | 7 (13) |
| Estómago proximal | 16 (29,6) |
| Estómago distal | 7 (13) |
| Estómago difuso | 13 (24,1) |
| Duodenal | 11 (20,3) |
DE: desviación estándar; HDT: hemorragia digestiva de origen tumoral.
Del total de la muestra en el 96% (52) se utilizó EndoClot™ y en 2 casos (3.7%) Hemospray®. El uso de polvos hemostáticos como monoterapia se aplicó en 44 casos (81.5%), mientras que en el 18.5% se usó como tratamiento de rescate en combinación con otras técnicas, como la coagulación con argón plasma en 4 casos, inyección adrenalina en 2 casos, tras colocación de hemoclips en 3 casos y un caso de sobreclip.
Con relación a la eficacia hemostática, se logró una hemostasia inicial a los 5min de la aplicación en el 100% de los casos, independientemente del tipo de polvo utilizado. La media de estancia hospitalaria fue de 13 días (DE: 16), con una hemoglobina promedio a 30 días de 9.03g/dl (DE: 2.1), sin presentar otros eventos adversos (tabla 3).
Análisis de la eficacia lel uso de polvos hemostáticos para la HDT
| Resultado del polvo hemostático | TotalN=54Frecuencia o media (%/DE) |
|---|---|
| Polvo hemostático | |
| EndoClot™ | 52 (96,2) |
| Hemospray® | 2 (3,7) |
| Monoterapia | 44 (81,5) |
| Terapia endoscópica adicional | 10 (18,5) |
| Adrenalina | 2 (3,7) |
| Hemoclips | 3(5,5) |
| Coagulación CAP | 4 (7,4) |
| Sobreclip | 1 (1,85) |
| Hemostasia inicial (5min) | 54 (100) |
| Eventos adversos | 0 (−) |
| Días de hospitalización | 13,1 (16) |
| Hemoglobina control a 30 días | 9,03 (2,1) |
| Resangrado a 7 días | 12 (22,2) |
| Resangrado a 30 días | 24 (44,4) |
| Mortalidad a 30 días | 19 (35,2) |
| Mortalidad acumulada a 90 días | 29 (53) |
| Endoscopia durante resangrado | |
| No requirió tratamiento | 44 (81,5) |
| EndoClot™ | 7 (13) |
| Coagulación CAP | 1(1,9) |
| Sobreclip | 1 (1,9) |
| SEMS | 1 (1,9) |
| Terapia hemostática definitiva | |
| No | 38 (70,4) |
| Radioterapia hemostática | 9 (16,7) |
| Angioembolización | 3 (5,6) |
| Cirugía | 2 (3,7) |
| Radioterapia/angioembolización | 2 (3,7) |
CAP: coagulación argón plasma; DE: desviación estándar; HDT: hemorragia digestiva tumoral.
Respecto a la frecuencia de resangrado, 12 pacientes (22.2%) presentaron resangrado a 7 días, y el acumulado a 30 días fue de 24 pacientes (44.4%). No se encontró diferencias entre aquellos pacientes en que el polvo hemostático fue usado como monoterapia y aquellos utilizados en combinación con argón plasma (6 y 3 pacientes, respectivamente; p=0.146). La mayoría de los pacientes con resangrado (81.5%) no requirió de nueva terapia hemostática endoscópica. Solo 10 pacientes requirieron reintervención endoscópica, a 7 de ellos (13%) se aplicó nuevamente polvo hemostático, un paciente fue tratado con coagulación con argón plasma, un paciente requirió colocación de un sobreclip OVESCO y un paciente requirió la colocación de una prótesis metálica autoexpandible (tabla 3).
Cabe resaltar que hasta el 70.4% de los casos no fue necesario realizar terapia hemostática definitiva tras el tratamiento endoscópico con polvo hemostático. Únicamente 9 pacientes (16.7%) recibió radioterapia hemostática 8-10Gy/7 fracciones, 3 pacientes (5.6%) requirieron angioembolización selectiva (arteria gastroduodenal derecha 2 casos, arteria gástrica izquierda un caso), 2 pacientes (3.7%) fueron sometidos a gastrectomía total y 2 pacientes (3.7%) requieron combinación de terapia con radioterapia y angioembolización. La mortalidad a 30 días fue de 19 pacientes (35.2%) (tabla 3).
Discusión y conclusionesLas características demográficas y clínicas de nuestra muestra son similares a las reportadas por otros autores nacionales2 e internacionales3. Al igual que en otros estudios, la principal etiología de la HDT en nuestra muestra es el cáncer gástrico, representando el 40.7% de los casos. Esto concuerda con el rango del 36-58% reportado en 2015 por Kim et al.4. Los pacientes con HDT en nuestra muestra presentaron un deterioro en su estado funcional, con limitaciones para realizar actividades diarias, reflejado en escalas de Karnofsky de 70% y ECOG de 2. Algunos de estos pacientes (22.2%) no habían recibido tratamiento oncológico al momento del episodio de sangrado. El síntoma principal reportado fue melena en el 59.3% de los casos, y al ingreso, los pacientes presentaron anemia con hemoglobina por debajo de 8g/dl, requiriendo un promedio de 1.5 paquetes globulares. En un estudio mexicano sobre población oncológica, la melena fue el principal síntoma de inicio en hasta un 79%2.
Es relevante destacar que, durante la endoscopia, se corroboraron hallazgos de hemorragia activa en el 52% de los casos de HDT, principalmente manifestados como sangrado en capa del lecho tumoral (57.4%), vaso visible en el tumor (9.3%), coágulo fresco adherido al lecho tumoral (14.8%) y tumor con abundante necrosis cubierto de fibrina (18.5%). En este contexto, la TE convencional no se ha reportado como eficaces1. Desde su aprobación en 2012, diversos autores han reportado resultados sobre la aplicación de polvo hemostáticos como EndoClot™ (EndoClot Plus Co, Santa Clara, CA, EE. UU.) y el Hemospray® (TC-325, Cook Medical Inc., Winston-Salem, NC, EE. UU.). Estos polvos al ser polímeros que permiten aplicarse de manera difusa sobre el lecho tumoral sangrante permiten formar una matriz gelatinosa que favorece la concentración de eritrocitos, plaquetas y factores de coagulación9,10.
En nuestro estudio, se utilizó principalmente EndoClot™, en parte debido a su mayor disponibilidad en la institución, lo que explica su uso en el 96.3% de los casos, mientras que Hemospray® se utilizó solo en 2 pacientes (3.7%). Este polvo hemostático demostró una efectividad importante, logrando hemostasia inicial a los 5min en el 100% de los casos. Se usó como monoterapia en el 81.5% de los casos y como herramienta de rescate en un 18.5%, en combinación con otras técnicas como coagulación con argón plasma, hemoclips o adrenalina (10 casos). Esta efectividad coincide con las cifras de hemostasia inicial de hasta el 73-100% en los pacientes con cáncer gástrico8. Además, en un estudio multicéntrico de pacientes mexicanos con sangrado digestivo tratado con Hemospray®, se reportó una tasa de hemostasia inicial del 98.8%, con una tasa de fracaso del 1.2% y resangrado del 20%, lo que es similar a nuestros resultados11.
La duración exacta del EndoClot™ adherido a la mucosa es desconocida, pero se manejan rangos de 1-48h, dependiendo de factores del paciente y de la lesión5. Esto podría explicar parcialmente la tasa de resangrado a corto plazo (7 días) de hasta el 22% en nuestra población. Otros autores, como Prei et al. (2016), reportan tasas de resangrado menores (11%)3. En contraste, en un estudio retrospectivo de 173 pacientes con hemorragia digestiva alta no variceal (HDANV) que requirieron tratamiento endoscópico con polvo hemostático, solo el 6.3% eran HDT. Para este subgrupo, la tasa de hemostasia inicial fue del 100%, con un resangrado del 4.8% y una mortalidad del 19%, comparado con HDANV por úlceras benignas que tuvieron un resangrado del 8.8% y mortalidad del 13.9%5.
Entre las principales ventajas del uso de polvos hemostáticos se encuentran su aplicación directa y la facilidad para esparcirse en sitios difíciles de alcanzar, requiriendo un breve entrenamiento12. Además, pueden servir como una terapia puente para estabilizar la hemorragia y permitir un tratamiento definitivo en mejores condiciones12. Sin embargo, en nuestra población, únicamente un tercio de los casos recibió terapia definitiva con radioterapia, angioembolización o cirugía.
En 2019, un metaanálisis de 24 estudios reportó una tasa de resangrado a 8 días del 17.9% (rango: 10.3-25%), con una tendencia a presentar mayor resangrado cuando el polvo hemostático se utilizó como terapia de rescate12. El resangrado a 30 días se reportó en un 16.9% (rango: 9.8-24%), lo cual es menor que en nuestra población (44.4%).
La mortalidad a 30 días en nuestra muestra fue del 35.2%, lo que coincide con otro estudio realizado en población oncológica mexicana, que reporta una mortalidad a 30 días de 35.7%2. Sin embargo, otros autores han reportado mortalidad a 30 días del 7.6%, aunque reconocen una alta heterogeneidad entre los estudios analizados13. En contraste, Paoluzi et al. reportan que en los pacientes con HDT tratados con endoscopia combinada, la tasa de resangrado a corto plazo puede ser de hasta el 40-80% y la mortalidad a 90 días puede alcanzar hasta el 95%14. De acuerdo al análisis de Pittayanon et al., se encontró que un estatus funcional deteriorado, ECOG>3 y un INR>1.3 se asociaban con un peor pronóstico, mientras que el uso de polvo hemostático fue predictivo de menor sangrado15.
Entre las limitaciones de este estudio se reconocen su carácter retrospectivo y unicéntrico, así como la marcada tendencia a aplicar EndoClot™ sobre otros polvos disponibles en el mercado, debido a su disponibilidad en nuestro centro. Las principales fortalezas incluyen que se trata de una serie que aborda específicamente las HDT, así como sus tratamientos complementarios y resultados en relación con hemostasia inicial, resangrado temprano y mortalidad asociada. Se sugiere realizar estudios prospectivos y aleatorizados para confirmar estos hallazgos.
A manera de conclusión, es importante reconocer que la HDT representa una complicación potencialmente mortal. En el contexto de los tratamientos endoscópicos, los polvos hemostáticos son altamente recomendables debido a su eficacia en el control inmediato del sangrado y su capacidad para actuar como terapia de rescate. No obstante, su eficacia puede verse limitada en los pacientes con un estado funcional deteriorado. Por lo tanto, su uso óptimo es como terapia puente, facilitando la estabilización de la hemorragia y permitiendo la implementación de tratamientos hemostáticos definitivos como la radioterapia, la angioembolización o la cirugía.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Consideraciones éticasEste estudio se realizó cumpliendo la normativa actual en investigación bioética, quedando registrado en el comité de investigación del Instituto Nacional de Cancerología con el No. 2023/095, después de cumplir con los siguientes criterios como la protección de personas y animales, confidencialidad de los datos siguiendo los protocolos del centro de trabajo sobre su publicación y preservación de su anonimato, derecho a la privacidad y consentimiento informado. Los autores declaran que no existe información personal que permita identificar a la paciente.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses relacionado con la publicación de este artículo.
Se agradece en particular a la Dra. Jaqueline Paola Bran Alvarado, Médico Gastroenteróloga del H. Universitario de Monterrey por su ayuda y orientación en el manejo de las bases de datos y del análisis estadístico.